Conflicto de intereses
Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin animo de lucro a las que estemos afiliadas.
INTRODUCCIÓN
La osteoporosis (OP) es una enfermedad del sistema esquelético caracterizada por unos valores bajos de masa ósea y el deterioro de la microarquitectura del tejido óseo, que originan un aumento de la fragilidad del hueso y el consiguiente, incremento del riesgo de fracturas (fig. 1)1. Su prevalencia es sustancialmente elevada en las mujeres posmenopáusicas ancianas. En las mujeres de raza blanca, el riesgo acumulado de fracturas durante la vida (lifetime risk), incluye una probabilidad del 16% de una o varias fracturas vertebrales dolorosas, del 16% de fracturas de Colles y también, en igual porcentaje, de fracturas de cadera2. Las fracturas osteoporóticas se asocian a un gran sufrimiento personal y familiar, mayor morbilidad, aumento de mortalidad (fracturas vertebrales y de cadera), mayor demanda de recursos sociales, disminución de la calidad de vida y elevación de los costes sanitarios asistenciales3.
Figura 1. Osteoporosis. Definición.
Más del 75% de las mujeres, y cerca del 90% de los varones con una muy alta probabilidad de OP no se investigan y solamente un 25% de los afectados inician tratamiento farmacológico4.
La OP es el factor de riesgo individual más importante de fractura en la población de edad avanzada, y existe evidencia consistente de la asociación entre el descenso de la densidad mineral ósea (DMO) y el riesgo de fractura5.
Kanis et al6, después de estudiar los metaanálisis del riesgo de fracturas y examinar importantes bases de datos, como los registros suecos de fracturas, de mortalidad y los archivos de exploraciones de la densitometría mineral ósea, para estimar la probabilidad a los 10 años de fracturas en múltiples localizaciones óseas en varones y mujeres de más de 45 años, llegan a la conclusión del efecto significativo de la edad como factor que contribuye al riesgo de fracturas y demuestran la importancia de tener en cuenta otros factores, además de la DMO, para la toma de decisiones relacionadas con el tratamiento de la fracturas.
La World Health Organization (WHO) decidió utilizar en el año 1994, las determinaciones de la DMO con DEXA (absorciometría bifotónica de rayos X, método de referencia por su alta precisión-exactitud [85 a 95%] y reproducibilidad [1 a 3%]), para definir el hueso normal, la osteopenia y la OP, estableciendo criterios diagnósticos de OP a partir de valores densitométricos concretos como punta de referencia para el diagnóstico, pronóstico e inicio de tratamiento7. Según la definición de la WHO, el 95% de las mujeres jóvenes tienen unos valores de DMO situados entre 2,0 y 2,0. Existen amplios y evidentes estudios epidemiológicos que indican que el riesgo de fracturas aumenta progresivamente a medida que disminuye la DMO8.
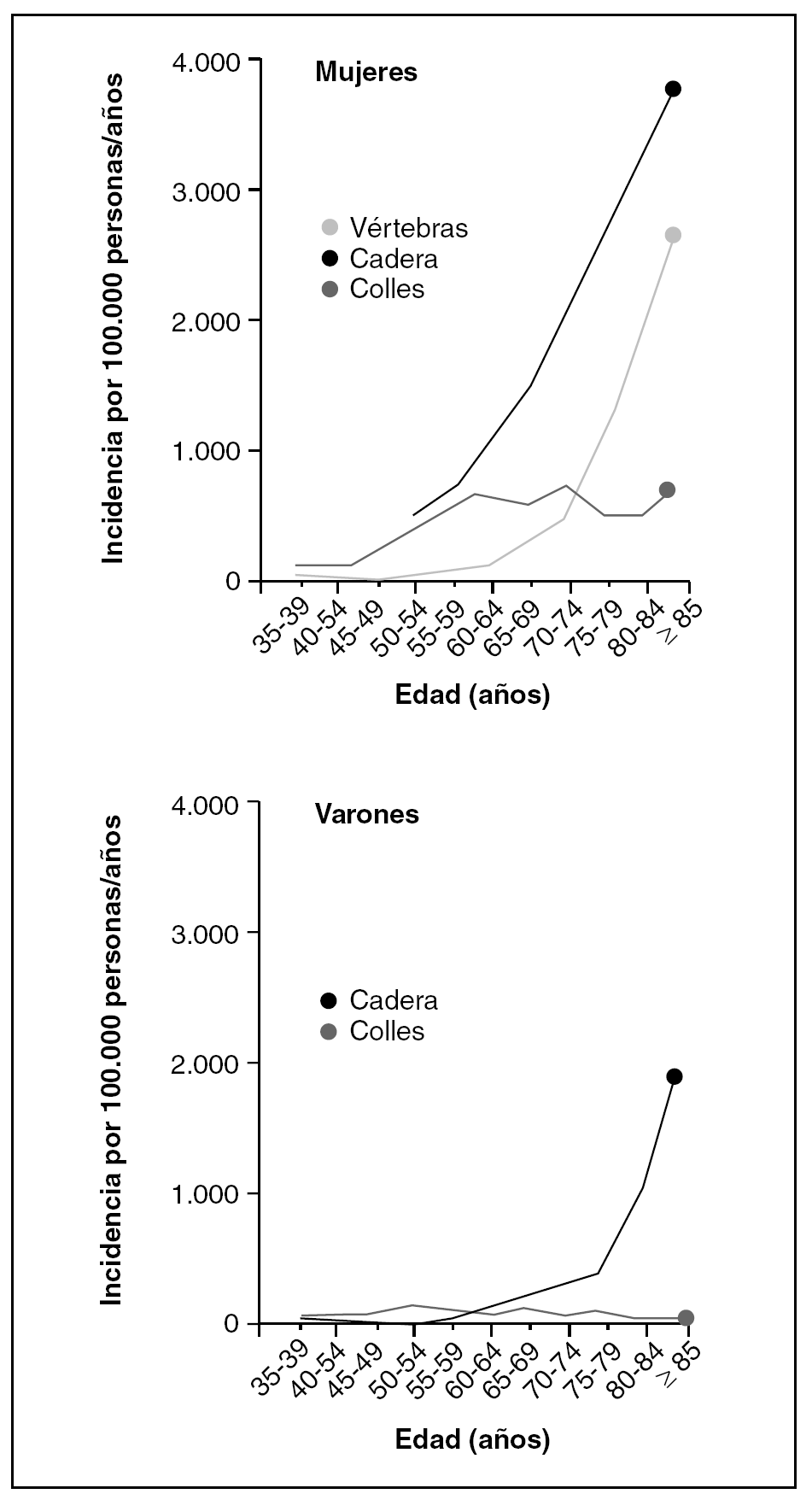
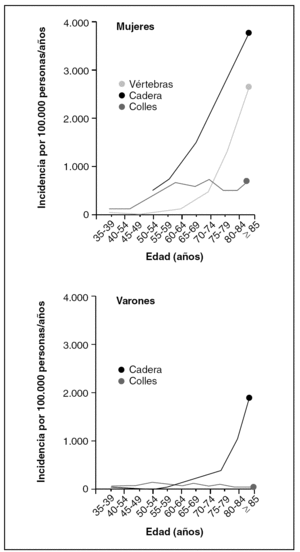
La incidencia de fracturas de muñeca (fractura de Colles) constituye la primera manifestación de la OP en algunas pacientes, se produce a una edad algo inferior a la de las fracturas vertebrales, aumenta rápidamente en la fase perimenopáusica y su papel como factor de riesgo de nuevas fracturas está bien documentado9 (fig. 2).
Figura 2.Tasa de incidencia de las 3 fracturas osteoporóticas más comunes, expresadas en función de la edad en el momento de la fractura. Las tasas son muy inferiores en los varones y ocurren a una edad superior a las de las mujeres. Tomada de Obrant et al. Calcif Tissue Int. 1989;44:157-67.
El déficit de estrógenos (ES) es un factor clave de la patogenia de la OP posmenopáusica. Los datos aportados recientemente por el estudio SOF (Study of Osteoporotic Fractures) descubren que las fracturas en la edad premenopáusica aumentan el riesgo en un 30% (riego relativo [RR] = 1,33; intervalo de confianza [IC] del 95%, 1,14-1,56) de aparición de nuevas fracturas en el período posmenopáusico, sin que intervengan otros factores como la edad, la DMO, la propensión a las caídas, el tratamiento con antirresortivos o los antecedentes familiares. Una historia clínica de fractura previa premenopáusica debe influirnos en la toma de decisiones sobre tratamientos preventivos10.
Las fracturas de cadera aumentan con la edad. El estudio Dubbo, prospectivo de 12 años de seguimiento, en el que se registraban todas las fracturas que ocurrían en varones y mujeres de más de 60 años, en una población predominantemente blanca, revela y confirma que el número de fracturas de cadera aumenta con la edad, descubriendo que el 48% de las fracturas en los varones acaecían antes de los 80 años y en el caso de las mujeres, el 66% ocurría antes de los 85 años. Esta distribución de edad subraya la necesidad de intervenciones preventivas precoces en la OP, de manera especial en los varones11. Además de esta estrecha relación entre una baja DMO y la fractura de cadera, también está emergiendo como un factor potencialmente significativo en estas fracturas, la geometría de la cadera y su contribución a la resistencia ósea12.
En los últimos años han surgido nuevas perspectivas y conocimientos científicos acerca de las acciones de los ES en el hueso y de su importancia en la salud ósea. El propósito de este trabajo es mejorar nuestra comprensión sobre el papel de los ES para el normal crecimiento y mantenimiento de la estructura ósea, detallando sus mecanismos de acción celular y examinando a la luz de la evidencia actual, sus efectos en la prevención y tratamiento de las fracturas osteoporóticas, incluyendo las recomendaciones de su utilización y manejo.
LA MASA ÓSEA
La masa ósea, a cualquier edad, es el resultado de 2 variables: la cantidad de hueso acumulado durante el crecimiento y el ritmo de pérdida de hueso que acontece a lo largo de los años. El fenómeno de crecimiento del esqueleto y el de mineralización ósea tienen lugar durante la infancia. Ambos procesos, determinantes del crecimiento en longitud de los huesos, son complejos y controlados mediante factores genéticos, ambientales y señales hormonales, los cuales son objeto de detenidos estudios científicos. La masa ósea aumenta, incluso después de que el crecimiento en altura se detiene, alcanzando su punto de mayor inflexión a la edad de 25-30 años para el hueso esencialmente trabecular, y de 35-40 años para los huesos de composición de predominio cortical, siendo esencial conseguir el pico de masa ósea (PMO) al inicio de la edad adulta para reducir el riesgo de OP del adulto13.
La actividad física intensa en mujeres jóvenes que mantienen un buen peso corporal, una nutrición adecuada y una menstruación regular se asocian a una DMO adecuada. Los factores que se correlacionan de manera más significativa con la DMO y el PMO en adolescentes son la ingesta de calcio, sobre todo en el período prepuberal, la masa magra, el peso, la altura y las horas de ejercicio14.
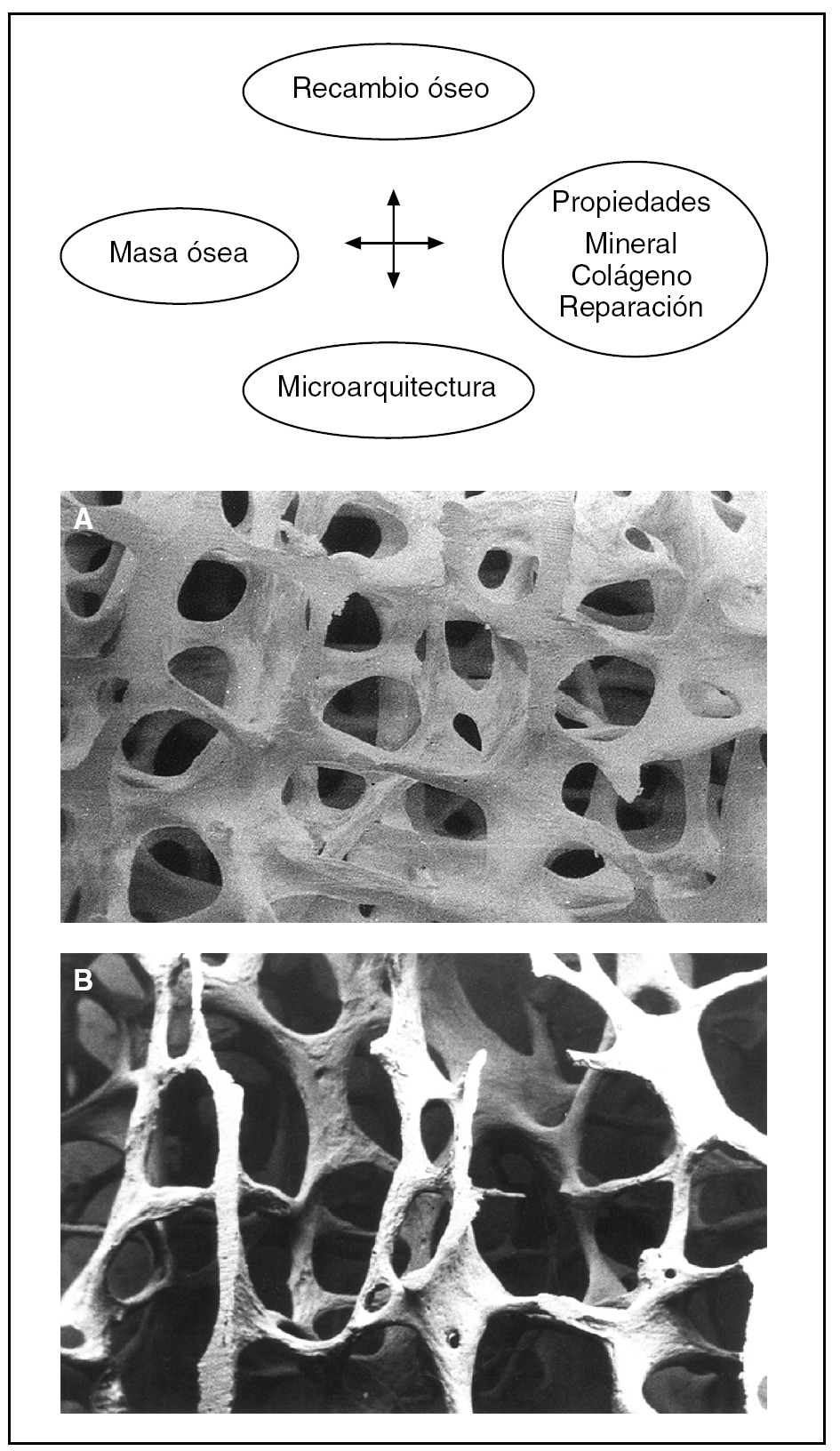
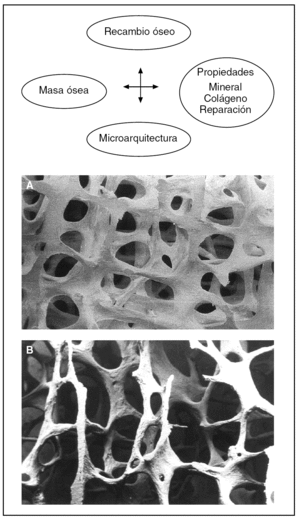
Después de la obtención del PMO, el esqueleto presenta modificaciones de 2 tipos: a) cuantitativas, con reducción de la masa y de la densidad ósea, y b) cualitativas, caracterizadas por alteraciones de la arquitectura y de la microarquitectura de los sectores trabeculares y de la cortical (fig. 3). Si hay un desequilibrio en las llamadas unidades multicelulares básicas (bone multicellular unit [BMU]), con recambio óseo elevado y aumento de la tasa de destrucción, tal como sucede en la menopausia, se produce la pérdida de masa ósea, a pesar de que la formación se acelera en un intento de hacer frente a esta situación. Finalmente, en el envejecimiento también hay un desequilibrio en este proceso, donde la destrucción se incrementa o es normal, pero la formación ósea está suprimida, invariable o aumentada ligeramente, conllevando a una pérdida ósea persistente, con el consiguiente aumento del riesgo de presentar fracturas en el futuro15.
Figura 3. Determinantes de la resistencia ósea.
Los factores de riesgo más frecuentes para la OP son los factores genéticos y nutricionales, el estilo de vida, los factores hormonales y reproductivos, las medicaciones (corticoides, diuréticos, etc.), algunas enfermedades (celíaca, artritis reumatoide, etc.) y los factores relacionados con las caídas (debilidad del cuádriceps, alteraciones visuales, etc.).
Los factores hereditarios desempeñan un papel importante en el riesgo de OP. En estudios en gemelos, el 70-80% de las diferencias encontradas en la DMO, medidas en la columna lumbar y cuello femoral, es atribuible a factores genéticos. Varios estudios han encontrado relación significativa entre el componente hereditario y el riesgo de fractura de Colles y de cadera en mujeres blancas16. El colágeno tipo I es el principal componente estructural proteico del hueso y los genes que codifican esta proteína (COLIA1 y COLIA2) y sus polimorfismos también parecen intervenir en la regulación genética de la masa ósea. Se han comunicado diferencias significativas entre diferentes etnias en la prevalencia del polimorfismo Sp1-COLIA1, lo que podría explicar la susceptibilidad racial de la OP de la raza caucásica frente a la africana y la asiática17. Las mujeres con menarquia tardía y/o menopausia precoz, o inducida quirúrgicamente, con una exposición más corta a las hormonas reproductivas normales, pueden tener un mayor riesgo de desarrollar la enfermedad18.
De todos los factores antropométricos, el peso corporal es el predictor más fuerte de la DMO. Esta relación positiva puede ser atribuida, junto a los factores hereditarios, al efecto mecánico de las cargas, a la coordinación neuromuscular del ejercicio, a la ingesta adecuada de calcio y a un estilo de vida activa y sana (abandono del tabaco, consumo menor de 200-300 mg/día de cafeína, consumo bajo-moderado de alcohol), intervenciones que podrían traducir una menor incidencia de aparición de la OP19.
En mujeres adolescentes con trastornos de alimentación, la baja concentración de ES observada en estas pacientes no sólo se relaciona con la amenorrea, sino también con osteopenia y OP. Este hecho ha conducido al estudio de la DMO y su posible relación con la duración de la enfermedad, la persistencia de la amenorrea secundaria, el índice de masa corporal, el aporte de calcio en la dieta, la cantidad de ejercicio y el uso de anticonceptivos orales. En la actualidad, se piensa que la gravedad de la pérdida mineral ósea está muy ligada con la duración de la enfermedad y con el índice de masa corporal de la paciente20.
Recientes investigaciones relacionan el estado estrogénico y su efecto óseo con la sobrecarga y la tensión mecánica. La investigación en modelos animales demuestra que la deficiencia de ES reduce la eficacia del ejercicio para prevenir la pérdida ósea. En mujeres con concentraciones disminuidas de ES, existe un aumento del umbral en la detección de las tensiones por parte del hueso y una reducción de la conversión de señales mecánicas en bioquímicas para la formación de tejido óseo21. Sin embargo, hay numerosos ensayos clínicos y revisiones que correlacionan directa y positivamente el efecto del ejercicio con la masa ósea en todas las edades. Estudios realizados en mujeres pre y perimenopáusicas, que efectuaban programas de ejercicios muy diversos que incluían actividades laborales, deportivas, domesticas o recreativas, encuentran mayor DMO en las practicantes (entre el 1 y el 2,8%, según las actividades realizadas, región anatómica de medición del esqueleto y tiempo de duración, que habitualmente oscilaba entre 0,5 y 2 años), respecto a las controles inactivas22.
Los ES también parece que influyen sobre la resistencia mecánica de los huesos alterando su geometría estructural. Beck et al, utilizando a las mujeres del estudio SOF, midieron la DMO, el área transversal del cuello femoral, el módulo de sección-SM (que es una medida de las fuerzas de flexión y torsión) y el grosor subperióstico, en mujeres mayores de 65 años que nunca habían tomado ES y las compararon con aquellas que los tomaban en la actualidad y con las que los habían utilizado anteriormente. Estos autores encontraron que los 3 grupos de mujeres perdían DMO, pero las usuarias que estaban tomando ES poseían corticales más gruesas y presentaban un aumento del SM del cuello y de la diáfisis de la cadera, lo que traducía en una mayor resistencia mecánica a las solicitaciones de carga sobre la cadera. Sin embargo, advierten que estos datos pueden no ser detectados cuando únicamente se mide la DMO como predictor de OP23.
MECANISMO DE ACCIÓN
Las hormonas esteroideas sexuales son esenciales para el normal crecimiento y mantenimiento de la calidad ósea, tanto en varones como en mujeres. Cada vez es más evidente el papel de acción de los ES y los receptores estrogénicos como mediadores "críticos" de una gran variedad de procesos biológicos específicos de órganos. Los recientes avances sobre la identificación y caracterización de las proteínas y señales moleculares, promovidas a través de los ES, demuestran claramente la complejidad de la regulación hormonal y contribuyen a una mejor comprensión de su papel en la fisiología y en la patogenia de la enfermedad en los seres vivos24. Las funciones de los ES son originadas, y en gran parte inducidas, a través de las 2 isoformas del receptores estrogénico, denominadas alfa y beta, ambas con expresión en los osteoblastos. El dominio de cada isoforma varía según las fases de la diferenciación del osteoblasto, estudiándose en la actualidad su papel en la expresión endógena de diferentes genes25.
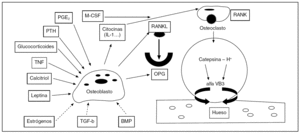
Los ES desempeñan un papel importante en el funcionamiento y mantenimiento del esqueleto, al actuar sobre la inducción de las células osteoblásticas de la estroma y regular la producción de varias citocinas como la interleucina-1 y la 6 (IL-1, IL-6), el receptor activador del factor nuclear kappa-b (RANK) y la osteoprotegerina (OPG) por las células de linaje osteoblástico. El raloxifeno, modulador selectivo del receptor estrogénico, actúa sobre el hueso de forma similar a los ES, aunque sus mecanismos de acción sobre los receptores del osteoblasto todavía siguen confusos26.
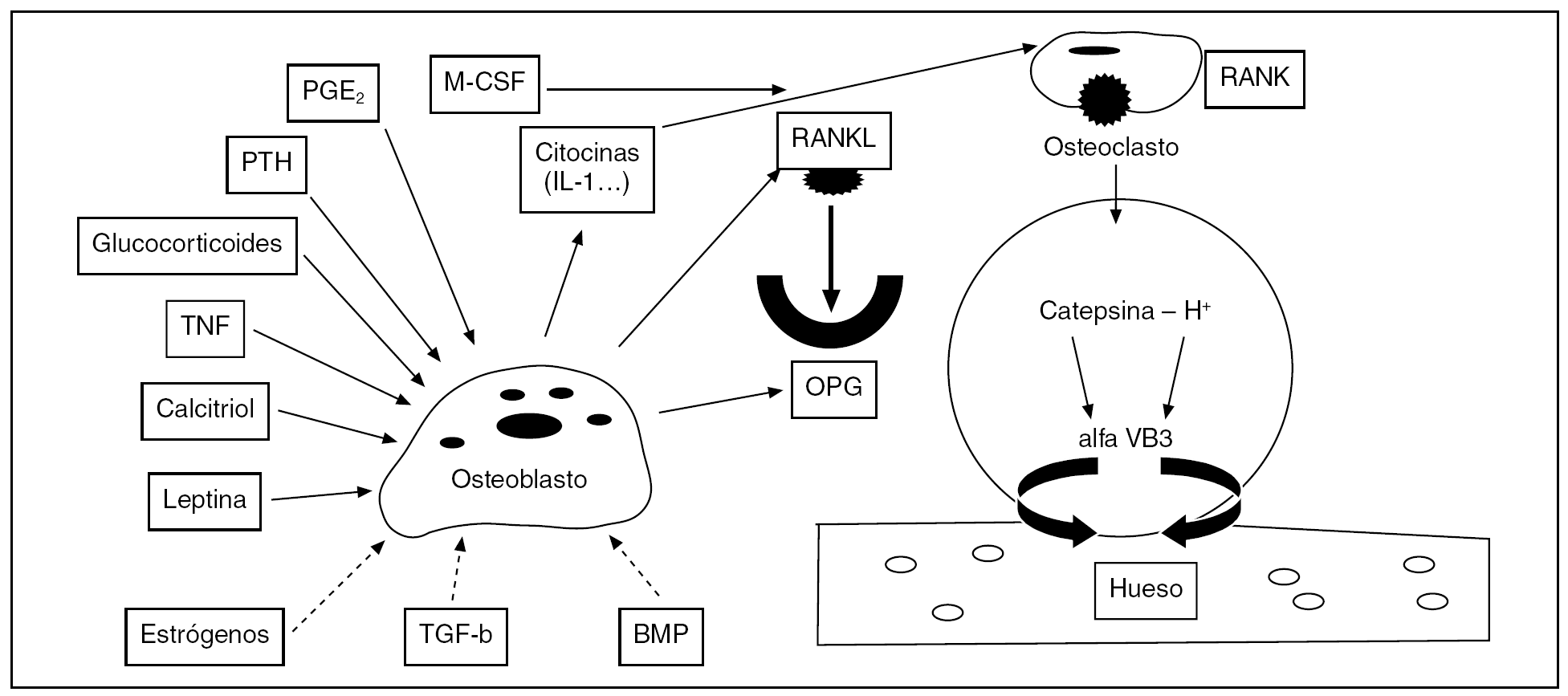
La diferenciación y la activación de los osteoclastos están reguladas por el sistema paracrino OPG/RANK/ligando RANK (RANKL). La diferenciación del precursor hematopoyético GM-CSF, célula progenitora de granulocitos y macrófagos, hacia la línea osteoclástica depende de la activación del receptor RANK. El RANKL se expresa en la superficie de las células estromales y osteoblásticas. Las hormonas osteorresortivas y las citocinas promueven la diferenciación osteoclástica al estimular la expresión del RANKL de las células osteoblásticas y estromales. El RANKL se une al RANK en la superficie de los progenitores de los osteoclastos y estimulan su diferenciación, en un paso que se requiere del factor estimulador de colonias de macrófagos 1, secretado por las células osteoblásticas. La OPG, proteína soluble sintetizada por los osteoblastos y que forma parte de la superfamilia del receptor del factor de necrosis tumoral (TNF), es un potente inhibidor de la diferenciación osteoclástica al trabajar como receptor trampa de RANKL, e impedir que se active el receptor RANK en las células de linaje osteoclástico. Los efectos de este bloqueo conllevan la inducción a la apoptosis celular y la inhibición de la activación de los osteoclastos27.
Diversas hormonas, citocinas y péptidos producidos por diversos tejidos modulan el metabolismo óseo mediante la expresión de RANKL en las células óseas. Los ES constituyen el principal inhibidor endógeno de la reabsorción ósea y su acción se explica por varios mecanismos:
Reducen el número de osteoclastos in vivo, suprimiendo posiblemente sus precursores.
Tienen un efecto inhibitorio en las citocinas prorresortivas (IL-1, IL-6) y TNF alfa.
Se ha descrito una acción directa sobre los osteoblastos que incrementan la producción de OPG e inhiben la actividad de RANKL. Estos datos concuerdan con los estudios que muestran que el tratamiento con OPG en ratas ovariectomizadas previene la pérdida de masa ósea28.
Estimulan la producción de factor transformador de crecimiento b (TGF-b), que actúa reduciendo la generación de los osteoclastos, su longevidad y la expresión de catepsina K (proteasa catepsina) que degrada el hueso y permite, tras el bombeo de protones en el área, excavar los túneles en el proceso de remodelación ósea por las BMU (fig. 4).
Figura 4.El Sistema OPG/RANK. La mayoría de los factores que estimulan la diferenciación y maduración de los osteoclastos lo hacen a través de los osteoblastos y de la vía OPG/RANKL/RANK. Las líneas de trazo continua representan agentes activadores de RANKL y las discontinuas, inhibidores. El precursor osteoclástico tiene un receptor RANK que se activa cuando es ocupado por RANKL que es secretado por los osteoblastos. Sin embargo, los osteoblastos también secretan un "receptor señuelo", llamado OPG, que se une a RANKL y antagoniza el sistema RANK/RANKL. La maduración del osteoclasto depende de la competición entre el receptor RANKL y el receptor OPG por el RANK. Durante la resorción (abajo a la derecha), el osteoclasto se une a la superficie ósea a través de una integrina llamada alfaVB3. Se produce un bombeo de protones hacia el área y la proteasa catepsina degrada el hueso.
Los factores que regulan directamente la reabsorción ósea por los osteoclastos, como las citocinas (RANKL, TNF-alfa, interferón gamma), las hormonas (ácido retinoico y ES) y los factores nucleares de transcripción (c-jun y Mitf) también regulan el gen de expresión de la catepsina K. Este hecho descubre y promueve la investigación de nuevas intervenciones terapéuticas en la OP29.
Cuando las concentraciones de ES disminuyen hasta cierto valor, aumentan las citocinas estimuladoras de los osteoclastos, se produce menor cantidad de OPG y más RANKL proosteoclastogénico. De igual manera, la mayor generación de osteoclastos induce una mayor apoptosis de los osteocitos, lo que equivale en la práctica a una mayor actividad de las BMU, que excavan grandes agujeros en el hueso que deterioran su microestructura y resistencia ósea. Si la mujer no alcanzó suficiente PMO en su juventud y se prolonga la pérdida ósea posmenopáusica, acontecen las fracturas "espontáneas" osteoporóticas30.
La relación entre los ES endógenos, los valores de OPG circulantes y el estado óseo en poblaciones humanas es confusa. El aumento dependiente de la edad de la OPG como factor antirresortivo puede reflejar un mecanismo paracrino insuficiente de las células óseas para compensar la pérdida ósea que acontece en la vejez. Recientemente, el Austrian Study Group al examinar los valores de OPG en 1.134 pacientes y su posible asociación de la edad y el sexo con otros parámetros clínicos del metabolismo óseo, encuentra un aumento significativo de la OPG en los grupos de más de 60 años en las mujeres y de 70 años en el caso de los varones, respectivamente, pero estos valores no se correlacionaban con los resultados de la DMO medida por DEXA en la cadera y en las lumbares ni eran predictores de la DMO en la población de estudio31. También se ha estudiado la posible relación entre marcadores óseos de reabsorción, valores de OPG y estradiol endógeno. Rogers et al, informan que los valores de estradiol son un factor importante que contribuye a evitar la perdida ósea y que sus valores endógenos están relacionados con los de OPG circulantes, los cuales podrían reflejar la actividad de la OPG sobre el hueso32.
El conocimiento actual del sistema de señalización mediado por RANKL puede ser muy útil en el estudio de nuevas posibilidades terapéuticas en diversos desórdenes metabólicos óseos incluyendo la prevención de la OP posmenopáusica. En este sentido, el trabajo reciente de Bekker et al, aleatorizado, doble ciego, controlado con placebo, con dosis específicas de OPG por vía subcutánea en mujeres posmenopáusicas, encuentra una disminución marcada y sostenida de la reabsorción ósea por los osteoblastos, con un buen perfil de seguridad33.
Los pacientes con calcificaciones vasculares tienen a menudo disminución de la DMO, pero sigue siendo incierto si la OP y la enfermedad vascular periférica están correlacionadas y ligadas a un mecanismo patogénico común. Los estudios más interesantes sobre los valores de OPG y los polimorfismos genéticos de la OP sugieren un papel importante del sistema OPG/RANKL en las enfermedades esqueléticas de reabsorción ósea y vasculares que coexisten con alta prevalencia en las personas mayores y en las mujeres posmenopáusicas. Además, se ha demostrado que la OPG actúa como un factor autocrino de supervivencia de células endoteliales34.
TRATAMIENTO CON TERAPIA HORMONAL SUSTITUTIVA
Después de la menopausia, todas las mujeres sin terapia hormonal sustitutiva (THS) se consideran con deficiencia estrogénica. Ettinger et al35, al estudiar la posible asociación entre valores de estradiol, DMO a varios niveles y fracturas vertebrales en mujeres que pertenecían al SOF, descubren que las que tenían mayores concentraciones de ES circulantes en la posmenopausia, presentaban menor riesgo de fracturas. El estudio SWAN (Women's Health Across the Nation), que evalúa las variaciones entre la DMO y las concentraciones hormonales endógenas de mujeres peri y premenopáusicas, apoya la hipótesis que las alteraciones hormonales al final del período fértil se asocian con diferencias en las DMO36.
Los ES extraováricos se sintetizan a partir de los andrógenos por la acción de la enzima aromatasa, presente en el tejido adiposo. Un reciente estudio aleatorizado ha evaluado el efecto del bloqueo de la síntesis de ES endógenos sobre los marcadores óseos en 42 mujeres sanas (edad media ± desviación estándar: 69 ± 5 años), observando que aquellas que recibían letrozol (un potente inhibidor de la aromatasa) presentaban una disminución de ES circulantes y un aumento de los marcadores de recambio óseo en comparación con los controles, apoyando la idea de que las variaciones de ES, aunque sean bajas pueden contribuir a las diferencias de la pérdida ósea37. Hoy día se piensa que junto con la deficiencia estrogénica hay un cierto factor adicional que predispone a la pérdida excesiva del hueso. En este sentido, el trabajo de Riggs et al38 respalda la hipótesis de que la mayor pérdida de hueso en la OP posmenopáusica es el resultado de una sensibilidad deteriorada del hueso a los esteroides sexuales.
En el tratamiento de la OP hay cuestiones controvertidas, como las relativas al cribado, la selección de las pacientes a quienes se debe ofrecer el tratamiento y el tipo de tratamientos que los clínicos deben recomendar. Los nuevos fármacos (bisfosfonatos inyectados, PTH [hormona paratiroidea], estatinas, OPG) han determinado una mayor complejidad en la toma de decisiones, por lo que habrá de fundamentarse las recomendaciones respecto a quién y cómo tratar con las evidencias más recientes y exhaustivas.
Las mujeres cercanas a la menopausia, con factores de riesgo y valores densitométricos en el intervalo de osteopenia, según las recomendaciones del WHO, son susceptibles de recibir tratamiento preventivo. Estas medidas generales deben incluir la identificación y tratamiento de las causas reversibles de la pérdida ósea, una actividad física apropiada, una dieta adecuada con particular atención a la ingesta de Ca y vitamina D, y evitar las conductas que promuevan la pérdida de hueso como fumar y beber alcohol en cantidades excesivas39.
En el caso de una mujer con OP posmenopáusica, son muchos los factores que pesan en la decisión última acerca del tratamiento. La solidez de la evidencia, los efectos adversos y los precios asociados a los diferentes fármacos se constituyen en circunstancias que influyen poderosamente con relación a esta cuestión.
La mayor parte de los datos de eficacia de la THS se basan en los resultados de estudios de casos y controles y de cohortes. Estos estudios han señalado que las fracturas no vertebrales disminuyen entre un 25 y un 50% y que las vertebrales lo hacen en un 50% en las mujeres tratadas frente a las no tratadas. Sin embargo, incluso los estudios de cohortes bien realizados con ajustes para los factores de confusión, están sometidos a un sesgo de selección (sesgo de usuarias) y pueden sobrestimar la magnitud del efecto del tratamiento40.
Con el objetivo de clarificar la eficacia de la THS en la reducción del riesgo de fracturas no vertebrales, Torgenson y Bell-Syer, en su metaanálisis que recoge 22 ensayos clínicos aleatorizados, encuentran que el tratamiento con ES reduce un 27% el riesgo de fractura no vertebral y que su efecto es mayor en mujeres menores de 60 años (reducción del 33%)41. La THS ha sido un tratamiento de primera elección por su eficacia para prevenir la fractura de cadera y vertebral. Sin embargo, el ensayo clínico WHI (Women's Health Initiative) realizado en Estados Unidos para comprobar los riesgos y confirmar los beneficios de la THS, fue interrumpido después de 5 años (estaba diseñado para 8,5 años), dado que en las mujeres tratadas con cierto tipo de terapia hormonal combinada (estrógenos equinos y medroxiprogesterona), aportaba la evidencia de que los beneficios (disminución de cáncer colorrectal --RR = 0,63 [0,43-0,92]-- y de fracturas de cadera --RR = 0,66 [0,45-0,98]--) no compensaban los riesgos (incremento del riesgo de cáncer invasivo de mama --RR = 1,26 [1,00-1,59]--, accidentes cerebrovasculares --RR = 1,41 [1,07-1,85]--, enfermedad cardíaca coronaria --RR = 1,32-- y enfermedad tromboembólica --RR = 2,13 [1,39-3,25]--)42.
El WHI ha mostrado una reducción del riesgo para cualquier fractura (RR = 0,76 [0,69-0,83]), entre mujeres sanas con tratamiento hormonal combinado. La rama de ES del WHI, recientemente suspendida por el desfavorable balance riesgo-beneficio, ha encontrado un efecto similar sobre el riesgo de fractura y la DMO43.
Otros estudios, como el HERS II (Heart ad Estrogen/Progestin Replacement Study) o el Million Women Study realizado en el Reino Unido encontraban resultados similares44,45. Todos los autores recomiendan que la disposición para prescribir o no tratamiento con THS y su duración se debe basar en el análisis de los factores individuales, en la decisión de la paciente una vez informada de los riesgos y ventajas potenciales y en que se deben supervisar periódicamente si acepta su utilización46.
Otra de las conclusiones derivadas de estos estudios reside en que la THS mejora los síntomas vasomotores de la menopausia y que tiene un efecto positivo en la masa ósea, con más intensidad en el hueso trabecular, pero este resultado se mantiene solamente durante su administración, reanudándose el desequilibrio óseo negativo tras su suspensión. Su efecto protector sobre las fracturas osteoporóticas es evidente en las mujeres mayores (alrededor de 60 años), pero esta protección no se mantiene y se pierde a largo plazo, razón por la cual su uso prolongado para la prevención de la OP no se recomienda actualmente47.
Sin embargo, nuevos estudios analizan sus ventajas e inconvenientes a largo plazo en la prevención de la pérdida ósea. En este sentido, el PERF Study informa que la THS circunscrita a los 2 o 3 años siguientes a la menopausia ofrece ventajas en la prevención de la OP y de la fractura vertebral osteoporótica (odds ratio [OR] = 0,48; IC del 95%, 0,26-0,88), frente al grupo placebo48. Un reciente trabajo ha evaluado la posible asociación entre la cesación de la THS y el riesgo de fractura. Las participantes ascendían a 140.584 mujeres posmenopáusicas, mayores de 50 años, sin diagnóstico previo de OP, incluidas en la base de datos del National Osteoporos Risk Assessment, a las que se solicitaba al inicio y al año del tratamiento, información acerca de la utilización, duración de THS y la incidencia de fractura de cadera en los últimos 12 meses. Coincidente con los datos del WHI, las mujeres que recibían THS durante el período del estudio tenían una incidencia más baja (40%) de fracturas de cadera comparadas con las que nunca la habían utilizado. Aquellas que la habían utilizado y habían suprimido su uso 5 años antes de finalizar el estudio tenían un riesgo similar a las que no habían usado nunca THS. Sin embargo, las mujeres que habían continuado el tratamiento con THS durante los últimos 5 años presentaban un aumento del riesgo de fractura de cadera comparada con las no usuarias (OR = 1,65; IC del 95%, 1,05-2,59) (nivel de evidencia 2b)49.
NIVEL DE EVIDENCIA
Existe evidencia de alto nivel que sugiere iniciar tratamiento antifractuario en pacientes con OP, tanto varones como mujeres, sobre todo si presentan antecedentes personales de fracturas, para reducir el riesgo de nuevas fracturas. La evidencia es menos completa en mujeres con osteopenia, con o sin fracturas y para los varones. En la actualidad, la THS no se recomienda en las mujeres para la reducción del riesgo de fractura exclusivamente50.
La actualización 2003 de la Guía de la National Osteoporosis Foundation (NOF) para la prevención y tratamiento de la OP recomienda que cuando se esté pensando en utilizar la THS solamente para la prevención de la OP, deberían considerarse en primer lugar los tratamientos no estrogénicos aprobados51.
La selección de la intervención farmacológica apropiada para la prevención y el tratamiento de la OP entre un bisfosfonato, PTH, calcitonina y raloxifeno dependerá principalmente del perfil de la eficacia, tolerabilidad y seguridad junto a la buena voluntad del paciente para conformarse con un tratamiento de larga duración. Deben seleccionarse, en consecuencia, aquellos fármacos que también demuestren reducción adicional de fracturas en otras localizaciones52.
Debe ser igualmente significativo, por parte de los clínicos, el conocimiento de los factores genéticos y de riesgo, de las técnicas de estudio del proceso de remodelación ósea y, sobre todo, de la disponibilidad de la densitometría ósea por DEXA, que permiten predecir el riesgo de fractura53.
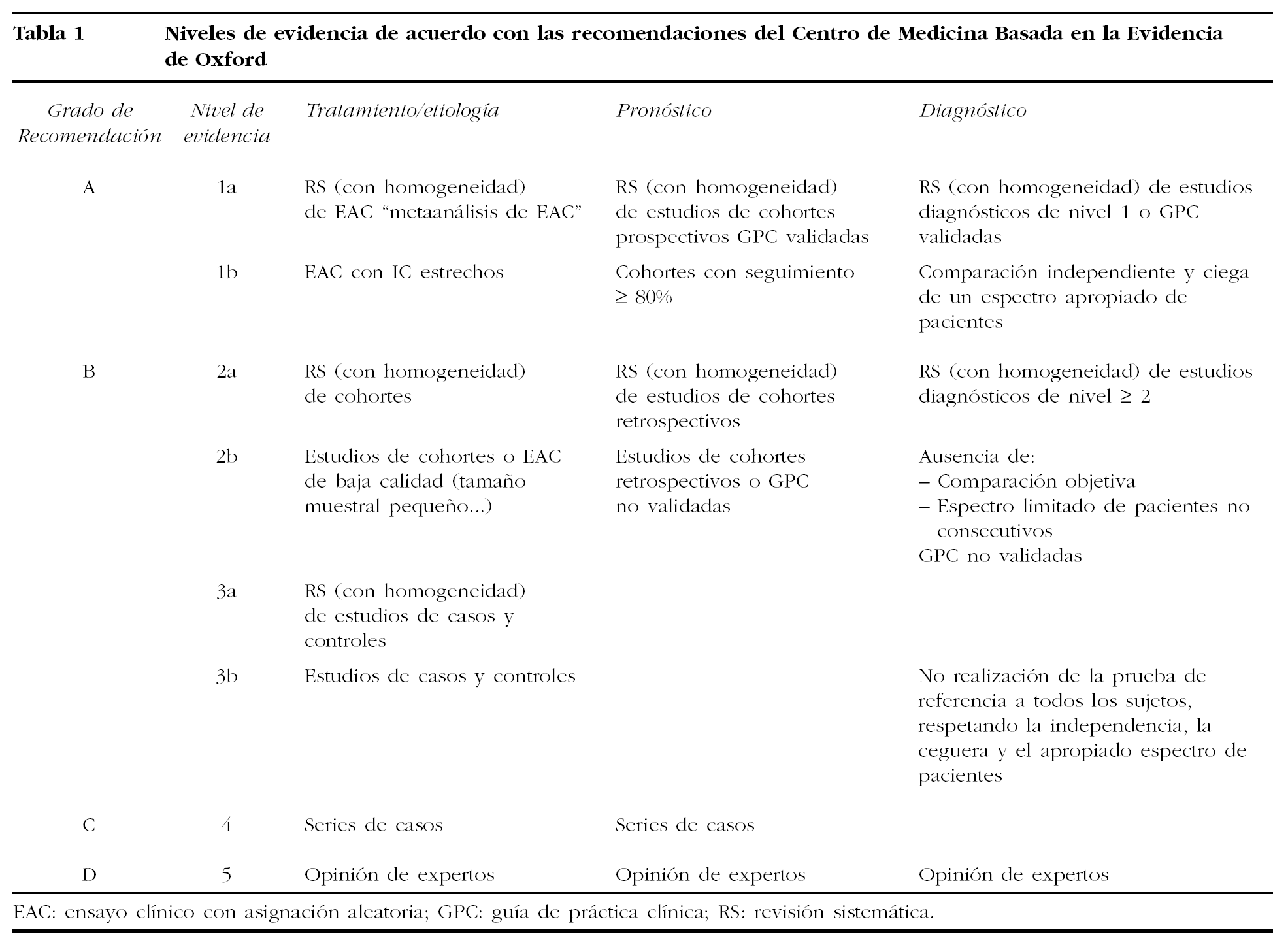
En fechas recientes, la Sociedad Española de Investigaciones Óseas y Metabolismo Mineral (SEIOMM) ha elaborado una guía de práctica clínica, que se constituye en recomendaciones elaboradas sistemáticamente para ayudar al profesional sanitario y al paciente en la toma de decisiones adecuadas en circunstancias clínicas específicas. Las evidencias se han clasificado, de acuerdo a las recomendaciones del Centro de Medicina Basada en la Evidencia de Oxford, en niveles del 1 al 5, otorgando subniveles a y b a los 3 primeros supuestos (tabla 1).
Existen datos de eficacia de la THS sobre la DMO provenientes de EAC (ensayo clínico con asignación aleatoria), si bien los ensayos dirigidos a reducir el riesgo de fractura, y en concreto vertebrales, son escasos, observacionales, o de EAC con limitaciones metodológicas (nivel de evidencia 2a y 2b, respectivamente).
Cuando se inicia el tratamiento antes de los 60 años, tiene eficacia en la reducción de fracturas no vertebrales (nivel de evidencia 1a). El tratamiento induce un ligero pero significativo incremento del riesgo de cáncer de mama, más patente en tratamientos prolongados (nivel de evidencia 2a) y de enfermedad tromboembólica (nivel de evidencia 1b).
El raloxifeno es un modulador selectivo del receptor estrogénico. Tiene efectos positivos sobre la masa ósea lumbar y femoral, así como acerca del riesgo de fractura vertebral (nivel de evidencia 1b) y en el análisis de subgrupos no predeterminados (post hoc) ha mostrado eficacia antifractura precoz (nivel de evidencia 2b). No ha demostrado eficiencia en la prevención de fracturas no vertebrales (nivel de evidencia 1b) e incrementa el riesgo de tromboembolia venosa de forma similar a los ES54,55.
Los comunicados recientes tanto de la Agencia Europea de Evaluación de Medicamentos como de la Agencia Española del Medicamento han señalado, tras los resultados del estudio WHI, que el tratamiento hormonal presenta una relación riesgo-beneficio desfavorable, por lo que no se recomienda en la prevención y/o tratamiento de primera línea de la OP56.
Para concluir, señalar que se han desarrollado numerosos algoritmos sobre problemas clínicos en los que se realizan recomendaciones explícitas sobre pacientes con fractura vertebral, con OP sin fracturas o sujetos con fractura no vertebral.
La evidencia muestra que los bisfosfonatos que contienen nitrógeno, alendronato y risendronato, han demostrado inequívocamente su capacidad para mejorar la DMO en el esqueleto axial y apendicular, así como para reducir de manera significativa la incidencia de fracturas vertebrales y no vertebrales en individuos tratados. Estos fármacos deberán considerarse como tratamiento farmacológico de primera línea en la mayoría de los pacientes con OP, u osteopenia con factores de riesgo para la OP57.