INTRODUCCIÓN
La combinación de marcadores bioquímicos y ecográficos para el cribado del síndrome de Down (SD) en el primer trimestre fue motivo de diversos estudios retrospectivos a finales de los años noventa del siglo pasado. La combinación más utilizada empleaba 2 marcadores bioquímicos de primer trimestre, la proteína plasmática A asociada al embarazo (PAPP-A) y la fracción β libre de la gonadotropina coriónica (fβ-hCG), conjuntamente con la translucencia nucal (TN) y los resultados de cada uno de los marcadores modificaban el riesgo epidemiológico basado en la edad materna1-5. Este método de cribado de trisomía 21 en el primer trimestre ha recibido el nombre de Test Combinado, y sus resultados se han publicado desde el año 2000, cuando se ha aplicado prospectivamente en la población general6-15.
En nuestro centro, desde el año 1991, se evaluaron retrospectivamente los marcadores bioquímicos de primer trimestre y la TN en la predicción del riesgo de aneuploidía, en las gestaciones programadas para biopsia de corion16,17. En octubre de 1999 se inició en nuestra unidad un programa prospectivo de intervención para el cribado poblacional en el primer trimestre de la gestación basado en el Test Combinado18. Una característica específica de nuestro programa reside en la práctica de las determinaciones bioquímicas y ecografícas en edades gestacionales, diferenciadas basándose en un análisis previo de nuestros datos retrospectivos, mostrando que en los casos no detectados de trisomía 21 las muestras de suero materno para la determinación bioquímica se habían obtenido después de las 12 semanas, o la ecografía para valoración de la TN se había realizado a las 10-11 semanas. Por esta razón, el estudio fue diseñado para determinar la bioquímica alrededor de las 10 semanas y la ecografía alrededor de las 12 semanas.
MATERIAL Y MÉTODOS
Desde octubre de 1999 hasta diciembre de 2003, se estudiaron 4.712 gestaciones únicas consecutivas, de bajo riesgo para aneuploidía, durante el primer trimestre. Para las gestantes de 38 o más años, el programa público de diagnóstico prenatal establecido por el Departamento de Sanidad en Cataluña, ofrece un procedimiento invasivo, pero se informó a las gestantes en este grupo de edad que podían también optar por el test previo de cribado para una mejor definición del riesgo, en el marco del presente estudio. Entre las 9 y las 10 semanas de gestación por amenorrea, se realizó una extracción de sangre materna para determinación sérica de PAPP-A y fβ-hCG, en muestras no congeladas y mediante un ensayo inmunofluorométrico (Delfia, Wallac, PerkinElmer®) previamente descrito16. Debido a que en el 98% de las gestaciones el decalaje entre la edad gestacional por amenorrea y por ecografía es inferior a 2 semanas, sólo en un 2% del total de gestantes se determinó la bioquímica fuera del período 7-12 semanas.
El protocolo de este estudio de intervención fue aprobado por el Comité de Ética e Investigación Clínica de nuestro hospital y el consentimiento informado se obtuvo antes del análisis materno durante la primera visita con el genetista clínico de nuestra unidad. Se programó una exploración ecográfica a las 12 semanas por amenorrea (Eccocee SSA 340A/EA, and Power-Vision 400, Toshiba Medical Systems; Tokio, Japón), asumiendo que podría corresponder a una ventana entre las 10 y 14 semanas en edad gestacional real. Se midió la longitud craneocaudal (CRL) y la TN, inicialmente en un corte transversal como se ha descrito previamente17, y desde 2001 en un corte sagital siguiendo los criterios establecidos por la Fetal Medecine Foundation19. Inmediatamente después de la ecografía, los datos ecográficos fueron transmitidos al Servicio de Bioquímica, y se ajustó la edad gestacional en el momento de la extracción de sangre en función de la CRL18. Los valores obtenidos de PAPP-A, fβ-hCG y TN se convirtieron en múltiplos de la mediana (MoM) para la correspondiente semana gestacional, y el riesgo para el síndrome de Down se calculó con el software Delfia (Delfia, Wallac, PerkinElmer®), sin aplicar un algoritmo específico para la trisomía 18.
El mismo día de la ecografía, el genetista clínico informó y comentó los resultados obtenidos, y ofreció la práctica de una biopsia corial el mismo día, siempre que el riesgo a término para trisomía fuera 1:250 o superior. En casos de bajo riesgo, se comentaron las limitaciones del test de cribado, con la obtención del documento firmado de conformidad o, en su caso, de rechazo para la práctica del procedimiento invasivo.
En los casos en que el parto no fue atendido en nuestro centro, los datos más relevantes relacionados con el resultado perinatal se obtuvieron por consulta telefónica o, en su defecto, se contactó con su obstetra. Los casos sin seguimiento o de pérdida fetal sin cariotipo conocido se excluyeron del estudio. Sin embargo, para minimizar la posibilidad de un falso negativo desconocido, en los casos excluidos se consultó el Registre de Defectes Congènits de la Ciutat de Barcelona, que recoge datos de las gestaciones afectadas de cromosomopatía observadas, tanto en recién nacidos vivos como en los casos de muerte intrauterina, aborto o interrupción voluntaria.
RESULTADOS
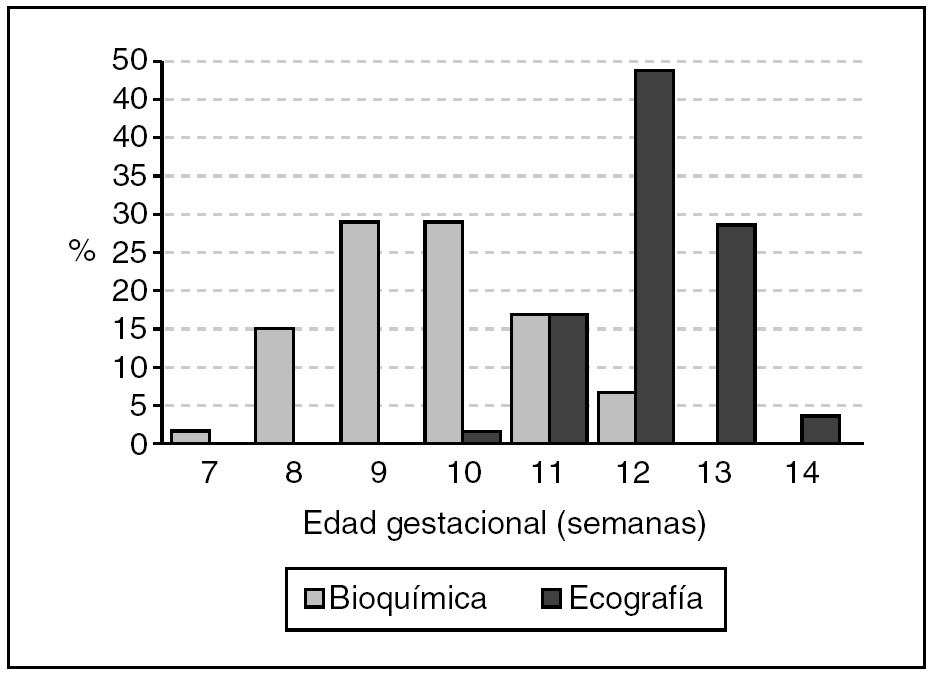
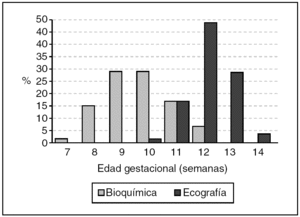
De las 4.712 gestantes con muestra para bioquímica, 141 no completaron el Test Combinado, 83 (1,8%) de ellas porque la edad gestacional estaba fuera de los límites previamente establecidos para el estudio y 58 (1,2%) no se presentaron para realización de ecografía por motivos diversos. Completaron el test 4.571 gestaciones, de las cuales 99 (2,2%) fueron excluidas por falta de seguimiento perinatal y 25 (0,5%) por pérdida fetal sin cariotipo conocido. En las restantes 4.447 gestaciones, la edad materna osciló entre 14 y 45 años, con una media de 31,1 años. El rango de la edad gestacional el día de la extracción de la muestra de sangre fue de 7 a 12 semanas después de la corrección por ecografía (aunque programada entre las 9-10 semanas por amenorrea), con una media de 9,5 semanas (fig. 1).
Figura 1. Distribución de la edad gestacional en el momento de la realización de los estudios bioquímico y ecográfico.
La ecografía se realizó entre las 10 y las 14 semanas, con una media de 12,1 semanas (aunque programada a las 12 semanas por amenorrea). El lapso medio entre bioquímica y ecografía fue de 2,3 semanas. La tasa de cribados positivos (verdaderos + falsos) fue del 4,2% (186/4.447), y todas las gestantes con "test positivo" optaron por la práctica de una biopsia corial. Se observaron 23 anomalías cromosómicas (el 0,5% de la población estudiada) por análisis citogenético prenatal o por seguimiento neonatal, 12 de las cuales estaban entre las 987 gestantes con edades a partir de los 35 años (el 1,2% en este grupo de edad).
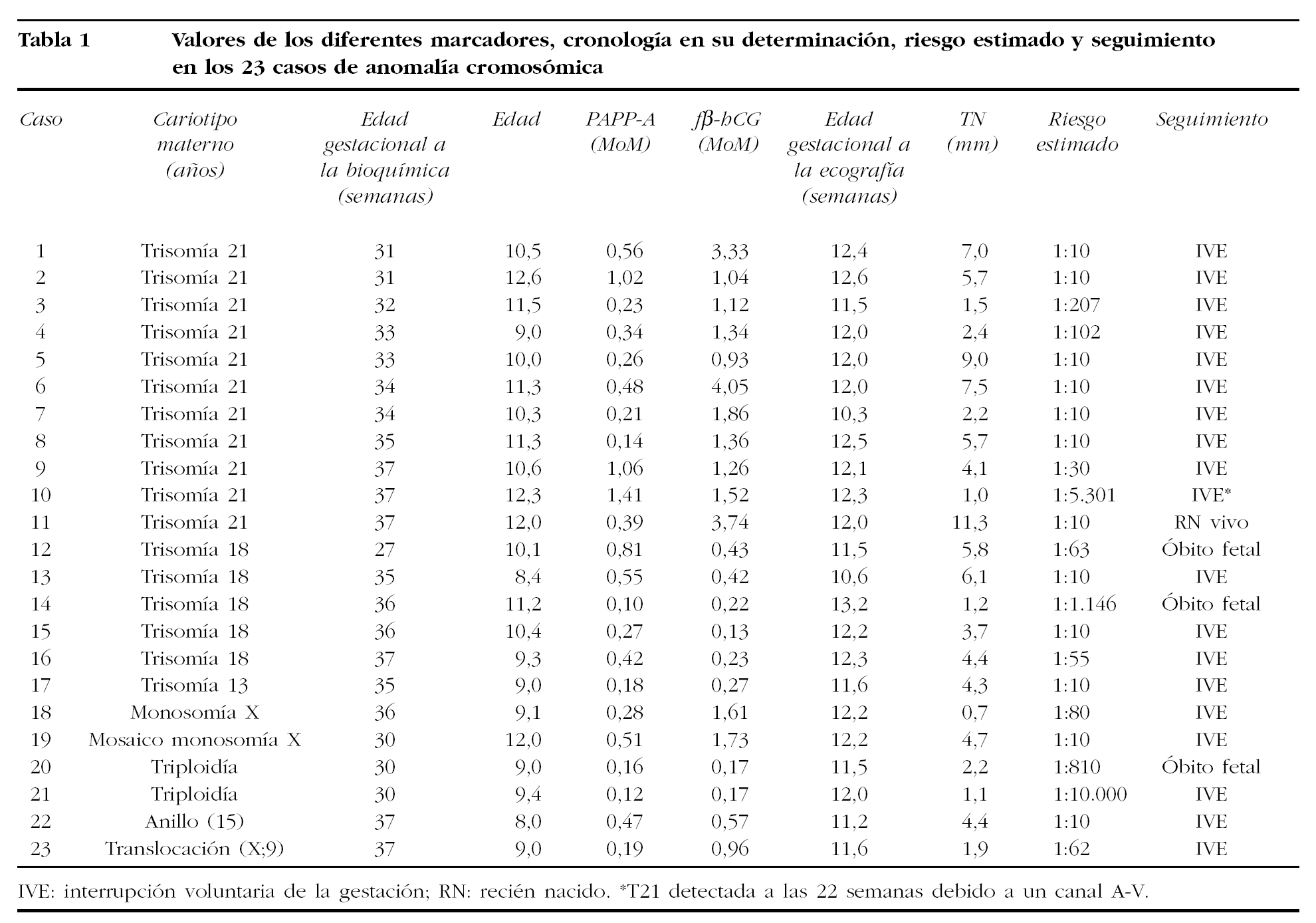
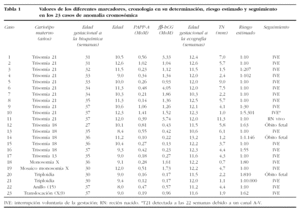
Las 23 anomalías cromosómicas observadas correspondían a trisomía 21 (11), trisomía 13 o 18 (6) y anomalías cromosómicas estructurales desequilibradas (6). Los valores obtenidos para cada uno de los marcadores y los riesgos estimados para trisomía 21 se recogen en la tabla 1. Los valores de los marcadores en las gestaciones trisómicas estaban alterados como era previsible: a) la PAPP-A estaba disminuida en las trisomías 21 con un valor medio de 0,55 MoM y en las trisomías 13 o 18 con un valor medio de 0,39 MoM; b) la fβ-hCG estaba aumentada en las trisomías 21 con un valor medio de 1,95 MoM y disminuida en las trisomías 13 y 18 con un valor medio de 0,28 MoM; c) la TN estaba elevada en ambas trisomías, en la 21 con un valor medio de 5,2 mm y en la 18 de 4,2 mm (tabla 2).
Las tasas de detección alcanzadas con el algoritmo fue del 91% (10/11) para la trisomía 21, del 83% (5/6) para la trisomía 13-18 y del 67% (4/6) para las restantes cromosomopatías. En uno de los 10 casos detectados de trisomía 21, la pareja optó por proseguir el curso la gestación, y mediante cesárea se obtuvo un recién nacido a las 37 semanas. En el único caso de trisomía 21 no detectado mediante el Test Combinado, se diagnosticó un canal atrioventricular en el estudio ecográfico a las 22 semanas y la pareja optó por una interrupción (caso 10 en tabla 1). En las restantes anomalías cromosómicas se procedió a una interrupción inducida o se produjo la muerte fetal espontánea (tabla 1).
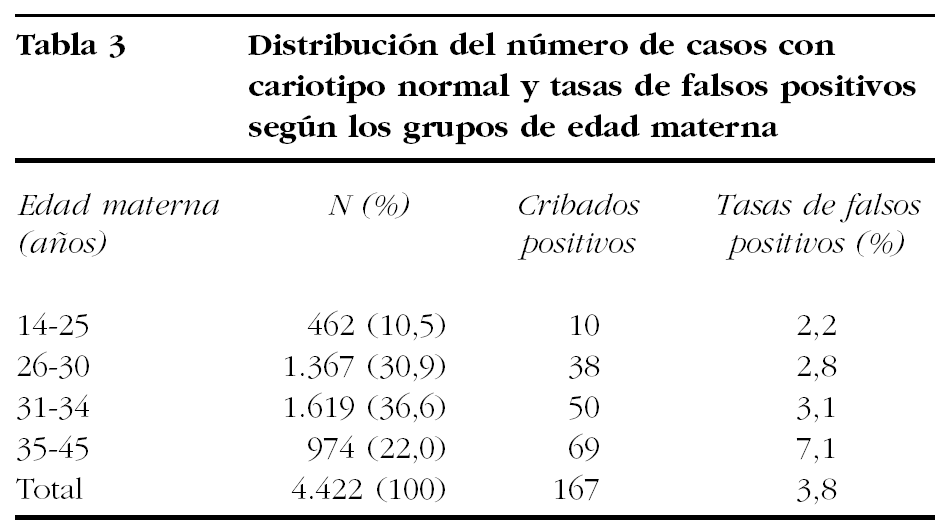
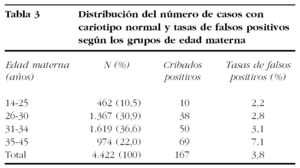
La tasa global de falsos positivos fue del 3,8% (167/4.423) y del 7,1% si se restringe al grupo de edad materna más elevada (35-45 años) (tabla 3). De las 99 gestaciones sin seguimiento excluidas del estudio, ninguna estaba incluida en el Registre de Defectes Congènits de la Ciutat de Barcelona, donde constan todas las anomalías cromosómicas en recién nacidos, muertes intrauterinas y abortos espontáneos o inducidos, por lo que razonablemente pueden descartarse los falsos negativos en este reducido grupo.
DISCUSIÓN
En los años setenta del siglo pasado, se estableció la edad materna avanzada como el criterio principal en la selección de la población con mayor riesgo de cromosomopatía y se fijó, un tanto arbitrariamente, en los 35 años. Este criterio ha pervivido hasta la actualidad a pesar de haber demostrado sus grandes limitaciones, ya que permite detectar sólo un 30% de las gestaciones afectadas de síndrome de Down. Por otra parte, el aumento progresivo en la edad de la población gestante ha generado un incremento notable del número de procedimientos invasivos basándose en una edad materna avanzada. Así pues, en Cataluña, el porcentaje de gestantes de 35 o más años en el año 2004 fue del 22%.
La implementación del cribado bioquímico del síndrome de Down en el segundo trimestre de la gestación, descrito en 198820, ha permitido aumentar el índice de detección hasta el 65%. En nuestro centro se realizó durante 6 años (1993-1998) el estudio piloto21 que permitió la recomendación para su aplicación en 1998 por el Servei Català de la Salut como programa público de cribado en Cataluña. En la actualidad ya existen datos epidemiológicos concluyentes que reflejan el impacto poblacional que el cribado bioquímico ha tenido sobre la disminución en la prevalencia de recién nacidos afectados de síndrome de Down22,23. Como inconvenientes del cribado bioquímico de segundo trimestre se han señalado el alto número de falsos positivos, traducido en amniocentesis innecesarias (el 11% en nuestra experiencia21) y el relativamente dilatado lapso de tiempo que transcurre entre el cribado y una eventual interrupción de la gestación, habitualmente entre las 15 y 20 semanas de gestación.
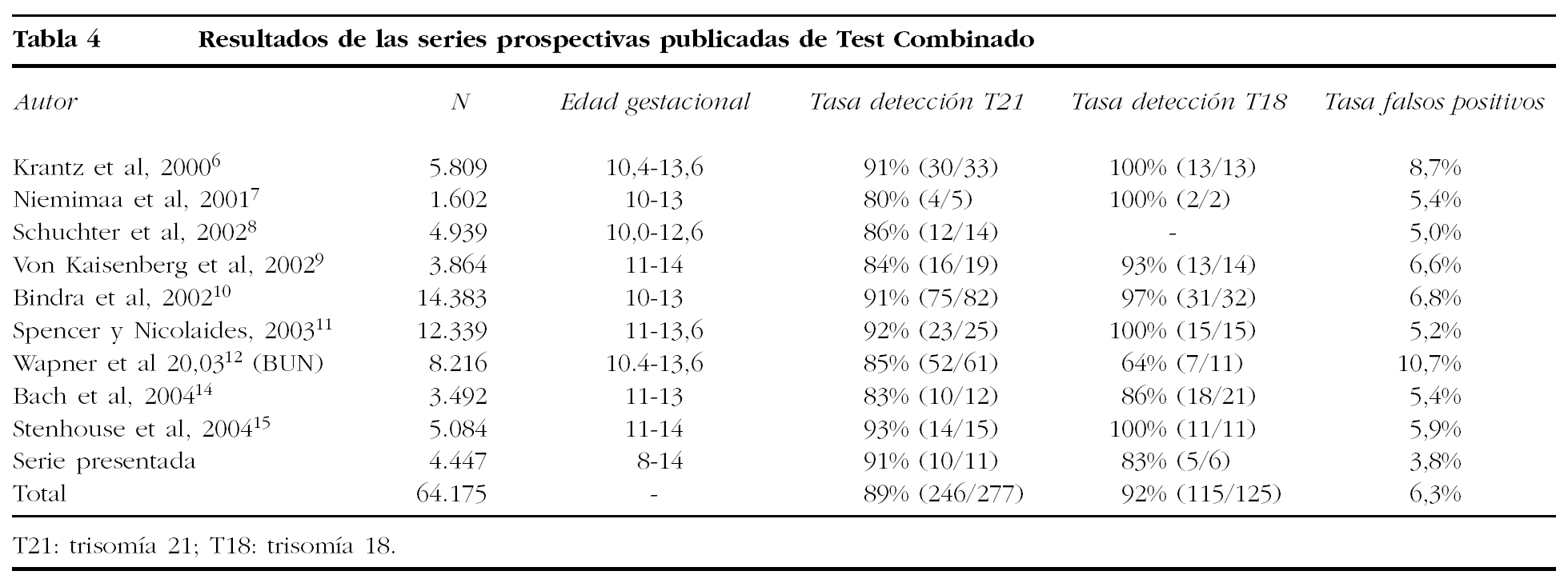
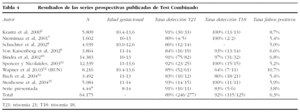
El Test Combinado de primer trimestre ofrece mayor precocidad y fiabilidad en el cribado del síndrome de Down. Comparando los presentes resultados con los previamente publicados en 9.401 cribados de segundo trimestre en una población de características similares de nuestro centro21, el índice de detección aumenta del 65 al 91%, paralelamente a una remarcable reducción de los falsos positivos, que pasan del 11 al 3,8%. Mientras que la tasa de detección observada es coherente con las cifras publicadas en la bibliografía, que oscilan entre el 80 y el 93%, la tasa de falsos positivos en nuestra serie (3,8%) es la más reducida de todas las series prospectivas publicadas, que oscilan entre el 5 y el 10%6-12,14,15 (tabla 4). Esta reducción en los falsos postivos adquiere mayor relevancia si se tiene en cuenta que el 22% de las gestantes en la serie presentada tiene una edad superior a los 34 años. La implementación del Test Combinado en España tiene grandes potencialidades: por un lado, la capacidad de aumentar la tasa de detección de trisomía 21 en zonas que todavía utilizan la edad materna como criterio principal de cribado24; por otro, permitiría disminuir el número excesivo de procedimientos invasivos que se realizan en otras zonas (en Barcelona, la tasa de procedimientos invasivos es del 30%; http://www.aspb.es/ quefem/docs/REDCB_informe2003.pdf).
En series ya publicadas sobre el Test Combinado, la determinación bioquímica materna y la ecografía se realizan en el mismo día, dentro del período gestacional óptimo para la ecografía. En el método OSCAR (one stop clinic assessment of risk)5, los resultados se comunican a la gestante el mismo día, pero en la mayoría de las series se difiere algunos días. Nuestra estrategia de realizar los estudios bioquímicos y ecográficos en 2 momentos diferenciados (two-stop) se diseñó basándose en el análisis previo de datos retrospectivos de nuestra unidad, que mostraba que en todos los casos de trisomía 21 no detectables por Test Combinado la bioquímica se realizó demasiado tarde (> 12 semanas) o la ecografía demasiado pronto (< 11 semanas). En este sentido, está bien establecido que el valor discriminativo de la PAPP-A disminuye progresiva y significativamente desde la semana 6 hasta la 1425. Dado que nuestra serie es la única en la que bioquímica y ecografía se han aplicado en las edades gestacionales razonadamente distintas, parece también razonable que esta diferencia metodológica pueda explicar la tasa más baja de falsos positivos, equivalente a una disminución de procedimientos invasivos. Aun aceptando la posible inconveniencia de acudir 2 veces al centro (alrededor de la 9 y la 12 semanas), nuestro enfoque permite por otro lado disponer de los resultados el mismo día de la ecografía (como en la metodología OSCAR), sin necesidad de posponerlo hasta unos días después, como es el caso de la mayoría de las series.
Finalmente, merecen un comentario aparte los resultados del amplio estudio colaborativo europeo SURUSS (serum, urine and ultrasound screening study) Trial, publicados en 200313 y que han tenido un considerable impacto en el diseño de las políticas sanitarias de cribado en diversos países. En este estudio se realizó la bioquímica y la ecografía en un mismo día entre las semanas 8 y 14 en 47.053 gestantes. Estos datos no fueron desvelados hasta obtenerse el resultado de la bioquímica de segundo trimestre para su integración en un cálculo de riesgo global. Con ello se excluyeron todos los casos de pérdida fetal espontánea (con cariotipo normal o cromosomopatía) previa a la obtención de los datos de bioquímica del segundo trimestre. Los resultados mostraron que, asumiendo un 5% de falsos positivos, el Test Combinado hubiera detectado el 83% de las trisomías 21 y que, esperando el resultado del Test Integrado de primer y segundo trimestres, la detección se eleva al 93%. Sin embargo, en nuestra opinión, esta mejora en la tasa de detección del Test Integrado sobre el Combinado no compensa su más dificultosa aplicación clínica y su menor aceptabilidad por parte de la gestante, porque pospone cualquier resultado hasta el final del estudio.
Un programa de cribado destinado a seleccionar a la población de alto riesgo no puede desligarse de las pruebas diagnósticas a aplicar en aquellos resultados positivos. La ventaja de la precocidad que ofrece el Test Combinado no es coherente con una espera hasta la semana 15 para la práctica de una amniocentesis en la semana 15 y un resultado citogenético a las 18 semanas. La biopsia corial, al contrario, permite optimizar las ventajas del cribado de primer trimestre ya que puede practicarse cuando se conoce el resultado del cribado y se dispone de un resultado citogenético en un plazo de 3-7 días26. Las ventajas de obtener un diagnóstico de cromosomopatía en el primer trimestre ya han sido suficientemente señaladas, pero también deben tenerse en cuenta los beneficios de la precocidad en un diagnóstico de cariotipo normal que permite avanzar la plena aceptación de la gestación.
Este estudio fue realizado en parte mediante subvencion del Ministerio de Sanidad. Becas FIS 99/0274 y FIS 02/0627.