La psoriasis es una enfermedad inflamatoria crónica y recidivante, que afecta principalmente a la piel y sus anejos. Es un proceso poligénico de alta prevalencia pues afecta entre el 1–3% de la población, con más de 125 millones de personas con psoriasis en todo el mundo1. Clínicamente se caracteriza por placas eritemato-descamativas bien delimitadas, localizadas principalmente en codos, rodillas o región glútea, que evolucionan por brotes. Aunque presenta otras formas clínicas menos frecuentes, como la psoriasis en gotas, eritrodérmica, pustulosa, invertida o ungueal. La gravedad es variable, desde formas leves o moderadas, hasta severas, con importante afectación de la superficie corporal. Histológicamente presenta una proliferación epidérmica con diferenciación anormal de los queratinocitos, y un infiltrado inflamatorio mediado principalmente por linfocitos T.
El impacto de la psoriasis sobre la calidad de vida es muy significativo. Los pacientes presentan depresión y ansiedad con mucha frecuencia2,3 y una baja puntuación en las escalas de calidad de vida, explicado por la morbilidad que ocasiona la propia enfermedad y la presencia de comorbilidades asociadas.
La enfermedad cardiovascular con sus tres vertientes, la cardiopatía isquémica, la enfermedad cerebrovascular y la enfermedad arterial periférica, constituyen una de las principales causas de mortalidad (30%) y de años potencialmente perdidos en los países desarrollados4. La ateroesclerosis, que subyace a todas estas enfermedades, es un proceso lento y silente, que suele estar avanzado cuando aparecen los primeros síntomas, siendo entonces el tratamiento, en muchas ocasiones paliativo. En este sentido, los médicos tienen una labor muy importante, detectando aquellos sujetos en riesgo y fomentando medidas de prevención primaria y secundaria.
Recientemente, se ha prestado gran interés al incremento del riesgo cardiovascular en los pacientes con psoriasis5, como ocurre en otras enfermedades inflamatorias crónicas, como el lupus eritematoso o la artritis reumatoide. Sin embargo, no es nueva la asociación de la psoriasis con algunos factores de riesgo cardiovascular como la obesidad, el tabaquismo, la dislipemia e incluso un incremento de la mortalidad en pacientes hospitalizados graves6. El conocimiento en profundidad de la fisiopatología de la psoriasis, en la que están implicados los linfocitos Th1 y Th17, que liberan gran cantidad de citoquinas7 (TNF-α, IL8, IL6, IL17, IL1, IL23…) responsables de la formación de las lesiones de psoriasis, además de permitir el diseño de nuevos fármacos, que bloquean estas señales inflamatorias con muy buenos resultados clínicos, ha puesto de manifiesto que algunas de la citoquinas implicadas en la patogenia de la psoriasis también lo están en la enfermedad cardiovascular8.
El dermatólogo suele ser con frecuencia el único médico que atiende a los pacientes con psoriasis y tiene, por tanto, un papel muy importante en la estratificación del riesgo cardiovascular de sus pacientes. Debe identificar las situaciones de riesgo e iniciar tratamiento preventivo, antes de que se establezca la enfermedad cardiovascular.
Síndrome metabólicoUn porcentaje importante de las personas de más de 40 años, que viven en países desarrollados, padecen algunas de las enfermedades llamadas de la civilización: obesidad, diabetes, hipertensión arterial, o dislipemia. La mayor parte de estas enfermedades no se presenta de forma aislada, sino formando parte del síndrome metabólico (SM), antes llamado síndrome X. El nexo común de estás patologías es la obesidad abdominal y la insulinresistencia cuya consecuencia es la hiperinsulinemia. La importancia del SM es que confiere un riesgo cardiovascular mayor que la presencia de sus componentes individualmente9. Algunos estudios determinan, que los sujetos que cumplen criterios de SM según los parámetros de la ATP-III presentan un riesgo 2,59 veces mayor de tener un evento cardiovascular en los próximos 10 años10.
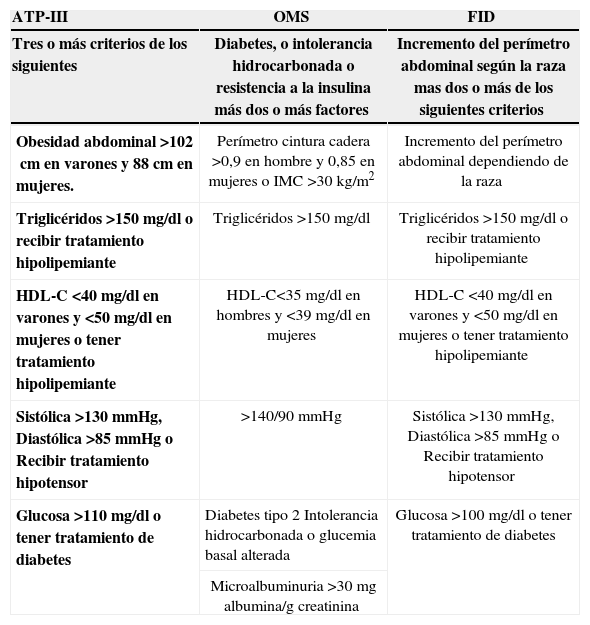
Existen varios grupos de criterios para el diagnóstico del SM, propuestos por diferentes organismos: la Organización Mundial de la Salud11, el Grupo Europeo para el Estudio de la Resistencia a la Insulina12 y el Third Report National Cholesterol Education Program Expert Panel On Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (ATP III)13 (tabla 1). De todos ellos, los más utilizados son los de ATP-III, por su facilidad de aplicación en la práctica clínica y porque algunos autores han descrito una mejor correlación con la presencia de enfermedad cardiovascular, que con los otros criterios14.
Criterios de síndrome metabólico según el National Cholesterol Education Program Adult Treatment Panel-III (ATP-III), la Organización Mundial de la Salud (OMS) y la International diabetes Federation (FID)
| ATP-III | OMS | FID |
| Tres o más criterios de los siguientes | Diabetes, o intolerancia hidrocarbonada o resistencia a la insulina más dos o más factores | Incremento del perímetro abdominal según la raza mas dos o más de los siguientes criterios |
| Obesidad abdominal >102cm en varones y 88cm en mujeres. | Perímetro cintura cadera >0,9 en hombre y 0,85 en mujeres o IMC >30kg/m2 | Incremento del perímetro abdominal dependiendo de la raza |
| Triglicéridos >150mg/dl o recibir tratamiento hipolipemiante | Triglicéridos >150mg/dl | Triglicéridos >150mg/dl o recibir tratamiento hipolipemiante |
| HDL-C <40mg/dl en varones y <50mg/dl en mujeres o tener tratamiento hipolipemiante | HDL-C<35mg/dl en hombres y <39mg/dl en mujeres | HDL-C <40mg/dl en varones y <50mg/dl en mujeres o tener tratamiento hipolipemiante |
| Sistólica >130mmHg, Diastólica >85mmHg o Recibir tratamiento hipotensor | >140/90mmHg | Sistólica >130mmHg, Diastólica >85mmHg o Recibir tratamiento hipotensor |
| Glucosa >110mg/dl o tener tratamiento de diabetes | Diabetes tipo 2 Intolerancia hidrocarbonada o glucemia basal alterada | Glucosa >100mg/dl o tener tratamiento de diabetes |
| Microalbuminuria >30mg albumina/g creatinina |
Los criterios diagnósticos de diabetes mellitus han sido expuestos en el texto. La intolerancia a la glucemia en ayunas se define como niveles de glucosa basales entre 100–125mg/dl y la intolerancia hidrocarbonada cuando tras una prueba de sobrecarga de glucosa con 75g la glucemia oscila entre 140–199mg/dl.
La prevalencia de SM tiene importantes variaciones según los distintos países, con cifras menores en los países en vías de desarrollo, aunque se está registrando un rápido incremento15. Además, su prevalencia aumenta con la edad, sobre todo a partir de los 60 años16. En España, la prevalencia del SM según estudios realizados en Murcia y Albacete, es sobre el 20%17,18. En otros países como Estados Unidos, la prevalencia es del 25%, frente al 10% de Francia o al 20% de Australia19.
Algunos autores han estimado que la prevalencia de SM en pacientes con psoriasis es mayor que en la población general. Gisondi20, utilizando los criterios de la ATP-III, encuentra una prevalencia del 30,1%, en relación al 20,6% del grupo control, tras estudiar por edad y sexo. Sommer21, utilizando los criterios de la OMS establece una OR de 5,29 para los pacientes con psoriasis. Según nuestra experiencia, los pacientes con psoriasis, presentan en un 40% criterios de SM, según la ATP-III con una OR similar al estudio de Sommer. No se ha establecido una relación directa entre la severidad de la psoriasis y el SM, pero sí se asocia con la duración de la enfermedad, sobre todo a partir de los 40 años. A pesar de que algunos estudios no han encontrado una mayor prevalencia de SM en pacientes con psoriasis, sí lo relacionan con algunos de sus componentes como la obesidad, la diabetes, la dislipemia o la hipertensión22,23.
Obesidad abdominalSegún los parámetros de la ATP-III, se considera cuando el perímetro abdominal es superior a 102cm en los varones y 88cm en las mujeres, aunque modificaciones recientes establecen que con valores inferiores, puede ya aparecer resistencia a la insulina (90–102cm en los varones y 80–88cm en las mujeres)24. El excesivo perímetro abdominal, se ha definido como criterio imprescindible para considerar que existe SM. Este síndrome representa un verdadero problema de salud pública, donde en algunos países, como Estados Unidos, afecta a más de un tercio de la población25. La grasa abdominal se considera como un verdadero órgano endocrino, que produce liberación de ácidos grasos libres y citoquinas, relacionadas con la resistencia a la insulina, elemento clave en la patogenia del SM, promoviendo la inflamación y la disfunción endotelial.
Otra forma de determinar la obesidad es mediante el índice de masa corporal (IMC), que se calcula dividiendo el peso en kilogramos, entre la altura en metros al cuadrado. Se considera obesidad cuando el cociente es superior a 30kg/m2. La obesidad y el aumento de perímetro abdominal se asocian al resto de los factores de SM (diabetes tipo 2, apnea del sueño, hipertensión, dislipemia, infarto agudo de miocardio…)26 y demás a un incremento de la mortalidad27. La asociación con la psoriasis ha sido puesta de manifiesto en diferentes estudios epidemiológicos y ensayos clínicos sobre los nuevos tratamientos, y afecta principalmente a mujeres que desarrollan formas más severas de psoriasis28–30. Nosotros hemos observado un incremento del perímetro abdominal en pacientes con psoriasis, que presentan valores medios superiores a 102cm., tanto en hombres como mujeres, y que se correlaciona de forma positiva con el PASI. Se ha demostrado que el riesgo de padecer psoriasis se asocia con valores superiores de IMC23, aunque otros estudios sugieren que la obesidad es secundaria y no precede al debut del psoriasis31, existiendo una correlación positiva entre los valores del BSA/PGA y el IMC32. Es posible que la depresión, conducta antisocial, los hábitos alimenticios, el sedentarismo y el consumo de alcohol favorezcan la obesidad, pero esta relación se explica fundamentalmente por la fisiopatología común de ambas enfermedades (IL-6, TNF-α, PAI-1)33.
Estudios recientes demuestran un incremento de la prevalencia de hígado graso no alcohólico, en pacientes con psoriasis asociado a obesidad abdominal, SM y artritis psoriásica34, con lo que en estos pacientes se incrementa el riesgo de hepatopatía, producida por metotrexate, desarrollando fibrosis hepática con dosis menores35.
El tratamiento de la obesidad continúa siendo un auténtico reto para médicos y pacientes. Además de las conocidas medidas no farmacológicas, como la dieta y el ejercicio físico, se pueden utilizar algunos fármacos como la sibutramina (un inhibidor de la recaptación de noradrenalina y serotonina) o el orlistat (un inhibidor de las lipasas) aunque estos no estarían exentos de efectos adversos. La cirugía bariátrica se reserva para aquellos casos de obesidad mórbida seleccionados y, generalmente, con IMC superior a 40kg/m2. A pesar de que no hay estudios con series importantes de pacientes, se han documentado algunos casos de mejoría de la psoriasis solo modificando el estilo de vida y algunos parámetros del SM, como la obesidad36.
HipertensiónLos criterios de la ATP-III consideran hipertensión cuando las cifras son superiores a 130/85mmHg o el paciente toma tratamiento antihipertensivo. Las guías de práctica clínica recomiendan iniciar el tratamiento cuando los cifras son superiores a 140/90mmHg, sin embargo, en pacientes que asocian diabetes, como le sucede a muchos pacientes con psoriasis, se debe comenzar cuando los valores son superiores o iguales a 130/80mmHg. Los pacientes tratados con retinoides orales o ciclosporina, deben de ser vigilados estrechamente, porque tienen más riesgo de tener cifras de tensión arterial elevadas. Numerosos trabajos establecen una mayor prevalencia de hipertensión, en pacientes con psoriasis asociado a otros factores de riesgo cardiovascular, en el contexto del SM. Los pacientes con psoriasis severa presentan una prevalencia media de hipertensión del 20%, mientras que cuando la psoriasis es moderada, esta prevalencia sería del 15%37,21. En nuestro estudio hemos observado unas cifras medias de tensión arterial sistólica y diastólica más elevadas, en hombres y mujeres, que en otros pacientes sin psoriasis (28 y 18mmHg más altas respectivamente). Sin embargo, no todos los trabajos encuentran esta asociación20.
El tratamiento de la hipertensión debe iniciarse de forma precoz. Cuanto mayores son las cifras medias de tensión arterial, mayor es el riego de infarto de miocardio, de enfermedad cerebrovascular o fracaso renal. Ensayos clínicos demuestran que el tratamiento correcto de la hipertensión arterial, disminuye el riesgo de insuficiencia cardíaca en más del 50%, el de infarto de miocardio en el 25% y el de enfermedad cerebrovascular en el 40%38. En pacientes con hipertensión no complicada, se debe iniciar el tratamiento con diuréticos de tipo tiazídico, teniendo en cuenta que muchos pacientes requieren la asociación de dos fármacos para un correcto control39. El uso de betabloqueantes se desaconseja en pacientes con psoriasis, porque puede agravar el cuadro cutáneo40. Además, otros fármacos como los IECAS, ARA-II, o los propios diuréticos tiazídicos, se han asociado con empeoramiento de la psoriasis, con lo que su utilización debe ser cuidadosa41. A pesar de esto, algunos IECAS han demostrado ser beneficiosos, evitando la progresión de la placa de ateroma42. El tratamiento farmacológico debe ir acompañado de una dieta adecuada y la realización de ejercicio físico. Es importante que los pacientes se sientan motivados para mejorar la adherencia al tratamiento, y en este aspecto, el dermatólogo tiene un papel importante que desarrollar.
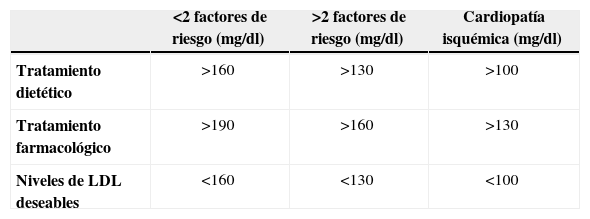
DislipemiaDos son los criterios referidos en los parámetros del SM: uno de ellos es la hipertrigliceridemia (>150mg/dl) y el otro, los valores bajos de HDL-C (<40mg/dl en el varón y <50mg/dl en la mujer). Numerosos estudios han relacionado la psoriasis, con valores elevados de LDL y colesterol total37. La relación entre los niveles elevados de colesterol y la enfermedad cardiovascular está bien documentada, de manera que se produce un descenso importante del riesgo, cuando se disminuyen los niveles plasmáticos43. Gisondi demostró que los pacientes con psoriasis, presentan valores más elevados de triglicéridos, sin diferencias en los niveles de HDL-C, con el grupo control20. Sommer lo relacionó con cifras más elevadas de LDL-C21. Nosotros hemos observado un incremento en los valores medios de triglicéridos, con descenso en los valores de HDL-C, en los pacientes con psoriasis. Sharrett44 determinó que la asociación de los niveles elevados de triglicéridos y bajos de HDL-C, con la presencia de placa de ateroma, no era muy importante, pero, sin embargo, se asociaban fuertemente con la enfermedad coronaria; así, todos estos estudios sugerían que los valores elevados de triglicéridos y los niveles bajos de HDL-C, se relacionaban con la transición de ateroma a aterotrombosis y que, por tanto, el control de estos dos factores de riesgo cardiovascular, es fundamental en pacientes con enfermedad subclínica. Los valores máximos de LDL-C, a partir de los cuales se recomienda tratamiento en pacientes que no asocian otras comorbilidades, son de 160mg/dl; sin embargo, como ocurre en la mayoría de los pacientes con psoriasis, cuando hay otros factores de riesgo concomitantes, como diabetes, tabaquismo, hipertensión, historia familiar de enfermedad cardiovascular o niveles bajos de HDL-C, se debe iniciar el tratamiento al superar los 130mg/dl. Cuando hay antecedentes personales de enfermedad cardiovascular, el tratamiento debe ser iniciado a partir de los 100mg/dl (tabla 2). Los fármacos que mejor reducen los niveles de LDL-C son los inhibidores de la HMG-CoA reductasa (estatinas), aunque el primer escalón del tratamiento, deben ser los cambios en el estilo de vida. En aquellos casos en que las estatinas estén contraindicadas o agraven el psoriasis45, se podrán utilizar otros fármacos como los fibratos, el ácido nicotínico, el ezetimibe, o los quelantes de ácidos biliares. Además, algunos estudios con series cortas de pacientes han demostrado que las estatinas per se (simvastatina 40mg) mejoran el psoriasis, reduciendo el PASI un 47% debido a la inhibición del antígeno leucocitario (LFA-1) y a la disminución de citoquinas producidas por los linfocitos Th146. El uso de estatinas ha demostrado que disminuyen la reacción en cadena de la polimerasa (PCR) en pacientes con enfermedad coronaria, mejoran la distensibilidad arterial y reducen la incidencia de ictus, debido a su acción antiinflamatoria ejercida a través de la inhibición de la actividad de los macrófagos y el descenso en la liberación de citoquinas (factor tisular, metaloproteinasas de la matriz, amiloide A… )47,48.
Recomendaciones de tratamiento hipolipemiante según los niveles de LDL colesterol y teniendo en cuenta los factores de riesgo cardiovascular del paciente
| <2 factores de riesgo (mg/dl) | >2 factores de riesgo (mg/dl) | Cardiopatía isquémica (mg/dl) | |
| Tratamiento dietético | >160 | >130 | >100 |
| Tratamiento farmacológico | >190 | >160 | >130 |
| Niveles de LDL deseables | <160 | <130 | <100 |
Tradicionalmente se ha considerado criterio de SM, la presencia de niveles de glucemia basales superiores a 110mg/dl. Recientemente se ha rebajado esta cifra a 100mg/dl24. Sin embargo, el diagnóstico de diabetes se debe hacer cuando en dos determinaciones, los valores de glucemia basal son superiores a 126mg/dl, o una determinación al azar mayor a 200mg/dl junto con los síntomas clásicos (polidipsia, poliuria, polifagia) o una respuesta anómala al test de sobrecarga oral de glucosa49 (tabla 3). Varios estudios asocian la diabetes tipo 2 y la intolerancia hidrocarbonada en el contexto del SM, con la psoriasis50,51. Algunos trabajos establecen una prevalencia de diabetes del 12% para pacientes con psoriasis grave, y del 10% para moderada, frente al 4% de los controles52. Nuestros pacientes, aunque no presentan mayor porcentaje de diabetes, tienen valores de glucemia en ayunas próximos a los 100mg/dl y superiores al grupo de sujetos sin psoriasis. La inflamación crónica y la liberación de citoquinas de los pacientes con psoriasis, que activan el sistema inmune, se relacionan con la obesidad abdominal y la resistencia a la insulina (elemento previo a la diabetes tipo 2). El tratamiento precoz de la diabetes es fundamental para evitar todas las complicaciones micro (neuropatía, nefropatía y retinopatía) y macrovasculares (infarto de miocardio, ictus, enfermedad arterial periférica), derivadas de esta enfermedad. El tratamiento de la diabetes es complejo y se basa en tres escalones fundamentalmente: la dieta y el ejercicio físico, los antidiabéticos orales y la insulina. La utilización de los niveles plasmáticos de la HbA1c, que debe ser inferior al 7% será de gran utilidad para el control del tratamiento. Algunos fármacos como las tiazolidinedionas, parecen mejorar tanto los niveles de glucemia, como la propia psoriasis, mediante la inhibición de la vía común de la inflamación, activada en las dos enfermedades53. Finalmente, los pacientes con psoriasis y en tratamiento con fármacos sistémicos como el metotrexate, la ciclosporina o el acitretino, deben controlarse más estrechamente los niveles de glucemia, ya que la enfermedad se asocia con mayor riesgo de hiperglucemia, progresión de la diabetes e intolerancia hidrocarbonada54,55.
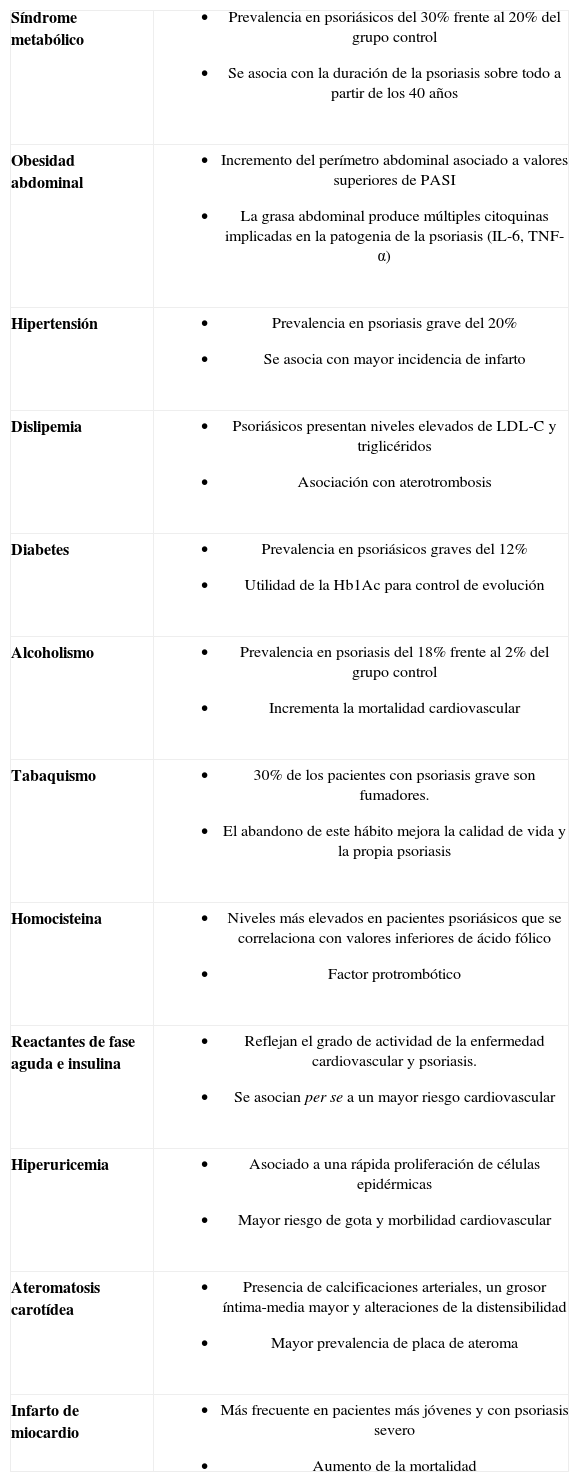
Otros factores de riesgo cardiovascularLa relación de la psoriasis con los principales factores de riesgo cardiovascular, que constituyen el SM, está bien establecida; sin embargo, la psoriasis se ha asociado a otros muchos factores de riesgo, que el dermatólogo debe de reconocer y tratar (tabla 4).
Puntos clave de los principales factores de riesgo cardiovascular asociados a la psoriasis
| Síndrome metabólico |
|
| Obesidad abdominal |
|
| Hipertensión |
|
| Dislipemia |
|
| Diabetes |
|
| Alcoholismo |
|
| Tabaquismo |
|
| Homocisteina |
|
| Reactantes de fase aguda e insulina |
|
| Hiperuricemia |
|
| Ateromatosis carotídea |
|
| Infarto de miocardio |
|
Poikolainen et al56 determinaron, que los pacientes hospitalizados por psoriasis, tenían un consumo más elevado de alcohol y que esto se relacionaba con una mayor mortalidad. Se ha descrito una prevalencia de alcoholismo del 18%, con un mayor riesgo de cirrosis en los pacientes con psoriasis, frente al 2% observado en pacientes con otras dermatosis55. Otros estudios determinan que los sujetos que consumen alcohol, tienen un riesgo 2,55 veces mayor de tener psoriasis57. Se sabe que si el consumo moderado de alcohol puede tener un cierto papel cardioprotector, pero cuando hay un exceso, se produce un incremento de la enfermedad cardiovascular y mortalidad por estas causas58. En nuestra experiencia los pacientes con psoriasis consumen más alcohol que otros pacientes sin psoriasis (42% vs. 32% respectivamente).
El consumo de tabaco también es mayor en los pacientes con psoriasis, con una OR de 2,2957, aunque no todos los autores encuentran diferencias51. Neimann37, en una serie importante de pacientes, establece una prevalencia de tabaquismo para los pacientes con psoriasis grave del 30,1%, del 28% para el psoriasis moderado y del 21,3% para los controles, cifras similares a las observadas en nuestros pacientes (36% en pacientes con psoriasis grave). La nicotina altera la respuesta inmune innata y adaptativa59, incrementa la secreción de citoquinas tipo Th-1 por las células dendríticas60 y acelera la diferenciación de los queratinocitos61. En cualquier caso, se ha demostrado que el dejar de fumar aumenta la esperanza de vida62 y que, el simple hecho de que el médico recomiende a sus pacientes que abandone el hábito tabáquico, aumenta la tasa de abandono hasta en un 30%63. Además podemos recomendar tratamiento con terapia sustitutiva de nicotina en forma de parches, chicles o inhaladores nasales, o antidepresivos como el bupropion, que parece tener buenos resultados.
Los niveles elevados de homocisteina, son un factor de riesgo cardiovascular independiente64, por ser un elemento protrombótico, que incrementa el riesgo de trombosis (venosa, infarto de miocardio, ictus) y embolia pulmonar, sobre todo asociado a otros factores aterogénicos como el tabaco, la hipertensión o la hiperlipidemia. Malerba65 en un estudio con 40 pacientes con psoriasis determinó valores más elevados de homocisteina, que se correlacionaban con los valores del PASI y asociado a cifras inferiores de ácido fólico. Cakmak66 no encuentra diferencias en los niveles de homocisteina ni ácido fólico, pero si una correlación positiva entre el PASI y valores más elevados.
Los valores inferiores de ácido fólico y de vitamina B6, B12, explicarían los niveles más elevados de homocisteina en pacientes con psoriasis. Estos valores pueden deberse a un déficit en la absorción, debido a cambios inflamatorios de la mucosa digestiva67 o por un incremento del gasto como el que se puede dar asociado al recambio celular acelerado68 o al propio tratamiento con metotrexate Otros autores sugieren, que el incremento de homocisteina en estos pacientes, se debe a una liberación mayor por parte de las células del estrado germinativo69. Nosotros hemos encontrado niveles más elevados de homocisteina en los pacientes con psoriasis, asociado a valores normales de ácido fólico. Esto nos conduce a pensar que la elevación en los niveles de homocisteina, puede ser debida a una mayor producción por parte de las células germinativas. A pesar de que la utilización de ácido fólico en pacientes con psoriasis es controvertida, sobre todo en aquellos en tratamiento con metotrexate, porque puede reducir sus efectos70, algunos estudios demuestran que disminuye el riesgo cardiovascular de los sujetos con cifras elevadas de homocisteina. Este hecho debería ser tenido en cuenta en estos pacientes, sobre todo, si asocian otros factores de riesgo cardiovascular71.
Los parámetros de inflamación aguda, como el fibrinógeno72, el dímero D o la PCR, están más elevados en los pacientes con psoriasis. Esto se correlaciona con la actividad de la enfermedad. Además, los pacientes que presentan ateromatosis carotídea o SM, también tienen elevados los reactantes de fase aguda. Se ha comprobado como la inflamación crónica, puesta de manifiesto en este caso por el incremento de reactantes de fase aguda, juega un papel importante en la disfunción endotelial, el SM y la resistencia a la insulina que, además de ser un elemento clave en la patogenia del SM, de la obesidad abdominal y la diabetes, es por sí misma un factor de riesgo cardiovascular, encontrado con frecuencia en pacientes psoriásicos73.
La hiperuricemia también es un hallazgo frecuente en la psoriasis, asociado al aumento del catabolismo de las purinas, debido a la rápida proliferación de las células epidérmicas. Otros artículos asocian la hipercolesterolemia, la hipertrigliceridemia, la obesidad y la alteración renal con la presencia de hiperuricemia en pacientes con psoriasis74. Así, los pacientes que son tratados de la hiperuricemia, también mejoran de la psoriasis. Algunos fármacos usados para el tratamiento de psoriasis pueden incrementar los niveles de ácido úrico, como el acitretino75. En cualquier caso, se debe hacer un screening de hiperuricemia en los pacientes con psoriasis porque, además del riesgo incrementado de gota, per se, asocia una mayor morbilidad cardiovascular76.
La psoriasis se ha asociado además de con todos estos factores de riesgo cardiovascular, a artritis psoriasica, enfermedad de Crohn, linfoma cutáneo de células T, ansiedad, depresión, EPOC… 77,78.
Ateromatosis carotídeaLa presencia de placa de ateroma carotídea y de un grosor íntima-media mayor a 1mm se consideran factores de riesgo cardiovascular. Se asume una patogenia similar entre la ateromatosis coronaria y la cardiaca por lo que, la detección de placa de ateroma carotídea, siendo una técnica menos invasiva, predice el daño coronario44.
Todos los factores de riesgo cardiovascular, que componen el SM, y otros, que también se asocian a la psoriasis, se relacionan con el de daño arterial y la formación de placa de ateroma, que es el paso previo al desarrollo del infarto, el ictus o la enfermedad arterial periférica.
Ludwig define un incremento de la calcificación de las arterias coronarias, realizado en 32 pacientes con psoriasis en relación al grupo control (59,4% vs. 28,1%), mediante la realización de un TAC sin contraste, como medida indirecta de ateromatosis carotídea, concluyendo, que el psoriasis es un factor de riesgo independiente, para el desarrollo de calcificaciones arteriales coronarias79. Estudios posteriores han demostrado que la psoriasis es un factor de riesgo independiente para la presencia de infarto de miocardio, sobre todo, en pacientes más jóvenes y con formas más severas de la enfermedad cutánea80.
Balci, en una serie con 43 pacientes, encontró diferencias significativas en el grosor íntima media carotideo y la dilatación de la arteria braquial, en los pacientes con psoriasis en relación al grupo control. Concluye que los pacientes con psoriasis presentan una disfunción arterial funcional y un mayor grosor de la íntima-media81. Recientemente Gisondi y Soy82,83 han constatado que la velocidad de onda del pulso carótido-femoral es mayor en los pacientes con psoriasis, lo que indica una alteración precoz en la distensibilidad arterial y una susceptibilidad a la ateroeslcerosis. También se han publicado trabajos que demuestran un incremento en el grosor íntima media en los pacientes con artritis psoriásica84. Nuestra experiencia coincide con la de estos autores: los pacientes con psoriasis presentan un grosor íntima media superior al grupo control y, además, la prevalencia de placa de ateroma, definida cuando el grosor íntima-media es mayor a 1,5mm, es muy superior. Sin embargo, los pacientes con psoriasis y sin enfermedad cardiovascular, no presentan alteraciones de la perfusión miocárdica medida mediante SPECT, sugiriendo que los infartos de miocardio en estos pacientes se producen por una estenosis no crítica de las arterias coronarias85.
Psoriasis e inflamaciónA pesar de que la patogenia de la psoriasis no es del todo conocida, la activación de los linfocitos T, juega un papel muy importante en la estimulación de la proliferación de los queratinocitos y la hiperplasia epidérmica. Se liberan citoquinas del perfil Th1 como TNF-α, IL-2 o INF-γ, y los propios queratinocitos activados producen IL-8, IL6, factor de crecimiento transformante α y β… Además el propio TNF-α induce nuevas citoquinas, la presencia de moléculas de adhesión y un incremento de la óxido nítrico sintetasa86. El resultado de esta activación inflamatoria es la formación de la placa psoriásica y, por todo ello, las dos dianas terapéuticas más recientemente empleadas en el tratamiento de la psoriasis han sido los linfocitos T (efalizumab, alefacept) y el TNF-α (infliximab, adalimumab, etanercept). El conocimiento reciente del papel de otras citoquinas, ha permitido el desarrollo de nuevos fármacos, como el ustekinumab, que bloquea la IL-12 y IL-23.
La patogenia del psoriasis, del SM y de la ateromatosis carotídea es común, al compartir una activación de los linfocitos Th187. La obesidad es el elemento clave en la patogenia del SM. El tejido adiposo se comporta como un verdadero órgano endocrino, que libera múltiples proteínas y citoquinas, promotoras de la inflamación y responsables de la resistencia a la insulina y la disfunción endotelial. Por su parte, los pacientes con psoriasis, presentan una liberación similar de citoquinas, en relación con la patogenia de la propia enfermedad, que no solo se encuentran a nivel local, sino distribuidas de forma sistémica. Algunas de las citoquinas más importantes implicadas en ambos procesos son la IL-6, TNF-α, adiponectina, el factor activador del inhibidor del plasminógeno tipo 1 (PAI-1) o la angiotensina II, que tiene un importante efecto hipertensivo, al producir una gran vasoconstricción. El TNF-α se relaciona con la resistencia a la insulina, al favorecer la liberación de ácidos grasos libres. También se relaciona con la hipertensión y la obesidad, pues incrementa sus niveles conforme lo hace el IMC, y facilita la adhesión de los monocitos-macrófagos, a las células endoteliales, iniciando el daño endotelial y, siendo el origen de la formación de las placas de ateroma. La resistencia a la insulina que produce el TNF-α se debe a que inhibe la tirosinkinasa del receptor de la insulina, promueve la proliferación epidérmica y modula la adipogénesis y el metabolismo de la glucosa, suprimiendo la secreción de adiponectina por los adipocitos. Junto con esto, hay un incremento del insulin-like growth factor II88 en los pacientes con psoriasis, que promueve la proliferación epidérmica, además de estar implicado en la ateroesclerosis, la hipelipidemia y la diabetes. El papel del TNF-α en la patogenia de la psoriasis89 ha quedado demostrado gracias a los buenos resultados que obtienen los fármacos que bloquean dicha citoquina. La IL-6, por su parte, se asocia también con la resistencia a la insulina, incrementa las moléculas de adhesión endoteliales y la adhesión plaquetaria, favoreciendo la ateroesclerosis y promoviendo la liberación hepática de reactantes de fase aguda, como el fibrinógeno y la PCR. Algunos estudios relacionan los niveles elevados de IL-6 con mayor rigidez arterial90. Sus niveles plasmáticos, junto con otras citoquinas como la IL-8 e IL-17, se encuentran más elevadas en pacientes que han tenido infarto de miocardio. En nuestro estudio hemos observado que los pacientes con psoriasis y ateromatosis carotídea presentan niveles más elevados de IL-6 y TNF-α.
Los niveles elevados del PAI-1 incrementados por el TNF-α alteran los procesos fisiológicos de la fibrinólisis, favoreciendo la formación de trombosis, sobre todo cuando se asocian con otros factores de riesgo25,91. La adiponectina, por el contrario, tiene una acción opuesta a estas moléculas y, por tanto, protectora del sistema cardiovascular. Sus niveles se correlacionan de forma inversa con el IMC o el índice cintura-cadera. Disminuye la producción de TNF-α, la adhesión de los monocitos a las células endoteliales y la transformación a células espumosas, además de aumentar la sensibilidad a la insulina. Los pacientes con obesidad abdominal, presentan cifras más bajas de adiponeptina25 y esto se ha relacionado un mayor riesgo de infarto en varones92.
Se han encontrado unos niveles más elevados de leptina en pacientes con psoriasis22. Se trata de una hormona producida por los adipocitos que, además de regular la ingesta y la masa corporal, se relaciona con la inflamación crónica regulando el equilibrio de los linfocitos Th1 y 2. Los niveles sanguíneos elevados de esta hormona, que depende en parte de la estimulación de ciertas citoquinas que intervienen en la patogenia del psoriasis, como la IL-1 y la IL-693, se correlaciona también con una incidencia mayor de SM y de infarto de miocardio94.
Otras moléculas de adhesión como ICAM-1, E-selectina y factores angiogénicos, como el factor de crecimiento endotelial vascular (VEG-F), están elevados en la obesidad, la enfermedad coronaria y la psoriasis95. Este último factor se relaciona con la severidad de la psoriasis y además, con la hiperinsulinemia que subyace al SM. Se ha de tener en cuenta también que la inflamación crónica, en el contexto de la psoriasis, altera las vías del metabolismo oxidativo, generando especies reactivas de oxígeno, como el anión superóxido, que favorece el daño arterial96.
Recientemente se han implicado a los Th17 en la patogenia de la psoriasis. Los Th17 se relacionan, con la producción de ciertas citoquinas como la IL-17 y la IL-22, que activan la inflamación en numerosos órganos y sistemas. Además, se han observado niveles elevados de estas IL en pacientes con enfermedad coronaria inestable97.
Los aspectos de la inflamación crónica, angiogénesis y proliferación epidérmica asociada al psoriasis tienen un gran impacto en otros procesos como la diabetes, trombosis y ateroesclerosis y a su vez las moléculas inflamatorias producidas en ciertas condiciones como la obesidad, la diabetes y la ateroesclerosis tienen su influencia en la patogenia del psoriasis aumentado la susceptibilidad al psoriasis o favoreciendo que ésta sea más severa.
Finalmente, de igual forma que la genética juega un papel importante en la patogenia del psoriasis, también lo puede hacer en la enfermedad metabólica, así algunos de los genes relacionados con la psoriasis como el PSORS 2, PSORS 3 y PSORS 4 se asocian también con más susceptibilidad al SM, la diabetes tipo 2, la hiperlipemia y la enfermedad cardiovascular98. A su vez, otros genes como el Apo E4, que se relaciona con mayor riesgo cardiovascular, son más prevalentes en pacientes con psoriasis que en controles99.
Influencia de los tratamientos biológicos en la enfermedad cardiovascularLa presencia de comorbilidades en pacientes con psoriasis, afecta al manejo de ambas enfermedades de forma bidireccional. Hemos comprobado como los fármacos sistémicos clásicos, como la ciclosporina, el acitretino o el metotrexate, pueden agravar diferentes factores del SM y, por tanto, han de manejarse con precaución. Sin embargo, se ha descrito una mejoría del riesgo cardiovascular, en pacientes con psoriasis tratados con metotrexate100. Por otra parte, los nuevos fármacos, dirigidos específicamente frente a dianas terapéuticas comunes del psoriasis y del SM, deberían mejorar ambos aspectos. Algunos trabajos han demostrado que los bloqueantes del TNF-α, reducen los niveles de reactantes de fase aguda, como la VSG o PCR, en pacientes con artritis reumatoide101,102.
La psoriasis y el SM comparten una etiopatogenia común, con un aumento de la actividad de los linfocitos Th1. Los pacientes con SM, presentan valores más elevados del TNF-α y de su receptor, y esto, se relaciona con la obesidad, la alteración en el metabolismo lipídico y la resistencia a la insulina Por tanto, la asociación de psoriasis y del SM se explica por la disfunción de las células Th1103,104. A pesar de que los nuevos fármacos biológicos, que actúan bloqueando el TNF-α, producen respuestas clínicas espectaculares en pacientes con psoriasis y artritis psoriasica, los efectos sobre los componentes del SM no son claros.
El infliximab se ha asociado con un incremento del peso y el IMC al terminar el tratamiento. Gisondi105, en un estudio comparativo con metotrexate, observa un incremento medio de 2,5kg y de 0,8kg/m2 en el IMC; además el 25% de los pacientes, incrementaron su peso entre 4 y 10kg. Saraceno también constató este incremento de peso, sin diferencias entre hombres y mujeres106. Este incremento de peso, sin embargo, no se ha asociado con un aumento del perfil lipídico (LDL-C, TG, colesterol total o descenso del HDL-C)105. En un caso aislado, un paciente con hipertrigliceridemia conocida, empeoró con el tratamiento con infliximab, volviendo a sus valores normales, tras suspender el tratamiento107. No se han publicado datos sobre los efectos de infliximab en la resistencia a la insulina, aunque se ha comunicado un caso de un paciente con artritis psoriásica y diabetes mellitus, que mejoró de la diabetes durante el tratamiento y empeoró al suspenderlo108.
El etanercept al igual que el infliximab, también se ha asociado con un incremento de peso y del IMC, iniciándose a partir de la semana 12, y persistiendo hasta la semana 48, con un mayor incremento en los pacientes más delgados105,106. En relación a la dislipemia, el tratamiento con etanercept, no modifica los valores de colesterol total, triglicéridos, LDL-C o HDL-C, según los estudios publicados105,106. Parece que etanercept mejora la resistencia a la insulina, con un descenso de la insulina en ayunas109.
El adalimumab, al igual que los otros anti-TNF-α, produce un incremento del peso y del IMC, que se hace patente en la semana 12, y se mantiene hasta la semana 48, según los estudios publicados. Sin embargo, hay una tendencia a la pérdida de peso, a partir de la semana 78106. Tampoco se han detectado cambios en los niveles basales de triglicéridos, LDL-C, HDL-C y colesterol total, hasta la semana 48 de tratamiento106. Solo se ha publicado un caso de un paciente con artritis psoriásica, en el que se produjo una elevación del colesterol total y los triglicéridos, a partir de la semana 8, con descenso de las cifras tras suspender el tratamiento110. En relación a la resistencia a la insulina, no se han publicado trabajos. No obstante, hay un caso publicado de un paciente con diabetes bien controlada que, tras iniciar el tratamiento con adalimumab realizaba episodios de hiperglucemia, y mejoró con la retirada del fármaco111.
A pesar de la asociación entre la psoriasis y el SM, explicada en parte por una fisiopatología común, en la que participan citoquinas como el TNF-α, se esperaba que los antagonistas del TNF-α para el tratamiento de la psoriasis, redujesen el riesgo cardiovascular de los pacientes. Sin embargo, aún son pocos los estudios publicados para obtener conclusiones certeras. Algunos trabajos sobre estos fármacos, utilizados en artritis reumatoide, si muestran una clara mejoría de la resistencia a la insulina, relacionada con la disfunción endotelial, y la diabetes mellitus tipo 2, tras el tratamiento con el anti-TNF-α, sobre todo con infliximab, pero habría que extrapolar con precaución estos resultados. No parece que estos fármacos modifiquen en principio el perfil lipídico, aunque la mayoría de los estudios tiene factores de confusión, como otros tratamientos concomitantes. Finalmente, si parece claro un incremento del peso y del IMC. A pesar de ello, mejora el metabolismo de la glucosa, en los pacientes en tratamiento con este grupo de fármacos112. Además, otros estudios han comprobado que los anti-TNF-α disminuyen los niveles de homocisteina, mejoran la función endotelial, reducen la incidencia de eventos cardiovasculares y disminuyen los niveles de reactantes de fase aguda, como la PCR y la IL-6102,113-115.
Las comorbilidades debe tenerse presente en la prescripción de fármacos en los pacientes con psoriasis. En algunos casos, la presencia de depresión o alcoholismo, disminuirá la tasa de adherencia al tratamiento. En los casos de obesidad, algunos fármacos que no están ajustados por peso, pueden ver disminuida su eficacia e incluso, el tratamiento con los nuevos anti TNF-α pueden empeorar la obesidad. En otros pacientes, la presencia de enfermedad hepática, hiperlipoproteinemia o intolerancia hidrocarbonada, limitará la utilización de fármacos clásicos, como el metotrexate o acitretino. En el caso de presentar hipertensión o alteración de la función renal, estará contraindicada la ciclosporina.
ConclusionesLa asociación entre la psoriasis y los factores de riesgo cardiovascular ha sido recientemente comprobada por numerosos autores, especialmente en pacientes jóvenes y con formas severas de psoriasis. Esta situación supone un cambio en la consideración de la psoriasis como enfermedad exclusivamente cutánea o articular, pasando a tener al consideración de una enfermedad inflamatoria crónica con afectación sistémica. El dermatólogo no debe de limitarse a tratar exclusivamente la sintomatología cutánea sino que ha de identificar a aquellos pacientes que presentan un mayor riesgo cardiovascular e iniciar tratamiento precoz cuando sea necesario. Pensamos que la incorporación de los criterios de SM en la práctica diaria del dermatólogo ayudará a estratificar el riesgo cardiovascular de sus pacientes y determinar que fármacos sistémicos para el tratamiento de la psoriasis son los más adecuados sin incrementar el perfil de riesgo cardiovascular (tabla 5). Es posible que los nuevos fármacos biológicos, que bloquean el TNF-α, reduzcan el riesgo cardiovascular, al ser una citoquina común en la patogenia de la psoriasis y del SM, sin embargo aún son necesarios más estudios que confirmen los datos preliminares.
Estudio y abordaje terapéutico de las principales comorbilidades asociadas al psoriasis
| Factor de riesgo | Diagnóstico | Tratamiento |
| Obesidad abdominal | Medición del perímetro abdominal y cálculo del IMC (kg/m2) |
|
| Diabetes | Glucemia basal | |
| Control de evolución con HbA1c |
| |
| Hipertensión | Medición de la TA en reposo en repetidas ocasiones |
|
| Dislipemia | Monitorizar niveles de LDL-C, Triglicéridos y HDL-C |
|
| Tabaquismo y alcoholismo | Cuantificar en cigarrillos/día y gramos de alcohol/día |
|
| Hiperhomocisteinemia | Solicitar en pacientes con factores de riesgo de trombosis |
|
| Hiperuricemia | Niveles plasmáticos de ácido úrico |
|
El dermatólogo debe diagnosticar y orientar el tratamiento de estas enfermedades y remitir al especialista competente en casos de difícil control o de asociación de múltiples patologías.
Los autores declaran no tener ningún conflicto de intereses.