El uso de esteroides posnatales en el tratamiento en pacientes dependientes de la ventilación es controversial. La dexametasona ha demostrado facilitar la extubación, pero se conocen sus efectos adversos a corto y largo plazo como hiperglucemia, hipertensión arterial, hemorragia y perforación gastrointestinal.
ObjetivosDescribir los efectos a corto plazo del tratamiento con esquema de dexametasona a dosis bajas.
Material y métodosEstudio retrospectivo descriptivo de una serie de casos de pacientes ingresados a la unidad de cuidados intensivos neonatales durante el periodo de enero de 2005 a diciembre de 2010 que se mantuvieron con intubación endotraqueal por más de 10 días administrándoles esteroides posnatales para extubación. El esquema utilizado fue: recién nacidos con peso≤1,500g 0.15mg/kg/día; con peso≥1,501g 0.25mg/kg/día; realizando reducción del 50% cada tercer día, hasta completar 9 y 12 días con fines de extubación. Se analizan efectos adversos a corto plazo.
ResultadosCuarenta y seis pacientes recibieron esteroides posnatales para fines de extubación; las características de los pacientes son las siguientes: edad gestacional, 25-39 semanas de gestación; peso de 560-3,140g. El inicio de esteroide posnatal promedio fue a los 34 días de vida, se logró la extubación exitosa a los 7 días de iniciado del esteroide posnatal. Solo se encontró como efecto adverso a corto plazo hiperglucemia en el 13.9% de los pacientes. No se observaron otros efectos como hipertensión arterial, hemorragia y perforación gastrointestinal.
ConclusionesEl uso de esteroides posnatales con dosis bajas facilita la extubación, encontrándose hiperglucemia como efecto secundario a corto plazo.
The use of post-natal steroids in the treatment of ventilation-dependent patients is controversial. Dexamethasone has been shown to be an aid in extubation, but its short and long-term adverse effects such as hyperglycaemia, hypertension, gastrointestinal bleeding, and perforation are also well-known.
ObjectivesTo describe the short-term treatment with dexamethasone scheme at low doses.
Material and methodsA retrospective descriptive study was conducted on patients admitted to neonatal intensive care unit during the period January 2005 to December 2010, and who were maintained with endotracheal intubation for more than 10 days and administered postnatal steroids for extubation. The scheme used was: Newborn infants weighing≤1,500g, a dose of 0.15mg/kg/day, and≥1,501g weight, a dose 0.25mg/kg/day, reduced by 50% every third day to complete 9 to 12 days of late extubation. An analysis was made of the short-term adverse effects.
ResultsA total of 46 patients received post-natal steroids for late extubation. The patient characteristics were as follows: gestational age of between 25 and 39 weeks, and weight 560-3140g. The mean age when starting on steroids was 34 days. Successful extubation was achieved within 7 days of receiving the post-natal steroid. Only one adverse effect of short-term hyperglycaemia was found in 13.9% of patients. There were no other adverse effects, such as hypertension, gastrointestinal bleeding, or perforation.
ConclusionsIn the use of post-natal steroids with low doses to help in extubation, hyperglycaemia was found as a side effect in the short term management with low doses.
En las últimas 4 décadas, con los avances obstétricos en embarazos de alto riesgo, los cambios importantes en atención materna incluyendo el uso universal de esteroides en embarazos menores de 34 semanas de gestación, los avances en el manejo del síndrome de dificultad respiratoria con la introducción del surfactante, el uso de estrategias ventilatorias suaves y la monitorización continua de la saturación de oxígeno se han asociado a un marcado incremento en la supervivencia de recién nacidos prematuros, aunque a costa de una alta morbilidad pulmonar como la displasia broncopulmonar (DBP)1–5.
Los esteroides han demostrado un efecto benéfico en la disminución de DBP en diferentes estudios, favorecen la producción de surfactante y enzimas antioxidantes, disminuyen el broncospasmo, el edema bronquial y pulmonar, la fibrosis, el daño secundario a la respuesta inflamatoria mediada por células y mejora la respuesta a la vitamina A. Pero también se han documentado posibles complicaciones como infección, hipertensión, hiperglucemia, incremento de la proteólisis, supresión adrenocortical, disminución del crecimiento somático y miocardiopatía hipertrófica3,6,7.
Los glucocorticoides afectan la función y enfermedad pulmonar a través de varios mecanismos, la exposición fetal causa un incremento en la formación de surfactante, y diferenciación del epitelio pulmonar. Los corticoesteroides disminuyen el reclutamiento de leucocitos polimorfonucleares del pulmón y reducen la producción de prostaglandinas, leucotrienos, elastasa y otros mediadores de la inflamación; también disminuyen la permeabilidad vascular y la formación de edema pulmonar. Asimismo quizá modulen la reparación posterior al daño pulmonar a través de la reducción de la producción de fibronectina y de la fibrosis por incremento de las concentraciones de retinol. (vitamina A)5.
Halliday informa en un metaanálisis que los corticoesteroides no disminuyeron el riesgo de muerte, pero sí la DBP y el fracaso a la extubación independientemente de la edad de inicio del tratamiento8. A pesar de que los corticoesteroides mejoran a corto plazo la función respiratoria permitiendo la reducción de los requerimientos de oxígeno suplementario y la extubación temprana lo cual teóricamente debería reducir la DBP, estas ganancias no superan los costos de los efectos adversos a largo plazo a nivel de sistema nervioso central3.
En respuesta a estos reportes, en 2002 la Academia Americana de Pediatría y la Asociación Canadiense de Pediatría tras los informes de los efectos adversos de esteroides en el neurodesarrollo recomendaron no usarlos para el tratamiento de DBP. Desde entonces disminuyó el uso de los mismos, siendo utilizados únicamente de manera selectiva en paciente de alto riesgo para DBP3.
Existen un sinnúmero de publicaciones y metaanálisis del uso de esteroides para disminuir la falla a la extubación, desde esquemas cortos a los más largos sin aparentes efectos colaterales y alteraciones neurológicas9–12.
Otros ponderan el beneficio del uso de esteroides para la extubación y disminución de la DBP con efectos colaterales mínimos, sin diferencias significativas para el neurodesarrollo8,9,13–20
Otros autores informan de efectos colaterales como hiperglucemia, hipertensión arterial y alteraciones del neurodesarrollo que van desde parálisis cerebral hasta disminución del perímetro cefálico. El uso de esteroides llegó a ser casi una rutina en los recién nacidos prematuros, un 43% de 1990 a 1992 y hasta un 84% de 1993 a 1995. Desde 1998 un estudio multicéntrico demostró alteraciones en el neurodesarrollo en neonatos tratados con un curso de dexametasona de 4 semanas iniciado dentro de las primeras 12h del nacimiento, con incremento de 2 veces el riesgo de parálisis cerebral y diplejía; asimismo varios estudios han reportado efectos a corto plazo como: hiperglucemia, hipertensión, cardiomiopatía hipertrófica, falla en el crecimiento, perforación intestinal, hemorragia, tasas incrementadas de infección, reducción del perímetro cefálico9,19–21.
Halliday advierte que la terapia con corticoesteroides reduce la mortalidad neonatal (esquema intermedio) y la DBP, pero los efectos adversos a corto plazo son importantes. Parece ser apropiado el uso para los neonatos que no pueden ser retirados de la ventilación mecánica a una dosis mínima y de corta duración. Se sugiere que son necesarias más investigaciones incluyendo seguimiento a largo plazo de supervivientes22.
El objetivo del presente trabajo fue describir los efectos colaterales a corto plazo del tratamiento con esquema de dexametasona a dosis bajas y los porcentajes de éxito para la extubación.
Material y métodosSe realizó un estudio descriptivo, retrospectivo de una serie de casos. Se revisaron los expedientes de los pacientes que recibieron esquema de esteroides en la unidad de cuidados intensivos en el periodo de 2005-2010.
Se capturaron variables demográficas, eventos colaterales, tiempo de extubación y morbilidad en ambos grupos.
El esteroide utilizado fue dexametasona 1ml inyectable que contiene fosfato sódico de dexametasona equivalente a 4mg de fosfato de dexametasona.
El esquema fue: recién nacidos con peso≤1,500g dosis de 0.15mg/kg/día.
Con peso≥1,501g dosis 0.25mg/kg/día; realizando reducción del 50% cada tercer día, hasta completar 9 y 12 días con fines de extubación.
Esquema de 0.15mg: cada 12h
0.15mg/kg/día/iv por 3 días.
0.075mg/kg/iv por 3 días.
0.035mg/kg/iv por 3 días.
Dosis total 0.87mg/kg/total.
Esquema de Halliday: cada 12h.
0.25mg/kg/día/iv por 3 días.
0.12mg/kg/día/iv por 3 días.
0.06mg/kg/día/iv por 3 días.
0.03mg/kg/iv por 3 días.
Dosis total de 1.29mg/kg/total.
A todos los recién nacidos se les anotó en la hoja de enfermería de cada turno los efectos adversos considerados por la utilización de corticoesteroides: Se consideró hiperglucemia:≥150mg/dl (glucosa central); hipertensión arterial sistémica: es el aumento de la tensión arterial por arriba del percentil 90 de acuerdo a la edad gestacional; hemorragia intestinal: cuando sucede una pérdida de sangre del tracto digestivo los síntomas pueden incluir salida de sangre por vía oral en pequeñas o grandes cantidades, vómito de sangre roja o heces con sangre.
Para el análisis se utilizó estadística descriptiva.
ResultadosSe recogieron 46 pacientes que recibieron esteroides posnatales. En cuanto a las características de los pacientes, el promedio del peso al nacer fue de 1,210g, con rango 560-3,140g, la edad gestacional promedio fue de 30.2 semanas, el 54.3% fue masculino, el 79.1% presentó retraso en el crecimiento intrauterino, el 56.5% recibió esteroides prenatales y el 78.2% surfactante profiláctico.
El inicio de los esquemas de esteroides posnatales en ambos casos tuvo un rango de 7-88 días con media de 26.4 días; la duración de la administración fue entre 4 a 17 días, media de 9 días; se logró la extubación entre el día 2 y el 18 con media de 7 días y moda de 31.
De los 46 pacientes estudiados, 43 recibieron un esquema de esteroide, de 0.15mg/kg/día, o 0.25mg/kg/día, en 3 de ellos hubo la necesidad de emplear un segundo esquema de 0.25mg/kg/día.
Con el esquema de 0.15mg se logró el éxito en la extubación en el 74%, en el 26% se consideró fracaso. Respecto al grupo de 0.25mg/kg/día se utilizaron 2 esquemas; para el primero, el éxito en la extubación fue del 80% y en el segundo esquema el éxito fue del 66.6% (tabla 1).
Esquema de esteroide posnatal utilizado y número de esquemas
| Esquema de esteroide 0.15mg/kg/día N=19 | Un esquema N=23 (%) | Dos esquemas N=0 (%) |
|---|---|---|
| Éxito a la extubación | 17(74) | |
| Fracaso | 6 (26) |
| Esquema de esteroide 0.25mg/kg/día N=22 | Un esquema N=20 (%) | Dos esquemas N=3 (%) |
| Éxito a la extubación | 16(80) | 2(66.6) |
| Fracaso | 4(20) | 1(33.3) |
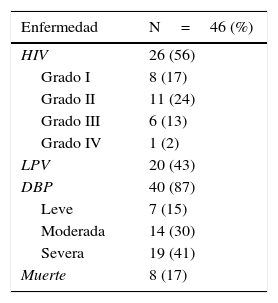
Entre las morbilidades más importantes se encontraron la hemorragia intraventricular con el 56.6% aunque solo el 2% fue grave, leucomalacia periventricular en 43.4%, y DBP severa en el 41%, la muerte se presentó en el 17% (tabla 2).
Morbilidad de los pacientes
| Enfermedad | N=46 (%) |
|---|---|
| HIV | 26 (56) |
| Grado I | 8 (17) |
| Grado II | 11 (24) |
| Grado III | 6 (13) |
| Grado IV | 1 (2) |
| LPV | 20 (43) |
| DBP | 40 (87) |
| Leve | 7 (15) |
| Moderada | 14 (30) |
| Severa | 19 (41) |
| Muerte | 8 (17) |
DBP: displasia broncopulmonar; HIV: hemorragia intraventricular; LPV: leucomalacia periventricular.
En la tabla 3 se describe la hipoglucemia como efecto adverso a corto plazo de los esteroides, predominando entre el 2.o y 7.o día sin reportarse sangrado digestivo o hipertensión arterial.
DiscusiónDurante años se han utilizado los esteroides en el periodo neonatal. La Vermox Oxford Neonatal Network informa que su uso se incrementó del 19 al 29% en 1997, siendo la dexametasona la más utilizada. Por otra parte se conoce la evidencia que asocia su uso a daño neurológico sobre todo en los esquemas tempranos (<96h); las guías actuales avaladas por asociaciones de Pediatría en EE. UU. y Europa no lo recomiendan como uso de rutina, limitándose a ensayos clínicos aleatorizados y en circunstancias excepcionales como dependencia de soporte ventilatorio17,22.
Hasta el momento no hay evidencia que indique cuál es la dosis y tiempo ideal de administración, sin embargo, de acuerdo a los ensayos clínicos que se han realizado, se observa que en los pacientes que reciben el esteroide entre los 7 y 14 días de vida (moderadamente temprano) no se han asociado incremento de riesgo de parálisis cerebral (RR: 0.83; IC95%: 0.39-1.74)23.
Las características demográficas de estos estudios consultados en general incluyen a recién nacidos con peso<1,500g. En el presente estudio la población estudiada tuvo una media de 1,210g, más baja que en el estudio de Halliday donde no refiere incremento de riesgo de morbilidades como la hemorragia intraventricular grave (RR: 0.44; IC 95%: 0.17-1.15); en la población de estudio la hemorragia grave (grado iv) también ocupó un porcentaje bajo, del 2%23.
En este estudio es importante señalar que el uso de esteroides posnatales fue indicado con fines de extubación, considerándose dependencia de soporte ventilatorio mayor de 10 días. Con respecto al éxito en la extubación Halliday informa falla al tercer día (RR: 0.92; IC 95%: 0.74-1.14), el riesgo se redujo al 7.o día (RR: 0.62; IC 95%: 0.46-0.84). Yates en 2010 informa éxito a la extubación al 4.o día del 34% y del 68% al 7.o día (OR: 11.3; IC 95%: 1.05-45.1) y tiempo promedio de extubación de 7.4 días. En el estudio que nos ocupa se logró el éxito en extubación en el 74% cuando se utilizó esquema de 0.15mg/kg/día y en el 69.5% con esquema de 0.25mg/kg/día, con promedio de día de extubación entre el 2.o y el 18 día, media de 7 días, lo que indica que el tiempo de extubación es parecido a los estudios referidos, aunque la duración de la administración del esteroide no se ajustó a los referido para los 2 esquemas de 9 y 12 días en material y métodos, ya que el esquema se aplicó con un rango de 4-17 días, ya que la media fue de 9 días, probablemente debido a la diversidad de criterios en el manejo para la extubación hasta el momento de esta publicación16,22.
Dentro de los efectos adversos a corto plazo informados en los diversos ensayos clínicos, en el esquema de administración moderadamente temprano se encuentran el mayor riesgo de hiperglucemia (RR: 1.51; IC 95%: 1.20-1.90), hipertensión arterial (RR: 2.73; IC 95%: 1.95-5.95), hemorragia gastrointestinal (RR: 1.74; IC 95%: 1.02-2.98), sepsis (RR: 1.35; IC 95%: 1.06-1.71) sin incremento de riesgo de enterocolitis necrosante (RR: 0.76; IC 95%: 0.38-1.49). Sin embargo, Yates no encuentra diferencias estadísticamente significativas en efectos adversos a corto plazo durante la administración del esteroide, hiperglucemia (OR: 1.55; IC 95%: 0.44-5.45), hipertensión arterial (OR: 1.16; IC 95%: 0.42-3.21). En el estudio que nos ocupa solamente se encontró como efecto adverso la hiperglucemia, siendo mayor la incidencia en el 2.o y 7.o día. Posiblemente no se encontraron más efectos adversos en este estudio debido a las dosis bajas utilizadas24,25.
En conclusión, se encontró que el uso de esteroides posnatales fue eficaz en lograr la extubación, con dosis de 0.15mg en el 74%, con 0.25mg se logró la extubación en el 80%. Solo se presentó como efecto adverso la hiperglucemia.
Es importante sistematizar las recomendaciones del uso de esteroides para extubación para obtener un mejor resultado y mejorar la morbilidad y la supervivencia de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.