Tras la introducción de tantas vacunas nuevas en la década pasada, y la proximidad de muchas más en un horizonte próximo, se suele preguntar a los médicos, o se lo preguntan ellos mismos, si más adelante será necesaria la revacunación para todas ellas. Las compañías fabricantes de vacunas han establecido estudios de poblaciones centinela como evaluaciones de fase 4 tras la autorización de comercialización para advertir a las autoridades sanitarias y a los médicos de la necesidad o no de tales revacunaciones. En esta revisión presento información sobre lo que se sabe sobre la memoria inmunológica de la célula B y la célula T y sobre la inmunidad innata y el ritmo de la patogénesis de las enfermedades que estamos previniendo actualmente mediante la vacunación, y examinaré la naturaleza dinámica de la situación cuando se producen cambios en el refuerzo natural.
IMPORTANCIA DE LOS ANTICUERPOS
Como observaron Robbins et al1 y Plotkin2, casi todas las vacunas actuales actúan mediante la inducción de los anticuerpos en el suero o en la mucosa (a través de la producción local o la transudación desde el suero) para bloquear la adhesión de los patógenos a las células epiteliales o interferir con la invasión microbiana del torrente sanguíneo. Para ser protectores, los anticuerpos inducidos deben actuar contra el patógeno relevante o ayudar al sistema inmunitario como una opsonina o, si el organismo ejerce su efecto patógeno elaborando una toxina, los anticuerpos deben neutralizar esta toxina2. La importancia de los anticuerpos en la protección inducida por la vacuna es innegable, como indican los estudios en los que la administración pasiva previene o mejora la enfermedad y la observación de un efecto protector en el neonato por los anticuerpos maternos3. Toda la protección materna del feto y el neonato es consecuencia de los anticuerpos, porque las células B y T maternas no atraviesan la placenta.
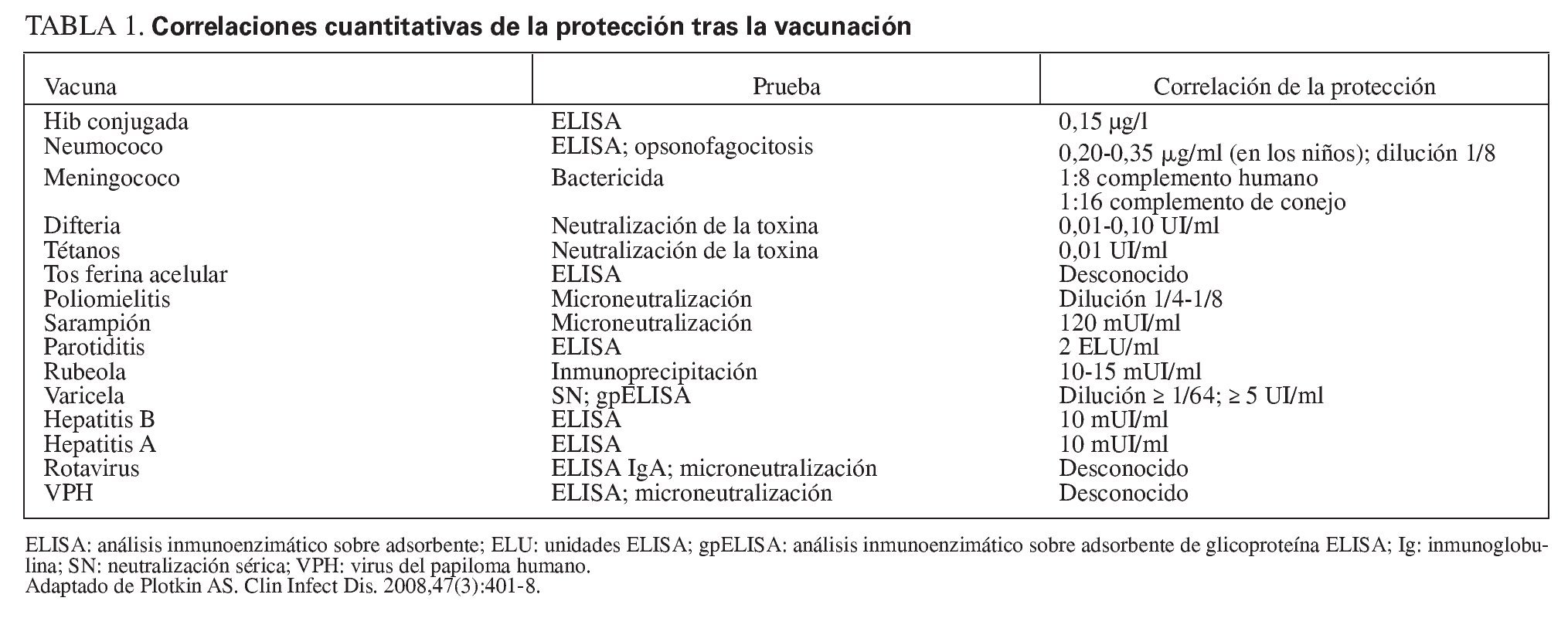
Los valores específicos de los anticuerpos han sido relacionados con la protección contra muchas enfermedades (tabla 1). Los valores de anticuerpos que se correlacionan con la protección suelen provenir de estudios poblacionales en los que se observa que individuos con un determinado valor de anticuerpos están protegidos siempre, o casi siempre, de la enfermedad. Sin embargo, un valor concreto de anticuerpos no constituye una correlación absoluta con la protección de cada persona, porque lo importante no es sólo la cantidad de anticuerpos, sino también su funcionalidad. Además, existe una variación genética en la susceptibilidad a la enfermedad, las diferencias de virulencia entre las cepas de patógenos, las diferencias en las respuestas inmunológicas innatas entre las personas y la variación en el inóculo del patógeno, y puede existir un impacto de la enfermedad coetánea o de la coinfección. Por lo tanto, un valor concreto y protector de anticuerpos debe considerarse como una estimación próxima aplicable en la mayoría de los anfitriones como correlación relativa de la protección.
Los valores de anticuerpos suelen declinar con el tiempo hasta cantidades indetectables si no se realiza una nueva estimulación antigénica, porque los anticuerpos tienen una semivida de ~30 días. Sin embargo, la persistencia de los anticuerpos inducidos por la vacuna suele superar con mucho el período en que los anticuerpos hubieran desaparecido según la matemática de su semivida. Esto podría ser consecuencia de un recuerdo sostenido "natural" u otros mecanismos inmunológicos analizados más adelante.
La revacunación natural puede ocurrir mediante la colonización asintomática por el patógeno o por un no patógeno que exprese un antígeno de reacción cruzada. La revacunación natural puede disminuir con el tiempo a medida que el patógeno circule menos en la población o por el creciente empleo de una vacuna, el establecimiento de la inmunidad de grupo, o ambas circunstancias. Éste es un tema recurrente y relacionado con varias vacunas, porque la ausencia de revacunación natural entre los receptores de la vacuna puede desembocar en un regreso a la susceptibilidad a la enfermedad.
Se han propuesto otras explicaciones de la persistencia de bajos valores de anticuerpos circulantes mucho después de la exposición al antígeno. Una hipótesis es que se retienen pequeñas cantidades de antígeno, que persisten en el interior de los ganglios linfáticos periféricos y del bazo. Esta pequeña cantidad de antígenos es suficiente para mantener la respuesta inmunológica4.
Una segunda hipótesis indica que algunas células B de memoria quedan secuestradas en el santuario de la médula ósea, donde se dividen periódicamente, maduran a células plasmáticas y producen pequeñas cantidades de anticuerpos en el suero5. La tercera hipótesis es que los activadores policlonales inespecíficos de la célula B mantienen un pequeño conjunto de células B de memoria. Los supuestos activadores inespecíficos de la célula B incluyen varios productos microbianos que estimulan a los receptores de tipo Toll (TLR) (analizados más adelante) y también podría producirse con la ayuda de una célula T transeúnte6,7.
PAPEL DE LA MEMORIA DE LAS CÉLULAS B
La producción de memoria de células B es un proceso de desarrollo complejo que acaece en los centros germinales del ganglio linfático y del bazo. Durante la generación de la memoria de células B se produce un proceso de selección denominado maduración de la afinidad8. A medida que disminuye la disponibilidad del antígeno tras la vacunación, se producen mutaciones aleatorias de los genes inmunoglobulina, y las células B que expresan anticuerpos sobre su superficie con la máxima afinidad por el antígeno vacunal en disminución prevalecen y persisten como células B de memoria. Existe una potente correlación entre los anticuerpos de gran funcionalidad y los anticuerpos con gran afinidad por un antígeno vacunal. Los aspectos de la memoria inmunológica inducidos por la vacuna y mediados por la célula B son: 1) una rápida producción de anticuerpos, 2) principalmente anticuerpos inmunoglobulina G, 3) un valor de anticuerpos superior al observado tras la exposición primaria y 4) la producción de anticuerpos de mayor afinidad (y una población de anticuerpos de mayor avidez) por el antígeno como consecuencia de un proceso conocido como maduración de la afinidad.
Para evaluar la duración de la memoria inmunológica, los sujetos vacunados ofrecen suero y células linfoides para el análisis in vitro a intervalos temporales tras la vacunación. Así se puede medir la persistencia de los valores de anticuerpos, la memoria de células B y la memoria de células T. La mejor ayuda para evaluar la memoria inmunológica es realizar experimentos de provocación en los que se administra a los sujetos del ensayo de una quinta a una décima parte de la dosis estándar de antígenos, tras lo que se evalúa la respuesta inmunológica. Esta simulación no es perfecta porque: 1) no conocemos la dosis real de antígenos específicos del patógeno, 2) la administración del antígeno por vía parenteral claramente no es la misma que la realidad natural, en la que casi todas las exposiciones se producen por la piel, las vías respiratoria, gastrointestinal o genitourinaria y 3) el contexto de la simulación no es durante una enfermedad coetánea (p. ej., una infección viral de las vías respiratorias altas, como sucede a menudo en la realidad).
MEMORIA DE CÉLULA T
La inmunidad de la célula T desempeña un papel en la finalización de la enfermedad o en el mantenimiento de la protección contra la enfermedad durante el tiempo. Además, hace poco se han descrito mecanismos de protección contra las infecciones dependientes de la célula T e independientes de los anticuerpos en el ratón9-11 y en la persona12. La inmunidad celular es una expresión utilizada a menudo de manera sinónima a la inmunidad por la célula T.
En la actualidad conocemos dos poblaciones de células T de memoria. Las células T de memoria efectoras residen en los tejidos periféricos, mientras que otro grupo, denominado células T de memoria centrales, residen en los órganos linfoides13. Ambas poblaciones de células T de memoria expresan proteínas de superficie que permiten distinguirlas de las células T vírgenes14. La continua circulación de células T de memoria efectoras hacia el tejido es un aspecto clave del sistema inmunológico que garantiza la diseminación por el organismo de las células T de memoria con especificidad concreta.
Está demostrado que las células T CD4+ de memoria responden con mayor rapidez y con una mayor gama de citocinas y que las células T CD8+ de memoria responden con la liberación de una mayor cantidad de moléculas citotóxicas (perforinas y granzima B) que la observada en la respuesta primaria12. Además, las células T CD4+ de memoria son más eficaces para ayudar a las células B que las células T CD4 vírgenes15,16.
La más rápida y más amplia respuesta de la memoria de célula T puede controlar la infección con rapidez tras la nueva exposición a los patógenos17-19. En los modelos in vitro tanto de CD4 como de CD8, la generación de las funciones efectoras de la célula T (inmunidad celular) puede ser evidente ~2 a 7 días tras la estimulación del antígeno20-23. El mantenimiento de la memoria de célula T varía según el antígeno. Tras la vacunación con pequeños fragmentos proteicos, la memoria de célula T es mucho más corta que la conseguida tras la vacunación con virus atenuado, pero que se duplica24-27.
INMUNIDAD INNATA
Además de la inmunidad adaptativa, la respuesta inmunológica innata puede disminuir el ritmo de la patogénesis28. Durante la última década, nuevas informaciones han revelado que el sistema inmunológico innato ha desarrollado una estrategia para reconocer las estructuras conservadas de los microbios que no se encuentran en las células de los mamíferos: los denominados patrones moleculares asociados con el patógeno29. Además, se ha descrito un sistema de reconocimiento y señalización, denominado TLR, que inicia una cascada de acontecimientos inmunológicos en las células anfitrionas humanas para contener la infección, dando tiempo para elaborar la respuesta inmunológica específica30,31. El TLR2 es un receptor del ácido lipoteicoico de las bacterias Gram positivas, las lipoproteínas bacterianas y el zymosan (levaduras); el TLR3 es un receptor del ADN viral bicatenario; el TLR4 es un receptor de los lipopolisacáridos de las bacterias Gram negativas, y el TLR9 es un receptor del ADN bacteriano32,33. Una vez estimulados los TLR por los patrones moleculares asociados con el patógeno, no es necesaria la proliferación o la maduración de las células inmunológicas efectoras; pueden responder inmediatamente liberando numerosos mediadores proinflamatorios y antiinflamatorios y citocinas. Como para producir una cantidad suficiente de anticuerpos y de células T efectoras son necesarios de 2 a 7 días, el anfitrión depende del sistema inmunológico innato para controlar temporalmente la infección. Si la respuesta innata no es adecuada, la infección puede ocurrir pese a la memoria inmunológica.
ADELANTAMIENTO A LA INFECCIÓN CON UNA RESPUESTA INMUNOLÓGICA
La probabilidad de que una respuesta de memoria de célula B o de célula T sea suficientemente rápida en ausencia de un valor protector de anticuerpos circulantes depende en gran medida del ritmo de la patogénesis de la infección impuesto por un organismo concreto (tabla 2). A continuación se describen varios ejemplos para ilustrar este aspecto.
Haemophilus influenzae de tipo b, Streptococcus pneumoniae y Neisseria meningitidis
El ritmo de la patogénesis de las bacterias respiratorias encapsuladas, como el Haemophilus influenzae de tipo b (Hib), el Streptococcus pneumoniae y la Neisseria meningitidis, es muy rápido. En cuestión de horas, las bacterias pueden adherirse a la nasofaringe, conseguir su entrada en el torrente sanguíneo, duplicarse y empezar a sembrar las meninges. La presencia de un anticuerpo funcional dirigido al polisacárido capsular previene la infección por estas bacterias encapsuladas.
Se ha medido la velocidad de producción de respuestas de anticuerpos mensurables al Hib y al meningococo tras la estimulación de la memoria de la célula B34-37. En ambos casos se observó una respuesta detectable no antes de 2 a 7 días después de la exposición al antígeno. Existe cierto intervalo entre la exposición al antígeno y la producción de anticuerpos, porque el antígeno debe ser captado y procesado por las células presentadoras de antígenos (p. ej., las células dendríticas y los macrófagos); luego, las células presentadoras de antígenos deben interactuar con las células B y las células T cooperadoras, las células B deben proliferar y madurar a células plasmáticas y, por último, las células plasmáticas liberan los anticuerpos a la circulación.
Tras la introducción de las vacunas conjugadas frente al Hib se produjo un debate sobre el papel protector de la memoria inmunológica en ausencia de anticuerpos detectables38. Lo mismo sucedió con la introducción de la vacuna acelular contra la difteria, el tétanos y la tos ferina (DTaP) combinada con las vacunas conjugadas contra el Hib, ya que varias vacunas combinadas DTaPHib no produjeron un valor de anticuerpos tan elevado como la administración de las 2 vacunas por separado39,40. El debate finalizó cuando empezó a aparecer la enfermedad por Hib en Inglaterra y Gales, donde estaban autorizadas las combinaciones DTaP-Hib y los investigadores demostraron la necesidad de un valor circulante de anticuerpos funcionales para la protección a largo plazo de algunos niños41-43. El mismo cuadro se repitió en el Reino Unido tras la introducción de las vacunas conjugadas contra el meningococo. La disminución de los anticuerpos, pese a la persistencia de la memoria inmunológica, se asoció con la declinación de la eficacia de la vacuna44-46. Como consecuencia de los casos intercurrentes de la enfermedad, el Reino Unido revisó su programa de vacunación para exigir dosis de recuerdo contra el Hib y de las vacunas conjugadas contra el meningococo para mantener unos valores protectores de anticuerpos en la sangre.
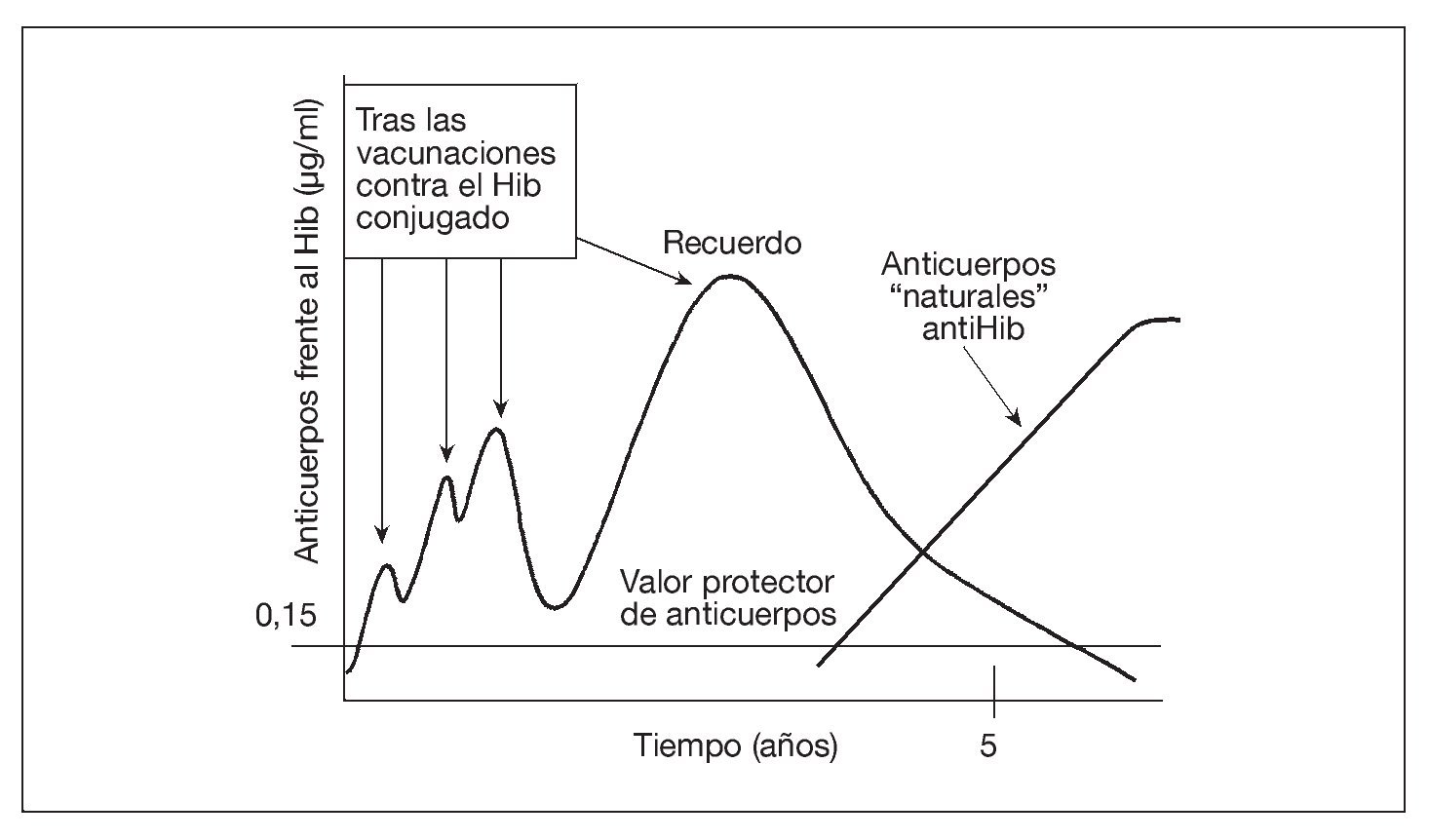
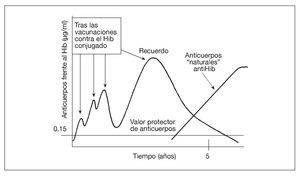
Tras completar la serie primaria de vacunación con vacunas conjugadas contra el Hib en el lactante, sólo es necesaria una dosis de recuerdo en el segundo año de vida para conseguir protección hasta ~5 años de edad. Esto se debe a que, entre el tercer y el quinto año de la vida, los niños desarrollan una inmunidad "natural" al Hib, inducida por la colonización de su tracto gastrointestinal por una especie de Escherichia coli que expresa un polisacárido capsular (K1 cápsula) casi idéntico al polisacárido capsular del Hib47 (fig. 1). También se producen anticuerpos naturales contra los meningococos y los neumococos, aunque hasta ahora se desconoce si la frecuencia de desarrollo de tales anticuerpos naturales será suficiente para complementar a la inmunidad inducida por la vacunación. La aparición esporádica de enfermedad meningocócica y neumocócica durante la vida indica la probabilidad de la necesidad de los recuerdos.
Fig. 1. La vacuna aumenta la concentración sérica de anticuerpos contra el Hib, que luego se desvanece. Sin embargo, la colonización del tracto gastrointestinal por una cepa de E. coli que expresa un polisacárido capsular prácticamente idéntico al de la cápsula del Hib produce los anticuerpos séricos "naturales" al polisacárido capsular del Hib, manteniendo así la protección sin necesidad de nuevas revacunaciones. El Hib conjugado significa el polisacárido del Hib conjugado con una vacuna portadora de proteína.
Hepatitis B y A
El ritmo de la patogénesis de la hepatitis B y de la hepatitis A es lento. Clínicamente, antes de disponer de vacunas contra la hepatitis B y la hepatitis A, la administración pasiva de anticuerpos en forma de γ globulina intramuscular podía realizarse 2 semanas después de la exposición y seguía siendo efectiva. Tras la infección natural, la inmunidad a la hepatitis B y a la hepatitis A es de por vida.
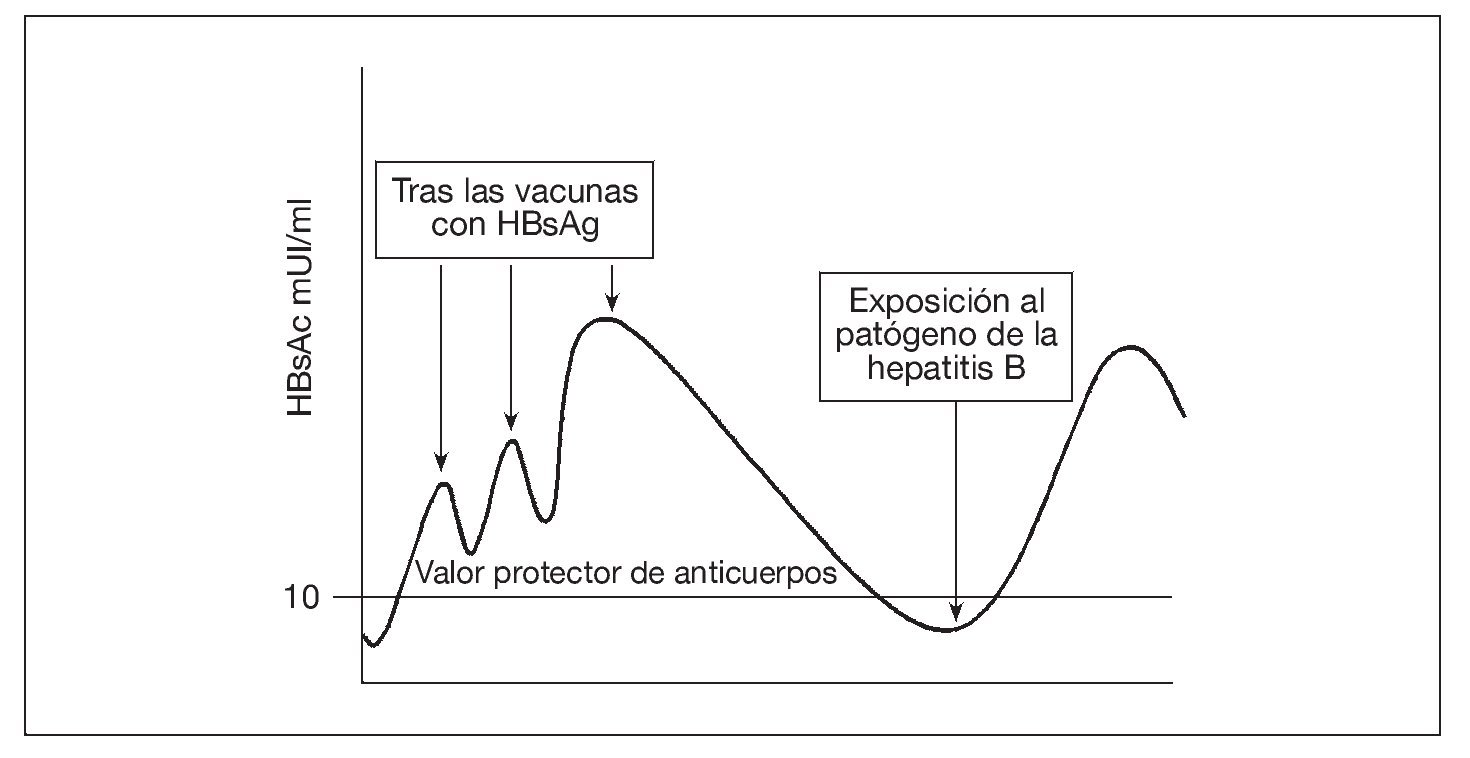
Los valores de anticuerpos inducidos por la vacuna contra la hepatitis B se desvanecen con el tiempo, de forma que, unos 10 años después de la vacunación, sólo cerca de la tercera parte de los receptores de la vacuna siguen presentando valores detectables de anticuerpos48. No obstante, hasta ahora no se ha producido una enfermedad intercurrente. Este éxito ha sido atribuido a las respuestas de memoria de anticuerpos que ocurren con un tiempo suficiente para ofrecer protección tras la exposición (fig. 2). Sin embargo, un informe reciente de la persistencia de la memoria inmunológica de 15 a 18 años después de la vacunación contra la hepatitis B es motivo de preocupación49. Disponemos de menos información sobre la persistencia de la inmunidad y la memoria inmunológica tras la vacunación contra la hepatitis A, ya que se ha introducido más recientemente.
Fig. 2. La vacunación aumenta la concentración sérica de anticuerpos al antígeno superficial de la hepatitis B, que luego se desvanece. De 2 a 14 días tras la exposición a la hepatitis B se produce una respuesta de la memoria de anticuerpos. Como el ritmo de la patogénesis de la hepatitis B es lento, la respuesta de la memoria llega a tiempo de prevenir la infección. HBsAc: anticuerpo al antígeno superficial de la hepatitis B; HBsAg: antígeno superficial de la hepatitis B.
Difteria, tétanos y tos ferina
La difteria, el tétanos y la tos ferina son enfermedades causadas por la liberación de toxinas; no existe una bacteriemia. El ritmo de la patogénesis es de varios días (difteria y tétanos) a varias semanas (tos ferina) entre la infección y la elaboración de una cantidad suficiente de toxina para manifestar la enfermedad. La infección natural no confiere protección de por vida para ninguna de estas 3 enfermedades. Se ha demostrado que las respuestas de memoria al tétanos ocurren tras un intervalo temporal de varios días a 2 semanas50.
Los casos intercurrentes de difteria en la antigua Unión Soviética produjeron una epidemia en los años ochenta que incluyó a muchos individuos vacunados51. Es bien conocida la aparición de casos intercurrentes de tétanos entre los receptores de vacunas, lo que condujo a la recomendada revacunación cada 10 años52. Se ha demostrado el desvanecimiento de la inmunidad tras el empleo de vacunas celulares contra la tos ferina53-56, lo que produjo casos entre adolescentes y adultos vacunados57-59, lo que probablemente sucederá en el futuro tras las vacunas acelulares contra la tos ferina si no se administran recuerdos. Respecto a la patogenia, podríamos predecir que el prolongado pródromo de la tos ferina, por lo general de 1 a 3 semanas de síntomas de las vías respiratorias altas antes del inicio de la enfermedad con tos, debería ser suficiente para permitir que la memoria inmunológica se adelante a la enfermedad. Sin embargo, no sucede así, muy probablemente porque la replicación del organismo sólo se produce en la superficie mucosa (no en el torrente sanguíneo) y porque el propio organismo no produce una vigorosa respuesta inflamatoria/inmunológica cuando se presenta en el árbol traqueobronquial. Quizá el sistema inmunitario sólo se estimule mediante la elaboración de una cantidad suficiente de toxina pertúsica.
Poliomielitis, sarampión, parotiditis, rubeola y varicela
La poliomielitis, el sarampión, la parotiditis, la rubeola y la varicela se caracterizan por 2 fases virémicas durante su patogénesis. La primera viremia ocurre de 2 a 4 días tras la exposición, y luego se produce un hiato de 1 a 3 días seguido de una segunda etapa virémica, más prolongada, durante la que se produce una más amplia diseminación del virus. Posteriormente aparecen los síntomas prodrómicos, seguidos de las manifestaciones clásicas de la enfermedad. La inmunidad permanente se alcanza tras la infección natural.
En la poliomielitis, el sarampión, la parotiditis, la rubeola y la varicela, el ritmo de la patogénesis puede ser suficientemente lento para permitir la intervención de las respuestas de la memoria inmunológica y prevenir la importante segunda fase virémica, productora de la enfermedad, en la mayoría de los individuos. En la actualidad no se recomienda la administración de dosis de recuerdo contra la poliomielitis, el sarampión, la parotiditis, la rubeola y la varicela, pero el desvanecimiento de la inmunidad ha planteado preocupaciones60-64. Se ha sugerido que dosis adicionales de estas vacunas producen inmunidad en una cohorte relativamente pequeña de individuos que no responden a la vacunación primaria65,66.
Las cepas vivas, atenuadas, mimetizan mejor a la infección natural, cuya inmunidad dura de por vida, que las vacunas con virus muertos. Es posible que la reactivación de los virus vacunales latentes induzca reactivaciones de los valores de anticuerpos. La duración de la inmunidad de la vacuna inactivada reforzada contra la poliomielitis es objeto de un estudio prospectivo67.
Rotavirus
Las infecciones naturales por rotavirus no son totalmente protectoras, aunque las reinfecciones son uniformemente más leves que las infecciones primarias68. Las 2 vacunas contra el rotavirus actualmente disponibles son vacunas reabsortivas de virus vivos atenuados. El ritmo de la patogénesis del rotavirus abarca varios días entre la infección y la enfermedad. Aunque la inmunidad puede ser incompleta tras la infección y puede desvanecerse tras la vacunación, no es probable que se recomiende la revacunación más adelantada la infancia, porque la tasa de infección en los niños mayores es mucho menor.
Virus del papiloma humano
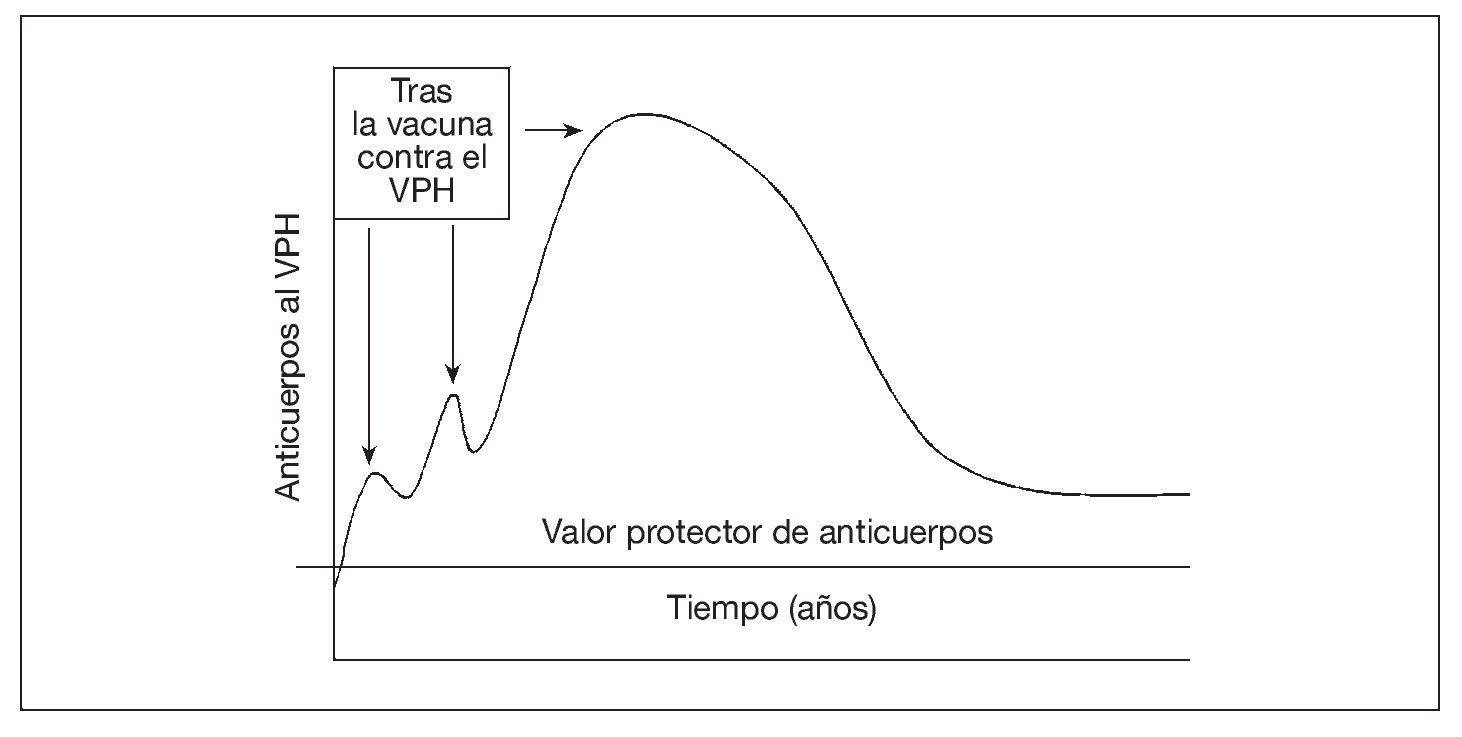
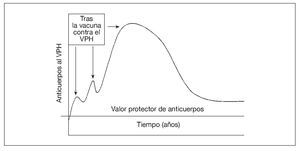
El mecanismo de protección tras la vacunación contra el virus del papiloma humano (VPH) parece ser la producción de anticuerpos neutralizantes69-72. No se conoce el ritmo de la patogénesis del VPH en las personas. En modelos animales, el virus tarda de 30 min a 24 h73-77 en penetrar en las células epiteliales basales (e infectarlas); luego, el virus se hace muy poco accesible a los anticuerpos. Por lo tanto, parecería necesaria la presencia de un valor mínimo de anticuerpos en el moco (producido localmente o como consecuencia de la transudación desde el suero) en el momento de la exposición para prevenir la infección (fig. 3). Tras la vacunación contra el VPH, hasta ahora es dudoso si la infección "natural" cervical por el VPH sería suficiente para estimular la respuesta protectora de anticuerpos78-83 (refuerzo natural). Aunque el papel de la memoria inmunológica siga siendo dudoso, se considera que un título elevado y sostenido de anticuerpos neutralizantes es el mejor marcador sustituto para la protección frente a la infección del VPH tras la vacunación84.
Fig. 3. La vacuna aumenta la concentración sérica de anticuerpos contra el VPH (que tienen la capacidad de transudar a la mucosa), que luego se desvanece. La persistencia de anticuerpos séricos por encima del valor protector puede ocurrir por la exposición natural al VPH (es decir, refuerzo natural u otros mecanismos inmunológicos). VPH: virus del papiloma humano.
CONCLUSIONES
Por lo general hacen falta ~2 a 5 días para que la memoria de las células B y de las células T (inmunidad celular) aumente y dé origen a células efectoras inmunológicas maduras después de que el anfitrión sufra la exposición a un posible patógeno. El sistema inmunológico innato y los valores preexistentes de anticuerpos circulantes deben prevenir la progresión de la enfermedad hasta que se produzcan las respuestas de la memoria. En las enfermedades infecciosas con ritmo rápido de patogénesis, algunos individuos contraerán la infección antes de la completa activación e instauración de la respuesta de la memoria. En las enfermedades infecciosas con ritmo lento de patogénesis, la memoria inmunológica debería ser suficiente para prevenir la enfermedad. En algunas vacunas nuevas no se sabe si aparecerán infecciones intercurrentes. Éste es un campo de investigación activa que ofrecerá futuras respuestas a esta importante pregunta.
Correspondencia: Michael E. Pichichero, MD, Rochester General Research Institute, Rochester General Hospital, 1425 Portland Ave, Rochester, NY 14621, Estados Unidos.
Correo electrónico: michael.pichichero@rochestergeneral.org