El descubrimiento de los antibióticos a mediados de los años treinta supuso un gran avance para la curación de enfermedades infecciosas, como la neumonía, la fiebre tifoidea, la sífilis y la tuberculosis, entre otras.
Pero aunque los antibióticos parecían ser la solución a muchas de las infecciones bacterianas que hasta entonces eran causa de complicaciones graves e incluso la muerte, actualmente siguen siendo un problema. Parece que las bacterias han evolucionado igual que los antibióticos y estamos ante un nuevo ejemplo de la teoría darwiniana, donde sobreviven los más aptos; es decir, las bacterias han sabido adaptarse e incluso superar la barrera de los antibióticos.
Desde las últimas décadas existe un abuso generalizado de estos fármacos. La utilización masiva en clínica humana, en los animales de granja e incluso en el mundo de la agricultura ha afectado de modo general a toda la cadena ecológica.
Aunque es muy interesante la evolución ecológica de las resistencias bacterianas, en este artículo nos ceñiremos a las resistencias, debido al abuso masivo de antibióticos con finalidades terapéuticas humanas.
Posiblemente, debido a un abuso inicial en las prescripciones médicas, además de generar un coste sensible a la Administración sanitaria, ha dado origen a una supuesta utilización generalizada por parte de los usuarios. Son muchas las personas que ante una infección, sin saber su origen, se automedican con antibióticos e incluso los aconsejan a familiares o amigos. Por otro lado, una mala administración de estas drogas, como administrarse la dosis incorrecta o la interrupción del tratamiento, además de causar efectos tóxicos, como dañar gravemente la flora intestinal, son el origen de muchas de las resistencias bacterianas.
La idea es muy simple, las bacterias pueden adquirir resistencias ante un antibiótico por dos mecanismos: mediante mutaciones específicas del genoma del propio microorganismo, o mediante la adquisición de nuevos genes procedentes de otras bacterias. El Dr. J. Vila, profesor de la Facultad de Medicina de la Universidad de Barcelona, explica que ante la presión selectiva debido a un determinado antibiótico, en una población bacteriana sensible a este antibiótico aparece una bacteria mutante resistente o una de las bacterias adquiere un gen de resistencia; la presencia del antibiótico provoca la muerte de las bacterias sensibles, favoreciendo el crecimiento de las bacterias resistentes, que pasan a ser la población dominante.
Todo ello ha llevado a los laboratorios a investigar contrarreloj para encontrar nuevos antibióticos o fármacos alternativos a éstos, y así contrarrestar las múltiples resistencias que se están desarrollando.
Bases genéticas y bioquímicas de las resistencias
Los avances en el mundo de la genética bacteriana han permitido entender los mecanismos moleculares y bioquímicos de las resistencias a los antibióticos.
Tal como hemos comentado anteriormente, conocemos dos mecanismos moleculares básicos por los que las bacterias pueden volverse resistentes. Por un lado existen las mutaciones cromosómicas, es decir, la secuencia de bases del ácido nucleico de las bacterias (ADN bacteriano) es modificada debido a factores endógenos o ambientales, produciendo una mutación que da lugar a una resistencia y ésta puede ser transmitida a su descendencia (transmisión vertical). La base genética de este tipo de mutaciones demuestra que los antibióticos seleccionan los mutantes resistentes espontáneos que surgen en una determinada población, es decir, el fármaco inhibe o mata a las bacterias silvestres sensibles, pero no afecta a los individuos resistentes que aparecen por mutación espontánea. Éstos se multiplican y pasan a ser la población dominante.
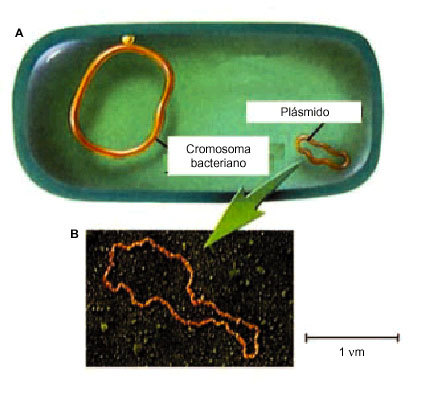
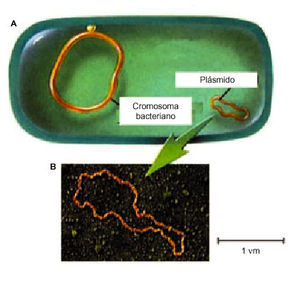
Por otro lado, las bacterias pueden adquirir resistencias provinentes de otras bacterias (transmisión horizontal); por ejemplo, mediante la transferencia de pequeñas porciones circulares de ADN llamados plásmidos R (plásmidos de resistencia a antibióticos) (fig. 1). Este mecanismo es el que parece ocasionar más problemas, puesto que se pueden transferir de una bacteria a otra, incluso de distinto género y especie mediante un proceso llamado conjugación (fig. 2). Pero también existen otros mecanismos de transferencia de genes entre bacterias conocidos como la transformación o la transducción.
Fig. 1. a) dibujo de una bacteria con su dotación cromosómica: cromosoma bacteriano y plásmido; b) fotografía de un plásmido.
Son muchas las personas que ante una infección, sin saber su origen, se automedican con antibióticos e incluso los aconsejan a familiares o amigos
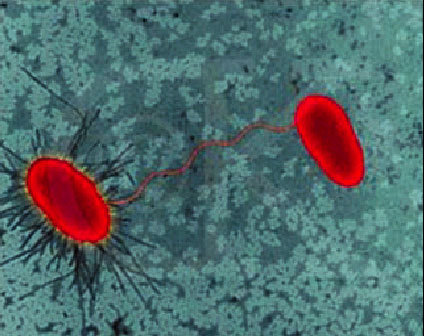
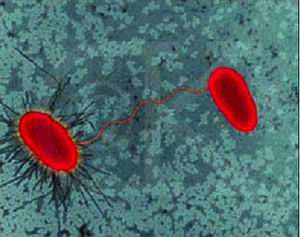
Fig. 2. Conjugación bacteriana de E. coli. En este proceso la bacteria dadora transfiere, a través del pili sexual, el ADN a la bacteria receptora.
A diferencia de las mutaciones cromosómicas, los plásmidos, generalmente no suponen ningún tipo de desventaja adaptativa, puesto que no afectan ni a su tasa de crecimiento ni a su virulencia.
La conjugación es un importante mecanismo de intercambio genético entre bacterias. Se trata de una especie de intercambio sexual, puesto que requiere que la cepa dadora (F+) se una a la cepa receptora (F-) mediante un pili sexual (fig. 2). La aparición de resistencias mediante este tipo de intercambio sexual es común entre las bacterias gramnegativas, en especial el grupo de las enterobacterias como E. coli, Salmonella, Shigella, Klebsiella y Pseudomonas aeruginosa, generado resistencias a antibióticos tales como las tetraciclinas, el cloramfenicol, las sulfonaminas, las penicilinas y los amnioglucósidos.
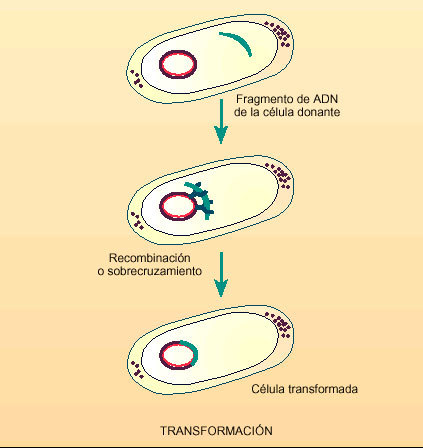
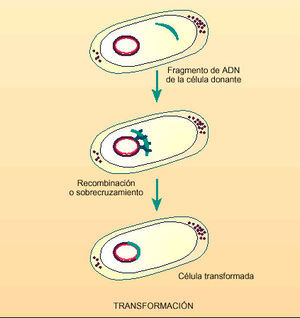
Aunque menos frecuente, la transformación (fig. 3) es otro mecanismo de intercambio genético entre bacterias que implica la incorporación de ADN desnudo que se encuentra en el medio ambiente y que puede penetrar en la bacteria si ésta se encuentra en estado competente, es decir, en estado receptivo.
Un buen ejemplo que ilustra cómo las bacterias van adquiriendo diferentes mecanismos de resistencia en función de la presión selectiva de los antibióticos es el tratamiento de la gonorrea
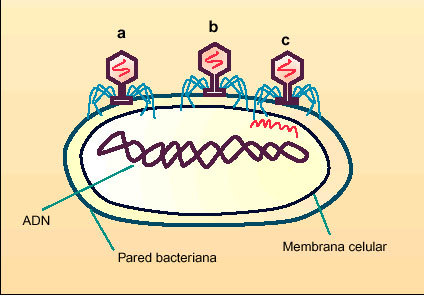
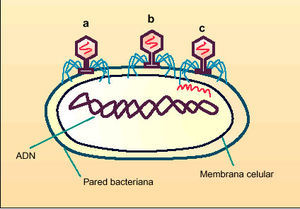
La transducción (fig. 4) es el tercer mecanismo de intercambio de ADN entre bacterias. Implica la intervención de un bacteriófago, un virus que afecta sólo a las bac terias. Los bacteriófagos pueden transferir genes de una bacteria resistente a una bacteria sensible. Un ejemplo de ello es la resistencia a las penicilinas por parte de Staphilococcus aureus.
Fig. 4. Transducción. Un virus bacteriófago (a, b, c) es el vector de transferencia de genes entre dos bacterias.
La historia de las resistencias adquiridas por Staphylococcus aureus es otro de los modelos de la interacción de los microorganismos patógenos con los antibióticos
La mayoría de las cepas resistentes aislada en clínica, pertenecen al grupo de resistencias adquiridas por plásmidos. Lo más preocupante es que estos plásmidos pueden conferir resistencia a más de un antibiótico, generando cepas multiresistentes.
Debido a estos cambios en el genoma de la bacteria, estos microorganismos sufren distintas alteraciones bioquímicas o estructurales, a saber:
Producir enzimas que destruyan el antibiótico, como las enzimas que adenilan, acetilan o fosforilan a los antibióticos del grupo de los aminoglucósidos, las acetiltransefrasas que inactivan al cloramfenicol, o las betalactamasas que destruyen los antibióticos betalactámicos.
Modificar la permeabilidad de la membrana bacteriana dificultando la penetración del antibiótico, o activar el flujo del antibiótico hacia al exterior. El género Pseudomonas ha modificado una determinada proteína de membrana del grupo de las porinas, que impide el paso de los antibióticos betalactámicos de última generación, al igual que E. coli, que también ha modificado la estructura de una de sus porinas para dificultar la penetración de algunas quinolonas.
Modificar los receptores específicos para un determinado antibiótico, como la bacteria Staphilococcus aureus que produce una forma especial de una proteína conocida como PBP2 que posee baja afinidad por los betalactámicos como la meticilina.
Desarrollar una vía alternativa a la que inhibe el antibiótico, como el caso de las resistencias a las sulfamidas. Determinados plásmidos R llevan genes que codifican por una dihidropteroico sintetasa muy resistente a la acción de estos quimioterapéuticos, puesto que tiene una afinidad mucho menor que la enzima normal codificada por la propia bacteria.
Todos estos cambios alteran significativamente los patrones de susceptibilidad a los antibióticos, generando numerosos problemas a los posibles tratamientos terapéuticos.
Pero no todo son malas noticias, pues en el Instituto de Biología Molecular del Consejo Superior de Investigaciones Científicas (CSIC) de Barcelona se ha descrito un mecanismo molecular implicado en la conjugación. Se trata de un mecanismo que podría ser útil para diseñar inhibidores que bloqueen la transferencia del intercambio genético entre bacterias, evitando así la transferencia de resistencias.
El mecanismo de conjugación ya estaba descrito, pero estos investigadores de Barcelona, junto con expertos de la Facultad de Medicina de la Universidad de Cantabria, han descrito la estructura atómica de una proteína anclada en la membrana de las bacterias en forma de canal por donde se transfiere el ADN entre bacterias. Tal como indica el Dr. Coll, han descubierto la cerradura y la llave de uno de los mecanismos de la conjugación bacteriana, y conociendo la cerradura se podría encontrar una manera de bloquearla.
Este estudio forma parte de un proyecto internacional que tiene como objetivo buscar inhibidores de la conjugación bacteriana.
Adquisición de resistencias a determinados microorganismos
Un buen ejemplo que ilustra cómo las bacterias van adquiriendo diferentes mecanismos de resistencia en función de la presión selectiva de los antibióticos es el tratamiento de la gonorrea. En 1960, se utilizaba la penicilina G para su tratamiento, pero con el paso del tiempo se han incrementado las dosis, e incluso actualmente se utilizan antibióticos alternativos, como las cefalosporinas de tercera generación, las fluoroquinolonas o la espectinomicina. Los gonococos que producen la gonorrea en primer lugar adquirieron un cambio de permeabilidad de su membrana, de manera que era necesario aumentar la dosis de penicilina para obtener el mismo efecto; posteriormente, por transferencia génica, adquirieron una betalactamasa, una enzima capaz de inactivar la penicilina.
La historia de las resistencias adquiridas por Staphylococcus aureus es otro de los modelos de la interacción de los microorganismos patógenos con los antibióticos. S. aureus forma parte de la flora saprofita humana, encontrándose especialmente en la piel y las mucosas. Cuando apareció la penicilina todas las cepas eran sensibles, pero al cabo de 3 años surgieron cepas resistentes productoras de una enzima, la penicilasa, que inactiva la penicilina. Estas cepas se diseminaron rápidamente ocasionando de nuevo graves problemas, pero posteriormente aparecieron penicilinas resistentes a la penicilasa (meticilina) y el problema se resolvió momentáneamente. En los años sesenta aparecieron nuevas cepas resistentes (MRSA: S. aureus resistentes a meticilina) que ocasionaron graves problemas en hospitales y centros sociosanitarios. Estas cepas eran capaces, tal como hemos comentado anteriormente, de sintetizar una proteína denominada PBP2a (penicillin-binding-protein). Las PBP intervienen en la síntesis de peptidoglucano de la pared celular bacteriana, y son las moléculas diana de la penicilina y los otros betalactámicos. Al unirse a éstas, impiden la síntesis de la pared bacteriana y secundariamente la replicación. La PBP2a se caracteriza por tener una baja afinidad a todas las penicilinas, de manera que por modificación de la diana el antibiótico pierde actividad, puesto que tiene dificultad para entrar en el interior de la bacteria.
Más tarde, a mediados de los años ochenta, se descubrió que las quinolonas fluoradas (ciprofloxacino) eran muy activas ante estas nuevas cepas, pero lamentablemente aparecieron en poco más de un año nuevas cepas resistentes.
Junto con las MRSA, han aparecido las cepas conocidas como MARSA, también resistentes a los aminoglucósidos. Así pues, estas cepas son actualmente un problema.
Las enterobacteriáceas son un grupo de bacterias que ocasionan también un gran número de procesos infecciosos, como los géneros Escherichia, Klebsiella y Proteus, causantes del 90% de las infecciones urinarias. Estas bacterias forman parte de la flora intestinal, por lo que están expuestas a todos los antibióticos que se ingieren por vía oral para tratar cualquier proceso infeccioso. Eso da lugar a unas condiciones ecológicas ideales para el desarrollo de resistencias en las propias bacterias de la flora humana y transmitirlas a posibles patógenos. Por otro lado, los antibióticos pueden destruir parte de la flora intestinal humana, facilitando la invasión de nuevos patógenos.
Un 40% de las cepas de E. coli son actualmente resistentes a la amoxicilina y un 30% al cotrimoxazol. Algunos científicos creen que en un período breve los tratamientos orales comunes para tratar este tipo de infecciones no serán eficaces.
También desde las últimas décadas se han descrito resistencias a las cefalosporinas de tercera generación (cefotaxima, ceftriaxona y ceftacidima) por parte de microorganismos como K. pneumoniae, E. coli, Proteus sp., Serratia sp. y Salmonella sp. El estudio de estas resistencias ha permitido caracterizar la producción de nuevas enzimas betalactamasas de espectro amplio, que son codificadas por plásmidos y tienen una gran capacidad de diseminación.
Las salmonelas implicadas en infecciones gastrointestinales también presentan resistencias a la ampicilina, pero tienen de momento una buena sensibilidad a la amoxicilina-ácido clavulánico, a ciprofloxacino y a cotrimoxazol. Este caso es un buen ejemplo de que la administración de antibióticos no siempre es aconsejable. En caso de salmonelosis, sólo es aconsejable la administración de antibióticos a individuos inmunodeprimidos como los enfermos de sida; en los otros casos, puesto que la bacteria normalmente es eliminada por el propio enfermo, sólo es necesario el tratamiento sintomático.
Conclusión
El futuro plantea numerosos problemas en este campo, como la aparición de nuevos patrones de resistencia desconocidos hasta ahora, y las cepas multirresistentes, que serán un problema terapéutico importante.
Para intentar controlar la resistencia existente y evitar los nuevos mecanismos que puedan aparecer en un futuro, las principales líneas de actuación inmediata deberían ser:
El desarrollo de nuevos fármacos con mecanismos de acción diferentes a los conocidos.
El control riguroso de la administración de antibióticos o fármacos similares en el mundo animal y vegetal.
El diagnóstico etiológico de las enfermedades infecciosas, con un posterior estudio de sensibilidad bacteriana para reducir el uso de antibióticos de amplio espectro.
Políticas de prevención de enfermedades infecciosas, de ámbito de salud pública y hospitalario.
El desarrollo de sistemas de vigilancia de control de resistencias en el ámbito mundial, para la detección de nuevos mecanismos de resistencias.
Sin embargo, no debemos olvidar que se hace necesario, por parte de todos los usuarios, un uso racional de este tipo de medicamentos, y en cualquier caso consultar al médico y nunca interrumpir el tratamiento antes de la prescripción determinada, puesto que no tomar estas medidas supone un riesgo para el propio enfermo, pero también supone un daño a toda la población. *
Bibliografía general
Caminal J, Rovira J, Segura A. Estudio de la idoneidad de la prescripción del tratamiento en la atención primaria y de los costes derivados de la no adecuación. Barcelona: AATM Servei Català de la Salud, 1996.
Chirinos J. Los mecanismos de resistencia bacteriana. La revista médica del CIEM (www.ucsm.edu.pe/ciemucsm/larev/mecre.htm).
Drobnic L, Salva JA. Curso sobre antibioticoterapia. Madrid: Ruan, 1980.
Figuras: http://fai.unne.edu.ar/biologia/bacterias/micro2.htm y www.biosci.uga.edu/ almanac/bio103/notes/may30.html
Giménez Pérez M, Matas X, Vallès X. Antibióticos en atención primaria. Resistencia a los antimicrobianos relacionada con el consumo. Badalona: Servicio de Microbiología Hospital Universitario Germans Trías i Pujol. UAB, 1998.
González T. El CESIC de Barcelona describe un mecanismo molecular implicado en la conjugación (www.diariomedico.com).
Stanier RY, Ingraham JL, Wheelis ML, Painter PR. Microbiología. Barcelona: Reverté, 1992.
Stuart T. Microbiología. México: McGraw-Hill Interamericana, 1999; 79-711.