En la actualidad, el tratamiento inmunosupresor tiene dos aplicaciones principales: prevención del rechazo agudo/crónico y tratamiento del rechazo agudo. La experiencia clínica establece que la clasificación terapéutica de un agente inmunosupresor está determinada por la eficacia de su aplicación en lugar de por su clase bioquímica.
Terapia de prevención
La terapia de prevención reduce la incidencia y la frecuencia del rechazo. Los agentes inmunosupresores profilácticos se administran en el período inmediatamente posterior y de forma crónica para el mantenimiento. Los agentes preventivos con actividad demostrada para la prevención del rechazo agudo son: micofenolato mofetil, ciclosporina, tacrolimus, azatioprina y corticoides.
Terapia de rescate
Por su parte, la terapia de rescate es el tratamiento de un episodio de rechazo agudo mediante la administración de fármacos con eficacia demostrada en rescate. Este tipo de terapia consiste en la adición de una de estas drogas a un régimen inmunosupresor de prevención del rechazo hasta que se produzca la resolución del episodio de rechazo agudo. La terapia de rescate de primera línea consiste normalmente en la administración de un corticoide por vía venosa, mientras que los agentes de segunda línea incluyen anticuerpos policlonales, como globulina antitimocítica (ATG) o globulina antilinfocitaria (ALG) y el anticuerpo monoclonal de origen murino muromonab-CD3. Algunos de los fármacos inmunosupresores utilizados en la prevención del rechazo agudo, son también eficaces en el tratamiento del rechazo agudo, como por ejemplo, tacrolimus y micofelonato mofetil.
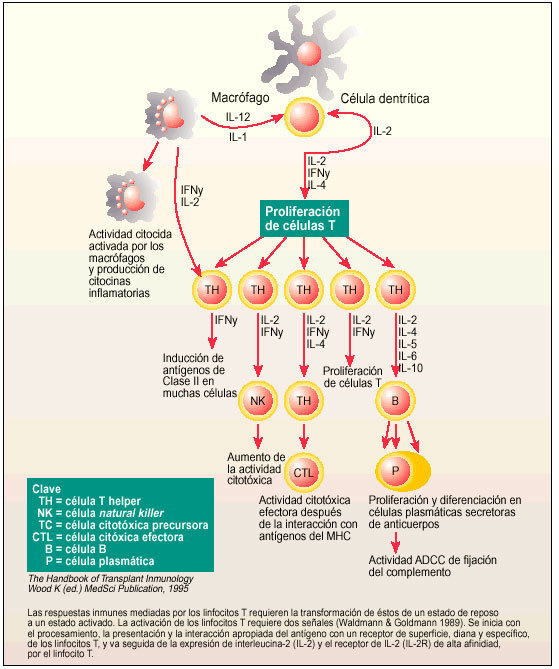
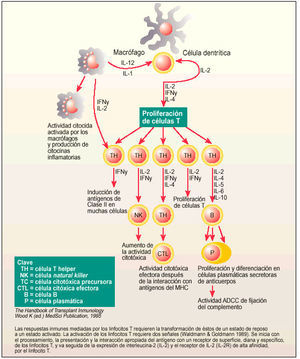
Esquema gráfico de la respuesta inmune
Terapia de inducción
La terapia de inducción consiste en la administración de agentes de rescate en un entorno profiláctico. La utilización de este tipo de terapia se realiza en el período previo a la intervención quirúrgica y durante el postrasplante inmediato.
Esta terapia también se puede utilizar para retrasar la administración de la primera dosis de agentes inhibidores de la calcineurina, para poder preservar el aloinjerto de los efectos nefrotóxicos de ciclosporina o tacrolimus en el período de postrasplante inmediato.
Terapia de combinación
En la mayoría de las unidades de trasplante se utilizan combinaciones de agentes inmunosupresores indicados en la prevención del rechazo agudo acompañado, o no, de un agente de inducción. La terapia de combinación permite administrar dosis más bajas de cada agente, por lo que se minimizan los efectos secundarios y toxicidades, a la vez que el efecto inmunosupresor puede ser aditivo. La terapia inicial consiste normalmente en la adiministración de ciclosporina en combinación con micofenolato mofetil, o azatioprina y corticoides (terapia triple). La terapia cuádruple incluye una terapia de inducción con anticuerpos como ALG, ATG o muromonab-CD3, al inicio del tratamiento.
Daclizumab
La introducción de daclizumab supone la posibilidad de utilización de un anticuerpo con eficacia demostrada en la prevención del rechazo agudo en trasplante. Daclizumab está indicado para la prevención del rechazo agudo y proporciona una inmunosupresión eficaz durante todo el período de mayor riesgo que dura 120 días tras el trasplante, reduciendo la incidencia de rechazo. Los pacientes sometidos a trasplante renal que reciben daclizumab no presentan un aumento del riesgo de experimentar efectos adversos asociados con la terapia inmunosupresora, ni requieren una monitorización adicional a consecuencia de su administración; todo ello es debido a su eficacia bien establecida y excelente perfil de seguridad.
En la actualidad, el siguiente desafío es controlar la incidencia de rechazo crónico y eliminar la nefrotoxicidad y la tendencia de los inmunosupresores disponibles a aumentar el riesgo de infecciones y neoplasias.
Hasta el momento, los fármacos inmunosupresores poseían importantes limitaciones:
Carecer de selectividad inmunológica. Al no ser específicos del aloantígeno, no sólo tienen como objetivo las células implicadas en la respuesta inmune dirigida por el aloantígeno del donante, sino también, los leucocitos involucrados en otras respuestas inmunes relacionadas con los agentes infecciosos.
Poseer una eficacia limitada. El rechazo agudo y crónico continúa siendo un importante problema clínico.
Producir inmunodeficiencia. Que puede dar lugar a infecciones oportunistas y a un aumento de las neoplasias inducidas por virus.
Poseer efectos adversos.
Los anticuerpos policlonales, tales como ALG y ATG, son sueros con actividad inmunosupresora potente que se producen en conejos y caballos. Producen una linfopenia profunda y una depleción de linfocitos T prolongada, efectos que dan lugar a un aumento del riesgo de que se desarrollen neoplasias e infecciones oportunistas. Uno de los principales problemas derivados de la administración de anticuerpos policlonales es la inmunosupresión excesiva, que está asociada con la falta de especificidad de los anticuerpos. Se puede manifestar en forma de infección, sobre todo de tipo viral, por ejemplo, citomegalovirus (CMV), y da lugar a una morbilidad e incluso mortalidad significativa del paciente.
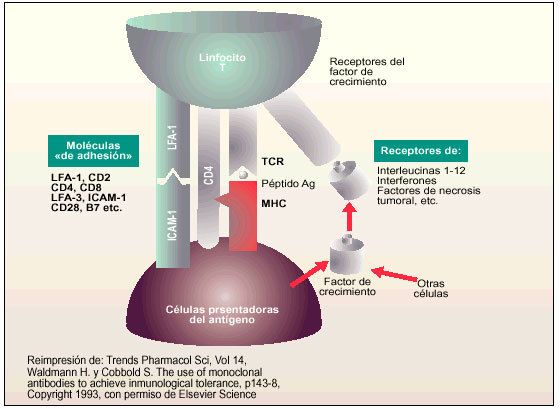
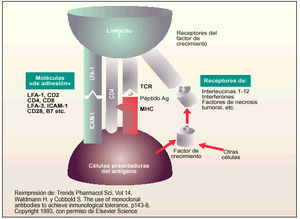
Moléculas de interacción con los linfocitos T/células presentadoras de antígeno
A través de la ingeniería genética se están creando nuevos anticuerpos monoclonales murinos para superar los problemas asociados, especialmente la inmunogenicidad, como son los anticuerpos monoclonales quiméricos o humanizados.
Anticuerpos monoclonales
Un agente inmunosupresor ideal estaría dirigido selectivamente a los linfocitos T destinados a participar en la reacción inmune al antígeno del donante. Puesto que el péptido Tac es selectivo para las células T activadas, un anticuerpo monoclonal que inactivase selectivamente estas células, inhibiría las respuestas inmunes incipientes o en curso, sin suprimir la inmunidad natural o la capacidad para producir una respuesta inmune específica a un antígeno nuevo, una vez completada la terapia anti Tac.
Desde principios de los años 80 se han desarrollado una serie de anticuerpos monoclonales dirigidos contra varios procesos de la activación de los linfocitos T. La mayoría están dirigidos a los receptores celulares de superficie. Los anticuerpos monoclonales se han investigado experimentalmente, obteniéndose resultados variables, en terapia de inducción para la prevención del rechazo agudo resistente a esteroides.
El primer anticuerpo monoclonal que se utilizó en trasplante fue muromonab-CD3, un anticuerpo monoclonal murino con eficacia de mostrada para retrasar el rechazo en el período postrasplante inicial e invertir los episodios de rechazo agudo incluso en pacientes que no responden a esteroides a dosis altas y a ALG policlonales. Pero el uso de muromonab se asocia a efectos secundarios producidos por la liberación de citoquina tales como fiebre, escalofríos, cefaleas, mialgia, náuseas, vómitos y diarrea. La inmunosupresión no selectiva del fármaco da lugar también a una incidencia alta de infecciones oportunistas y linfomas.
Se han desarrollado diversos anticuerpos monoclonales murinos de alta afinidad, son específicos de diferentes epítopes presentes en la cadena alfa. Estudios experimentales han demostrado su eficacia pero los resultados obtenidos en pacientes no han sido del todo satisfactorios.
A través de la ingeniería genética se están creando nuevos anticuerpos monoclonales murinos para superar los problemas asociados, especialmente la inmunogenicidad, como son los anticuerpos monoclonales quiméricos o humanizados.
Los anticuerpos monoclonales quiméricos están compuestos por regiones constantes humanas y regiones variables de cadenas pesadas y ligeras de ratón, por consiguiente contiene menos secuencias de aminoácidos extrañas para el sistema inmunológico humano aunque pueden seguir siendo inmunogénicos, lo que limita su eficacia y acorta su vida media sérica, reduciendo su potencial de uso repetido.
Los anticuerpos monoclonales humanizados conservan sólo los componentes mínimos necesarios del anticuerpo de ratón, sólo el lugar de unión al antígeno se combina con la estructura de la región V humana y las secuencias de la región C humana. Estos anticuerpos monoclonales conservan la capacidad para reconocer secuencias diana, pero son menos inmunogénicos que los anticuerpos de ratón o quiméricos. Estas características del diseño mejoran las propiedades farmacocinéticas del anticuerpo y reducen su inmunogenicidad, lo que permite prolongar el período de tratamiento y administrar tratamientos repetidos. La vida media sérica larga de estos anticuerpos monoclonales implica que se puedan manipular como una proteína endógena.Daclizumab es un fármaco inmunosupresor diseñado a medida específicamente para superar los defectos generales de los anticuerpos monoclonales. Se trata de una versión humanizada obtenida por ingeniería genética. La mayor parte de la molécula está elaborada a partir del IgG1 humano, tiene una vida media circulante más larga, inmunogenicidad reducida y una actividad citotóxica in vitro dependiente del anticuerpo elevada.