EL SÍNDROME DE LISIS TUMORAL (SLT) es una de las emergencias oncológicas metabólicas identificadas por la Oncology Nursing Society1. Este síndrome se produce cuando se eliminan (o se lisan) un gran número de células tumorales malignas de división rápida, lo que libera grandes cantidades de sus componentes intracelulares, entre ellos electrolitos, en la circulación sistémica. Como consecuencia, el SLT puede dar lugar a complicaciones potencialmente mortales, como desequilibrio electrolítico, insuficiencia renal aguda (IRA), desequilibrio ácido-base, y posiblemente la muerte. Después de describir el desarrollo del SLT, en este artículo se explica qué personas están en riesgo, cómo se diagnostica y qué medidas pueden tomar las enfermeras para ayudar a prevenir esta peligrosa complicación del tratamiento contra el cáncer.
Comprensión de la fisiopatologíaEl SLT se suele desarrollar cuando se expone un gran número de células cancerosas a un tratamiento antineoplásico, que puede ser quimioterapia, radioterapia, bioterapia (como con algunos anticuerpos monoclonales), fármacos hormonales, esteroides o cualquier combinación de los anteriores2. También se ha notificado SLT espontáneo cuando los hallazgos analíticos descritos más adelante aparecen antes de que el paciente haya recibido cualquier tratamiento antineoplásico3,4. Lo más probable es que el SLT se desarrolle en pacientes con una carga tumoral elevada (es decir, un tumor grande con muchas células cancerosas), porque cuantas más células se lisan, más componentes intracelulares se liberan en el torrente circulatorio (entre ellos potasio, fosfato y ácidos nucleicos)1,2,5–7. Esto da lugar a complicaciones como hiperpotasemia, hiperfosfatemia e hipocalcemia secundaria; los ácidos nucleicos liberados se convierten en ácido úrico, lo que provoca hiperuricemia.
La hiperuricemia y la hiperfosfatemia propician la IRA y promueven la formación de precipitados de ácido úrico y depósitos de fosfato cálcico en los túbulos renales, la vasoconstricción renal, la disminución del flujo sanguíneo renal y la inflamación3,8.
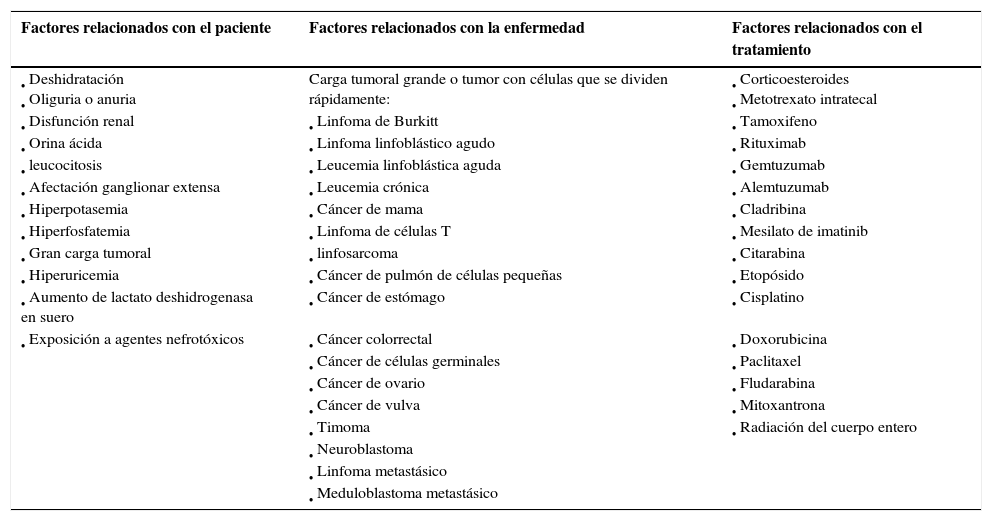
¿Quién está en riesgo?La incidencia exacta de SLT no se conoce; es impredecible y depende de la enfermedad. Además, la mejora de la profilaxis de SLT ha reducido su incidencia9. Los factores de riesgo asociados con el SLT se dividen en tres categorías: relacionados con el paciente, relacionados con la enfermedad y relacionados con el tratamiento (véase el cuadro Factores de riesgo del síndrome de lisis tumoral). El SLT es más probable que ocurra en pacientes con neoplasias malignas hematológicas. Las neoplasias malignas más asociadas al SLT son el linfoma no hodgkiniano de Burkitt, la leucemia linfoblástica aguda, el linfoma linfoblástico agudo y la leucemia crónica, porque son las que pueden suponer una mayor carga tumoral, una mayor sensibilidad a la quimioterapia y una renovación celular más rápida1,5.
Los pacientes con mayor riesgo de SLT presentan tumores malignos de proliferación rápida que son sensibles al tratamiento. Los niveles elevados de lactato deshidrogenasa (LDH) en suero se asocian con un gran volumen tumoral, que es un factor de predicción potente de complicaciones relacionadas con el tratamiento1. La disfunción renal preexistente se asocia con SLT porque las células tumorales lisadas y su contenido intracelular no pueden excretarse de manera eficaz. Los antecedentes médicos del paciente también pueden ayudar a identificar los factores de riesgo de SLT. Por ejemplo, los antecedentes de gota con hiperuricemia o de disfunción renal aumentan el riesgo del paciente de sufrir SLT.
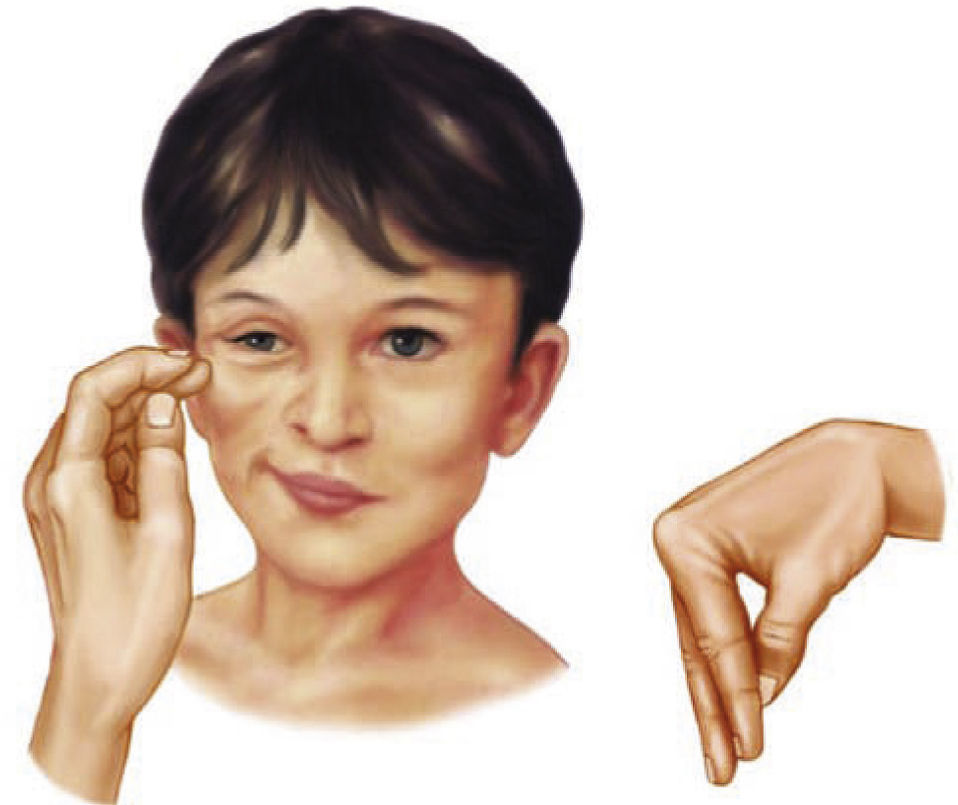
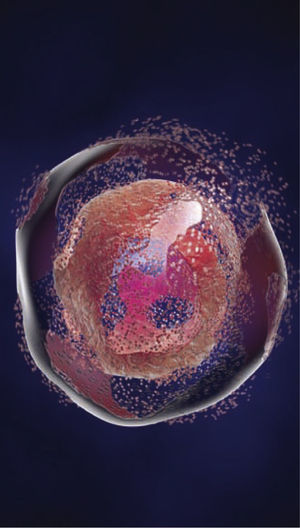
Manifestaciones clínicas del síndrome de lisis tumoralEl cuadro clínico del SLT no es específico y refleja su relación con complicaciones metabólicas de hiperpotasemia, hiperfosfatemia, hipocalcemia secundaria e hiperuricemia. Las manifestaciones clínicas incluyen debilidad, anorexia, náuseas, vómitos y diarrea, así como anomalías cardiovasculares y neuromusculares (véase el cuadro Signos y síntomas de síndrome de lisis tumoral). Hay dos signos neurológicos que pueden asociarse a la hipocalcemia: los signos de Chvostek y de Trousseau (véase el cuadro Los dos signos neurológicos del síndrome de lisis tumoral). El signo de Chvostek no es específico de la hipocalcemia. De hecho, aproximadamente una tercera parte de pacientes con hipocalcemia no lo presentan, y un 10% de los pacientes con signo de Chvostek presentan concentraciones de calcio normales10.
Factores de riesgo del síndrome de lisis tumoral1,2,5,9,19
| Factores relacionados con el paciente | Factores relacionados con la enfermedad | Factores relacionados con el tratamiento |
|---|---|---|
| • Deshidratación • Oliguria o anuria | Carga tumoral grande o tumor con células que se dividen rápidamente: | • Corticoesteroides • Metotrexato intratecal |
| • Disfunción renal | • Linfoma de Burkitt | • Tamoxifeno |
| • Orina ácida | • Linfoma linfoblástico agudo | • Rituximab |
| • leucocitosis | • Leucemia linfoblástica aguda | • Gemtuzumab |
| • Afectación ganglionar extensa | • Leucemia crónica | • Alemtuzumab |
| • Hiperpotasemia | • Cáncer de mama | • Cladribina |
| • Hiperfosfatemia | • Linfoma de células T | • Mesilato de imatinib |
| • Gran carga tumoral | • linfosarcoma | • Citarabina |
| • Hiperuricemia | • Cáncer de pulmón de células pequeñas | • Etopósido |
| • Aumento de lactato deshidrogenasa en suero | • Cáncer de estómago | • Cisplatino |
| • Exposición a agentes nefrotóxicos | • Cáncer colorrectal | • Doxorubicina |
| • Cáncer de células germinales | • Paclitaxel | |
| • Cáncer de ovario | • Fludarabina | |
| • Cáncer de vulva | • Mitoxantrona | |
| • Timoma | • Radiación del cuerpo entero | |
| • Neuroblastoma | ||
| • Linfoma metastásico | ||
| • Meduloblastoma metastásico |
Signos y síntomas de síndrome de lisis tumoral1,19
| Hiperpotasemia | Hiperfosfatemia | Hipocalcemia | Hiperuricemia |
|---|---|---|---|
| • Diarrea | • Anuria | • Fasciculaciones musculares | • Náuseas |
| • Náuseas | • Oliguria | • Espasmo carpopedal | • Vómitos |
| • Vómitos | • Azoemia | • Tetania | • Diarrea |
| • Paresia o parálisis | • Signos y síntomas de hipocalcemia | • Parestesias | • Edema periférico |
| • Parestesias | • Laringoespasmo | • Dolor lumbar | |
| • Calambres | • Convulsiones | • Oliguria | |
| • Defectos en la conducción cardiaca | • Signo de Trousseau | • Anuria | |
| • Arritmias cardiacas | • Signo de Chvostek | • Azoemia | |
| • Cambios en el ECG* | • Confusión | • Cristaluria | |
| • Delirio | |||
| • Hipotensión | |||
| • Arritmias ventriculares | |||
| • Prolongación del intervalo QT |
* Los cambios en el ECG por hiperpotasemia incluyen: ondas T altas y con grandes picos con un intervalo QT reducido; la prolongación progresiva del intervalo PR y de la duración del QRS; la desaparición de la onda P; y la ampliación del complejo QRS a un patrón de onda sinusoidal20.
El diagnóstico de SLT se basa en datos analíticos que reflejan sus cambios fisiopatológicos asociados, entre ellos hiperpotasemia, hiperfosfatemia, hipocalcemia secundaria e hiperuricemia.
La hiperpotasemia se puede desarrollar tan pronto como 6 horas después del inicio del tratamiento antineoplásico6. La hiperfosfatemia se suele desarrollar en un intervalo de 24 a 48 horas tras del inicio del tratamiento6. La hipocalcemia normalmente aparece entre 24 y 48 horas después6 y la hiperuricemia se suele desarrollar de 48 a 72 horas después del inicio del tratamiento antineoplásico1,6,9 (véase el cuadro Uso de la definición/clasificación de Cairo y Bishop para consultar más criterios de diagnóstico).
Si el paciente presenta una gran carga tumoral, el nivel de LDH sérica será elevado (como ya se ha comentado). Si el paciente tiene disfunción renal subyacente o presenta IRA como consecuencia del SLT, los resultados analíticos pueden incluir la reducción del aclaramiento de creatinina y de la tasa de filtración glomerular estimada y el aumento del nitrógeno ureico en sangre y de la creatinina sérica. Los gases arteriales pueden ser indicio de acidosis metabólica. En un análisis de orina podrían hallarse cristales de ácido úrico2.
Estrategias de tratamientoCuando un paciente recibe un diagnóstico de SLT, las prioridades de enfermería son evaluar y conservar la vía aérea, la respiración y la circulación del paciente; controlar sus constantes vitales y el ritmo cardiaco; comprobar si hay anomalías metabólicas y electrolíticas; mantener el estado de líquidos óptimo; administrar los medicamentos recetados; y proporcionar instrucciones y apoyo emocional al paciente y a sus familiares. Las anomalías metabólicas y electrolíticas se tratan como se indica a continuación:
- •
Hiperpotasemia. El tratamiento de la hiperpotasemia incluye el uso de monitorización cardiaca continua para detectar arritmias, la restricción del potasio de la dieta y la administración de gluconato de calcio o de cloruro cálcico, bicarbonato de sodio, insulina regular con glucosa, agonistas beta-2 adrenérgicos (como albuterol), o una combinación de esos fármacos. El calcio antagoniza la acción del potasio en la membrana celular cardiaca. La insulina, el bicarbonato de sodio y los agonistas beta-2 adrenérgicos llevan el potasio extracelular a las células. La glucosa se administra con insulina regular para prevenir la hipoglucemia durante la administración de insulina.
Como los efectos de la administración de calcio y de las intervenciones para trasladar el potasio dentro de las células son temporales, también se pueden requerir intervenciones para eliminar el potasio del cuerpo. Estas conllevan la administración de una resina de intercambio catiónico (sulfonato sódico de poliestireno) o un diurético de asa o tiazídico, o la ejecución de una hemodiálisis11.
Otras intervenciones son asegurarse de que el paciente no recibe líquidos i.v. que contengan potasio ni medicamentos con potasio o que contribuyan a su retención, como los inhibidores de la enzima convertidora de la angiotensina.
- •
Hiperfosfatemia. Los aglutinantes de fosfato, como el acetato de calcio y el hidróxido de aluminio, se utilizan para reducir los niveles de fósforo en suero impidiendo la absorción gastrointestinal de fosfato. Por la relación inversa del fósforo y el calcio, hay que controlar las concentraciones séricas de calcio y de fósforo3,6,12. Existen también aglutinantes de fosfato (como el sevelámero) que no contienen calcio (o aluminio). Como en el caso de la hiperpotasemia, hay que asegurarse de no administrar medicamentos que contengan fósforo. La administración de solución de cloruro de sodio al 0,9% con un diurético de asa (como furosemida) también puede estimular la excreción renal de fósforo13.
- •
Hipocalcemia. Las enfermeras deben establecer medidas de actuación frente a crisis convulsivas en pacientes con hipocalcemia sintomática y administrar calcio i.v. según lo prescrito; para los pacientes no sintomáticos, por norma general no se requiere tratamiento5.
Al menos en cada turno se debe medir el intervalo QT y calcular el QTc. La hipocalcemia puede hacer que se prolongue el intervalo QT y que aumente el QTc, lo que incrementa el riesgo de arritmias ventriculares, entre ellas torsades de pointes. La torsade de pointes es una forma de taquicardia ventricular polimórfica que se produce en la prolongación del intervalo QT14.
- •
Hiperuricemia. Utilizado en pacientes con un riesgo intermedio de desarrollar SLT, el alopurinol es un inhibidor de la xantinooxidasa que previene la acumulación de ácido úrico reduciendo la producción de nuevo ácido úrico, y no reduciendo el ácido úrico sérico preexistente15,16. El alopurinol puede interactuar con otros fármacos, entre ellos los diuréticos de asa o tiazídicos. El alopurinol también se ha asociado a reacciones de hipersensibilidad, entre ellas el síndrome de Stevens-Johnson15.
(Izquierda) El signo de Chvostek: contracción de los músculos faciales en respuesta a un ligero toque en el nervio facial que pasa por delante de la oreja.
(Derecha) El signo de Trousseau: espasmo carpopedal inducido al hinchar un manguito de presión arterial por encima de la presión arterial sistólica.
La rasburicasa se administra para tratar el SLT consolidado. La rasburicasa es una enzima recombinante uratooxidasa que convierte el ácido úrico en un metabolito de ácido úrico soluble e inactivo, con lo que se reducen los niveles plasmáticos de ácido úrico en las 4 horas posteriores a la administración13. La rasburicasa no impide la producción de ácido úrico. Cuando la rasburicasa se utiliza en pacientes que están en tratamiento por neoplasias malignas tumorales sólidas o hematológicas, sus reacciones adversas más frecuentes son fiebre, cefalea, náuseas, vómitos e hipofosfatemia17. La rasburicasa está contraindicada en pacientes con déficit de glucosa 6-fosfato deshidrogenasa (G6PD) por el riesgo de reacciones hemolíticas graves17. Antes de iniciar el tratamiento con rasburicasa, hay que cribar a los pacientes con más riesgo de déficit de G6PD (es decir, pacientes de ascendencia africana o mediterránea)3,6,9,12,17. La rasburicasa también puede provocar reacciones de hipersensibilidad graves y mortales, como la anafilaxia17.
Prevención del síndrome de lisis tumoralEn primer lugar, las enfermeras deben identificar el nivel de riesgo de SLT para poder tomar medidas preventivas de 24 a 48 horas antes de iniciar el tratamiento antineoplásico1. Deberán evitarse los medicamentos potencialmente nefrotóxicos, como los fármacos antiinflamatorios no esteroideos y los antibióticos aminoglucósidos. Deberá introducirse una dieta baja en fósforo y potasio.
No obstante, la medida fundamental para prevenir el SLT es la hidratación intensiva durante las 24 a 72 horas previas al inicio del tratamiento antineoplásico1. Entre los fines de la hidratación se encuentran el aumento de la diuresis, la mejora de la perfusión renal y la ayuda para la prevención de precipitados de fosfato cálcico y de ácido úrico y de IRA. La diuresis deseada es de 2 a 3 L/m2/día o al menos de 80 a 100mL/m2/h1,5,8.
La definición/clasificación de Cairo-Bishop proporciona criterios de diagnóstico analítico específico para el SLT. Los pacientes deben presentar dos o más de los siguientes resultados en el análisis sanguíneo:
- •
Potasio igual o superior a 6 mEq/L (normal: de 3,5 a 5,0 mEq/L)
- •
Fósforo igual o superior a 4,5mg/dL (normal: de 2,5 a 4,5mg/dL)
- •
Calcio igual o inferior a 7mg/dL (normal: de 8,5 a 10,5mg/dL)
- •
Ácido úrico igual o superior a 8mg/dL (normal: de 2,6 a 8,2mg/dL)
Estos datos analíticos deben observarse en los 3 días anteriores o en los 7 días posteriores al inicio del tratamiento antineoplásico21. De acuerdo con la definición/clasificación de Cairo-Bishop, se acepta un cambio del 25% desde el nivel basal de estos parámetros analíticos en el mismo periodo para determinar un diagnóstico de SLT5–7
La selección del líquido i.v. dependerá del estado clínico del paciente. Por ejemplo, para pacientes con deshidratación o hiponatremia se suele indicar solución de cloruro de sodio al 0,9%8. El peso específico esperado de orina es de menos de 1,01018.
La administración de alopurinol es otra medida esencial para la prevención del SLT1. A los pacientes con una tasa de filtrado glomerular más baja o a los que tienen antecedentes de reacción grave o alergia al alopurinol se les puede administrar un nuevo inhibidor de la xantinooxidasa: el febuxostat7.
Como los pacientes reciben hasta 3 L/m2 de líquido en 24 horas para la hidratación previa al tratamiento, tienen riesgo de sobrecarga de líquidos. En estos casos, se puede empezar a administrar un diurético (como la furosemida) una vez iniciada la reanimación con líquidos para ayudar a mantener la diuresis. Aparte de aumentar la diuresis, la furosemida ayuda a eliminar el potasio, con lo que se reducen los niveles de potasio sérico1,13.
Algunos expertos recomiendan administrar diuréticos solamente en caso de sobrecarga de líquidos7. El uso de diuréticos está contraindicado en pacientes hipovolémicos1,8.
Antiguamente, los pacientes también recibían bicarbonato de sodio y/o acetazolamida junto con la hidratación i.v. como fármacos alcalinizantes de la orina. La premisa de este tratamiento fue reducir el riesgo de formación de cristales de ácido úrico en los túbulos renales. No obstante, datos más recientes indican que solo con hidratación se puede minimizar eficazmente el riesgo de cristalización del ácido úrico. Además, al alcalinizar la orina aumenta el riesgo de hipocalcemia y de nefropatía por ácido úrico y de formación de cristales de fosfato de calcio una vez desarrollado el SLT7,8. Actualmente se recomienda administrar bicarbonato de sodio solamente si hay acidosis metabólica5.
Las enfermeras también tienen que abordar las necesidades psicosociales del paciente y de sus familiares, y enseñarles por qué el paciente presenta riesgo de SLT, incluyendo la justificación de cada medida preventiva que se implemente. Hay que hacer hincapié en los signos y síntomas del SLT y en la importancia de informar inmediatamente a su médico si aparecen. Desarrollar SLT en la fase temprana del tratamiento contra el cáncer puede ser psicológicamente estresante para el paciente y sus familiares, que ya intentan lidiar con el estrés y la incertidumbre de un diagnóstico de cáncer.
Un paciente con esta urgencia oncológica puede tener que ingresarse en la unidad de cuidados intensivos para controlar las arritmias potencialmente mortales o para tratar la IRA. Si se desarrolla IRA, se puede interrumpir temporalmente el tratamiento antineoplásico. Retrasar el tratamiento para un tumor de gran malignidad también puede ser muy estresante. Hay que tranquilizar al paciente y a sus familiares afirmando que esta interrupción temporal es necesaria para reducir el riesgo de daño renal irreparable.
Si colabora con el servicio de atención religiosa del hospital para ofrecer apoyo espiritual y emocional o con el departamento de psiquiatría puede ayudar a superar este periodo vulnerable de manera eficaz. Algunos centros también cuentan con un equipo de gestión del estrés experimentado en tratar los síntomas psicológicos notificados por pacientes con cáncer.
Tratamiento de pacientes con síndrome de lisis tumoralSi las estrategias de prevención no son totalmente eficaces y el paciente desarrolla SLT, aparte de ofrecer apoyo emocional e instrucciones al paciente y a sus familiares hay que estar listos para iniciar diferentes intervenciones de enfermería. Estas incluyen la colaboración con profesionales sanitarios para determinar si conviene ejecutar una monitorización cardiaca continua. Si se desarrolla hiperpotasemia, es fundamental reconocer y tratar cuanto antes las arritmias y otros cambios en el ECG asociados1,2,5.
Normalmente los centros sanitarios disponen de protocolos relativos a la frecuencia de obtención de resultados analíticos para detectar si hay SLT. Se recomienda controlar regularmente los electrolitos séricos, el ácido úrico y los análisis de la función renal (normalmente cada 4-12 horas) para poder identificar tendencias en los datos analíticos y tratar a los pacientes cuanto antes1,2,5.
El tratamiento con líquido i.v. debe continuar en la medida en que el paciente esté en riesgo de desarrollar SLT. No es frecuente desarrollar IRA que requiera tratamiento de reemplazo renal. No obstante, si estuviera indicado, el paciente podría requerir tratamiento de reemplazo renal temporal1,2,5.
Idea generalEl SLT puede ser una complicación de tumores malignos con células de división rápida potencialmente mortal. La atención de enfermería rigurosa, que incluirá la identificación de pacientes en riesgo, la implementación de medidas preventivas y el seguimiento de los resultados analíticos del paciente, puede ayudar a optimizar los resultados de los pacientes. ■
Las autoras y planificadoras han declarado que no existen conflictos de interés, financieros o de otro tipo.