El señor P., de 56 años, tenía antecedentes de cirrosis, pancreatitis y úlcera péptica. Fue hospitalizado en el servicio de urgencias con hematemesis (se calculó aproximadamente 1 l). En la primera consulta, solo respondía a estímulos dolorosos. Se le colocó de inmediato un monitor de frecuencia cardíaca. Sus constantes vitales iniciales eran: PA 70/40 mmHg; taquicardia sinusal con frecuencia cardíaca de 134 lat./min; frecuencia respiratoria de 28 resp./min; temperatura de 35,5 ¿C, y SpO2del 89% a temperatura ambiente. La hipotermia leve que presentaba probablemente estaba relacionada con la pérdida de una cantidad considerable de sangre y con la hipotensión durante un tiempo indeterminado1.
Al Sr. P. se le colocó de inmediato una cánula endotraqueal para proteger las vías respiratorias y se le introdujeron dos catéteres periféricos i.v. de gran calibre, una sonda orogástrica (SOG) de gran calibre y una sonda urinaria permanente. Se le insertó una vía arterial y se le administraron 3 l de cloruro de sodio al 0,9% en bolo i.v.
Los valores analíticos iniciales fueron 4,4 g/dl de hemoglobina (Hb; valores normales: 14-17,4 g/dl) y 13,2% de hematocrito (Hto; valores normales: 42-52%). Para conocer otras cifras del análisis, véanse los cuadros Valores analíticos iniciales del Sr. P. y Valores iniciales de la gasometría arterial del Sr. P.
Al Sr. P. se le realizó una esofagogastroduodenoscopia de urgencia, que mostró una hemorragia aguda varicosa. Se inició tratamiento con octreotida i.v. y se intentó realizar la ligadura endoscópica de las varices. El Sr. P. se mantuvo hipotenso a 90/50 mmHg a pesar del tratamiento en curso con bolos salinos normales, transfusiones de sangre y tratamiento vasopresor. La SOG drenó unos 2,5 l de sangre de color rojo brillante.
En ese momento se inició el protocolo de transfusión masiva de hemoderivados del hospital.
Los cuidados enfermeros de los pacientes que reciben una transfusión masiva es un desafío porque esta se relaciona con consecuencias graves y potencialmente mortales, como hipocalcemia, hipotermia, coagulopatía por dilución, hipomagnesemia, reacciones adversas causadas por citrato, acidosis láctica y embolia gaseosa2. La hipocalcemia clínicamente importante, una complicación frecuente de la transfusión masiva, puede provocar disfunción neurológica y cardiovascular que puede comprometer aún más la supervivencia. Se calcula que la mortalidad de los pacientes que reciben una transfusión masiva para tratar la hemorragia por causas no traumáticas se encuentra alrededor del 23%3.
Basado en la exposición del caso clínico del Sr. P., este artículo se centra específicamente en el papel de la enfermera en el cuidado de pacientes con hipocalcemia relacionada con una transfusión masiva.
Definición de transfusión masivaSegún el protocolo del centro, la transfusión masiva se puede definir de las siguientes maneras4:
- •
La transfusión de 10 unidades de concentrado eritrocitario o más en un periodo de 24 horas.
- •
La transfusión de 5 unidades de concentrado eritrocitario o más durante 3 o 4 horas.
- •
La transfusión de 3 unidades de concentrado eritrocitario en 1 hora.
Las dos últimas definiciones tienen como objetivo incluir a los pacientes que podrían morir prematuramente o aquellos en fase de reanimación aguda5. Se anima a que cada médico revise el protocolo sobre transfusión masiva del centro correspondiente, incluidos los criterios específicos sobre transfusión masiva del centro donde trabajan.
Un análisis exhaustivo de los protocolos sobre transfusión masiva queda fuera del ámbito de este artículo. Sin embargo, dado que la transfusión masiva es una actividad clínica poco frecuente, pero de grandes repercusiones, se anima al equipo multidisciplinario a estar familiarizado con el protocolo sobre transfusión masiva mediante formación continua (p. ej., con simulaciones clínicas) y una sesión de análisis y reflexión tras un caso para conseguir una mejora continua de la calidad (v. el cuadro Elementos clave de un protocolo sobre transfusión masiva)6.
Comprender el papel del calcioEl calcio (Ca++) es el principal catión divalente del organismo. Casi todo (99%) el Ca++ del cuerpo humano se almacena en los huesos, donde proporciona resistencia y estabilidad al sistema esquelético y se utiliza como fuente intercambiable para mantener los niveles de calcio en el líquido extracelular (LEC). La mayor parte del calcio restante (aproximadamente, el 1%) se encuentra en el líquido intracelular. Solo el 0,1-0,2% (aproximadamente de 8,5 a 10,5 mg/dl, o de 21 a 26 mmol/l) del calcio restante se encuentra en el LEC7.
Valores analíticos iniciales del Sr. P.
Cuando el Sr. P. ingresó en el servicio de urgencias, los valores analíticos iniciales eran los siguientes:
- •
Cifra de leucocitos: 16.000 células/mm3 (normal: 5.000-10.000 células/mm3)
- •
Cifra de eritrocitos: 2,0 × 106/mm3 (normal: 4,5-5,5 × 106/mm3)
- •
Hb: 4,4 g/dl (normal: 14-17,4 g/dl)
- •
Hto: 13,2% (normal: 42 -52%)
- •
Plaquetas: 86.000/mm3 (normal: 140.000-400.000/mm3)
- •
Tiempo de tromboplastina parcial activada: >60 s (normal: 21,0-35,0 s)
- •
Tiempo de protrombina: 30 s (normal: 11,0-13,0 s)
- •
Índice internacional normalizado: 2,10 (normal: 0,8-1,2)
- •
Sodio sérico: 148 mEq/l (normal: 135-145 mEq/l)
- •
Potasio: 4,8 mEq/l (normal: 3,5-5,2 mEq/l)
- •
Cloruro: 105 mEq/l (normal: 96-106 mEq/l)
- •
Dióxido de carbono: 17 mEq/l (normal: 23-30 mEq/l)
- •
Ca++ total: 7,8 mg/dl (normal: 8,8-10,4 mg/dl; Ca++ ionizado: no se determinó en este paciente)
- •
Fosfato: 5,1 mg/dl (normal: 2,7-4,5 mg/dl)
Referencia para valores analíticos normales: Fischbach F, Dunning III MB. Manual of Laboratory and Diagnostic Tests. 9th ed. Philadelphia, PA: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2014.
Valores iniciales de la gasometría arterial del Sr. P.
- •
pH: 7,30 (normal: de 7,35 a 7,45)
- •
PaCO2: 33 mmHg (normal: de 35 a 45 mmHg)
- •
HCO3: 16 mEq/l (normal: de 21 a 27 mEq/l)
- •
PaO2: 65 mmHg (normal: superior a 80 mmHg)
- •
SaO2: 89% (normal: superior al 95%)
Referencia para valores normales: Theodore AC. Arterial blood gases. UpToDate 2015. www.uptodate.com
La concentración total de calcio sérico se encuentra de tres formas: ionizada, en complejos y unida a proteínas7. Aproximadamente el 50% del Ca++ sérico total está ionizado o libre, lo que significa que la molécula del Ca++ es metabólicamente activa8. Solo la forma ionizada del Ca++ (normal: 4,65-5,28 mg/dl [1,16-1,32 mmol/l]) puede salir libremente del compartimento vascular y participar en las funciones celulares. Como se analiza con más detalle más adelante, estos efectos de amplio alcance están implicados en la coagulación de la sangre, los potenciales de membrana y la excitabilidad neuronal; la función del músculo esquelético, cardíaco y liso, y la liberación de varias hormonas y neurotransmisores. La concentración de Ca++ sérico ionizado está estrictamente regulada por la hormona paratiroidea (PTH) y la vitamina D7 (v. el cuadro Comprender la homeostasis del Ca++).
Alrededor del 10% del Ca++ sérico se encuentra en complejos o unido a ácidos orgánicos e inorgánicos, como el citrato y el fosfato. El 40% restante del Ca++ sérico está unido a las proteínas, principalmente a la albúmina9. Por esta razón, los niveles totales de Ca++ sérico están muy influidos por los niveles de albúmina sérica. Los niveles de Ca++ ionizado también están inversamente afectados por el pH de la sangre; cuando el pH arterial aumenta, se une más calcio a la proteína7.
Se han propuesto fórmulas para obtener un nivel de Ca++ corregido basado en los niveles de Ca++ sérico total y de albúmina sérica, pero el método más preciso para medir el calcio sérico metabólicamente activo es obtener un nivel de Ca++ ionizado. Sin embargo, quizá no se lo pueda utilizar como protocolo estándar en todos los entornos8,9.
Cómo surge la hipocalcemiaLa hipocalcemia refleja un nivel de calcio sérico total inferior a 8,8 mg/dl (2,2 mmol/l) y un nivel de Ca++ ionizado inferior a 4,65 mg/dl (1,16 mmol/l). La seudohipocalcemia está provocada por hipoalbuminemia. Produce una disminución del Ca++ unido a proteínas más que del Ca++ ionizado y en general es asintomática. Antes de que se pueda establecer un diagnóstico de hipocalcemia, el calcio sérico total debe corregirse con niveles bajos de albúmina7.
Las causas más frecuentes de hipocalcemia son las pérdidas anormales de calcio por el riñón, el deterioro en la capacidad de movilizar calcio del hueso debido a hipoparatiroidismo y el aumento de la unión a proteínas o quelación, de tal manera que grandes cantidades de calcio se encuentran en una forma no ionizada. En la insuficiencia renal, una causa importante de hipocalcemia, la disminución de la producción de vitamina D activada y la hiperfosfatemia desempeñan un papel. Debido a la relación inversa entre calcio y fosfato, cuando los niveles de Ca++ sérico disminuyen, aumentan los niveles de fosfato7.
Los niveles de magnesio también afectan a los niveles de Ca++ sérico al influir en la secreción de PTH y la reabsorción intestinal de Ca++10. Se ha demostrado que la hipomagnesemia grave provoca hipocalcemia secundaria8. En casos de hipomagnesemia crónica, el descenso del calcio sérico se debe a un efecto inhibidor sobre la secreción de PTH. Sin embargo, en la hipomagnesemia de inicio agudo, el mecanismo aún no se conoce por completo11.
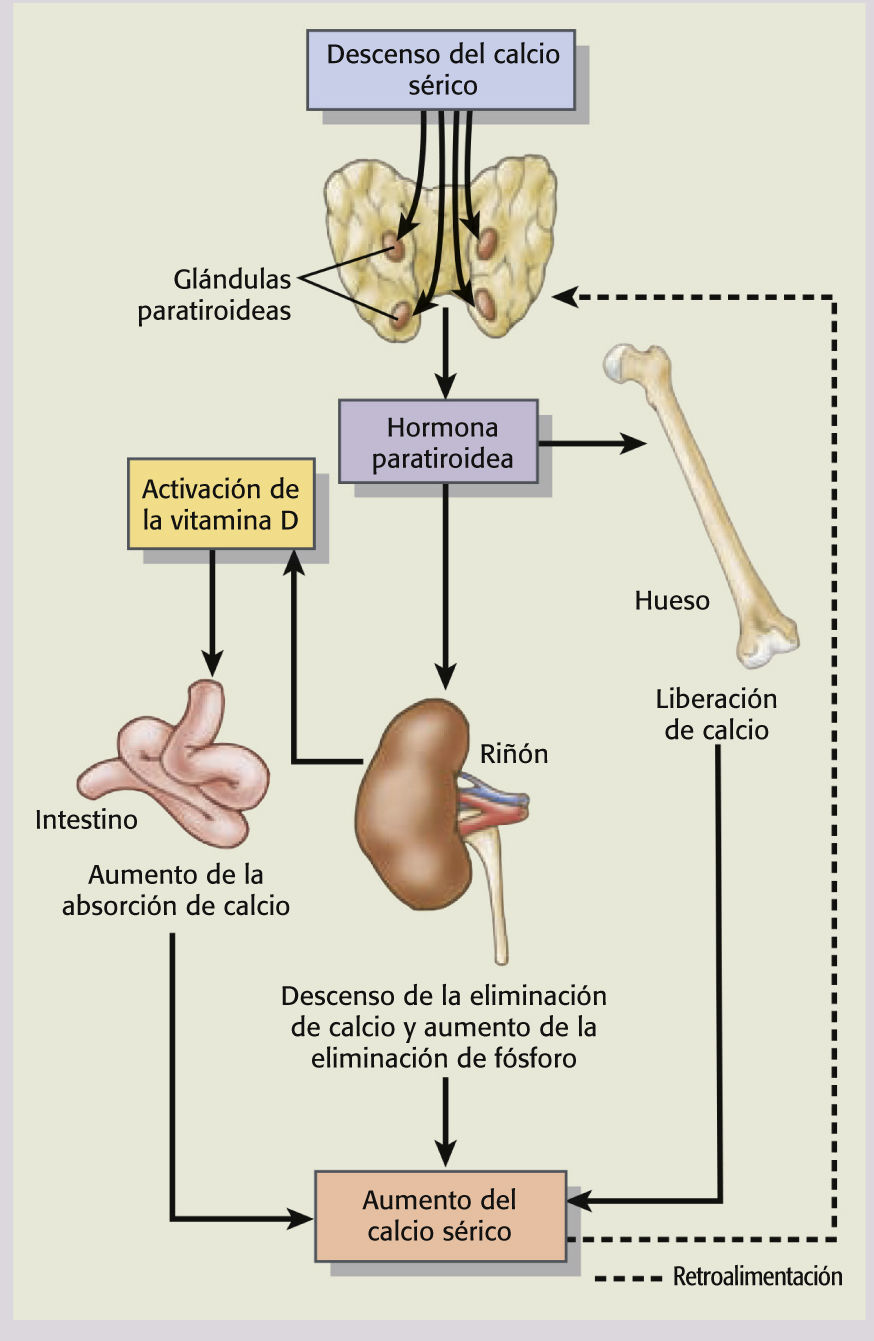
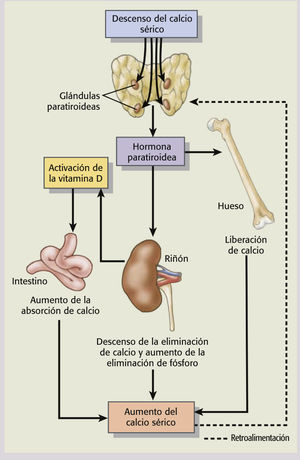
Comprender la homeostasis del Ca++7
Los mecanismos homeostáticos que regulan los niveles séricos de calcio y fósforo implican al intestino, riñón y hueso, principalmente mediante la interacción compleja de la PTH y la vitamina D. La función principal de la hormona paratiroidea (PTH) es mantener las concentraciones de calcio del líquido extracelular (LEC) mediante la estimulación de la liberación de calcio y fósforo del hueso en el LEC; el aumento de la reabsorción renal de calcio y la excreción de fósforo; y la mejora de la absorción gastrointestinal de calcio y fósforo con sus efectos sobre la síntesis de vitamina D. La vitamina D, que funciona como una hormona, es sintetizada por la piel y es convertida en su forma activa, calcitriol, en el riñón. La forma activa de la vitamina D tiene varios efectos sobre los intestinos, los riñones y los huesos, que aumentan los niveles séricos de calcio y fósforo, y contribuyen a la regulación de su retroalimentación. Estimula la absorción del calcio y, en menor medida, del fósforo por el intestino; aumenta la reabsorción de calcio y fósforo por los túbulos renales, e inhibe la síntesis de PTH por las glándulas paratiroideas.
Los pacientes hospitalizados corren el riesgo de sufrir hipocalcemia debido a su estado de enfermedad y causas yatrógenas. Por ejemplo, la sepsis y otros estados proinflamatorios están relacionados con la hipocalcemia. Se ha demostrado que muchas citocinas inflamatorias, como el factor de necrosis tumoral α, inhiben la PTH, lo que provoca hipocalcemia. La lesión renal aguda y la hipervolemia, que son trastornos frecuentes en pacientes en estado crítico, también pueden contribuir a la hipocalcemia9.
Al igual que en el caso del Sr. P., la pancreatitis aguda a menudo se asocia con hipocalcemia. La combinación se relaciona con peores resultados (v. el cuadro Pancreatitis e hipocalcemia: una combinación mortal)12.
Por qué la transfusión masiva puede provocar hipocalcemiaEntre las causas yatrógenas de hipocalcemia en pacientes en estado crítico se pueden citar la sobrecarga de volumen a causa de reanimación con líquidos y transfusiones de sangre intensivas9. Desde hace mucho tiempo se conoce la asociación entre transfusión de sangre e hipocalcemia13. En un estudio retrospectivo de pacientes traumatológicos que recibieron una transfusión masiva, se observó que el 97% (n = 152) de los pacientes presentaban hipocalcemia. El 71% de estos pacientes tenía hipocalcemia grave, definida como calcio ionizado < 3,6 mg/dl (0,90 mmol/l)14. La hipocalcemia grave se relacionó con peores resultados.
Pancreatitis e hipocalcemia: una combinación mortal
La pancreatitis aguda a menudo se asocia con hipocalcemia debido a la autolipólisis de las enzimas pancreáticas y la saponificación grasa (hidrólisis de los ésteres de ácidos grasos, que la convierten en sales de calcio o “jabón”)15. La hipocalcemia en la pancreatitis es un fenómeno bien reconocido, pero la comprensión del mecanismo de la lesión aún no se conoce por completo. La teoría actual afirma que en la fase aguda de la pancreatitis las células acinares lesionadas en el páncreas liberan enzimas que disuelven lípidos que digieren la grasa mesentérica y liberan ácidos grasos. Estos ácidos grasos pueden formar sales de calcio que no se absorben, lo que provoca hipocalcemia28.
Los marcadores inflamatorios liberados de la pancreatitis aguda también acrecientan la hipocalcemia al inhibir la PTH. La hipocalcemia en la pancreatitis aguda es un indicador de gravedad y se asocia con peores resultados12.
Elementos clave de un protocolo de transfusión masiva6
El American College of Surgeons Trauma Quality Improvement Program ofrece recomendaciones para desarrollar e iniciar un protocolo de transfusión masiva (PTM) en traumatología. Las recomendaciones especifican que los PTM deben ser documentos escritos accesibles y familiares para todos. Todo el personal debe recibir una formación inicial y se deben programar simulacros con regularidad para mantener el dominio. Las recomendaciones establecen que esto es muy importante en centros más pequeños donde la transfusión masiva es poco frecuente.
El PTM debe abordar:
- •
Desencadenantes para iniciar la transfusión masiva en traumatología. Entre los desencadenantes se debe encontrar, al menos, uno de los siguientes: evaluación de la puntuación del consumo de sangre de dos o más, inestabilidad hemodinámica continua, hemorragia activa que requiera cirugía o angioembolización, y transfusión sanguínea en casos de traumatismos.
- •
Reanimación en el área de traumatología, incluida la disponibilidad de productos para el PTM, suministro y transfusión.
- •
Continuar el PTM en el quirófano, la sala de angiografía y la UCI.
- •
Procesos del servicio de transfusión respecto al suministro de hemoderivados.
- •
Objetivos de la transfusión.
- •
Finalización del PTM.
- •
Control de la mejora del rendimiento.
Las recomendaciones analizan cada elemento en detalle y ofrecen indicadores de rendimiento, como el tiempo desde la solicitud de PTM hasta la perfusión de la primera unidad de concentrado eritrocitario y los hemoderivados desperdiciados.
En pacientes que reciben transfusiones de sangre, la hipocalcemia es el resultado de la quelación de citrato del Ca++ sérico15. Cada unidad de concentrado eritrocitario (UCE) y plasma fresco congelado (PFC) contiene, aproximadamente, 3 g de citrato utilizado como conservante y anticoagulante. En general, el hígado metaboliza y elimina el citrato en cuestión de minutos. Sin embargo, en pacientes con shock hemorrágico y que requieren una transfusión masiva, como en el caso del Sr. P., la función hepática a menudo se encuentra afectada debido a la hipoperfusión14. En el caso del Sr. P., los antecedentes de cirrosis y pancreatitis aumentaban el riesgo de hipocalcemia. En el contexto del shock hemorrágico, la hipoperfusión hepática provocó niveles críticos de hipocalcemia debido a la unión del citrato.
La hipocalcemia en pacientes en estado crítico que requieren una transfusión masiva es excepcionalmente perjudicial porque el Ca++ desempeña un papel fundamental en la coagulación normal15. El Ca++ es un cofactor en los factores II, VII, IX, y X junto con la proteína C y la proteína S de la cascada de coagulación, y también contribuye a la adherencia plaquetaria en el sitio de la lesión vascular14. En combinación con la transfusión de una gran cantidad de hemoderivados a temperatura fría, la transfusión masiva puede empeorar la tríada mortal de hipotermia, acidosis y coagulopatía, pues en esta situación los pacientes con shock hemorrágico corren mayor riesgo de muerte16. En el caso del Sr. P., la hipotermia se trató con un calentador de sangre durante la transfusión y se evitó la exposición innecesaria de la superficie corporal del Sr. P. La acidosis metabólica en la transfusión masiva es el resultado de la hipoperfusión de órganos específicos (metabolismo anaeróbico) y la disfunción hepática, lo que impide la conversión del citrato en bicarbonato y provoca acidosis láctica17.
Hipocalcemia y disfunción cardíacaAdemás de la coagulación, el Ca++ desempeña un papel importante en la estabilidad de la membrana neuromuscular y cardiovascular, la conducción cardíaca y la contractilidad miocárdica18. Se ha demostrado que la administración de suplementos de Ca++ mejora los signos y síntomas de la insuficiencia cardíaca e hipotensión en pacientes en estado crítico con hipocalcemia crónica y sin ella9.
Puesto que el Ca++ desempeña un papel en la contractilidad miocárdica, la hipocalcemia se ha relacionado con disfunción cardíaca. Newman et al. realizaron una revisión sistemática y un metaanálisis de casos clínicos desde 1948 hasta 2011 en que describieron la hipocalcemia relacionada con la disfunción cardíaca19. La revisión mostró que las disfunciones cardíacas más frecuentemente relacionadas con la hipocalcemia son insuficiencia cardíaca, prolongación del intervalo QT corregido (QTc) y taquicardia sinusal. Aunque no se puede establecer una relación causal clara, el 98% de las disfunciones cardíacas descritas se resolvieron después del tratamiento con perfusiones de calcio. Y en un pequeño estudio que utilizó la ecocardiografía para evaluar la función cardíaca posterior a diálisis en pacientes con enfermedad renal terminal, una disminución aguda de la función sistólica se asoció con una disminución del nivel de Ca++ ionizado19.
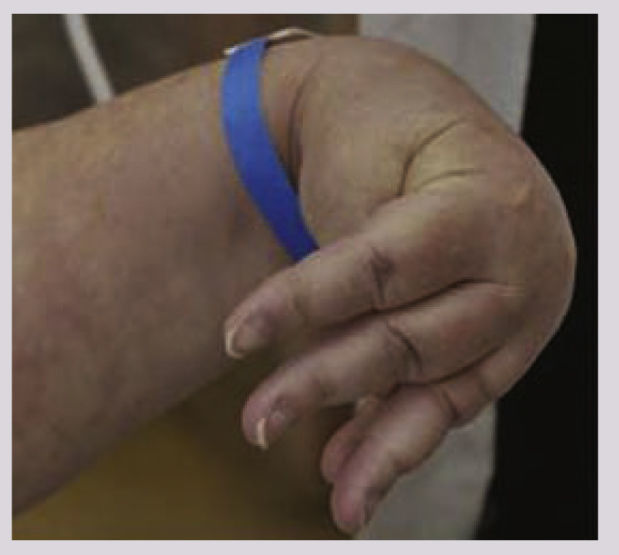
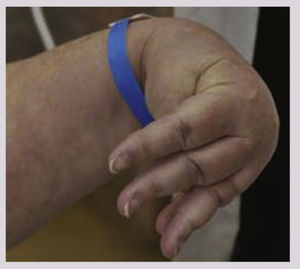
Las constantes vitales del Sr. P.Mientras estaba en la UCI, el Sr. P. estaba aletargado y movía bruscamente sus extremidades superiores (convulsiones focales cuestionables). También presentó el signo de Trousseau, que es un espasmo carpopedal provocado cuando se hincha un manguito esfigmomanómetro por encima de la PA sistólica durante 3 minutos (v. el cuadro Signo de Trousseau en la hipocalcemia). El espasmo carpopedal se caracteriza por la aducción del pulgar, la flexión de las articulaciones metacarpofalángicas, la extensión de las articulaciones interfalángicas y la flexión de la muñeca, y es un signo de hipocalcemia20. Su nivel de calcio sérico total en ese momento era 6,8 mg/dl y el nivel de Ca++ionizado, 3,0 mg/dl. El ECG mostró taquicardia sinusal y prolongación del QTc. La hipocalcemia, de forma característica, provoca la prolongación del QTc, lo que aumenta el riesgo de sufrir torsades de pointes, una arritmia cardíaca potencialmente mortal20. Además, la ecocardiografía a la cabecera del paciente mostró una nueva disfunción sistólica moderada del ventrículo izquierdo. La fracción de eyección era del 50% (normal: ≥55%).
El Sr. P. presentaba signos de hipocalcemia grave relacionada con una transfusión masiva y agravada por hipocalcemia previa y comorbilidades, entre las cuales se encontraban cirrosis y pancreatitis.
Las manifestaciones clínicas de la hipocalcemia dependen de la gravedad y cronicidad. Entre los síntomas y signos inespecíficos pueden citarse cansancio, hiperirritabilidad, ansiedad y depresión. Los signos específicos, como el signo de Trousseau (como en el caso del Sr. P.) y el signo de Chvostek indican excitabilidad neuromuscular20.
El signo de Chvostek es la contracción de los músculos faciales ipsilaterales al percutir el nervio facial justamente por delante de la oreja. La respuesta varía desde la contracción del labio hasta el espasmo de todos los músculos faciales y depende de la gravedad de la hipocalcemia8,20.
Los signos graves de hipocalcemia incluyen convulsiones, laringoespasmo y broncoespasmo. Puesto que ponen en peligro las vías respiratorias de un paciente, está indicada la intervención inmediata9.
Las mejores prácticas de regulación del calcioActualmente, no hay recomendaciones publicadas para regular la hipocalcemia secundaria a una transfusión masiva. La práctica clínica deriva principalmente del manejo general de la hipocalcemia21. Entre las recomendaciones generales se encuentran una estrecha vigilancia de los niveles de Ca++ ionizado sérico del paciente y evaluar los síntomas y signos de hipocalcemia.
Signo de Trousseau en la hipocalcemia20
El signo de Trousseau es un espasmo carpopedal provocado cuando se hincha un manguito de esfigmomanómetro por encima de la presión arterial sistólica durante 3 minutos. La muñeca y las articulaciones metacarpofalángicas están flexionadas, las articulaciones interfalángicas hiperextendidas y el pulgar en aducción.
La hipocalcemia provocada por una transfusión masiva con niveles de Ca++ ionizado por debajo de 3,6 mg/dl (0,9 mmol/l) o niveles séricos de calcio total corregido de 7,5 mg/dl o inferiores, especialmente en pacientes con manifestaciones neurológicas y cardíacas, exige una inmediata reposición de calcio15,21,22. Unos niveles de Ca++ ionizado por debajo de 3,6 mg/dl se relacionan con mayor mortalidad en adultos en estado crítico; además, unos niveles de Ca++ ionizado inferiores a 3,2 mg/dl (0,8 mmol/l) se asocian con arritmias cardíacas22–24.
¿Gluconato cálcico o cloruro cálcico?Generalmente, el gluconato cálcico es la sal de calcio i.v. preferida porque es menos probable que el cloruro cálcico provoque necrosis tisular si se extravasa22. Sin embargo, el cloruro cálcico puede ser preferible al gluconato cálcico cuando la función hepática no es normal (como en el caso del Sr. P.), ya que la disminución del metabolismo del citrato produce una liberación más lenta de calcio ionizado25. El 10% del gluconato cálcico contiene 90 mg de calcio elemental por cada 10 ml, mientras que el 10% del cloruro cálcico contiene 270 mg de calcio elemental por cada 10 ml22.
La reposición de cloruro cálcico generalmente se reserva para la hipocalcemia grave sintomática, con niveles de Ca++ ionizado inferiores a 4 mg/dl (1 mmol/l)21. Para evitar la extravasación y la necrosis tisular, el cloruro cálcico debe administrarse con un dispositivo de acceso venoso central.
En el caso del Sr. P., se perfundieron 2 g de gluconato cálcico durante 2 horas. También se administró loracepam i.v. para controlar la posible actividad convulsiva. Los movimientos espasmódicos del brazo desaparecieron después de la primera hora y su QTc volvió a la normalidad, aunque permaneció hipotenso con una PA sistólica de 85 a 92 mmHg.
Las perfusiones de reposición de calcio deben administrarse lentamente a una velocidad de perfusión máxima de 100 mg/min, excepto en situaciones de urgencia, ya que las reacciones adversas a los preparados de Ca++ i.v. están asociadas con la perfusión rápida22. El calcio debe diluirse en dextrosa y agua o solución salina porque las soluciones concentradas de calcio irritan las venas. Además, la solución i.v. no debe contener bicarbonato ni fosfato, que puede formar sales de calcio insolubles. Debe tenerse precaución para evitar administrar demasiado calcio y provocar hipercalcemia al controlar la concentración de calcio ionizado. Los pacientes con niveles de Ca++ sérico muy bajos requieren un control cardíaco continuo y mediciones frecuentes del QTc22.
No perder de vista los electrolitosLa transfusión masiva produce una serie de desequilibrios metabólicos interrelacionados debido a la rápida perfusión de gran cantidad de hemoderivados en un corto espacio de tiempo. Además de la hipocalcemia y los potenciales desequilibrios electrolíticos y del pH se pueden citar hiperpotasemia (a causa de la hemólisis eritrocitaria en sangre almacenada), hipopotasemia (por reentrada de potasio en los eritrocitos transfundidos), hipomagnesemia (por la unión de citrato), acidosis metabólica (provocada por la pérdida de potasio de los eritrocitos almacenados , sobre todo sangre irradiada) y alcalosis metabólica (por la sobrecarga de citrato; el citrato genera bicarbonato)17. Los paneles metabólicos en serie o las pruebas electrolíticas en el punto de asistencia y las tendencias de la gasometría arterial (ABG, arterial blood gas) forman parte de las mejores prácticas para los pacientes que reciben una transfusión masiva.
Después de recibir 2 g de gluconato cálcico i.v., la ABG del Sr. P. mostró acidosis metabólica parcialmente compensada, además de hiperpotasemia e hipomagnesemia. El nivel de Ca++sérico total se mantuvo en 7,8 mg/dl y el Ca++ionizado fue 2,3 mg/dl. La SOG continuó drenando cantidades importantes de sangre. La acidosis metabólica y la cirrosis pueden haber desempeñado un papel en su mala respuesta a la reposición de Ca++i.v.
Una transfusión masiva rápida en pacientes con disfunción hepática puede provocar hipocalcemia ionizada más grave y prolongada en comparación con una en pacientes con una función hepática normal26. La quelación de Ca++ con citrato en sangre de donantes forma un complejo de Ca++-citrato que se metaboliza en el hígado. Alguna evidencia indica que el Ca++ ionizado < 2,4 mg/dl (0,60 mmol/l) puede provocar paro cardíaco27.
En el caso del Sr. P., la disfunción hepática puede haber retrasado la corrección de los niveles de Ca++ sérico. Además, su pancreatitis también puede haber empeorado la hipocalcemia secundaria a la retención de Ca++ por saponificación. Como parte del tratamiento integral de la hipocalcemia provocada por transfusión masiva, se deben iniciar intervenciones simultáneas para corregir la hipomagnesemia, la hiperfosfatemia y la hipoalbuminemia15,26.
En total, el Sr. P. recibió 14 unidades de concentrado eritrocitario, 12 unidades de plasma congelado en fresco y 10 unidades de plaquetas en un periodo de 12 horas. Los resultados analíticos posteriores a la transfusión fueron: 5,8 g/dl de Hb; 16,00% del Hto; 60.000 plaquetas/mm3; tiempo de tromboplastina parcial activada > 100 s, e índice internacional normalizado de 2,3. El Ca++sérico se mantuvo en 7,8 mg/dl y el Ca++ionizado fue 2,3 mg/dl.
El Sr. P. presentó taquicardia ventricular sin pulso unas horas más tarde, muy probablemente por la combinación de hipocalcemia grave y acidosis metabólica. Durante un intento fallido de reanimación, se mantuvo la hematemesis masiva.
Superar el desafíoIndicada o no por causas traumáticas o no traumáticas, la transfusión masiva de hemoderivados se asocia con complicaciones graves y elevada mortalidad. Las enfermeras deben estar familiarizadas con el protocolo de transfusión del centro en que trabajan y participar en cursos de formación continua y simulacros para mantener la competencia6. ■
Los autores y los editores declaran no tener ningún conflicto de intereses potencial, económico o de otro tipo relacionado con este artículo.
En la ciudad de Nueva York, Fidelindo Lim es profesor asistente clínico en la New York University College of Nursing, Leon L. Chen enfermera de práctica avanzada en el departamento de anestesia y cuidados críticos del Memorial Sloan Kettering Cancer Center, y Daniel Borski es enfermero clínico en el Presbyterian Weill Cornell Hospital de Nueva York.