B.L., DE 45 AÑOS, ACUDIÓ a su médico refiriendo un “dolor de garganta intenso” desde hacía unas 3 semanas y con la sensación de “tener algo obstruido” en la parte posterior de la garganta —una sensación conocida como globo faríngeo. Durante la exploración física el médico observó una cierta hinchazón en la parte izquierda del cuello e inflamación y eritema en la amígdala ipsilateral; le recetó paracetamol e hidrocodona y lo derivó a un cirujano maxilofacial. La biopsia de la amígdala izquierda de B.L. reveló la presencia de un carcinoma epidermoide.
Los cánceres de cabeza y cuello representan del 3% al 5% de todas las neoplasias malignas1. El carcinoma epidermoide es el más frecuente y afecta a las vías respiratorias y digestivas altas, entre ellas las amígdalas2. La American Cancer Society estimó que se diagnosticarían 48.330 casos nuevos de cáncer de la cavidad bucal y la bucofaringe en 2016, y los hombres tienen entre tres y cinco veces más probabilidades de sufrir estos cánceres que las mujeres3.
En este artículo se describen las características anatomopatológicas del cáncer de amígdala, su diagnóstico y tratamiento y las observaciones relativas a la disciplina de la enfermería para la atención de los pacientes.
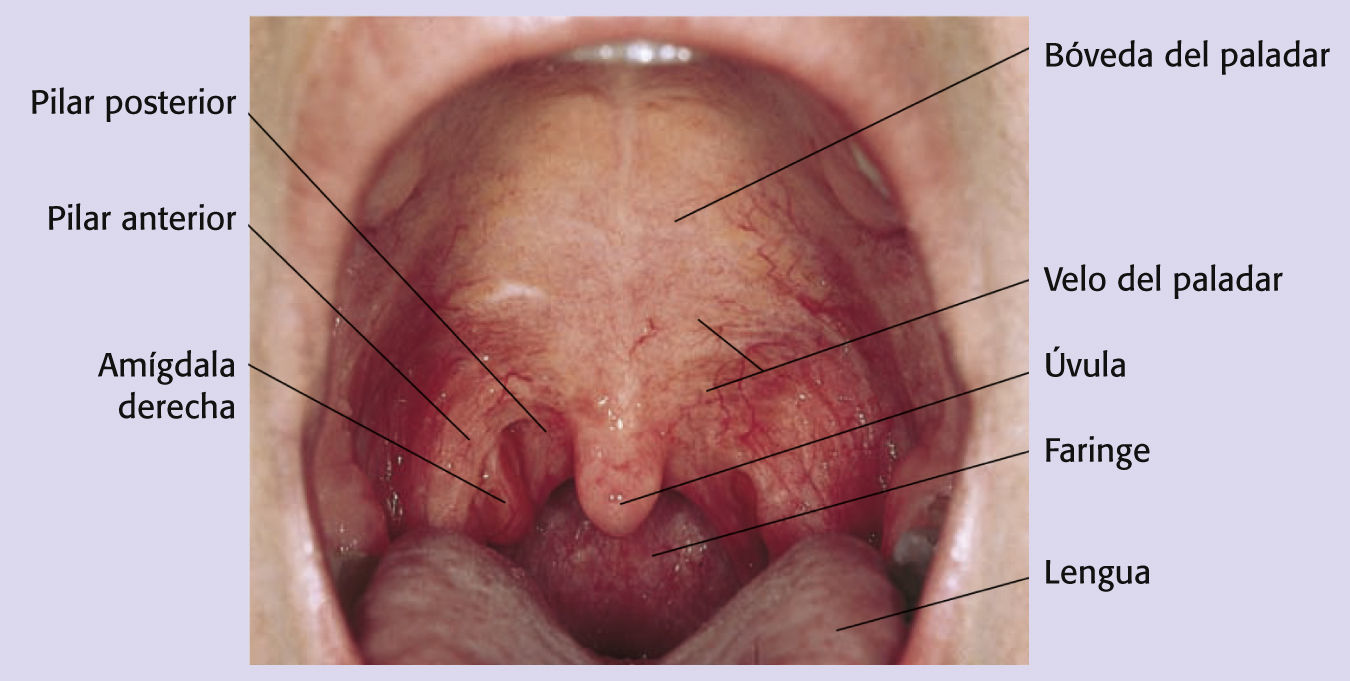
Anatomofisiología de las estructuras sanasLas amígdalas forman parte de la faringe, constituida por el velo del paladar, la faringe, la fosa amigdalina y la base de la lengua (véase el cuadro Un vistazo desde más cerca)4. Dado que en esa zona no hay huesos, solo tejidos blandos y muchos ganglios linfáticos que drenan el área, la enfermedad progresa prácticamente sin obstáculos y puede extenderse rápidamente; en consecuencia, los pacientes pueden presentar un cáncer avanzado en el momento del diagnóstico.
La mayoría de neoplasias bucofaríngeas malignas se originan en las células escamosas que revisten la bucofaringe. Tradicionalmente, los factores causales más habituales del carcinoma epidermoide de cabeza y cuello han sido el tabaco y el alcohol y, en épocas más recientes, la infección por el virus del papiloma humano (VPH)2.
El consumo de alcohol y tabaco aumenta el riesgoEl tabaco fumado en cigarrillos —la forma de administración más típica del tabaco— contiene nicotina, que es la sustancia adictiva. La nicotina no es necesariamente cancerígena, pero muchos de los demás componentes del tabaco se asocian claramente con la aparición de los cánceres de cabeza y cuello. Además, estas sustancias inhaladas a través del humo se absorben en el torrente sanguíneo y se diseminan por el organismo, por lo que pueden desencadenar un cáncer de vejiga, de riñones y de otros órganos.
Los carcinógenos de los productos del tabaco que permanecen en contacto con la cavidad bucal, como el tabaco de mascar o el tabaco en polvo, e incluso las pipas o los puros que suelen sostenerse en la misma zona de la boca, pueden absorberse directamente a través de la piel o de los tejidos bucales húmedos5. Dichas sustancias también provocan trastornos gingivales y destrucción ósea, que derivan en la caída de piezas dentales (véase el cuadro Los productos del tabaco disparan el riesgo), además de cáncer. Abstenerse de fumar probablemente consiga reducir el riesgo, pero no lo elimina por completo.
Se calcula que 7 de cada 10 pacientes de cáncer bucal son consumidores excesivos de alcohol, de acuerdo con la American Cancer Society. El consumo simultáneo de tabaco y alcohol produce un efecto sinérgico que aumenta en gran medida el riesgo de sufrir cáncer de cabeza y cuello. Algunos estudios apuntan a que el riesgo de las personas que fuman y beben excesivamente aumenta hasta 100 veces más en comparación con el de las personas que no beben ni fuman6.
Dado que estos productos provocan millones de muertes cada año, los cánceres asociados al tabaco constituyen un problema sanitario público de grandes proporciones. Dos sustancias que contiene el tabaco, la 4-(metilnitrosamino)-1-(3-piridil)-1-butanona (NNK) y la N’-nitrosonornicotina (NNN), son conocidas por provocar mutaciones en oncogenes y en antioncogenes. La unión de la NNK y la NNN al receptor nicotínico de acetilcolina también promueve el crecimiento del tumor fomentando y desregulando la proliferación, la supervivencia, la migración y la invasión celulares. De este modo la NNK y la NNN actúan de forma sinérgica y provocan cánceres en personas que consumen productos del tabaco.
Durante las últimas décadas, el número de personas de 60 y 70 años con antecedentes de tabaquismo y alcoholismo ha ido decreciendo, una tendencia que refleja con toda probabilidad la disminución del hábito tabáquico en todos los grupos de edad durante estos años. Sin embargo, sí ha aumentado la incidencia de cáncer de amígdalas en adultos más jóvenes (de cuarenta o cincuenta y pocos años) sin antecedentes de factores de riesgo asociados al consumo de tabaco y alcohol2,4.
Cuando se analizan estos tumores se observan resultados positivos del VPH, que permiten suponer en estos pacientes un factor de riesgo asociado a sus antecedentes sexuales, que abarcan relaciones orales, vaginales y anales tanto heterosexuales como homosexuales2; el virus, que se aloja en la boca y la bucofaringe, parece ser la causa.
El VPH es un oncovirus, es decir, que provoca cáncer. El VPH es responsable de aproximadamente el 70% de los cánceres bucofaríngeos. Si bien se han identificado más de 150 tipos de VPH, los tipos 16 y 18 son los que más se asocian al cáncer bucofaríngeo6,7.
Las personas con cáncer bucofaríngeo positivo para el VPH suelen ser más jóvenes y tienen menos probabilidades de fumar y beber. Gracias a la investigación, se está demostrando que los tumores bucofaríngeos con VPH responden mejor al tratamiento que los tumores sin VPH4.
Algunos pacientes manifiestan tumores mixtos, es decir, dan positivo en las pruebas del VPH, pero también tienen hábitos (fumar y beber) de los que se ha demostrado que provocan tumores sin la presencia del VPH. Estos pacientes habitualmente responden al tratamiento un poco mejor que los que sufren un cáncer sin VPH puro4. Todos los tumores de la zona de la cabeza y el cuello deben analizarse para detectar la presencia del VPH.
En la biología molecular de los tumores de las amígdalas se observa una mutación de la proteína antioncogénica p53 por causa de factores tales como la exposición al tabaco, que suelen asociarse a una supervivencia global escasa; este fenómeno permite que el tumor crezca sin resistencia alguna. Además, la hiperexpresión del gen del receptor del factor de crecimiento epidérmico (EGFR) se produce en casi todos los tipos de tumores de cabeza y cuello. Cuando el gen EGFR se encuentra hiperexpresado, la proliferación celular aumenta y se reduce la apoptosis (muerte celular programada), lo que explica la frecuencia de la recurrencia local del cáncer de cabeza y cuello y la baja supervivencia global8.
Diagnóstico del cáncer de amígdalasEl primer signo de cáncer de amígdala que nota el paciente es un ganglio linfático agrandado en el cuello, que puede ser doloroso o no; otros síntomas y signos son faringitis, disfagia, odinofagia, globo faríngeo, otalgia, dolor de oídos y hemoptisis9. Estos síntomas se relacionan con mayor probabilidad con el tamaño del tumor primario de la amígdala. Algunos pacientes acuden a la consulta por una linfoadenopatía cervical unilateral asintomática.
Una tomografía computarizada (TC) puede manifestar la presencia de una asimetría amigdalina, pero es preciso hacer una biopsia para confirmar el diagnóstico. Dado que tal vez se necesiten biopsias de varias zonas, muchos cirujanos prefieren explorar con anestesia y un laringoscopio para observar diferentes puntos de posible biopsia.
Con frecuencia se utiliza la ecografía para orientar la biopsia de los ganglios linfáticos del cuello. La tomografía por emisión de positrones es la mejor técnica si se aplica conjuntamente con una TC para valorar la afectación de los ganglios linfáticos y si el tumor es primario o metastásico, pero no puede aplicarse a menos que hayan transcurrido 4 meses desde que el paciente sufriese un traumatismo importante, como una operación quirúrgica o una exposición a la radiación ionizante, porque durante ese período los tejidos afectados aparecerán “activos” en la exploración10. Algunos facultativos hacen una biopsia aspirativa de un ganglio muy localizado, visible y palpable.
Un gran número de tumores de las amígdalas no se ven en ninguna exploración, en cuyo caso el médico puede efectuar una exploración con anestesia, como se ha mencionado antes, para extraer diversas muestras biópsicas y determinar un diagnóstico11.
El médico puede solicitar una TC o una resonancia magnética (RM) para lograr estadificar el cáncer y determinar la vía de tratamiento (véase el cuadro Estadificación del cáncer bucofaríngeo). La TC, rápida y sencilla, es una técnica útil para valorar una posible necrosis de los ganglios linfáticos y para identificar una posible diseminación extracapsular, es decir, la diseminación de la neoplasia por fuera de la pared ganglionar; no obstante, con esta técnica el paciente se expone a la radiación y es necesario administrar un contraste para ver todas las zonas11.
El sistema de estadificación TNM, creado por la American Joint Committee on Cancer y la Unión Internacional de Control del Cáncer, describe la extensión del tumor (T), el grado de diseminación a los ganglios linfáticos (N) y la presencia de metástasis a distancia (M). En los siguientes puntos se describen las categorías pertinentes para la estadificación de un tumor primario en la bucofaringe. En cada elemento (T, N, M) se asigna una letra y un número, como por ejemplo T2 N2b M0.
| Tumor (T) | |
| T1 | Tumor primario de aprox. 2cm o menos |
| T2 | Tumor primario de 2 cm a 4 cm |
| T3 | Tumor primario mayor de 4cm en su máxima dimensión o que se extienda hasta la superficie lingual de la epiglotis |
| T4a | Tumor que invade la laringe, el músculo extrínseco de la lengua, el músculo pterigoideo interno, la bóveda del paladar o la mandíbula |
| T4b | Tumor que invade el músculo pterigoideo externo, las apófisis pterigoides, la nasofaringe lateral o la base del cráneo, o que atrapa la arteria carótida |
| Ganglios (N) | |
| N1 | Metástasis en un solo ganglio linfático ipsilateral de 3 cm o menos |
| N2 | Metástasis en un solo ganglio mayor de 3 cm, pero de un máximo de 6 cm, o en varios ganglios ipsilaterales, ninguna mayor de 6 cm, o en ganglios linfáticos bilaterales o contralaterales, ninguna mayor de 6 cm |
| N2 (a) | Metástasis en un solo ganglio ipsilateral mayor de 3 cm, pero de un máximo de 6 cm |
| N2 (b) | Metástasis en varios ganglios ipsilaterales, ninguna mayor de 6 cm |
| N2 (c) | Metástasis en ganglios linfáticos bilaterales o contralaterales, ninguna mayor de 6 cm |
| N3 | Metástasis en un ganglio de más de 6 cm en su máxima dimensión |
| Metástasis a distancia (M) | |
| M0 | Sin metástasis a distancia |
| M1 | Con metástasis a distancia |
La RM es más útil que la TC para observar los tejidos blandos y permite detectar la diseminación perineural del tumor con mucha mayor claridad que la TC —cabe destacar que los cánceres de cabeza y cuello suelen diseminarse por los nervios. Sin embargo, en algunos casos no resulta práctico o posible hacer una RM debido a que la prolongada duración de la exploración puede amedrentar al paciente o bien porque tiene un dispositivo implantado, como un marcapasos, que constituya una contraindicación para su uso11.
Todas estas técnicas de imagen ayudan al médico a determinar el estadio de la neoplasia maligna en el momento del diagnóstico y durante la evolución de la enfermedad.
Amigdalectomía radical: el pilar del tratamientoA lo largo de los años, el cáncer de amígdalas se ha venido tratando con cirugía, radioterapia, quimioterapia y, en años ya más recientes, con tratamientos selectivos que interfieren en la actividad de moléculas específicas implicadas en la progresión del cáncer de amígdala. Más o menos en la última década se ha ido cambiando el rumbo hacia un tratamiento quirúrgico menos invasivo y centrado en preservar el órgano afectado aplicando una combinación de radioterapia y quimioterapia para tratar la enfermedad, si bien la amigdalectomía radical sigue siendo el pilar del tratamiento12,13.
Un paciente con un tumor de tamaño T2 o levemente mayor con biopsia positiva en los ganglios linfáticos necesitará con mucha más probabilidad una amigdalectomía radical que abarque algunas porciones de la pared faríngea y del velo del paladar para asegurarse de que los márgenes no presenten afectación tumoral. En una amigdalectomía radical transoral, los cirujanos no pueden ver adecuadamente la zona afectada; incluso con anestesia general, por muy relajada que esté la boca del paciente, no se abre lo suficiente como para poder acceder a todo el campo quirúrgico y verlo en su totalidad.
Antiguamente se hacía una amigdalectomía radical a través de una mandibulotomía o una faringotomía lateral, aunque ambas pueden conllevar riesgos importantes14. Por ejemplo, la mandibulotomía deja una cicatriz facial visible y puede causar daños permanentes en los nervios. Asimismo, la faringotomía lateral puede dañar los nervios y los principales vasos sanguíneos del cuello, y el riesgo de formación de una fístula en la cavidad bucal también es significativo12. Por causa de estos riesgos e inconvenientes, en el pasado muchos pacientes eran reacios a que les practicaran una amigdalectomía radical quirúrgica.
Por suerte, la cirugía transoral robótica (TORS, transoral robotic surgery) y la microcirugía transoral láser (TLS, transoral laser microsurgery) son métodos más modernos que mejoran el desenlace de los tumores en estadios iniciales sin los efectos negativos asociados a la amigdalectomía radical. Con la ayuda de un robot, los cirujanos que ejecutan la TORS emplean un procedimiento quirúrgico de mínimo acceso en zonas recónditas de la cabeza y el cuello, y esta técnica ofrece una visión tridimensional del campo quirúrgico mucho más precisa que con un laringoscopio13,15. Las últimas investigaciones apuntan a que la TORS en solitario resulta extremadamente eficaz para los tumores en estadios iniciales13.
La TLS, un método endoscópico con láser que apenas se utiliza, puede aplicarse en los cánceres incipientes; tiene menos reacciones adversas y permite conservar mejor la función de deglución en comparación con la amigdalectomía radical, aunque los resultados globales pueden no ser igual de buenos16.
Más datos sobre la TORSLa introducción de la TORS en las amigdalectomías radicales ha facilitado a los pacientes escoger con comodidad un tratamiento quirúrgico para el cáncer; no solo proporciona al cirujano más visibilidad, ya que la amplifica y la muestra en tres dimensiones, sino que también le permite operar cánceres más extendidos con excelentes resultados gracias a que puede alcanzar a ver hasta la base de la lengua para comprobar la extensión de la neoplasia12.
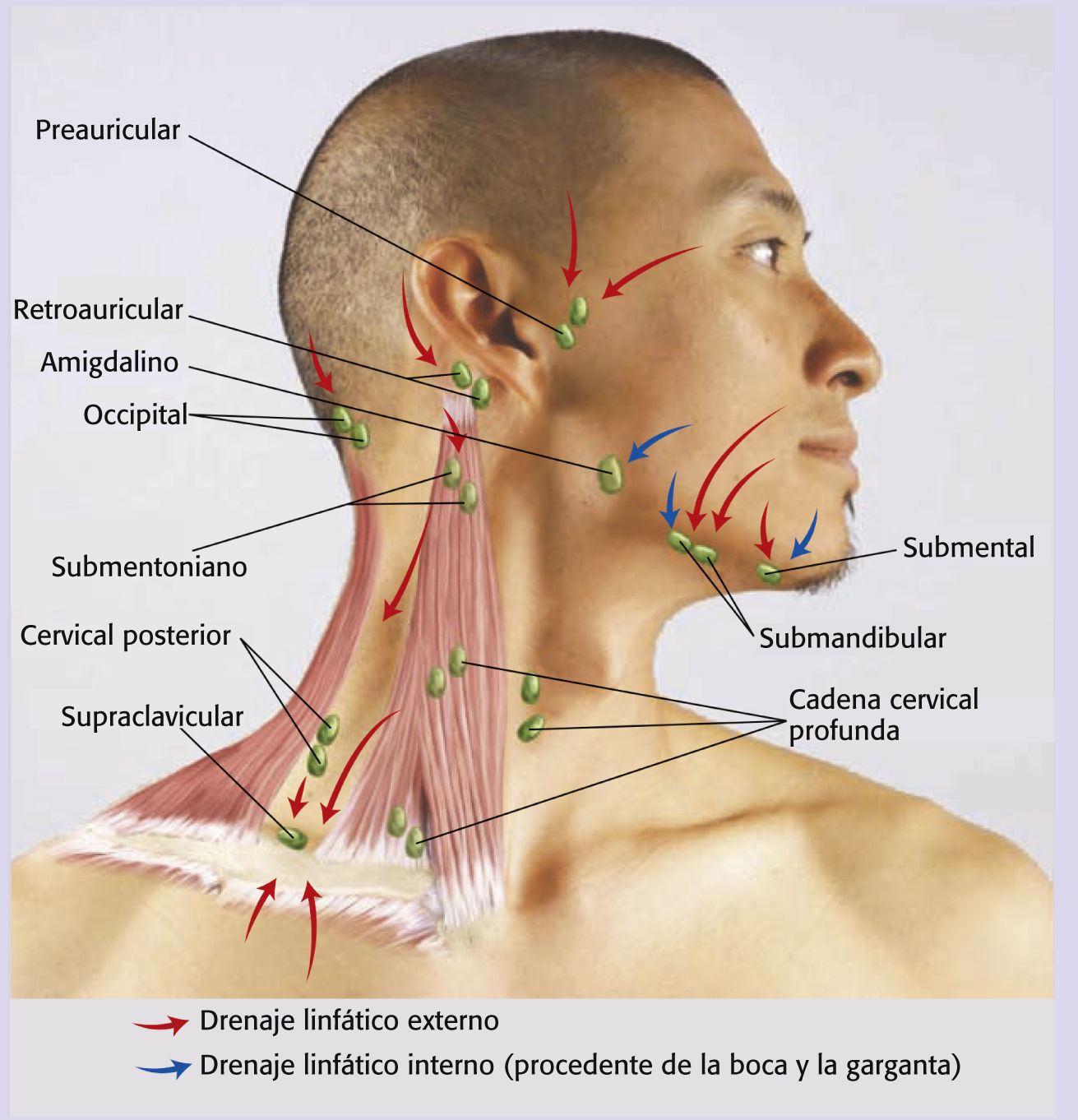
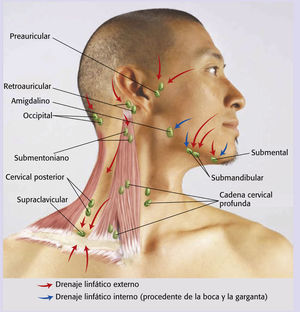
Anteriormente, los cirujanos efectuaban la operación por fases: primero se hacía la TORS y, 1 o 2 semanas más tarde, la linfadenectomía cervical. Se creía que la operación por fases disminuía el riesgo de aparición de fístulas faringocutáneas (formación de una fístula entre la faringe y el cuello) y también el edema cervical que puede obstruir las vías respiratorias y derivar en una traqueotomía12, pero a medida que la TORS se va instaurando como tratamiento de referencia para esta enfermedad, los cirujanos se han ido percatando de que pueden acabar la linfadenectomía cervical justo después de la TORS con complicaciones mínimas en la mayor parte de los casos. Sin embargo, aquellos pacientes que se sometan a una linfadenectomía cervical en el nivel Ib, que abarca los ganglios linfáticos del triángulo submandibular, pueden escoger un procedimiento por fases a criterio del cirujano, dado que estos ganglios se encuentran justo debajo de la mandíbula ipsilateral y pueden estar demasiado cerca del lecho quirúrgico primario17 (véase el cuadro Ganglios linfáticos de la cabeza y el cuello).
Posibles complicaciones postoperatoriasEl riesgo de hemorragia tras una amigdalectomía radical con TORS ronda el 7%12. Es preciso evitar la arteria carótida y las venas yugulares interna y externa, ubicadas en las proximidades, pero justo en el campo quirúrgico suelen encontrarse la rama amigdalina de la arteria palatina menor y una rama amigdalina de las arterias linguales dorsales. Los vasos sanguíneos de 1 mm de tamaño o más deben graparse y dividirse para prevenir una hemorragia postoperatoria12, y normalmente los pacientes permanecen en observación en el hospital durante 2 o 3 días hasta que desaparezca el riesgo de hemorragia.
Otra posible reacción adversa es la formación de una fístula faringocutánea, que puede producirse durante la operación, sobre todo cuando se ejecutan linfoadenopatías cervicales en ciertos niveles de forma simultánea; suele corregirse con un cierre por primera intención en el momento de la operación. La formación de una fístula postoperatoria ocurre en entre el 1% y el 4% de los pacientes, que pueden necesitar un taponamiento de la herida y profilaxis antibiótica12.
Otro de los grandes problemas postoperatorios es el dolor, porque el área amigdalina y la faringe están ampliamente inervados por los ramos de los nervios trigémino y glosofaríngeo, que la convierten en una zona especialmente sensible18. Los pacientes producen y tragan saliva continuamente, movimientos que pueden ser intensamente dolorosos. Pueden verse obligados a recibir una nutrición enteral (NE) durante los días que se prolongue el dolor, y también está indicado administrar analgesia controlada por el paciente.
Los investigadores han intentado aplicar diferentes métodos quirúrgicos para reducir el dolor postoperatorio, como evitar la electrodisección con electrocauterización. No obstante, hacer una disección roma en su lugar lleva mucho más tiempo y provoca una hemorragia más profusa en la zona. En algunos estudios se ha destacado que los antinflamatorios no esteroideos (AINE) mitigan adecuadamente el dolor en algunos de estos pacientes, aunque muchos cirujanos son renuentes a aumentar el riesgo de hemorragia, una posible reacción adversa de los AINE19.
Otra de las complicaciones que pueden aparecer es la aspiración, en especial si el cirujano reseca una gran cantidad de tejido faríngeo20. Con la ayuda de la foniatría, los pacientes pueden compensar este defecto aprendiendo técnicas específicas, por ejemplo girar la cabeza hacia la zona afectada para cerrar la zona que ha quedado abierta. Si un paciente no logra tragar los líquidos aceptablemente para alimentarse, ya sea por un dolor intenso o por un defecto quirúrgico, probablemente necesite NE durante algo más de tiempo.
Será necesario contemplar la posibilidad de aplicar una reconstrucción quirúrgica en caso de que el defecto en la faringe sea lo suficientemente grande como para exponer otras estructuras que se encuentran por debajo, un procedimiento que puede efectuarse durante la TORS, aunque es complicado de hacer con el robot y resulta más fácil si se lleva a cabo una operación quirúrgica abierta (cirugía tradicional con incisión). Los músculos que se utilizarán en la reconstrucción pueden obtenerse del antebrazo radial o del muslo anterolateral21. La recuperación toma mucho más tiempo y los pacientes pueden presentar una disfagia importante debido a la desinervación de los músculos de la zona.
Observaciones relativas a la enfermería postoperatoriaTras la amigdalectomía radical, un elemento importante de la atención de enfermería es vigilar la aparición de una posible hemorragia. Hay que mantener la cabecera de la cama elevada como mínimo 30 grados. Debe mantenerse el ayuno completo tal como se ha prescrito o hasta que un foniatra examine al paciente para garantizar que pueda tragar con seguridad.
Con toda probabilidad, el enfermo quedará ingresado para que se le trate el dolor y para permanecer en observación durante al menos 4 días para detectar signos de hemorragia, si bien algunos pacientes necesitan hasta 10 días antes de recibir el alta. Para disminuir las posibilidades de que se presente una hemorragia diferida, se le da el alta al paciente con una dieta líquida absoluta con complementos alimenticios que le proporcione la mayor parte de la nutrición que necesite.
Además, la enfermera tiene que vigilar si se produce una aspiración cuando el paciente bebe. Disponga el equipo de aspiración mecánica para poder acceder a él inmediatamente en caso de hemorragia o aspiración. Debe poder accederse con facilidad a un carrito de reanimación y una bandeja de traqueotomía desde la habitación del paciente.
La enfermera tiene que vigilar para detectar síntomas y signos de una fístula cutánea, como la dehiscencia de la sutura de la incisión del cuello o un cambio de la coloración o de la cantidad del drenaje de la incisión cervical; si observa estos fenómenos, ha de notificarlos inmediatamente al cirujano para que examine y trate al paciente. Puede que el paciente necesite más operaciones para cerrar la zona y muy probablemente tenga que recibir antibióticos para evitar una infección en la zona.
Asimismo, la enfermera deberá intervenir en varias ocasiones para impedir la aparición de posibles complicaciones por la inmovilidad, como la neumonía y la tromboembolia venosa. Es preciso levantar al paciente de la cama y que camine lo antes posible, y animarle a toser y a respirar profundamente mientras detecta posibles signos de hemorragia de esfuerzo.
El tiempo de recuperación depende de la extensión de la operación quirúrgica y de diversos factores que guardan relación con el paciente. El dolor suele ser el síntoma que define la rapidez de la recuperación. La enfermera tiene que estar preparada para administrar suficientes analgésicos como para aliviar el dolor de modo que el paciente pueda caminar y empezar a comer en cuanto sea posible. Si un paciente no puede recibir una nutrición suficiente por vía oral debido al dolor, tendrá que colocársele una sonda de gastrotomía percutánea para las tomas de alimento y tal vez requiera rehabilitación para tragar.
Los cánceres de cabeza y cuello responden bien a la radioterapia; antes de que apareciese la cirugía robótica, la radioterapia se utilizaba con frecuencia como tratamiento de elección para el cáncer de amígdalas incipiente4. Los cánceres de cabeza y cuello, junto con el cáncer de próstata, fueron de los primeros en ser tratados con radioterapia de intensidad modulada (RTIM). Con este tratamiento se dirigen las dosis de radiación máximas directamente hacia el tumor, reduciendo al mínimo la irradiación de los tejidos sanos circundantes. Aunque la investigación sigue su curso, en algunos estudios se da a entender que la RTIM causa menos reacciones adversas que la radioterapia convencional4,22.
Si el paciente tiene ganglios linfáticos cervicales afectados, suele aplicarse una radioterapia posquirúrgica. Se tratará la zona del foco primario (la amígdala) y del cuello del lado del que se haya extirpado el ganglio linfático afectado. Además del número y el tamaño de los ganglios linfáticos afectados, los efectos adversos que deben tenerse en cuenta tras la radioterapia postoperatoria son la invasión perineural y la diseminación extracapsular (por fuera del ganglio linfático)22.
Algunos investigadores están estudiando dosis de radiación menores para los tumores bucofaríngeos con positivo para el VPH. Como estos pacientes suelen ser más jóvenes y tienen una esperanza de vida mayor, los médicos considerarán la posibilidad de aplicar protocolos de desintensificación para restringir su exposición a la radiación. Los protocolos de tratamiento que se están investigando abarcan una quimioterapia combinada con la radioterapia, la reducción de las dosis de radiación y la reducción de las dosis postoperatorias de radioterapia o quimioterapia. Aun así, los pacientes con tumores sin infección por el VPH tal vez necesiten una intensificación de la radioterapia22.
Las reacciones adversas a la radioterapia de cabeza y cuello pueden clasificarse en agudas y crónicas. Las agudas comprenden úlceras en la boca que pueden extenderse por el interior del esófago en algunos pacientes, causándoles disfagia y dolor. Los pacientes pueden tener que alimentarse por NE para evitar la deshidratación, la desnutrición y el adelgazamiento22; algunos manifiestan eritema, irritación y escozor, que deben atajarse con un tratamiento cutáneo emoliente.
La reacción adversa crónica más común a la radioterapia de cabeza y cuello es la xerostomía, porque la radiación destruye las glándulas salivales22. Los pacientes pueden usar varias ayudas, como preparados de saliva artificial, pero solo alivian de forma transitoria.
Otras posibles complicaciones crónicas son:
- •
Hipotiroidismo, que puede no manifestarse en varios años. Se corrige con hormonas tiroideas sintéticas y un seguimiento por parte del endocrinólogo.
- •
Friabilidad cutánea y muscular en las zonas irradiadas, que pueden provocar directamente una hemorragia.
- •
Osteorradionecrosis mandibular, que tuvo lugar en pacientes que recibieron radiación directamente en la mandíbula22.
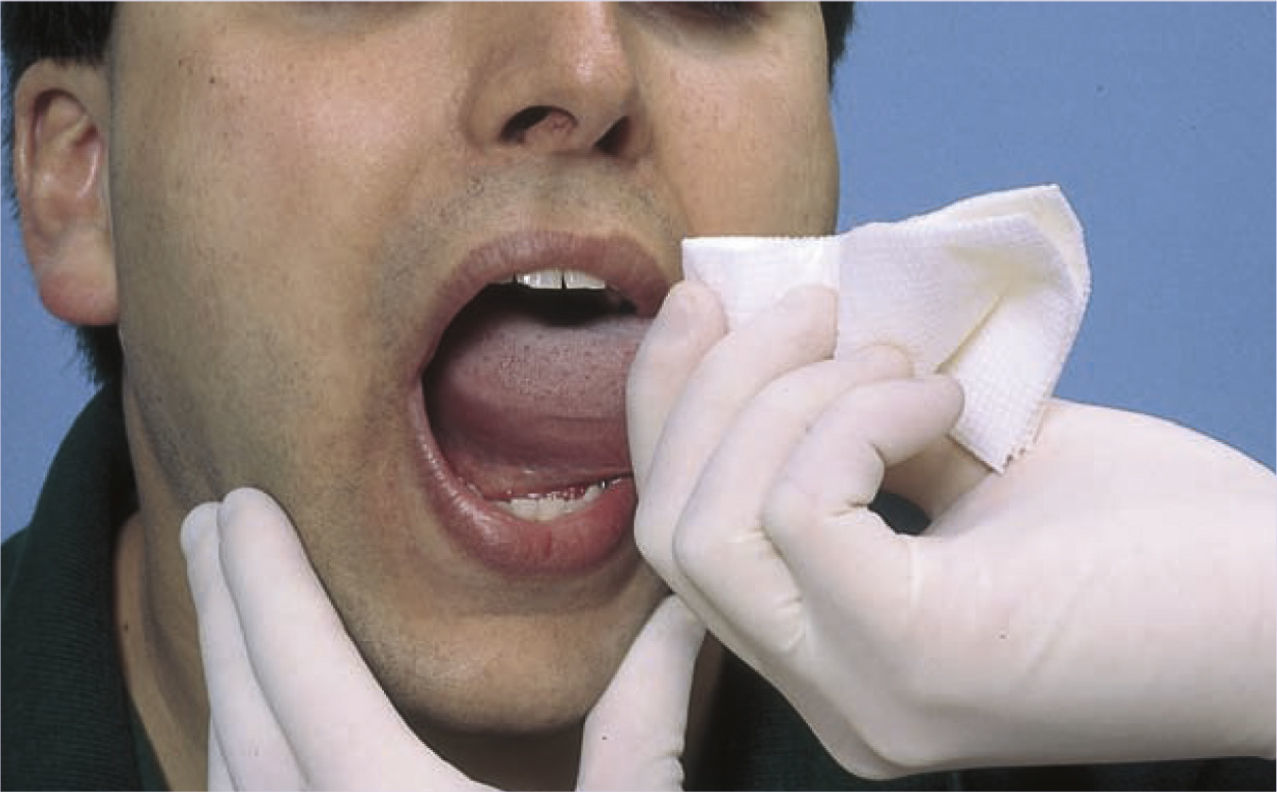
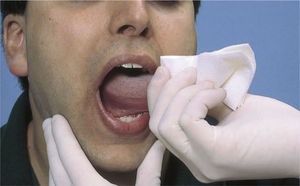
El dentista o el higienista bucal pueden hacer un cribado del cáncer oral durante las revisiones dentales bianuales. La lengua se envuelve con gasa, se extrae y se retira a cada uno de los lados para explorar toda la cavidad bucal, como se muestra en la foto.
El médico de atención primaria también debe sospechar si el paciente tiene factores de riesgo y si presenta los síntomas y signos asociados al cáncer bucofaríngeo.
La prevención inicial del cáncer de amígdala pasa por eliminar factores de riesgo como fumar tabaco (o cualquier tipo de exposición al tabaco) y beber alcohol; otro paso importante es vacunar contra el VPH.
Los antecedentes sexuales influyen en la probabilidad de que un paciente sufra un cáncer de cabeza y cuello asociado al VPH. La educación sexual de los pacientes para que eviten las relaciones de riesgo y que sigan las recomendaciones sexuales seguras pueden ayudarlos a reducir este riesgo.
La atención de enfermería del paciente al que se le realiza radioterapia de la cabeza y el cuello abarca las curas cutáneas y la consulta con enfermeras especializadas en la cura y prevención de escaras y heridas crónicas, así como supervisar estrictamente y anotar la ingesta oral y pesar al paciente cada día para determinar si necesita NE. Es preciso informar al paciente sobre las posibles complicaciones crónicas tras la radioterapia de cabeza y cuello y sobre la forma de detectarlas.
Tratamientos sistémicosLos tratamientos sistémicos para los cánceres bucofaríngeos incluyen la quimioterapia y el tratamiento selectivo. La quimioterapia citotóxica convencional destruye las células que se dividen rápidamente. El tratamiento farmacológico selectivo, también llamado medicina de precisión, está diseñado para centrarse selectivamente en dianas moleculares específicas implicadas en el crecimiento y la progresión de un tumor individual. Los tratamientos selectivos causan menos reacciones adversas porque la probabilidad de que dañen tejidos sanos es menor23.
La quimioterapia y los fármacos selectivos raramente se usan como monoterapia de primera línea para el cáncer de amígdalas, aunque el tratamiento sistémico puede combinarse con la radioterapia como tratamiento principal. La mayoría de tratamientos sistémicos se administran en régimen ambulatorio.
Las pautas quimioterápicas que contienen cisplatino, un alquilante, se emplean habitualmente junto con la radioterapia para tratar el cáncer de amígdala24. Si bien estas pautas se pueden administrar en régimen ambulatorio, exigen una hidratación intravenosa para evitar la nefrotoxicidad asociada al cisplatino. Los profesionales de enfermería deben supervisar la urea, el ácido úrico sérico y las concentraciones de creatinina para detectar una reducción del aclaramiento de la creatinina25.
Las dosis altas de cisplatino pueden provocar náuseas y vómitos, por lo que deben administrarse antieméticos de acción prolongada según lo prescrito; también pueden inducir reacciones adversas auditivas, de modo que hay que vigilar la aparición de acúfenos y de una posible hipoacusia.
El cisplatino puede sustituirse por carboplatino en los pacientes que ya tienen alteraciones de la función renal24; este último provoca menos vómitos y nefrotoxicidad, pero más mielodepresión. Es necesario hacer un seguimiento de los pacientes para buscar signos de anemia, hemorragia, infección, trombocitopenia, neutrocitopenia y leucocitopenia.
Las pautas que contienen cetuximab, un anticuerpo monoclonal selectivo contra el EGFR, son tratamientos específicos que pueden asociarse con la quimioterapia para tratar el cáncer de amígdalas4. Los pacientes han de recibir un tratamiento previo con difenhidramina, corticoesteroides y un antihistamínico H2 como famotidina o ranitidina antes de la administración de cetuximab para evitar reacciones adversas a la infusión. Las enfermeras deben vigilar a los pacientes para ver si manifiestan reacciones a la infusión, hipotensión, disnea, hipomagnesemia, erupción acneiforme e infecciones cutáneas, así como arritmias4,26. Para tratar los problemas de piel y de las uñas de las manos, enseñe al paciente a usar cremas emolientes para mantener la zona húmeda y no lociones, ya que estas provocan más sequedad por contener alcohol. Indíqueles que deben restringir su exposición al sol durante el tratamiento y notificar todo síntoma respiratorio que aparezca o que empeore.
Los taxanos paclitaxel y docetaxel son antimitóticos (inhibidores de la mitosis celular) que a veces se utilizaban para tratar los cánceres de cabeza y cuello24. Teniendo en cuenta el riesgo de aparición de reacciones de hipersensibilidad graves que abarcan hasta la anafilaxia, los pacientes que vayan a recibir estos medicamentos también toman un tratamiento previo con corticoesteroides, difenhidramina y un antihistamínico H2. Otras reacciones adversas son las náuseas, la mielodepresión y la neuropatía periférica27. Debe enseñarse a los pacientes a que notifiquen toda dificultad respiratoria o infección, o un posible entumecimiento, hormigueo o escozor en las manos o los pies. En la pauta terapéutica puede emplearse cualquiera de los taxanos de forma simultánea con el cisplatino.
Observaciones relativas a la enfermería sobre los tratamientos sistémicosEn la atención de un paciente que está recibiendo una quimioterapia o un tratamiento selectivo, la enfermera debe tener conocimientos de estos medicamentos y estar adecuadamente formada para administrarlos con inocuidad28. También tiene que saber las reacciones adversas asociadas a cada fármaco y supervisar correctamente al paciente. Ha de explicar a los pacientes las posibles reacciones adversas y los aspectos que deben notificar al médico de forma inmediata.
Estudio de caso: un buen pronósticoB.L. recibió un diagnóstico de T2 (tumor mayor de 2 cm, pero de no más de 4 cm en su mayor dimensión), N2 (metástasis en un solo ganglio ipsilateral mayor de 3 cm pero de un máximo de 6 cm en su mayor dimensión). Se sometió a una amigdalectomía radical mediante TORS con una linfadenectomía unilateral izquierda. La muestra biópsica y el informe de histopatología quirúrgica revelaron que el cáncer daba positivo para el VPH. Tras la disección se detectó el tumor en un solo ganglio, de 5 cm de tamaño. No se observó invasión perineural en la muestra ni diseminación extracapsular en el ganglio. El médico le recomendó una radioterapia postoperatoria desintensificada dado su pronóstico favorable.
B.L. seguirá teniendo visitas de seguimiento con el oncólogo y realizándose TC con periodicidad para detectar una posible recurrencia local cada 6 meses durante el primer año, con exploraciones clínicas cada 3 meses. Luego se le practicarán exploraciones clínicas y TC cada 6 meses durante 1 o 2 años, y después exploraciones anuales a menos que cambie su estado de manera que necesite un seguimiento más estrecho. ■