El síndrome paraneoplásico es secundario a una respuesta a distancia por la presencia de una neoplasia y representa un reto en el diagnóstico de la enfermedad primaria. Las neoplasias testiculares de células germinales se clasifican en seminomatosas o no seminomatosas y la presencia de un componente pluripotencial puede generar un raro tumor mixto que se asocia a trastornos hormonales e inmunológicos (síndromes paraneoplásicos). A continuación, se expone el caso de un paciente de 17 años sin antecedentes de importancia, que empezó con alteraciones en el comportamiento hasta llegar a cuadros de despersonalización, sobre todo, violenta; en la evolución de la enfermedad existió ginecomastia y síndromes hipotalámicos-hipofisarios. Los cambios de comportamiento violento llevaron al diagnóstico tras trauma testicular. Los marcadores onconeuronales, el perfil hormonal y la histopatología definieron el diagnóstico. En este artículo se discute la encefalitis límbica-hipotalámica en el contexto de tumores mixtos de células germinales.
The paraneoplastic syndrome is a distant secondary response due to the presence of a neoplasia; it represents a challenge in the primary disease diagnosis. Testicular germ cell neoplasms are classified into seminomatosous and non-seminomatous, and the presence of a pluripotential component may lead to a rare mixed tumor that is associated with hormonal and immunological disorders (paraneoplastic syndromes). In this paper we present the case of a 17-year-old patient with no relevant history, who began with behavioral alterations up to depersonalization, especially violent. During the disease progression there was gynecomastia and hypothalamic-pituitary syndromes. In this article we discuss limbic-hypothalamic encephalitis in the context of mixed germ cell tumors, and the changes in violent behavior that led to the diagnosis after testicular trauma. The diagnosis was confirmed by onconeuronal markers, the hormone profile and histopathology.
La encefalitis límbica paraneoplásica (ELP) fue descrita por primera vez en los años sesenta. El primer reporte estuvo asociado a psicosis en carcinoma de células pequeñas de pulmón1. Quizás la descripción más famosa fue en el contexto de la enfermedad de Hodgkin, conocida como síndrome de Ofelia, descrito por Carr en su hija adolescente1. En los últimos años el avance del estudio de anticuerpos onconeuronales (AcO) ha permitido diferenciar los subtipos de ELP. El AcO identificado en la mayoría de los casos es el anti-Ma2 (conocido también como anti-Ta)2. El signo más importante de encefalitis límbica es el cambio de comportamiento, inclusive 5 años antes del diagnóstico tumoral primario. El tumor testicular mixto de células germinales (TTMCG) es poco común, y aún lo son menos los reportes de asociaciones con ELP1.
Presentación del casoA continuación, se expone el caso de un paciente de 17 años con antecedente de tratamiento psicológico por actitudes violentas, que acudió a la urgencia por trauma testicular producto de una confrontación con individuos de su edad. El examen físico y la ecografía doppler testicular evidenciaron ausencia de flujo sanguíneo en teste izquierdo y en el derecho con un 40%. Se le practicó orquidectomía izquierda y orquidopexia derecha con abordaje transescrotal; el diagnóstico postoperatorio fue de una torsión extra- e intravaginal izquierda y extravaginal derecha. Después, el estudio histopatológico y de inmunofenotipización demostró un TTMCG (fig. 1A-K). La evolución postoperatoria fue favorable. Quince días después, el paciente reingresó por episodios maniáticos. Al examen físico, se evidenció palidez generalizada y ginecomastia (fig. 2E). Al examen neurológico, el paciente estaba vigil, orientado en tiempo, espacio y persona. Las funciones mentales superiores y el examen neuropsicológico fueron compatibles con daño frontocorticosubcortical (fig. 2B).
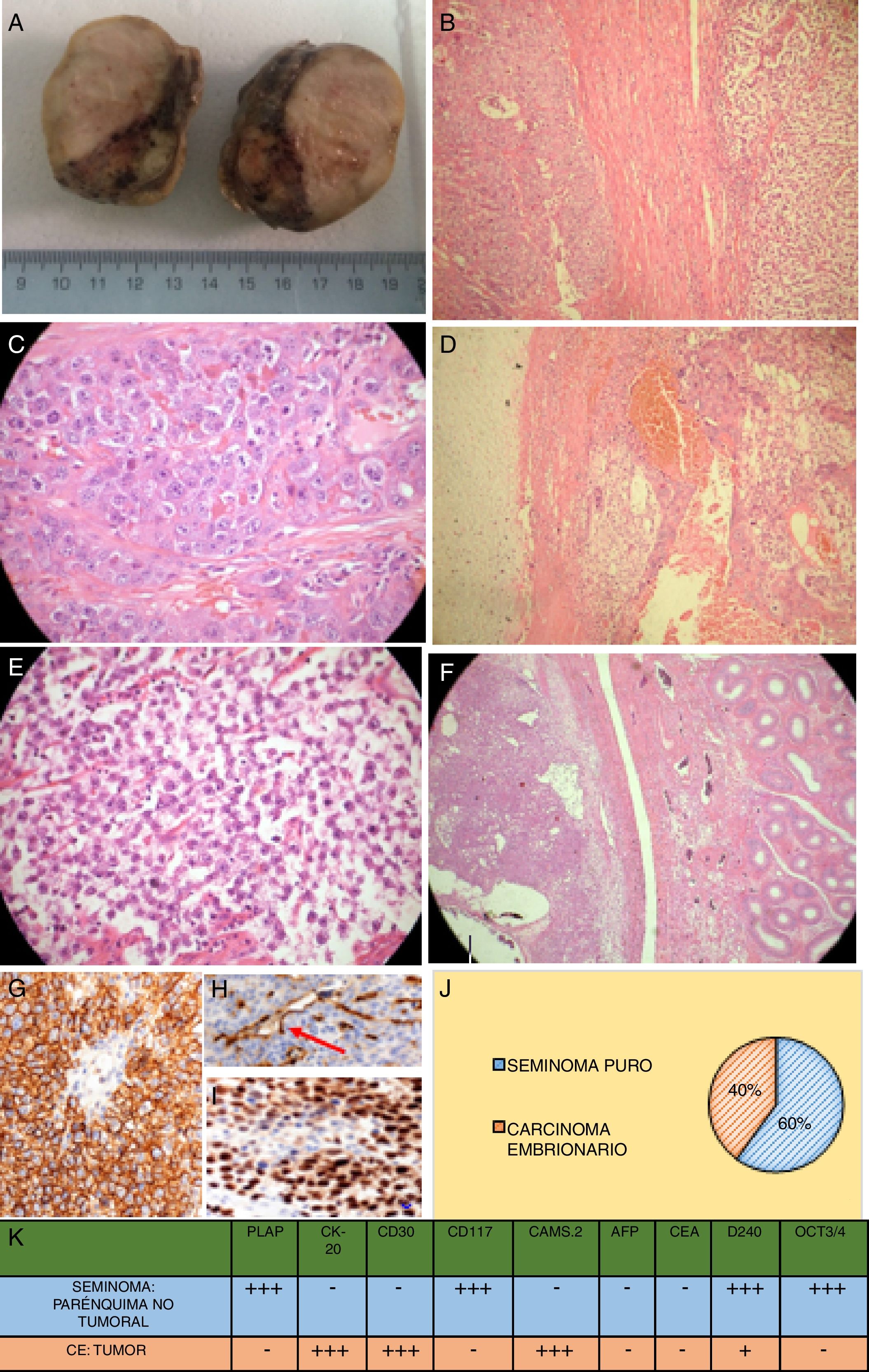
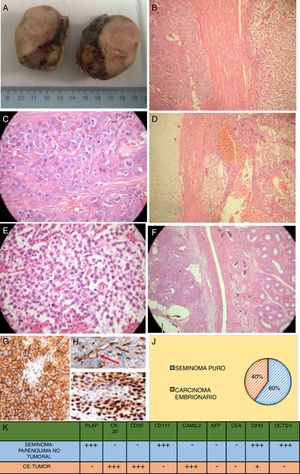
Estudio anatomopatológico posquirúrgico. A) Macroscopia del testículo izquierdo postorquidectomía transescrotal, cubierto por túnica vaginal y albugínea lisas, homogéneas edematosas, íntegras. Al corte, se observa parénquima testicular reemplazado por zona de aspecto amarillento, blanda, con zonas heterogéneas blanquecinas firmes y quísticas hemorrágicas. La lesión comprime el epidídimo sin infiltrarlo, el cordón espermático con vasos y el conducto deferente. B) Microscopia: transición del componente seminomatoso y embrionario (60×). C) Microscopia: componente embrionario (100×). D) Microscopia: cartílago hialino y componente embrionario (60×). E) Microscopia: componente seminomatoso (100×). F) Microscopia: tumor y transición a epidídimo (60×). G) Inmunofenotipización: expresión de D2-40 podoplanina en seminoma (100×). H) Inmunofenotipización: en el carcinoma embrionario, la D2-40 podoplanina se expresa solo en zonas apicales (100×). I) Inmunofenotipización: seminoma con expresión nuclear de OCT3/4 (100×). J) Distribución del tumor mixto de células germinales con componente seminomatoso en el 60%, carcinoma embrionario en el 40%. K) Estudio inmunohistoquímico completo tanto del parénquima no tumoral con neoplasia seminomatosa intraepitelial como del carcinoma embrionario de zona tumoral. Así, el seminoma testicular mostró intensa positividad frente al PLAP y CD117: estos marcadores fueron negativos en el carcinoma embrionario; por el contrario, la CK y el CD30 fueron intensamente positivos en el carcinoma embrionario y negativos en el seminoma. La expresión de OCT3/4 y D2-40 demuestra presencia de seminoma pluripotencial como precursor del tumor mixto.
Fuente: Elaboración propia (Departamento de Anatomo-Patología del Hospital Isidro Ayora).
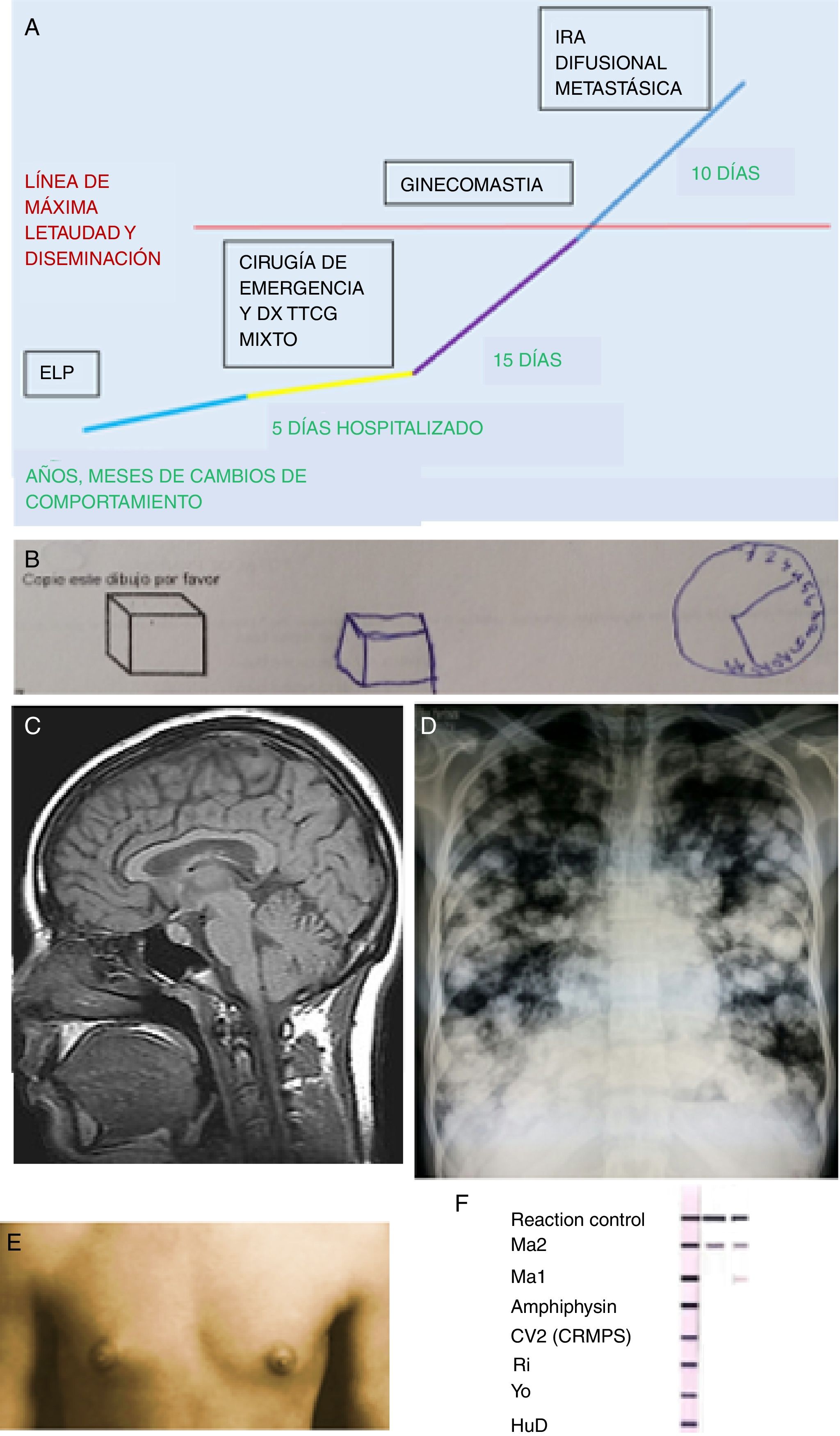
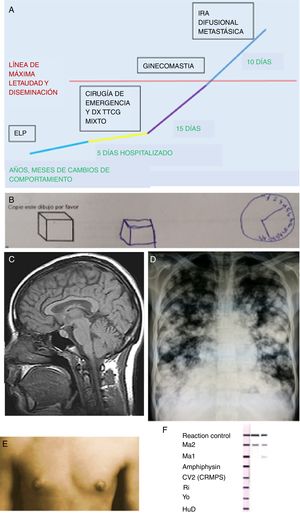
Hallazgos clínicos diagnósticos en el caso para encefalitis límbica-hipotalámica en tumor testicular mixto de células germinales. A) Línea de tiempo que describe la evolución y progresión del ELP en el contexto del TTCG mixto. B) Estudio de producciones en el examen neuropsicológico que mostró distraibilidad y mala interpretación espacial. C) RMN: corte sagital sin evidencia estructural de sistema límbico, lóbulos frontales y diencéfalo; los resultados en LCR: proteínas (0,60g/L), pleocitosis (PMN 55%), la IgG fue normal y no se detectaron bandas oligoclonales. D) Radiografía estándar de tórax: imágenes de nodulaciones múltiples radiopacas en ambos campos pulmonares, correspondientes a metástasis pulmonares, imagen «en suelta globos» o aspecto de «balas de cañon». El valor de los marcadores tumorales: LDH (4.100 UI/I); HGC (55.000 UI/l); alfafetoproteína (17.000 ng/ml). E) Ginecomastia bilateral asimétrica, sin galactorrea, hipertelorismo mamario e hiperpigmentación a nivel de pezones. F) Positividad seriada del inmunoblot de AcO, que muestra la más fuerte positividad en Ma2. Se observan 3 tirillas, la primera es la de control, las 2 siguientes columnas son las muestras seriadas del paciente.Fuente: Elaboración propia.
En el examen de pares craneales, se vio paresia de mirada ascendente. El examen motor fue normal; la sensibilidad superficial y profunda estaban conservadas. El examen cerebelar no mostró alteración. No existieron signos de meningismo, ni de liberación frontal ni evidencia de disautonomismo.
La RMN craneal no mostró alteraciones, el electroencefalograma fue normal, el LCR mostró características inflamatorias (fig. 2C). Las determinaciones de estradiol, testosterona, andrógenos adrenales y cortisol fueron normales. Se realizó perfil hormonal del eje hipotálamo-hipofisario con evidencia de discreta disminución de TSH, FSH y LH e hiperprolactinemia. Con la prueba de estimulación con Luforán (GnRH sintético), la FSH y la LH doblaron su valor. Se corroboró panhipopituitarismo con hiperprolactinemia de origen hipotalámico.
Se enviaron muestras seriadas de LCR y suero sanguíneo a laboratorios en el extranjero para dosificación de AcO (Hu, Yo, Ri, amfifisina, CV2, Ma1 y Ma2). Un inmunoblot con antígenos recombinantes reveló positividad para Ma2 (fig. 2F).
En los estudios de extensión y estatificación tumoral (imagen y marcadores tumorales) se clasificó el tumor en T2 N3 M1a S3+ (fig. 2D).
El paciente, 10 días después, presentó insuficiencia respiratoria aguda producto de metástasis pulmonares. Se le practicaron cuidados paliativos y 5días después falleció (fig. 2A).
Revisión y discusiónEl TTMCG es infrecuente, pero la asociación de ELP en tumores no seminomatosos está claramente descrita2,3. El inicio suele ocurrir antes que los síntomas del tumor primario; la aparición de desórdenes conductuales puede ser 5 años antes del diagnóstico del tumor primario2. La ELP pertenece a los SPN clásicos: se considera un síndrome autoinmune cuyos antígenos se encuentran en las neuronas límbicas, corticales, subcorticales, hipotálamo y tallo cerebral. Esta misma respuesta puede disminuir el crecimiento del tumor primario, y hacerlo menos evidente3, lo que podría ser la causa del infradiagnóstico del tumor primario.
El anticuerpo de la ELP es el de superficie anti-Ma2, relacionada sobre todo con tumores de pulmón en adultos masculinos3. En un estudio de 18pacientes que expresaron anti-Ma2: el 76% presentaron encefalitis límbica, el 15% síntomas hipotalámicos y el 9% síndromes del tronco encefálico3. En nuestro caso, la positividad de anti-Ma2 corroboró la presunción clínica de síntomas límbicos e hipotalámicos.
El antecedente de consultas psiquiátricas previo al diagnóstico es una característica encontrada en un 98% de los pacientes con ELP: en seguimientos neuropsiquiátricos durante 5 años en ELP causados por anti-Ma2, existen síntomas iniciales como: ansiedad, agitación, comportamiento extraño, delirios paranoides o alucinaciones auditivas y visuales, risas inmotivadas, afecto lábil, aislamiento social, hiperreligiosidad y síntomas obsesivo-compulsivos; semanas después puede existir verbalización de palabras incomprensibles, ecolalia o mutismo, con fenómenos de desinhibición social4. La historia natural de paciente obedeció a la literatura: cuando aumentó la letalidad del tumor experimentó psicosis.
La probabilidad de que sucedan acontecimientos violentos en el transcurso de la enfermedad depende de los fenómenos de desinhibición social4. El proceder violento del paciente le provocó un trauma testicular, que evidenció incidentalmente el tumor primario. El diagnóstico del tumor primario coincide con la exacerbación de síntomas psiquiátricos y la máxima diseminación del tumor primario con altas concentraciones de anticuerpos neuronales4.
La ginecomastia e hiperprolactinemia en ELP tienen origen en la disminución del factor inhibidor hipotalámico y se relaciona en el 70% de los casos. Otros signos que la acompañan son fiebre central, anormalidades del sueño REM, hiperfagia y alteraciones de pares craneales como parálisis de la mirada supranuclear5. El panhipopituitarismo de origen hipotalámico demostrado con el test de Luforán explicaría la topografía.
Las pruebas diagnósticas rutinarias son inespecíficas; sin signos claros en LCR, ni RMN ni en electroencefalograma6, hecho que llevó a realizar exámenes más complejos.
La prueba de referencia para el diagnóstico se fundamenta en evaluar las alteraciones en el tejido cerebral límbico y lóbulo temporal con inmunoglobulinas aisladas del suero y LCR6. Sin embargo, por coste/efectividad se prefiere la combinación de valoración neuropsicológica y dosificación de AcO con inmunoblot en suero o LCR (especificidad del 89% y sensibilidad del 97%). En un segundo tiempo se puede realizar la combinación de pruebas de inmunofluorescencia indirecta e inmunoblot anti-Ma2 para alcanzar una especificidad del 98%6. Nuestro caso tuvo la evidencia de daño límbico con examen neuropsicológico con positividad de anti-Ma2, elementos usados en el diagnóstico.
La intervención de elección en los casos de tumor testicular maligno es la orquidectomía radical por vía inguinal con ligadura alta del cordón espermático7; sin embargo, en la entidad escrotal isquémica aguda es de elección la orquidectomía transescrotal u orquidopexia8. Es poco común un cuadro escrotal agudo en el contexto de tumores testiculares9, en el que lo indicado es la intervención precoz con abordaje inguinal, debido a que el abordaje transescrotal cambiará el patrón de diseminación9. En nuestro caso, sin contar con evidencia de sospecha de tumor testicular en la urgencia, se practicó el abordaje transescrotal.
La coexistencia de componente seminomatoso y no seminomatoso en TTCG es infrecuente10. Este fenómeno se explica por la diferenciación a partir de células de seminoma puro o de un carcinoma embrionario totipotencial10. La clasificación de los componentes del tumor debe realizarse porque el tratamiento y el pronóstico dependen de ello. La inmunohistoquímica diferencia a los SP (CD30+ CD117−) y carcinoma embrionario (CD117+ y CD30−)10. Se realizó un panel de anticuerpos con cobertura de los tipos frecuentes de los TTCG para determinar su composición mixta.
El patrón de metástasis de los seminomas es a través de vía linfática, mientras el carcinoma embrionario utiliza la vía linfática y hematógena (pulmón, hígado, sistema nervioso central, médula)11. El causante de metástasis fue el carcinoma embrionario, por lo tanto, esta última marca la agresividad del tumor.
El tratamiento paliativo indicado en metástasis de mal pronóstico es 4ciclos de bleomicina, etopósido y cisplatino (BEP)12. Los síntomas psiquiátricos en ELP mejoran con el tratamiento del tumor primario (quimioterapia paliativa) sin un tratamiento eficaz con antipsicóticos típicos ni atípicos13-15.
ConclusiónAunque la ELP es ampliamente descrita por la literatura, su asociación con hipotalamitis, anti-Ma2 y TTMCG es infrecuente; puede esperarse el inicio con ELP por el componente no seminomatoso, cuyo síntoma cardinal es la alteración en el comportamiento, que empeora en las fases de alta diseminación del tumor primario. El diagnóstico es incidental la mayoría de veces. En nuestro caso, un trauma de escroto evidenció el tumor primario, las decisiones prequirúrgicas se tomaron sin tener sospecha de una neoplasia testicular y la inmunofenotipización corroboró la coexistencia de componente seminomatoso y no seminomatoso. La evaluación neuropsicológica y los signos de hipotalamitis confirmaron daño límbico e hipotalámico que, con positividad de anti-Ma2, confirmaron la ELP. La quimioterapia en las etapas finales de la enfermedad no solo es la medida paliativa para el tumor primario, sino que es el único tratamiento efectivo para disminuir los síntomas de ELP. Finalmente, la valoración neuropsicológica y las pruebas AcO serían la mejor alternativa para el diagnóstico temprano ante la baja disponibilidad de pruebas más complejas.
DedicatoriaA la memoria del paciente (†), el motivo mayor de nuestras investigaciones.
Conflicto de interesesLos autores refieren no presentar conflicto de interés.