La notalgia parestésica es una neuropatía sensitiva secundaria al compromiso de los nervios espinales. Como síntoma característico, se describe el prurito dorsal asimétrico, que compromete los dermatomas D2 a D6, sin irradiación al tórax.
Caso clínicoPaciente hombre de 63 años, que refiere prurito dorsal paravertebral derecho a nivel D4 de 2 años de evolución. No presenta dolor neuropático asociado y el examen neurológico fue normal. La resonancia de columna dorsal mostró estenosis foraminal a nivel D3-D4.
ConclusionesSi bien la notalgia parestésica no parece ser una entidad de baja prevalencia, es infrecuente su descripción como una neuropatía sensitiva. El tratamiento local con antihistamínicos y corticoides tópicos suele ser ineficaz. Algunos pacientes han mostrado buena respuesta con el uso de capsaicina tópica y gabapentina. El conocimiento por parte de dermatólogos y neurólogos de la expresión clínica de los síndromes por atrapamiento, como la notalgia parestésica, es fundamental para un diagnóstico temprano y tratamiento específico, lo que mejorará la evolución de los pacientes y evitará el uso de medicaciones ineficaces.
Notalgia paresthetica is the result of spinal nerves compromise. The typical feature is pruritus that affects dorsal segments T2 to T6 without chest spreading.
Case report63 years old male patient refered pruritus in right dorsal paravertebral region at T4 dermatome that began 2 years ago. He did not refer neuropathic pain in the area and the complete neurological exam was normal. Dorsal MRI shows foraminal stenosis at T3-T4 levels.
ConclusionNotalgia paresthetica does not seem to be a low prevalent disorder, but the description is not usual as a sensory neuropathy. Local treatment using antihystaminics and topical steroid therapy used to be ineffective. Some patients have reported some relief with topical capsaicin and gabapentin. Knowledge of clinic expression by dermatologists and neurologists of this entrapment syndrome is mandatory for an early diagnosis and specific treatment that will end up in a better outcome and avoidance of ineffective therapies.
El prurito es un síntoma que se presenta en humanos y animales, y ha sido reportado desde tiempos inmemoriales. Ya en el siglo xvii, Samuel Hafenreffer definió el prurito como «una sensación displacentera que genera el deseo o reflejo de rascado». Si bien es uno de los motivos de consulta dermatológica más frecuentes, los neurólogos deben tener en mente que esta sensación puede estar marcando la presencia de daño neurológico de origen central o periférico.
Por muchos años se consideró el prurito como una manifestación relacionada etiológicamente al dolor neuropático. Existen varios factores que diferencian estas sensaciones, como por ejemplo la respuesta que evocan, siendo que el dolor neuropático genera reacción de retirada y el prurito evoca la necesidad refleja o consciente de un estímulo mecánico como el rascado. Por otro lado, el prurito solo se manifiesta en la piel y las mucosas, no como el dolor neuropático que puede referirse a tejido visceral también. Estos son algunos de los motivos que llevaron a estudiar la neurofisiología del prurito y evaluar si su origen era independiente al dolor.
Ya en 1927, Lewis propuso que la histamina generaba prurito en áreas inflamadas de la piel1. Shelley y Arthur definieron las áreas más pruriginosas de la piel, en respuesta a la aplicación de la espícula de la mucuna pruriens2 y posteriormente se demostró que esas áreas de la piel tenían mayor cantidad de receptores de fibras amielínicas (fibras tipo C)3. Otro estudio importante en 1980 mostró que al aumentar la intensidad del prurito, no se inducía la aparición de dolor neuropático4. Estos hallazgos llevaron a la conclusión que el dolor neuropático y el prurito son sensaciones separadas y que son transmitidas en forma independiente.
Objetivo: presentar un caso de notalgia parestésica (NP) y realizar una revisión de los mecanismos fisiopatogénicos, así como de los tratamientos disponibles.
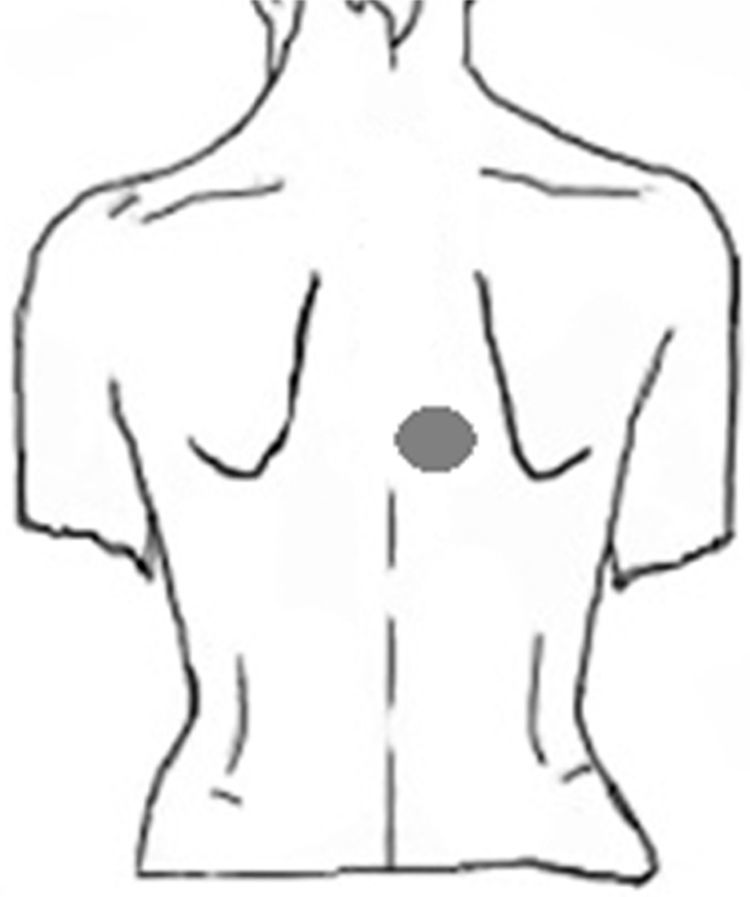
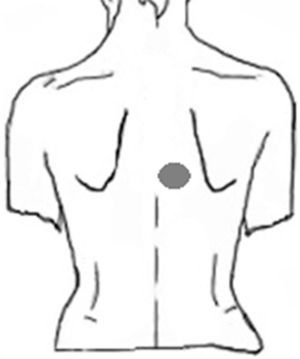
Caso clínicoPaciente hombre de 63 años, el motivo de consulta primario al neurólogo fue cefalea tipo tensión y, como comentario final, refirió prurito interescapular de 2 años de evolución. Del interrogatorio dirigido se rescató como dato importante una tendencia a la mejoría en el invierno, con empeoramiento del prurito al exponer la piel al sol en verano, así también comentó haber consultado previamente a distintos centros de dermatología, sin obtener respuesta con tratamientos locales a base de cremas con antihistamínicos. La localización del área pruriginosa se correspondía al dermatoma T4 derecho (fig. 1). No refería irradiación intercostal, ni presencia de disestesias o dolor neuropático. El examen neurológico no arrojó signos de daño central o periférico. Del examen termoalgésico con tubos de agua tibia y fría, no se obtuvieron diferencias entre el área afectada y otras áreas adyacentes. El examen de la piel mostró un área de hiperpigmentación muy tenue en la zona pruriginosa, al mismo tiempo que negó antecedentes de infección por herpes zóster. Se solicitó una resonancia magnética de columna cérvico-dorsal, que mostró múltiples protrusiones disco-osteofitarias y fenómenos hipertróficos osteoligamentarios a nivel cervical. En columna dorsal se evidenció una disminución del espacio foraminal nivel de la tercera y la cuarta vértebras dorsales, interpretado como posible hipertrofia focal osteoligamentaria que comprimía el paso de las raíces nerviosas a ese nivel.
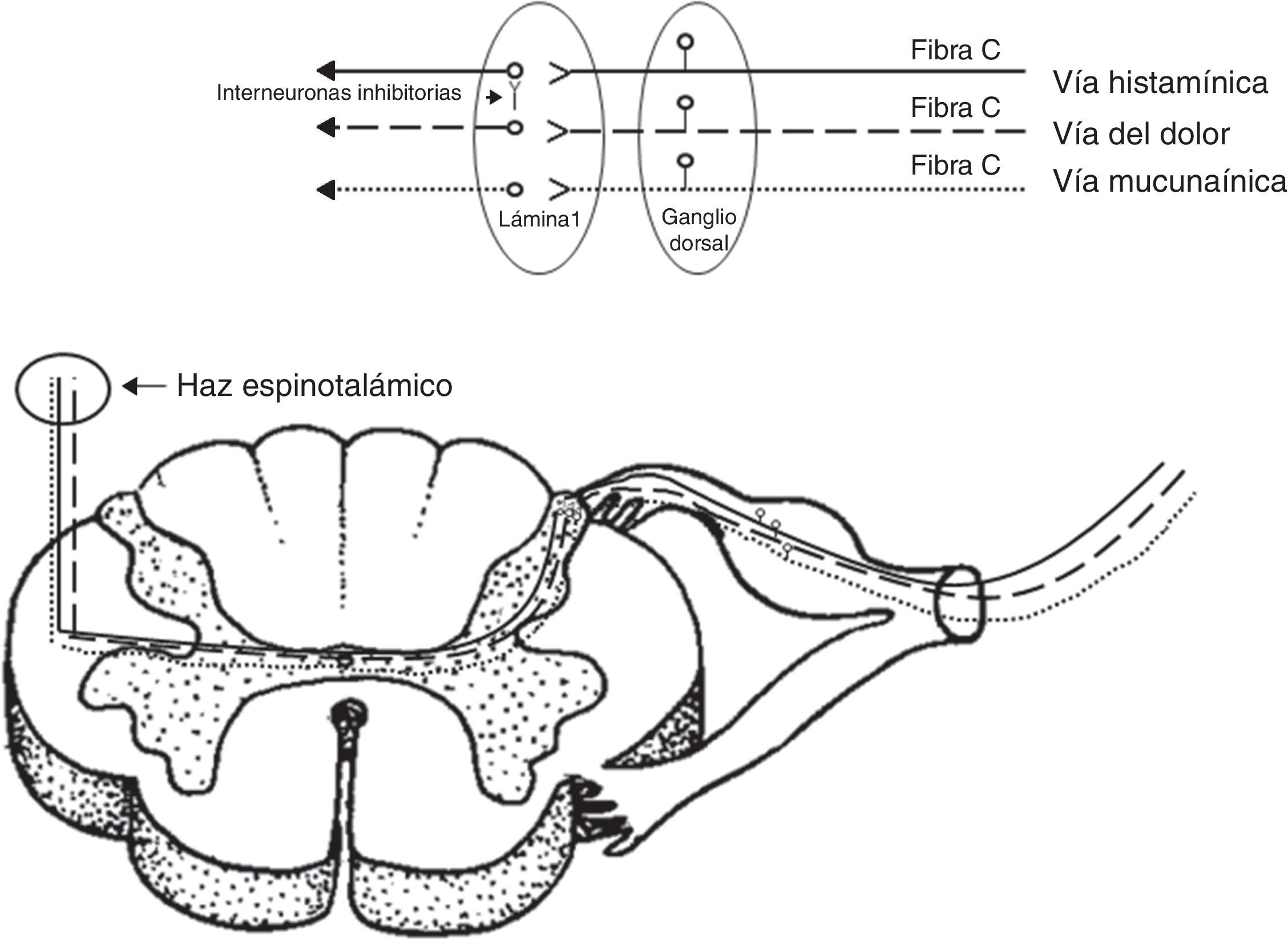
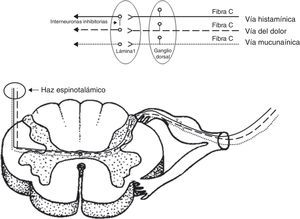
DiscusiónLa sensación de prurito se transmite por medio de las neuronas aferentes primarias5. Estas neuronas de tipo monopolares tienen su cuerpo (soma) en los ganglios de las raíces dorsales para los nervios espinales, o ganglios sensitivos para los nervios craneales. Los axones que transmiten la sensación de prurito son fibras de pequeño calibre tipo C (amielínicas) que terminan a nivel de la unión dermo-epidérmica, penetrando a la epidermis como receptores llamados terminales libres6. Recientemente, se han descrito 2 vías independientes que transmiten la sensación de prurito7, una activada por histamina y otra activada por una sustancia específica de las espículas aterciopeladas del frijol (cowhage) llamada mucunaína, que es una cisteína proteasa. Si bien estas 2 sustancias activan distintos receptores, por ejemplo, la histamina receptores acoplados de proteína G y la mucunaína receptores activados por proteasas 2; ambas comparten la activación de receptores de potencial transitorio V1 (TRPV1) o receptor vainiloide. Este último receptor se activa también a distintos rangos de temperaturas elevadas8.
Las aferencias de ambas vías independientes del prurito terminan en las láminas más superficiales del asta posterior de la médula. De estudios realizados en gatos se han definido neuronas prurito-específicas que son sensibles a la histamina e insensibles a los estímulos mecánicos y térmicos9. A nivel de la lámina 1, distintos neurotransmisores, como el péptido relacionado con el gen de la calcitonina, el péptido liberador de gastrina, sustancia P y glutamato, han sido descritos. A este nivel, se ha demostrado la presencia de interneuronas inhibitorias (Bhlhb5), que mediante su activación pueden suprimir el prurito y, por el contrario, la pérdida de las mismas resulta en su persistencia. Estas interneuronas inhibitorias conectan fibras nociceptivas con fibras de la vía pruriginosa activada por histamina por medio de la liberación de glicina y de ácido gamaaminobutírico. De esta manera, podría explicarse la supresión por medio del rascado (como estímulo mecánico nociceptivo) del prurito mediado por histamina, no así por mucunaína10.
Luego de la primera sinapsis en la lámina 1, ambas vías cruzan y ascienden en forma independiente por el tracto espinotalámico lateral contralateral (fig. 2), terminando sus proyecciones a nivel lateral del tálamo. La representación talámica es diferente para ambas vías, siendo más amplia para la vía activada por mucunaína que la activada por histamina. Si bien ambas tienen sinapsis con los núcleos ventro-postero-lateral contralateral, ventro-postero-inferior y posterior, la vía activada por mucunaína tiene proyecciones adicionales al núcleo suprageniculado contralateral y geniculado medial11.
Por medio del uso de tomografía por emisión de positrones y evaluación del flujo sanguíneo cerebral regional, se ha podido demostrar que las proyecciones hacia áreas subcorticales y corticales no son similares en ambas vías, compartiendo la corteza somatosensorial, la corteza parietal, áreas motoras, prefrontales, cinguladas anteriores y mesencefálicas. Solamente la vía activada por mucunaína se relaciona con la ínsula, el putamen y los ganglios basales10–12.
La NP fue definida en 1934 por Astwazaturow como una neuropatía sensitiva secundaria al compromiso de los nervios espinales13. Como síntoma característico se describe el prurito dorsal asimétrico, que compromete los dermatomas D2 a D6, sin irradiación al tórax. La presencia ocasional de parestesias y/o hiperalgesia asociadas al prurito ha sido descrita14. La hiperpigmentación en el área pruriginosa es frecuente y se da como resultado del roce o el rascado crónico13. Ya en 1968 la NP había sido descrita en trabajadores de países tropicales expuestos a una radiación solar excesiva, por lo que durante años ha sido clasificada como una fotodermatosis15. Una característica no aclarada aún es la presencia de aumento del prurito en verano y mejoría en invierno. Esta particularidad fue referida en nuestro paciente. Posiblemente, la activación de los receptores vainiloides (TRPV1) a altas temperaturas podría explicar el incremento del prurito8.
Si bien no parece ser una entidad de baja prevalencia, no es frecuente su descripción como una neuropatía sensitiva. Recientes reportes y estudios han descartado algunos factores previamente asociados a la NP, como los componentes hereditarios o metabólicos, relación directa con el uso o aplicación de químicos, etc.16.
La presencia de hallazgos patológicos a nivel de la columna dorsal en muchas de las series descritas ha definido a la NP como una radiculopatía, para algunos una neuropatía por atrapamiento17. Un aspecto que apoya esta hipótesis es que las raíces nerviosas dorsales emergen en ángulo recto entre los músculos espinales y se encuentran expuestas a microtraumatismos repetidos o atrapamiento17.
Se ha descrito como pauta fundamental diagnóstica de la NP que los hallazgos clínicos, es decir, el dermatoma afectado por el prurito, deben correlacionarse con los hallazgos de la resonancia magnética. La ausencia de lesiones en la resonancia magnética en presencia de NP ha sido descrita principalmente en pacientes jóvenes; esta situación podría explicarse como un daño radicular secundario a espasmos musculares por microtraumas locales repetidos o bandas fibróticas que comprimen las raíces dorsales no visibles en los estudios de imágenes convencionales16. Recientemente, Huesmann et al., describen los hallazgos en 65 pacientes con NP, siendo que en solo el 15,7% de los casos pudo correlacionarse los hallazgos radiológicos con el dermatoma afectado18. Por otro lado, la evaluación de la densidad de terminales libres por medio de biopsia de piel e inmunomarcación con PGP 9.5 mostró un descenso significativo de las fibras en las áreas pruriginosas comparado con el área no afectada contralateral. Estos resultados ponen en duda al atrapamiento como la causa primaria de la NP.
Las experiencias con estudios de electromiografía a nivel dorsal no han arrojado resultados positivos en la mayoría de las series19. Solo Pleet y Massey13 han reportado, en 7 de 9 casos, la presencia de ondas agudas positivas como posible manifestación de denervación paraespinal.
Otros hallazgos reportados de las biopsias de piel en el área pruriginosa muestran queratinocitos y necrosis intraepitelial asociados a la presencia de melanina y macrófagos en la dermis papilar17. La biopsia de piel no tiene utilidad para el diagnóstico de la NP, solo puede estar indicada ante la necesidad de descartar otras afecciones con prurito e hiperpigmentación, como la parapsoriasis, la dermatitis pigmentada por contacto o la amiloidosis primaria cutánea.
Otra entidad relacionada a la NP por su fisiopatología es el prurito braquiorradial, que se caracteriza por la presencia de prurito persistente en la cara lateral de los brazos y antebrazos15. En 1983, Heyl20 indicó la posibilidad de que la base etiopatogénica subyacente fuera una compresión radicular en los segmentos cervicales C5-C8. Desde entonces, se han descrito múltiples casos adicionales asociados a enfermedad degenerativa, traumatismos o tumores medulares en la columna cervical.
Por último, recientemente Cohen et al.21 han reportado que en hasta un 80% de los casos de prurito anogenital es posible demostrar una radiculopatía lumbosacra susceptible de tratamiento mediante bloqueos paravertebrales.
El uso de antihistamínicos por vía oral o corticoides tópicos suele ser ineficaz. Aunque se han obtenido respuestas en casos aislados, el papel de la capsaicina tópica, un inhibidor de la recaptación de sustancia P, es muy discutido, ya que 2 estudios controlados y aleatorizados no han mostrado un beneficio adicional respecto del placebo22,23. Actualmente, uno de los tratamientos farmacológicos que ha mostrado mejor respuesta es la gabapentina24. Aunque existen publicaciones aisladas con respuestas satisfactorias, el papel terapéutico de otros fármacos antiepilépticos de más reciente introducción, como pregabalina u oxcarbazepina, está mucho menos establecido25. También se han descrito buenas respuestas tras la realización de técnicas de acupuntura, manipulación cervical y bloqueos radiculares paravertebrales26.
El conocimiento por parte de dermatólogos y neurólogos de la expresión clínica de los síndromes por atrapamiento como la NP es fundamental para un diagnóstico temprano y un tratamiento específico, lo que mejorará la evolución de los pacientes y evitará el uso de fármacos y técnicas diagnósticas ineficaces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.