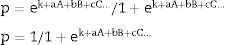La hemorragia subaracnoidea aneurismática es un fenómeno muy grave asociado a altas tasas de morbimortalidad. Previniendo los resangrados, tanto la embolización endovascular como la cirugía disminuyen la tasa de mortalidad y mejoran la calidad de vida de los supervivientes. Actualmente, la embolización endovascular se ha convertido en el método de elección para prevenir el resangrado, especialmente en Europa, reemplazando ampliamente a la cirugía.
ObjetivoEl objetivo de este estudio fue describir a una serie de pacientes con hemorragia subaracnoidea espontánea tratados en el Hospital Universitario de Getafe (Madrid), entre los años 1995 y 2015, analizar el diagnóstico y el tratamiento, así como establecer los principales factores pronósticos y comparar los resultados de ambos tratamientos (clip y coil). Se realizó un estudio retrospectivo, de revisión de historias clínicas, analizando datos epidemiológicos y con un estudio estadístico de estos datos.
ResultadosSe estudió a un total de 343 pacientes (pinzamientos quirúrgicos 185 y embolizaciones 158). Se estableció que la realización de tomografía computarizada (TC) de cráneo y arteriografía cerebral, así como el ingreso en la Unidad de Cuidados Intensivos, es el mejor manejo en este tipo de pacientes. Se ha demostrado que la embolización ha ido disminuyendo el número de complicaciones, siendo el tratamiento de elección a día de hoy. En este estudio, la situación clínica al ingreso, la cantidad de sangre hallada en la TC y la edad del paciente han resultado ser las variables más determinantes en el resultado final.
Aneurysmal subarachnoid hemorrhage is a very serious phenomenon associated with high rates of morbidity and mortality. After the initial hemorrhage, 50% of patients die, and 30-40% of patients rebleed during the first month. The percentage of deaths due to rebleeding ranges between 60% and 75%. Rebleeding prevention with both endovascular embolization and surgery decreases mortality and improve the quality of life of survivors. Nowadays, endovascular embolization has become the method of choice to prevent rebleeding, especially in Europe, largely replacing surgery.
ObjectiveThe aims of this study were to describe a series of patients with spontaneous subarachnoid hemorrhage treated at the University Hospital of Getafe between 1995 and 2015 (n=343; 185 surgically and 158 endovascular embolization); to analyze their diagnosis and treatment; to establish main prognosis factors; and to compare the results of both treatments (clip and coil). We conducted a retrospective study, by reviewing patients’ medical histories and analyzing epidemiological data.
ResultsWe studied a total of 343 patients (185 surgery and 158 embolization). It has been established that Computed Tomography (CT) and cerebral arteriography, with ICU admission, is the best therapeutic approach in this type of patients. It has been shown that embolization, the treatment of choice today, has decreased the number of complications in these years. In this study, patient's clinical condition at admission, the amount of blood found in the CT and patient's age have proved the most decisive factors in the final outcome.
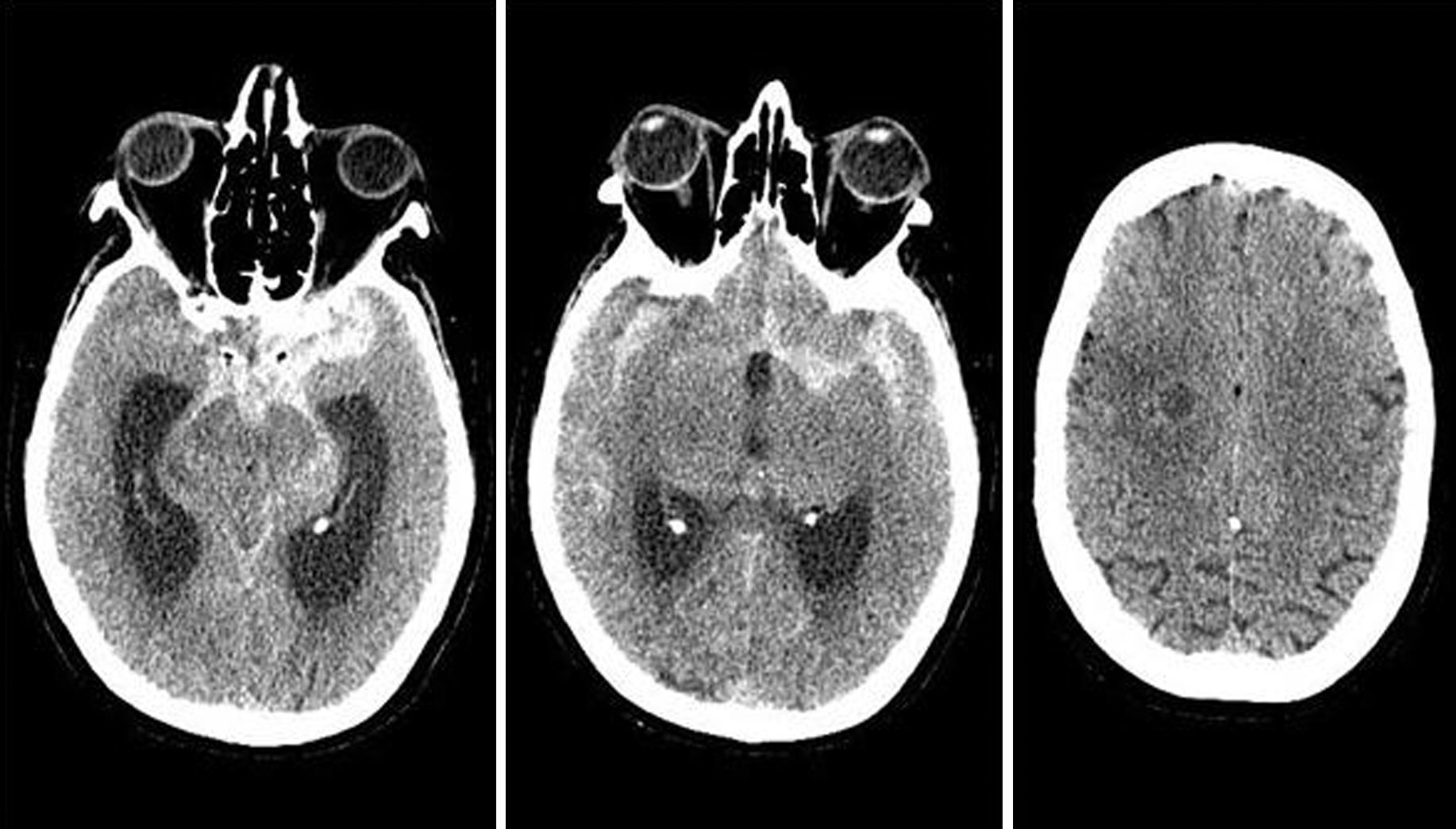
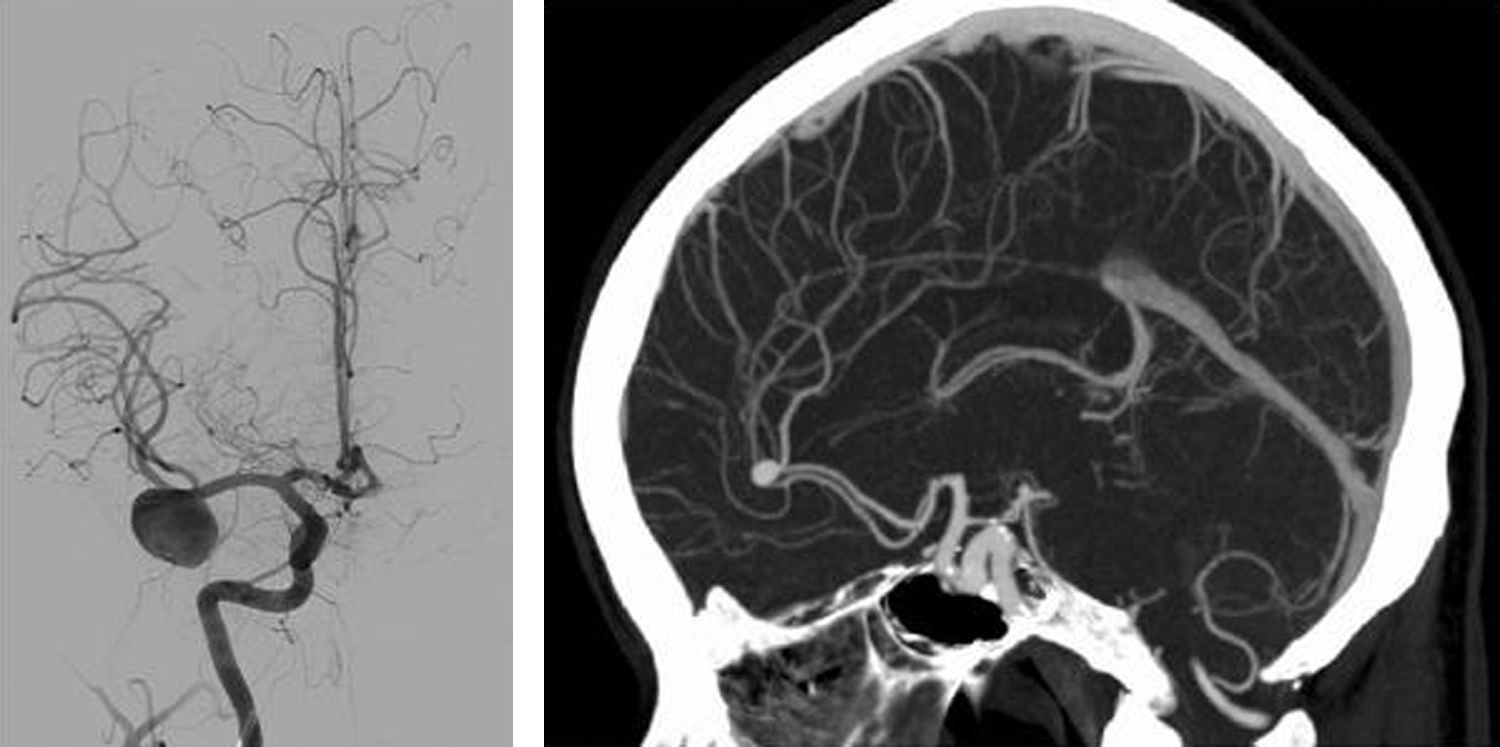
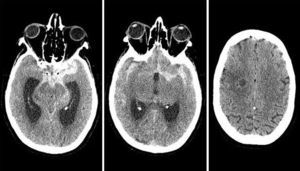
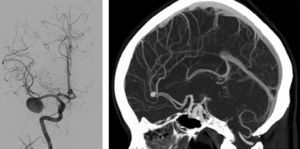
La hemorragia subaracnoidea (HSA) es una extravasación de sangre en el espacio subaracnoideo o leptomeníngeo (fig. 1). El 85% de las HSA no traumáticas o espontáneas se deben a la rotura de un aneurisma cerebral (fig. 2), aunque existen muchas otras causas1.
Entre las diferentes etiologías se encuentran las malformaciones vasculares, los tumores cerebrales y las alteraciones de la pared vascular, así como los trastornos de la coagulación. La HSA debida a rotura aneurismática es un fenómeno muy grave, asociado a altas tasas de morbimortalidad.
La HSA representa el 5-15% de todos los ictus cerebrales (uno de cada 20), pero, debido a que la enfermedad afecta a una considerable proporción de pacientes jóvenes, la pérdida de años de vida productivos es tan significativa como la secundaria al infarto cerebral isquémico, el más frecuente entre los ictus. Existen grandes variaciones en la incidencia de HSA aneurismática. Esta varía dependiendo del tipo de población estudiada (p. ej., es doble en Finlandia o Japón, e inferior al resto en países de Centro y Sudamérica), de la distribución de edad de dicha población, del tamaño de la misma, de la prevalencia de tabaquismo e hipertensión, de los criterios diagnósticos utilizados y de las diversas técnicas diagnósticas empleadas2.
Se estima que la incidencia real se encuentra aproximadamente alrededor de 7,4-28 por 100.000 personas por año, aunque según los estudios más exhaustivos dicha incidencia podría acotarse a 9 por 100.000 personas por año1. Si aplicamos esta incidencia a la población española en 2015 (según datos del Instituto Nacional de Estadística), serían esperables un total de 4.140 casos de hemorragias subaracnoideas anuales en el ámbito nacional para una población estimada de 46 millones de habitantes.
Sin embargo, no existen verdaderos datos epidemiológicos generales sobre la incidencia de esta enfermedad en nuestro país, aunque sí existen datos parciales referidos a alguna comunidad autónoma en concreto. Según los cálculos del Grupo de Patología Vascular de la Sociedad Española de Neurocirugía, la incidencia de la HSA es menor que en otros países de nuestro entorno, ya que no supera los 5 casos anuales por cada 100.000 habitantes.
La incidencia de HSA aneurismática por debajo de los 20 años de edad es realmente muy baja, pero posteriormente se incrementa de forma progresiva, hasta alcanzar un máximo entre la cuarta y la quinta década de la vida. En la diversa literatura recogida hasta el momento, a nivel general, la mitad de los pacientes que presenta HSA tiene una edad inferior a 55 años en el momento del diagnóstico1.
Sin embargo, en nuestro medio, según la base de datos del Grupo de Patología Vascular de la Sociedad Española de Neurocirugía, el 66% del total de pacientes que presentan un episodio de HSA son mayores de 55 años. De igual manera, cabe destacar, si consideramos la diferencia establecida por sexos, que existe una mayor incidencia en mujeres (entre 1,2 y 4,5 veces mayor que en varones), especialmente en el grupo de edad definido a partir de los 55 años.
La prevalencia de población portadora de aneurismas intracraneales «no rotos» varía enormemente entre los diferentes estudios. Según la publicación más exhaustiva, dicha prevalencia en la población adulta es de aproximadamente el 2%. En un 20-35% de los casos de las personas portadoras de aneurismas existe la posibilidad de tener aneurismas múltiples1.
Aproximadamente, un 15% de los pacientes con HSA fallecen antes de recibir atención médica. Se ha descrito que la mortalidad acumulada de la HSA aneurismática durante el primer día es del 32%, se eleva al 46% durante la primera semana, asciende al 56% durante el primer mes y alcanza el 60% durante los primeros 6 meses3. Diversos factores influyen en la evolución de los pacientes con HSA. Entre ellos destaca la situación neurológica inicial postsangrado, ya que el evento hemorrágico inicial es el causante de las mayores cifras de mortalidad2.
De hecho, aquellos pacientes que se mantienen en «buen grado clínico» en las principales escalas de valoración durante los 3 primeros días tienen un 80% de probabilidades de sobrevivir durante los 2 próximos años, mientras que en aquellos que lo consiguen durante 7 y 21 días las probabilidades se incrementan hasta el 95%. El vasoespasmo cerebral a distancia es la segunda mayor causa de mortalidad en pacientes que sobreviven al ictus inicial. Otras complicaciones frecuentes son la hidrocefalia, las crisis comiciales, la trombosis venosa profunda y el tromboembolismo pulmonar.
Tras las primeras horas posteriores al episodio inicial de HSA, hasta el 15% de los pacientes presentan deterioro del nivel de consciencia debido a resangrado. El episodio de resangrado se produce en las primeras 24h entre el 2 y el 7% de los pacientes y aproximadamente en el 15-20% se presenta durante las primeras 2 semanas. En aquellos pacientes que sobreviven al primer día, el riesgo de resangrado durante el primer mes se establece en un 30-50%, en el caso de que no reciban tratamiento, estabilizándose posteriormente en un 3% aproximado anual.
Más allá de un año, los datos de historia natural indican una tasa de resangrado constante. En diversas series se ha descrito una tasa de resangrado del 2,2% anual durante los primeros 10 años pasados los 6 primeros meses tras la hemorragia, descendiendo a un 0,86% anual a partir de la segunda década posterior al evento. El principal y determinante peligro del resangrado es que entre el 60 y el 75% de los pacientes que lo desarrollan fallecen por su causa3.
Una vez realizado el diagnóstico de HSA mediante tomografía computarizada (TC) y arteriografía cerebral, el paciente debe ser vigilado en Unidad de Cuidados Intensivos (UCI). El siguiente reto radica en el manejo clínico del paciente. Para prevenir los resangrados aneurismáticos, tanto la embolización endovascular como la cirugía de los aneurismas disminuyen la tasa de mortalidad y mejoran la calidad de vida de los supervivientes4. En 1937, Walter Dandy realizó la primera intervención quirúrgica, utilizando un clip vascular diseñado por Harvey Cushing, como tratamiento de los aneurismas cerebrales. Durante décadas el tratamiento óptimo («gold standard») fue el pinzamiento quirúrgico.
Sin embargo, desde finales de la década de los 80, cuando los coils de platino de Guglielmi fueron introducidos como técnica endovascular percutánea, para aquellos pacientes que no eran buenos candidatos para tratamiento quirúrgico, ha habido un creciente aumento en popularidad como método alternativo y menos invasivo que la cirugía abierta convencional. En 1995, su uso rutinario para la práctica clínica fue aprobado por la Food and Drug Administration de los Estados Unidos.
En el año 2000, Koivisto et al. publicaron el primer estudio prospectivo aleatorizado que comparaba los resultados de ambos tratamientos para la HSA aneurismática (tratamiento quirúrgico vs. embolización endovascular). Posteriormente, el ensayo clínico multicéntrico aleatorizado conocido como International Subarachnoid Aneurysm Trial (ISAT) comparó los resultados clínicos de ambos tratamientos2.
Los resultados del mismo fueron publicados por primera vez en 2002. El estudio mostraba una reducción estadísticamente significativa del grado de dependencia y de la tasa de mortalidad tras un año de la hemorragia a favor del tratamiento endovascular respecto al quirúrgico. Sin embargo, el estudio tiene sus limitaciones, ya que cabe destacar que los resultados del ISAT son aplicables a pacientes con un buen grado clínico posthemorragia (88% de los pacientes del estudio se encontraban en buena situación neurológica, grados i y ii de la escala de la World Federation of Neurologic Surgeons) con aneurismas localizados en la circulación anterior (93%) y de tamaño inferior a 10mm (92%). Algunas publicaciones posteriores han indicado que el hecho de generalizar estos resultados a todos los casos no es apropiado, ya que los pacientes que se encuentran en peor grado clínico, los de edad avanzada y los enfermos con aneurismas de arteria cerebral media y de circulación posterior se encuentran pobremente representados en este ensayo clínico5.
A pesar de todo, y como consecuencia de dichas conclusiones, desde la primera publicación del ISAT, la embolización endovascular se ha convertido en el método de elección para prevenir el resangrado, especialmente en Europa, reemplazando ampliamente a la cirugía. Dicho fenómeno también se ha dado en nuestro país, en contraste con la práctica habitual en los Estados Unidos, donde el tratamiento endovascular no se ha generalizado, e incluso se reserva solo para aquellos casos con peor pronóstico en determinados centros hospitalarios.
En muchos estudios se han empleado las escalas de Glasgow, tanto la escala para el coma como la escala evolutiva o pronóstica, como índices de resultado clínico del tratamiento de la HSA aneurismática6. Sin embargo, ambas escalas tienen una alta variabilidad interpersonal y son dependientes del estado clínico residual pretratamiento, por lo que no son universalmente aceptadas, con algunos interrogantes. El objetivo último, tanto de la cirugía como de la embolización, es evitar el resangrado7, manteniendo la mejor situación neurológica posible. El resultado final del tratamiento de la HSA también depende de los cuidados médicos del paciente, tales como las medidas antivasoespasmo, la profilaxis de crisis comiciales y el tratamiento de complicaciones asociadas, procedimientos bien descritos en gran número de protocolos5.
Los méritos relativos tanto del tratamiento quirúrgico convencional como de la embolización endovascular dependen tanto de su seguridad (riesgo de complicaciones médicas asociadas, estancia hospitalaria o integridad neurológica, entre otros), como de su capacidad para prevenir el resangrado1.
Planteamiento y objetivosLa HSA es una entidad clínica grave y representa una importante causa de mortalidad y morbilidad en los países industrializados, lo que constituye un esfuerzo, tanto a nivel humano como económico, muy importante1. Actualmente, los conocimientos de la fisiopatología intracraneal han avanzado mucho, pero todavía existen amplias lagunas en el entendimiento de la patogenia que limitan el desarrollo de un esquema terapéutico óptimo. Además, el modelo clínico de la HSA es multifactorial, tanto en términos clínico-patológicos como de tratamiento, por lo que resulta muy difícil determinar el efecto de una variable patológica o terapéutica en la evolución o el pronóstico final de los enfermos. Los progresos experimentados en el manejo y el tratamiento de los pacientes que presentan HSA han permitido una notable mejoría en el pronóstico5. Así, se ha conseguido disminuir el índice de mortalidad hasta en un 30%, sin incrementar el número de enfermos que quedan en estado vegetativo persistente o desarrollan incapacidad severa, según los criterios de la escala evolutiva de Glasgow, aunque este se mantiene todavía cercano al 40%. Actualmente, es necesario determinar los factores más influyentes en la evolución final para establecer modelos pronósticos y poder elaborar planes de actuación terapéutica y rehabilitación lo más eficaces posibles.
Considerando todo lo anteriormente expuesto, este trabajo intenta cumplir los siguientes objetivos:
- 1.
Reunir una serie amplia de pacientes que han presentado HSA y estudiar su perfil epidemiológico y forma de presentación clínica.
- 2.
Diseñar un esquema práctico de actuación clínica en estos pacientes, así como describir los factores de riesgo que determinan la probabilidad de desarrollar complicaciones en el grupo de pacientes que presentan HSA, estudiando los principales factores que influyen en la evolución clínica.
- 3.
Comparar el tratamiento quirúrgico convencional («clip») con la terapia de embolización endovascular («coil»).
- 4.
Analizar las distintas variables que pueden actuar sobre el pronóstico, determinando cuáles tienen mayor significación y diseñando un modelo de predicción pronóstica inicial y tardía.
El Hospital Universitario de Getafe comenzó a funcionar en el año 1991. Desde su puesta en funcionamiento, el hospital desarrolla actividades de mejora continua adoptando el modelo EFQM de excelencia. Ello ha permitido que se hayan certificado mediante la norma ISO 9001 diversos sistemas de gestión de la calidad en distintos ámbitos asistenciales y no asistenciales de la actividad diaria.
Asimismo, el trabajo de análisis de la realidad del hospital y la continua propuesta de acciones de mejora ha hecho que le fuese reconocido el Sello 400 de Excelencia en la Gestión en 2009 y el Sello 500+ en 2011, siendo el primer hospital público de España en conseguirlo.
Desde 2012, el hospital cuenta también con un sistema de gestión ambiental certificado con la Norma ISO 14001 que se enfoca, principalmente, en el uso eficiente de los recursos energéticos y en la adecuada segregación de residuos con el fin de ser más respetuosos con el ambiente.
En la actualidad, el Hospital Universitario de Getafe dispone de unas 620 camas y de unos 2.482 trabajadores. El Servicio de Neurocirugía ofrece cobertura a una población asignada de unos 850.000 habitantes.
Se ha realizado un estudio retrospectivo, de revisión de historias clínicas, de los pacientes que presentan HSA aneurismática tratada en el Hospital Universitario de Getafe desde el año 1995 hasta el 2015.
Los criterios de inclusión han sido:
- 1.
HSA espontánea.
- 2.
Aneurisma de arterial cerebral.
- 3.
Tratamiento del aneurisma, bien mediante pinzamiento quirúrgico clásico o bien mediante embolización endovascular.
Los criterios de exclusión han sido:
- 1.
HSA traumática o «no filiada» (no aneurismática).
- 2.
Pacientes que ingresan para tratamiento de aneurismas arteriales cerebrales asintomáticos («no rotos» o aneurismas incidentales).
- 3.
Pacientes tratados en otros centros.
- 4.
Pacientes en los que se decidió no efectuar tratamiento.
- 5.
Historia y/o datos incompletos.
Con la revisión de las historias clínicas se han recogido los siguientes datos:
- 1.
Edad, sexo y fecha de ingreso.
- 2.
Situación clínica al ingreso según la escala de Glasgow para el coma.
- 3.
Antecedentes médicos (hipertensión arterial esencial, diabetes, cardiopatías, enfermedades respiratorias o renales, tabaquismo y otros hábitos tóxicos).
- 4.
Hallazgos en la TC de ingreso, confirmación de la HSA y medición del volumen de sangre, con software específico aportado por el Servicio de Radiodiagnóstico.
- 5.
Valoración de la arteriografía cerebral, estudiando el número de aneurismas y la localización específica de los mismos.
- 6.
Tipo de tratamiento realizado (pinzamiento quirúrgico clásico vs. embolización endovascular), fecha del mismo y si se ha requerido nuevo retratamiento.
- 7.
Fecha de ingreso en UCI, fecha de alta de UCI, fecha de alta de la planta de Neurocirugía.
- 8.
Morbilidad y complicaciones asociadas.
- 9.
Desarrollo de resangrado y fecha del mismo, en su caso.
- 10.
Evolución final al alta hospitalaria y con entrevista telefónica en el tercer trimestre del 2015, según la escala pronóstica de Glasgow.
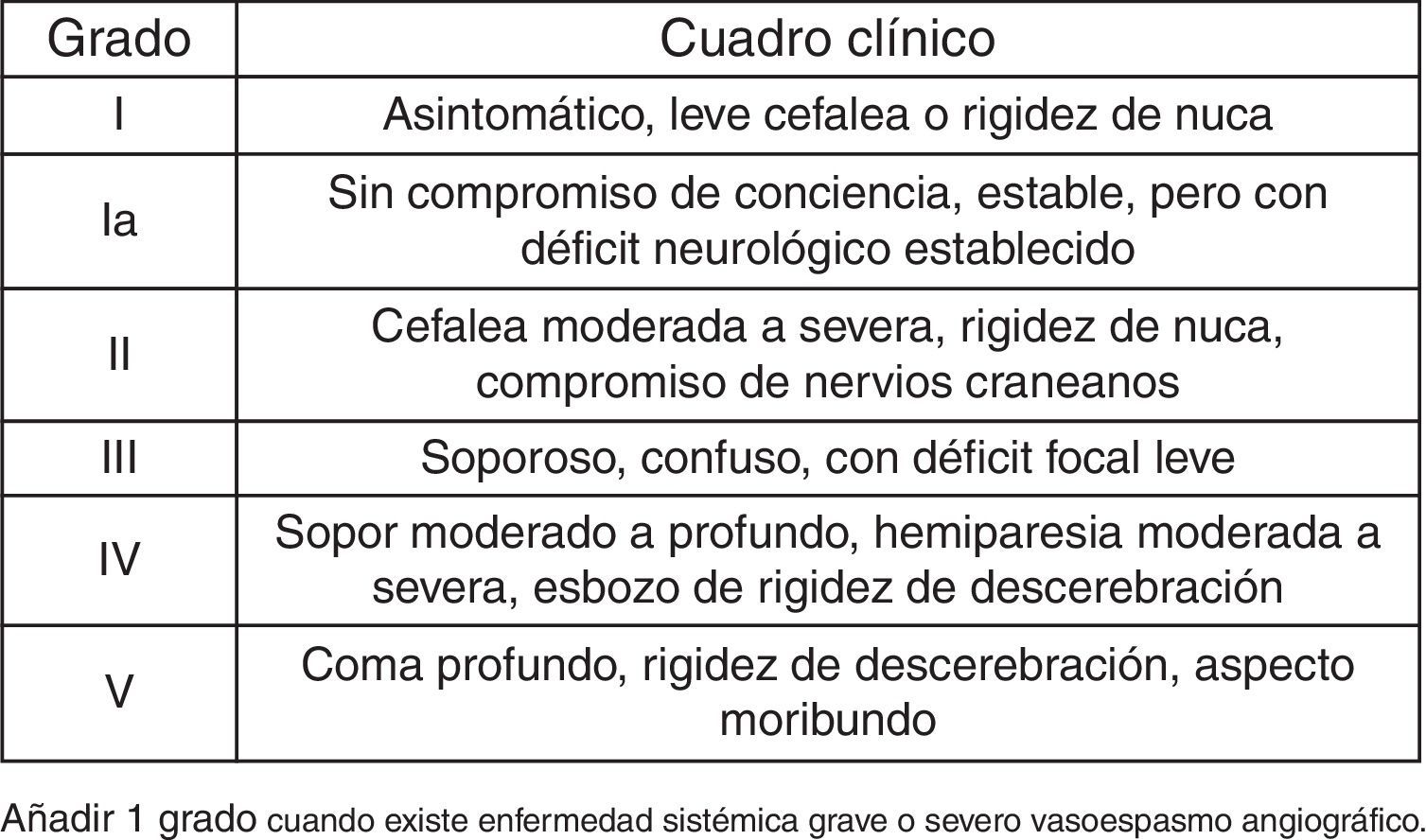
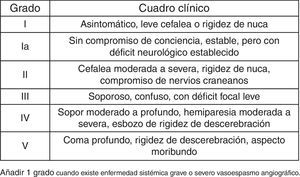
Con los datos obtenidos en el trabajo se han calculado la incidencia de HSA en relación al área sanitaria dependiente del Hospital Universitario de Getafe, la estancia hospitalaria global, la estancia en la UCI, el número de ingresos hospitalarios por paciente en el Servicio de Neurocirugía, el número de reingresos precisados en planta, el número de reingresos en UCI, el tiempo de demora entre la HSA y el tratamiento, y la estancia hospitalaria postratamiento. Se han agrupado las localizaciones aneurismáticas en arteria comunicante anterior, comunicante posterior, carótida interna, cerebral media, circulación cerebral posterior u otros. Se ha medido el volumen de sangre en la TC. Se han utilizado las escalas de Fisher (fig. 3) y de Hunt y Hess (fig. 4).
Se han comparado ambos tratamientos según la estancia hospitalaria global media, el número de ingresos medio por paciente, el número de pacientes que han reingresado, la estancia media en la UCI, el tiempo de demora entre la HSA y el tratamiento, el número de pacientes con morbilidad postratamiento, el número de pacientes que han precisado retratamiento, el número de pacientes que han desarrollado resangrado y la evolución final, como resultado «bueno» (buena recuperación o incapacidad moderada) o «malo» (incapacidad grave, estado vegetativo persistente o defunción).
El interés por obtener predicciones pronósticas tempranas de alta fiabilidad ha llevado a desarrollar un gran número de modelos estadísticos para intentar anticipar la evolución de una situación clínica determinada. La mayoría de ellos han utilizado diversos parámetros valorados en las fases clínicas tempranas, aunque la fiabilidad aumenta si se consideran datos obtenidos más tardíamente.
Los primeros modelos se basaban en pruebas fundamentadas en el teorema de Bayes para calcular la evolución combinando diversos factores, pero estas pruebas ignoran la interdependencia entre los mismos. Posteriormente, se introdujo la regresión lineal logística, la más utilizada actualmente, que valora la influencia de diversas variables sobre un modelo previamente establecido, en general buena o mala evolución, posibilitando la realización de una escala de factores pronósticos, y mediante diversos modelos matemáticos, un índice de fiabilidad pronóstica. La regresión lineal permite elaborar un modelo clasificador de los diversos indicadores evolutivos.
Con estos modelos se ha conseguido una fiabilidad pronóstica que oscila entre el 30 y el 90%, dependiendo de si se emplean precoz o tardíamente, siempre considerando previsiones falsamente optimistas para no interferir en las posibles medidas terapéuticas que pudieran aplicarse al enfermo.
Para la estadística descriptiva se han utilizado los parámetros más usuales, como son medias, porcentajes, desviaciones típicas, proporciones y otros. La evolución final del paciente con HSA se ha determinado en el momento de su alta hospitalaria y mediante entrevista telefónica posterior. Dentro del capítulo de la estadística analítica, para el estudio bivariable se han empleado las pruebas de la chi al cuadrado, el coeficiente de correlación de Spearman, la «t» de Student y la prueba exacta de Fisher.
El límite de significación estadística se ha establecido en un intervalo de confianza del 95% (p<0,05). Se ha utilizado el paquete estadístico IBM SPSS 22.0 (IBM Corp. Released 2013. IBM SPSS Statistics for Windows, Version 22.0. IBM Corp. Armonk, NY, EE. UU.). El estudio multivariable se ha realizado mediante el método de regresión lineal por máxima verosimilitud.
La predicción pronóstica se calcula mediante las siguientes fórmulas:
En estas, p es el valor de probabilidad de aparición de la variable objetivo considerada en su forma dicotómica; A, B, C… son los valores de las variables que entran en el modelo; a, b, c… son los coeficientes otorgados a dichas variables, y k es un valor constante o término independiente.
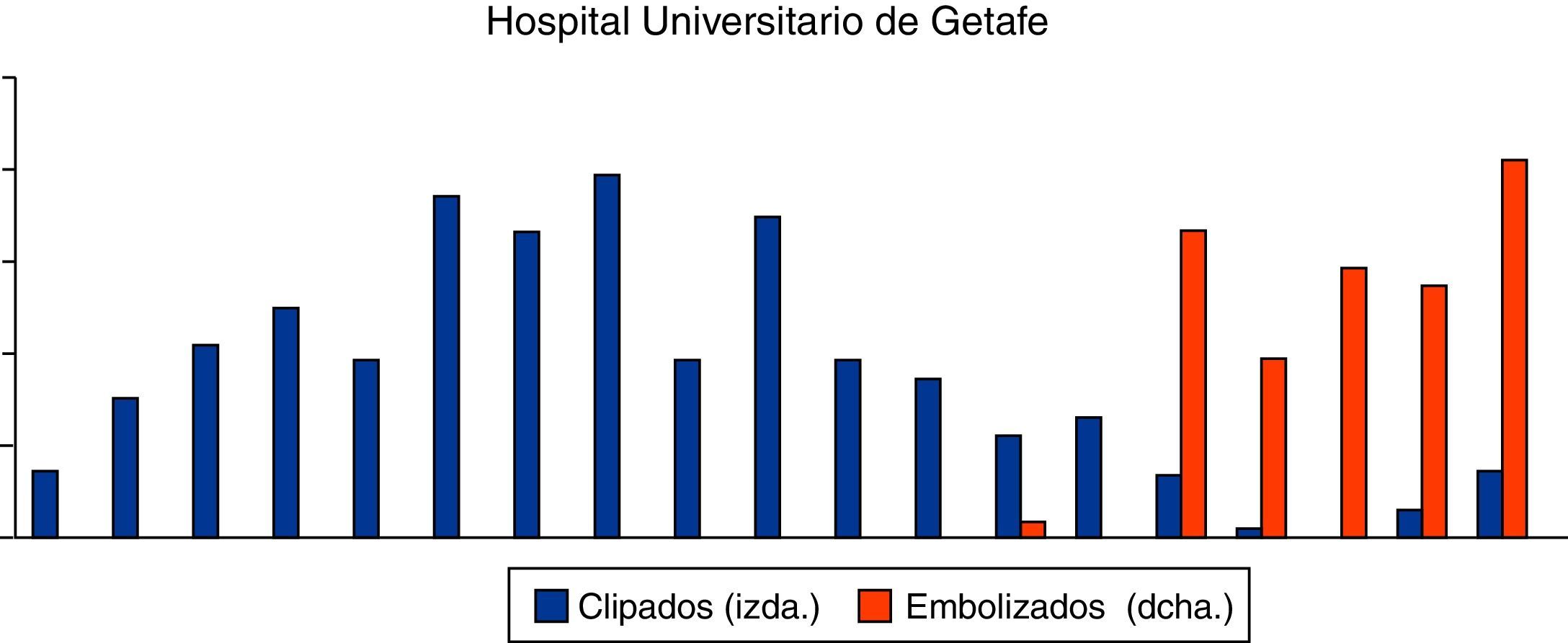
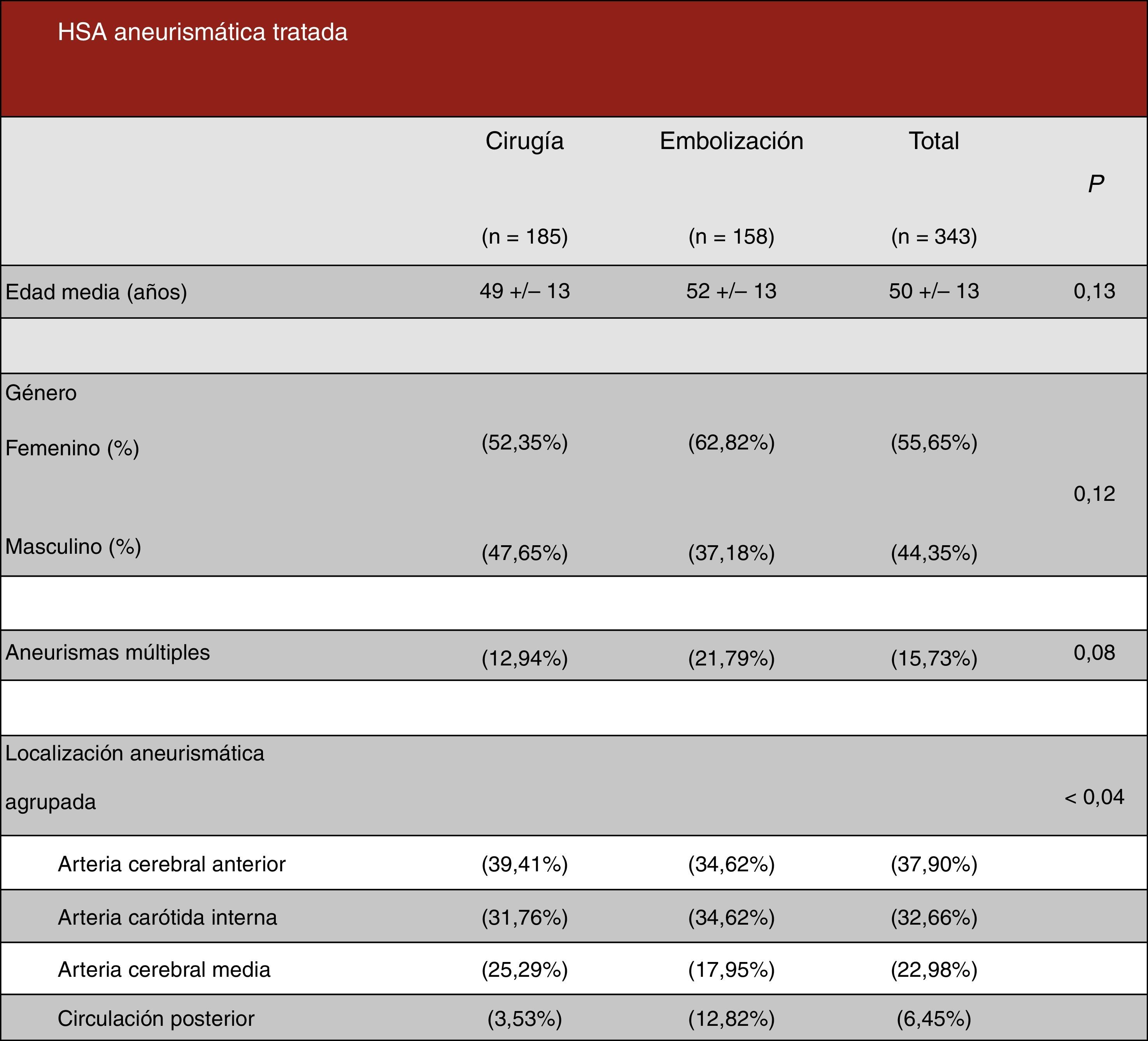
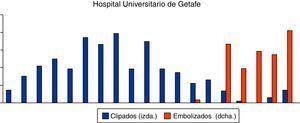
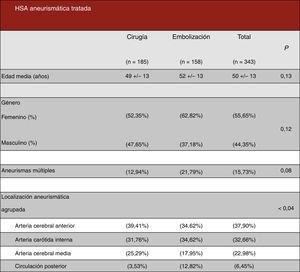
ResultadosEpidemiología descriptivaSe han revisado 494 historias clínicas, siendo excluidos 151 pacientes debido a que o no cumplían criterios de inclusión o cumplían criterios de exclusión, por lo que finalmente en este estudio se han analizado los datos de 343 pacientes con HSA aneurismática. De ellos, 185 han sido tratados mediante cirugía y 158 con embolización endovascular (figura 5, en azul los pacientes intervenidos quirúrgicamente, y en rojo los casos embolizados). Se ha evidenciado presencia de aneurismas múltiples en el 15,73% de los pacientes (clipados=12,94% vs. embolizados=21,79%). Del total de 343 pacientes, fueron 191 mujeres (55,65%) y 152 varones (44,35%). El rango de edad comprende de 14 a 82 años con una edad media de 50±13 años. La incidencia anual media estimada en el estudio ha sido de 1,84±0,63 por cada 100.000 habitantes por año (considerando el área sanitaria subsidiaria de este centro como de 850.000 habitantes).
No se han encontrado diferencias estadísticamente significativas en ambos grupos en relación con la edad media al ingreso (pinzados=49 años vs. embolizados=52 años, p=0,13), el porcentaje de mujeres (pinzados=52,35% vs. embolizados=62,82%, p=0,12) y la presencia de aneurismas múltiples (pinzados=12,94% vs. embolizados=21,79%, p=0,08). Se han encontrado diferencias estadísticamente significativas (p<0,04) en la localización aneurismática agrupada.
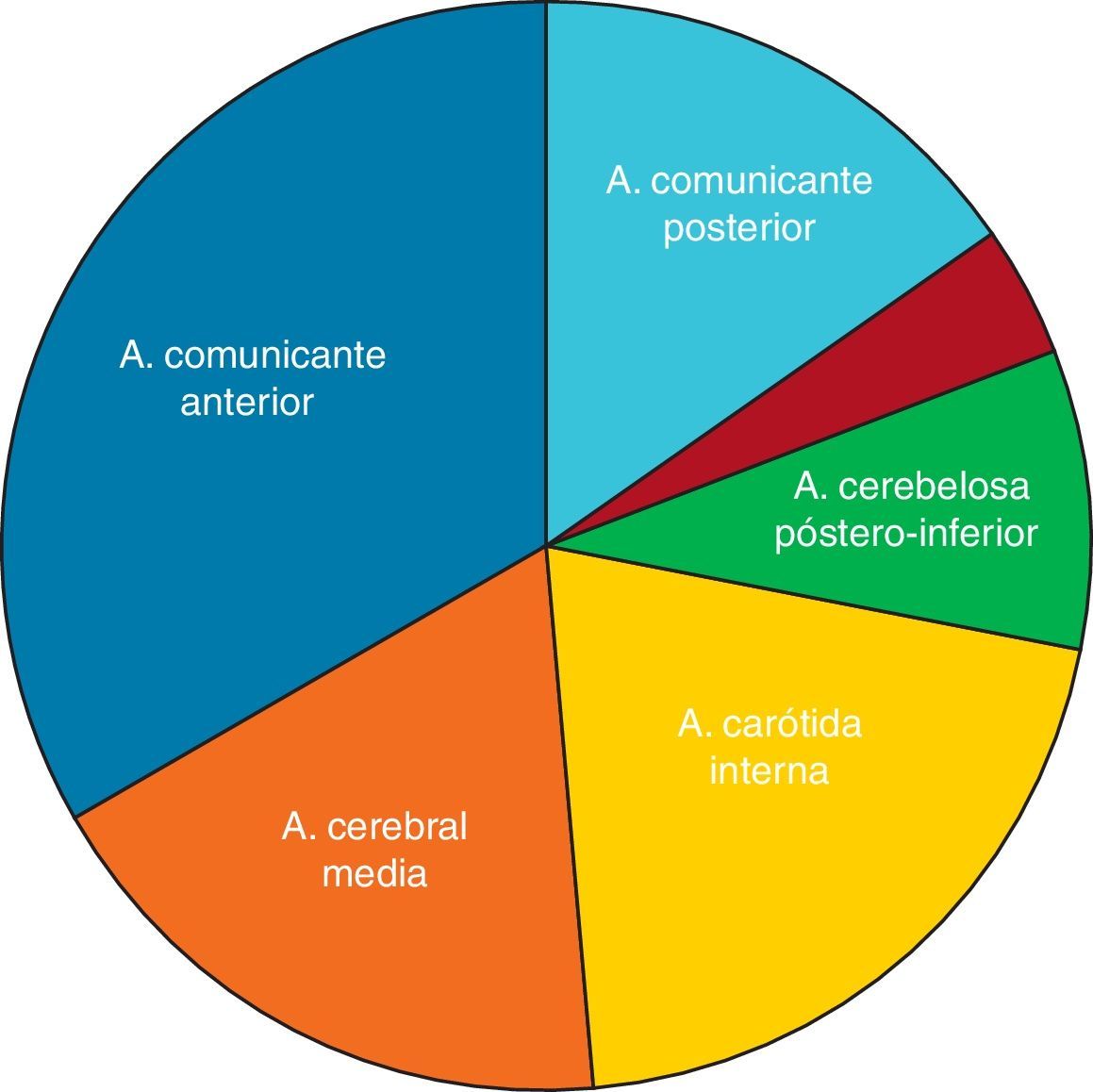
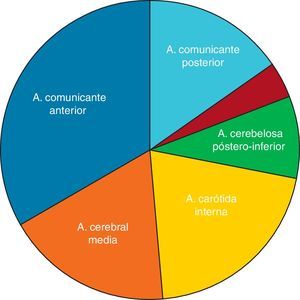
Las localizaciones específicas de los aneurismas cerebrales rotos tratados en nuestro centro han sido, por orden de frecuencia: arteria comunicante anterior (pinzados quirúrgicamente=35,88% vs. embolizados por vía endovascular=33,33%), arteria cerebral media (pinzados 25,29% vs. embolizados 17,95%), arteria comunicante posterior (pinzados 23,53% vs. embolizados 20,51%), arteria carótida interna (pinzados 7,06% vs. embolizados 8,97%), arteria cerebelosa póstero-inferior (PICA) (pinzados 2,94% vs. embolizados 3,84%) y otras localizaciones (pinzados 5,24% vs. embolizados 15,38%). Estos datos se encuentran reflejados en la figura 6.
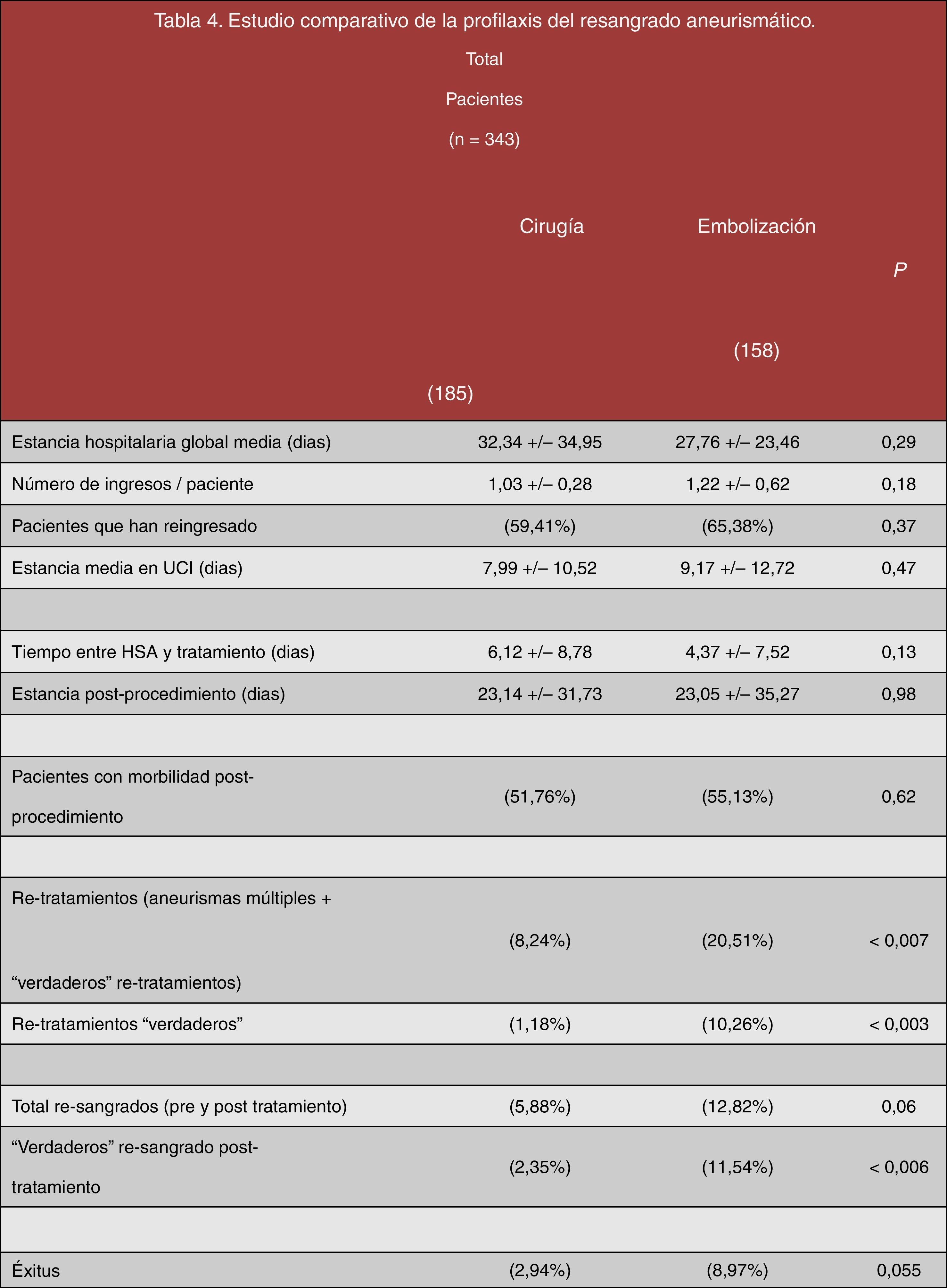
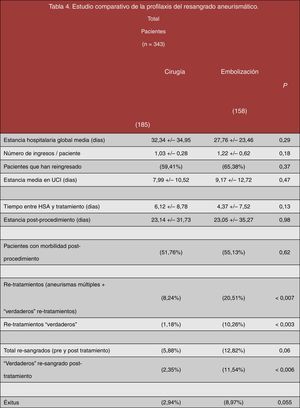
Al comparar ambos tratamientos no se han encontrado diferencias estadísticamente significativas en la estancia hospitalaria global media (pinzados=32 días vs. embolizados=28 días, p=0,29); el número de ingresos realizados por paciente (pinzados=1,03 ingresos/paciente vs. embolizados=1,22 ingresos/paciente, p=0,18); el número de pacientes que han precisado reingreso (pinzados=59,41% vs. embolizados=65,38%, p=0,37); la estancia media en la UCI (pinzados=8 días vs. embolizados=9 días, p=0,47); el tiempo transcurrido entre la HSA y el tratamiento (pinzados=6 días vs. embolizados=4 días, p=0,13); la estancia postoperatoria (pinzados=23 días vs. embolizados=23 días, p=0,98) y la morbilidad que se desarrolló posterior a ambos procedimientos (pinzados=55,76% vs. embolizados=51,13%, p=0,62) (véanse los datos estadísticos recogidos en la figura 7 y las imágenes ilustrativas de la figura 8).
Un total de 45 pacientes han precisado retratamiento. De ellos, 30 han sido debidos a presencia de aneurismas múltiples. Pero solo 15 de ellos han requerido «verdadero» retratamiento en el aneurisma inicial. Se han encontrado diferencias estadísticamente significativas en relación con el número de pacientes que precisaron retratamiento (tanto por aneurismas múltiples como por «verdadero» retratamiento), siendo el grupo endovascular aquel que más porcentaje de pacientes ha precisado retratamiento (pinzados=8,24% vs. embolizados=20,51%, p<0,007).
Al excluir los retratamientos debidos a aneurismas múltiples (incidentales), se mantienen las diferencias significativas, mostrando un mayor porcentaje de pacientes que han precisado un «verdadero» retratamiento entre los pacientes previamente embolizados (pinzados=1,18% vs. embolizados=10,26%, p<0,003). A pesar de todo, no se debe olvidar que la «n» comparada en este caso es bastante pequeña y que el tamaño de la muestra puede no tener suficiente potencia estadística.
Un total de 30 pacientes han desarrollado resangrado. De ellos, 14 enfermos presentaron resangrado pretratamiento y 16 postratamiento. Todos ellos fueron secundarios a resangrado de los aneurismas iniciales, aunque en 9 de ellos coexistían aneurismas incidentales múltiples a distancia.
Analizando el total de resangrados, si bien no se alcanzaron diferencias significativas entre ambos procedimientos, los resultados muestran una mayor tendencia al resangrado en el grupo de embolizados (pinzados=5,88% vs. embolizados=12,82%, p=0,06). Esta tendencia alcanzó la significación estadística al excluir a los pacientes que habían sangrado antes del tratamiento y analizar los que verdaderamente resangraron postratamiento (pinzados=2,35% vs. embolizados=11,54%, p<0,006), si bien es cierto que la muestra es pequeña, por lo que esta característica queda pendiente de confirmación.
No se han encontrado diferencias estadísticamente significativas en relación con el porcentaje de defunciones hospitalarias entre los pacientes tratados en nuestro centro, aunque hay una tendencia a un mayor porcentaje de fallecimientos entre los pacientes intervenidos quirúrgicamente (pinzados=8,97% vs. embolizados=2,94%, p=0,055) (fig. 9).
Estudio analítico de los resultadosLas variables que demostraron significación estadística (p<0,05) en el resultado final fueron:
- –
la edad,
- –
la hipertensión arterial,
- –
la diabetes,
- –
el tabaquismo,
- –
la situación neurológica al ingreso, y
- –
la cantidad de sangre encontrada en la TC.
Sin embargo, en el estudio multivariable, los factores más decisivos en el pronóstico final (p<0,05, Marginal Proportion of Explained Variation 16,56; Partial Proportion of Explained Variation 3,28) son solo 3, por este orden:
- 1.
Situación clínica y neurológica al ingreso, según la escala de Glasgow para el coma.
- 2.
Volumen de la HSA (a partir de 22ml el pronóstico empeora claramente).
- 3.
Edad del paciente (peor pronóstico en mayores de 55 años).
En el presente estudio tenemos 2 grupos de pacientes, que podrían agruparse en aquellos intervenidos quirúrgicamente y en los pacientes con aneurismas embolizados. Según los datos obtenidos, ambos grupos de tratamiento son homogéneos, uniformes y comparables, aunque se pueden observar diferencias significativas en la localización aneurismática.
Para el tratamiento se siguieron las guías clínicas aceptadas en cada momento. Asumimos que la situación neurológica de ingreso es equiparable en los 2 grupos, habiendo sido determinada por la escala de Glasgow, a pesar de la relativa subjetividad del observador. Los datos hallados en el estudio sobre edad a la que se presenta la hemorragia, distribución por sexo y presencia de aneurismas múltiples son superponibles a los publicados en la literatura científica.
La incidencia de HSA recogida es inferior a la esperable respecto a los datos publicados tanto en la literatura nacional como internacional1. Se sospecha que la causa de esta diferencia podría ser secundaria a un posible sesgo de selección, ya que uno de los criterios de exclusión es no recibir tratamiento quirúrgico o endovascular, o pacientes que han sido derivados a otros centros, debido a la dispersión del área sanitaria.
La distribución de las localizaciones aneurismáticas en la literatura es: arteria cerebral anterior 31-36%, arteria carótida interna 21-36%, arteria cerebral media 21% y circulación posterior 6-10%. Los casos tratados en el Hospital Universitario de Getafe muestran una tendencia a tener más pacientes intervenidos quirúrgicamente en el territorio de la arteria cerebral anterior y la arteria cerebral media, y más pacientes sometidos a embolización en el territorio de la circulación posterior. Esta tendencia es similar a la publicada en la literatura, tanto nacional como internacional4.
La estancia hospitalaria media de todos los pacientes tratados en este estudio (tanto hospitalaria global como en la UCI) supera con diferencia a la publicada tanto por el Grupo de Patología Vascular de la Sociedad Española de Neurocirugía, como por las series internacionales5. Dicho dato es posible que sea debido a que en este estudio se han recogido todos los reingresos originados tanto por complicaciones microquirúrgicas o del tratamiento endovascular, como los debidos a retratamientos o a arteriografías cerebrales de control.
Ninguna de las series de nuestro entorno con las que comparamos el presente estudio recoge dichos reingresos. Sin embargo, es interesante ver que se ha publicado que en determinados centros con un alto volumen de tratamiento de HSA se muestran estancias hospitalarias más largas4. Dichos estudios argumentan que este fenómeno podría ser debido bien a que agrupan a pacientes de mayor complejidad, o bien a que son centros menos «eficientes». Según la opinión de diversos autores, la posible causa de la larga estancia no es debida a ninguna de las anteriores teorías, sino a que la recogida de todos los reingresos penaliza en la estancia global media respecto a otros estudios, al igual que en nuestro trabajo.
La estancia media hospitalaria recogida en la literatura científica es 15-20 días y 14-17 días para los pacientes operados y embolizados, respectivamente. La gran mayoría de series encuentran diferencias estadísticamente significativas en las estancias hospitalarias, tendiendo a mostrar estancias más breves para los pacientes embolizados, si bien hay algunas series en que esto no queda claramente demostrado.
La estancia media en la UCI recogida en la diversa literatura analizada es de 1,8 y 1,7 días para los operados y embolizados, respectivamente. En el presente estudio se invierte la tendencia previamente publicada en la que los pacientes embolizados suelen tener una menor estancia en la UCI. Desafortunadamente, no disponemos de una muestra suficientemente grande de pacientes intervenidos como para poder asegurar dicha tendencia.
La estancia en la UCI suele reflejar el nivel de complejidad de los pacientes tratados. Muy probablemente, tanto el exceso de estancia en la UCI respecto a lo previamente publicado, como la inversión de las diferencias estadísticas, sean debidas a que los pacientes embolizados tengan un posible peor grado clínico postsangrado y pretratamiento respecto a los pinzados, por las propias indicaciones de las guías clínicas.
En relación con el tiempo de demora entre la hemorragia y el tratamiento, no ha habido diferencias estadísticamente significativas en el presente estudio, aunque sí hay una tendencia a tener periodos más largos para la cirugía. Esta tendencia concuerda con la descrita en la literatura, aunque en ella los periodos son más breves y sí se encuentran diferencias estadísticas (2,58 y 1,48 días para operados y embolizados, respectivamente [p<0,01]). Además, en el ISAT también se confirman estos datos; el periodo entre diagnóstico y tratamiento ha sido mayor para la cirugía, teniendo una media de 1,7 días para la cirugía y de 1,1 días para la embolización (p < 0,0001). Esto podría explicar por qué en el presente estudio, entre los pacientes operados, se ha evidenciado una mayor tendencia al resangrado prequirúrgico, al igual que sucedió en el ISAT, sin que resulte estadísticamente significativo debido a los pocos pacientes intervenidos.
Debido a que la valoración de la morbilidad de los tratamientos no era el objetivo primario de este estudio, se ha contabilizado la misma como presente o ausente indistintamente del tipo de morbilidad asociada. Por ello, no se ha distinguido entre complicaciones como el vasoespasmo posprocedimiento, el resangrado, la infección, la trombosis venosa profunda u otras. Teniendo en cuenta esto, el número global de complicaciones es similar en ambos tipos de tratamiento. En la revisión de la literatura encontramos que es un tema altamente controvertido y hallamos resultados enormemente dispares según los diferentes estudios publicados y las preferencias de tratamiento quirúrgico o embolizador de los distintos centros neuroquirúrgicos7,8.
En relación con los retratamientos, hay uniformidad de criterio en toda la literatura, siendo nuestros resultados superponibles a la misma. En los estudios en los que se valora el retratamiento para los aneurismas rotos embolizados se describe una tasa entre el 7 y el 13%. Aunque hay alguna serie en la que dicha tasa llega a alcanzar el 71%, estos resultados están probablemente sesgados.
En el ISAT los pacientes con aneurismas embolizados mostraron diferencias estadísticamente significativas, precisando retratamiento en más ocasiones que los intervenidos quirúrgicamente. Las tasas de retratamiento tanto en el ISAT como en otras publicaciones son superponibles, siendo 3,4-3,8% para los operados vs. 12,5-17,4% para los embolizados. En este estudio ha habido una mayor tasa de resangrado entre los pacientes embolizados. En la literatura se confirma esta tendencia, mostrándose una significativa mayor tasa de resangrado entre los pacientes embolizados, siendo la tasa de resangrado posquirúrgico del 1-3% y la postembolización del 1,27-3,3%, con un riesgo relativo de resangrado del 0,1-2% para los pacientes embolizados8.
En diversas series publicadas en la literatura la tasa de mortalidad intrahospitalaria se encuentra en torno al 25%, siendo del 2-25% la correspondiente a la posquirúrgica y del 2-6% la de la postembolización9. No obstante, siguen existiendo grandes diferencias (hasta un 20%) entre la supervivencia descrita en series hospitalarias y en series poblacionales generales.
En el ISAT la mortalidad global intrahospitalaria ha sido inferior a la publicada previamente (6% en ISAT vs. 26% en EE. UU.). En el presente estudio no ha habido diferencias estadísticas en relación con la mortalidad intrahospitalaria tras HSA tratada, aunque se ha dado una tendencia a un mayor porcentaje de fallecimientos entre los pacientes intervenidos, probablemente porque el grupo de estos pacientes es mucho menor. Llama la atención la relativa baja tasa de mortalidad en ambos grupos de tratamiento respecto a las cifras publicadas en la literatura. Estos resultados podrían deberse al posible sesgo de selección previamente comentado.
Los pacientes de muy mal grado clínico no se suelen tratar debido a que es extraordinario poder cambiar la historia natural de la enfermedad cuando se encuentran en ese estado.
Debido a ese motivo, el peso específico que aportan estos pacientes a la mortalidad en este tipo de estudios es bastante importante. Por ello, con la exclusión de los pacientes no tratados se ha obtenido una significativa mejoría en la mortalidad.
Dado el sesgo de selección demostrado por la baja incidencia de la HSA y la baja tasa de mortalidad, junto a la pequeña muestra de pacientes intervenidos en nuestro estudio, se podría argumentar que las conclusiones sobre el resangrado pierden su validez estadística. Sin embargo, las tasas de resangrado no son diferentes de las que se encuentran en la literatura y el sesgo histórico de nuestro estudio en principio penalizaría a los pacientes operados, ya que estos son mucho menores.
Hay que tener en cuenta que en el Hospital Universitario de Getafe a lo largo de la última década se ha sustituido la cirugía convencional por la embolización endovascular. Estos resultados indican que la embolización endovascular es un excelente tratamiento para la HSA aneurismática, pero que no puede determinarse con rotundidad su indicación absoluta frente a la cirugía10. Por todo ello, cualquier toma de decisión en el tipo de tratamiento debería incluir una comparación del riesgo natural, con la eficacia, morbimortalidad asociada al procedimiento dependiendo de la localización, el tamaño y la morfología del aneurisma, sin olvidar la voluntad del paciente.
Como reflexión de futuro, los resultados quirúrgicos empeorarán a medida que el número de cirugías se vaya dividiendo entre un número creciente de neurocirujanos. Si el número de embolizaciones por radiólogo es significativamente mayor que el de pinzamientos quirúrgicos por neurocirujano, son esperables mejores resultados en el tratamiento endovascular debido a la diferencia en experiencia. Menor experiencia en la cirugía significa un aumento del riesgo quirúrgico.
En lo referente a los factores pronósticos, se establecen claramente criterios clínicos y radiológicos, según los estudios más recientes, que permiten la orientación de cara al tratamiento ideal, así como del momento oportuno o «timing», tan controvertido en el campo neuroquirúrgico. Es importante destacar lo novedoso de la medición del volumen de sangre en la TC, algo que condiciona claramente el resultado final. Los modelos de regresión logística nos permiten conocer, introduciendo las variables analizadas, el «teórico» pronóstico evolutivo final del paciente y, según esto, decidir cuál es el tratamiento ideal para cada paciente y el momento del mismo, siempre siguiendo los principios de «optimismo» lógicos que hacen que se administren todas las posibilidades terapéuticas válidas, aunque el enfermo se encuentre en una mala situación clínica y neurológica.
El presente estudio intenta describir nuestra experiencia en el manejo de la HSA aneurismática a lo largo de 20 años, periodo en el que se ha desarrollado la radiología vascular intervencionista en nuestro hospital, y según ha ido aumentando la destreza, el número de casos se ha incrementado, razón por la que durante varios años los criterios de selección no han sido uniformes. Al ser un periodo amplio, la muestra no es homogénea, pero permite sacar conclusiones interesantes y, sobre todo, describe la realidad vivida en nuestro servicio con los grandes cambios acontecidos en estos 2 decenios.
Conclusiones- 1.
La HSA es más frecuente en mujeres (1,2/1), predominando en pacientes cuyas edades oscilan entre 45 y 55 años. La incidencia en nuestro medio puede establecerse en 1,5 casos por 100.000 habitantes por año, por debajo de las cifras recogidas en estudios previos.
- 2.
En el manejo clínico de la HSA los enfermos pueden clasificarse en grupos, de acuerdo con los factores de riesgo que presentan, según la situación neurológica, los antecedentes médicos y las imágenes encontradas en la TC.
- 3.
Todos los enfermos deben ser examinados con TC, inmediatamente después de ser recibidos en el hospital, así como proceder a su ingreso en la UCI. La medición del volumen de sangre en la TC es útil, quedando demostrado que a mayor volumen de sangre, peor pronóstico.
- 4.
La escala de Glasgow para el coma y la escala evolutiva de Glasgow se relacionan bien con la situación clínica y el pronóstico final del paciente con HSA.
- 5.
El tratamiento endovascular mejora el pronóstico y la supervivencia global de los pacientes que presentan rotura aneurismática.
- 6.
Los parámetros más influyentes en el pronóstico final en los pacientes que presentan HSA son, por este orden, la situación neurológica al ingreso, la cantidad de sangre en la TC de cráneo y la edad.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl presente trabajo no ha recibido ninguna financiación.
Conflicto de interesesNo existen conflictos de intereses de los autores.
El presente trabajo es inédito, no ha sido enviado a ninguna otra revista para su publicación ni ha sido presentado en ningún congreso ni reunión científica.