Esta revisión pretende actualizar y resumir la evidencia disponible sobre los factores de riesgo ambientales que se han asociado a riesgo de enfermedad de Parkinson (EP) o de Alzheimer (EA) y discutir sus posibles mecanismos.
DesarrolloHay evidencia consistente de mayor riesgo de EP asociado a pesticidas y de mayor riesgo de EA asociado a pesticidas, hipertensión y colesterol en edad media, hiperhomocisteinemia, tabaco, traumatismo craneoencefálico grave y depresión. Hay evidencia débil de mayor riesgo de EP asociado a consumo elevado de leche en hombres, ingesta alta de hierro, anemia crónica y traumatismo craneoencefálico grave, y de mayor riesgo de EA asociado a ingesta elevada de aluminio en agua potable, alta exposición a redes eléctricas, DM e hiperinsulinemia, obesidad en edad media, consumo excesivo de alcohol y anemia crónica. Hay evidencia consistente de menor riesgo de EP asociado a hiperuricemia, tabaco y café, y de menor riesgo de EA asociado a consumo moderado de alcohol, ejercicio físico, terapia hormonal sustitutiva perimenopáusica y buena reserva cognitiva; hay evidencia débil de menor riesgo de EP asociado a mayor consumo de vitamina E, alcohol, té y AINE y a ejercicio físico vigoroso, y de menor riesgo de EA asociado a dieta mediterránea, café y consumo crónico de AINE.
ConclusionesDiversos factores ambientales contribuyen significativamente al riesgo de EP y EA. Algunos de ellos podrían actuar ya desde etapas tempranas de la vida o interaccionar con otros factores genéticos. Estrategias poblacionales de modificación de estos factores podrían potencialmente evitar algunos casos de EP o de EA.
The purpose of this review is to update and summarise available evidence on environmental risk factors that have been associated with risk of Parkinson disease (PD) or Alzheimer disease (AD) and discuss their potential mechanisms.
DevelopmentEvidence consistently suggests that a higher risk of PD is associated with pesticides and that a higher risk of AD is associated with pesticides, hypertension and high cholesterol levels in middle age, hyperhomocysteinaemia, smoking, traumatic brain injury and depression. There is weak evidence suggesting that higher risk of PD is associated with high milk consumption in men, high iron intake, chronic anaemia and traumatic brain injury. Weak evidence also suggests that a higher risk of AD is associated with high aluminium intake through drinking water, excessive exposure to electromagnetic fields from electrical grids, DM and hyperinsulinaemia, obesity in middle age, excessive alcohol consumption and chronic anaemia. Evidence consistently suggests that a lower risk of PD is associated with hyperuricaemia, tobacco and coffee use, while a lower risk of AD is associated with moderate alcohol consumption, physical exercise, perimenopausal hormone replacement therapy and good cognitive reserve. Weak evidence suggests that lower risk of PD is associated with increased vitamin E intake, alcohol, tea, NSAIDs, and vigorous physical exercise, and that lower risk of AD is associated with the Mediterranean diet, coffee and habitual NSAID consumption.
ConclusionsSeveral environmental factors contribute significantly to risk of PD and AD. Some may already be active in the early stages of life, and some may interact with other genetic factors. Population-based strategies to modify such factors could potentially result in fewer cases of PD or AD.
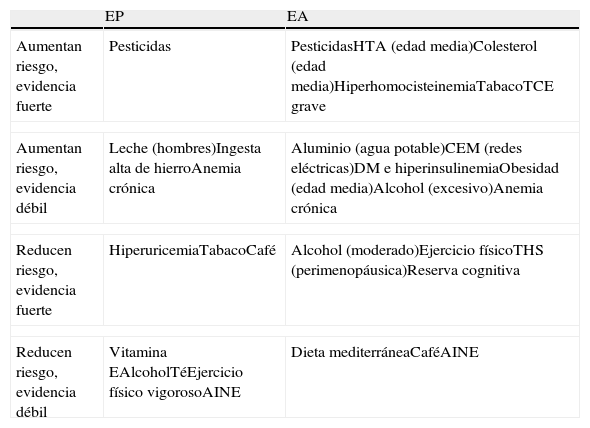
Las enfermedades neurodegenerativas más frecuentes son la enfermedad de Parkinson (EP) y la enfermedad de Alzheimer (EA). Una pequeña proporción de casos son atribuibles a mutaciones genéticas conocidas, cuyo descubrimiento está contribuyendo a conocer mejor su fisiopatología. Sin embargo, la gran mayoría se consideran debidas a la acción e interacción de diversos factores genéticos y ambientales, que actúan como factores de susceptibilidad o precipitantes. Numerosos estudios epidemiológicos han relacionado diversos factores ambientales con mayor o menor riesgo de padecer estas enfermedades. Estos trabajos son muy heterogéneos y han mostrado resultados más o menos consistentes en función del factor analizado y del diseño del estudio. El objetivo de este trabajo es revisar los factores de riesgo que se han asociado a EP y EA, su posible mecanismo fisiopatogénico, y sintetizar la evidencia disponible obtenida de la búsqueda bibliográfica en Medline de las revisiones sistemáticas y metaanálisis y los trabajos epidemiológicos más importantes publicados en los últimos 10 años. Los principales factores de riesgo para EP y EA se resumen en la tabla 1.
Factores de riesgo más importantes para EP y EA
| EP | EA | |
| Aumentan riesgo, evidencia fuerte | Pesticidas | PesticidasHTA (edad media)Colesterol (edad media)HiperhomocisteinemiaTabacoTCE grave |
| Aumentan riesgo, evidencia débil | Leche (hombres)Ingesta alta de hierroAnemia crónica | Aluminio (agua potable)CEM (redes eléctricas)DM e hiperinsulinemiaObesidad (edad media)Alcohol (excesivo)Anemia crónica |
| Reducen riesgo, evidencia fuerte | HiperuricemiaTabacoCafé | Alcohol (moderado)Ejercicio físicoTHS (perimenopáusica)Reserva cognitiva |
| Reducen riesgo, evidencia débil | Vitamina EAlcoholTéEjercicio físico vigorosoAINE | Dieta mediterráneaCaféAINE |
El interés por la relación entre pesticidas y EP deriva de la observación de parkinsonismo en usuarios de un opiáceo sintético contaminado con MPTP en los años 80. Los pesticidas inducen degeneración de las neuronas dopaminérgicas (DA) y por ello se usan en modelos animales de EP1. En los estudios de casos y controles (CC) la exposición a pesticidas en general se asocia a mayor riesgo de EP o no hay asociación, con un odds ratio (OR) combinado de 1,94 en un metaanálisis (MA) de 19 estudios CC, sin relación dosis-respuesta2. En 4 estudios prospectivos se halló una asociación consistente (riesgo relativo [RR] 1,7-1,9). Herbicidas e insecticidas por separado han mostrado mayor riesgo o no asociación, y fungicidas por separado, no asociación. Trabajar en agricultura, vivir en medio rural y consumir agua de pozo se han asociado a riesgo de EP solo en algunos estudios, y además no podemos asegurar que sean factores independientes pues suelen ir asociados entre ellos y con el uso de pesticidas1. En una revisión sistemática (RS) de 21 estudios CC y 3 estudios de cohortes3 también se observó una asociación consistente entre exposición a pesticidas y riesgo de EA. La evidencia de asociación entre exposición a pesticidas y mayor riesgo de EP y de EA es fuerte y no sería explicable solo por azar y por sesgos; a pesar de que muchas veces la exposición a pesticidas es baja, no se puede cuantificar bien y hay factores de confusión. Sin embargo, al tratarse de estudios observacionales, no se puede concluir que la relación sea causal. Además, el mecanismo de acción no se conoce con exactitud, y a pesar de disponer de modelos animales, las condiciones no son comparables pues las dosis y rutas de administración no son las mismas que en las personas expuestas.
MetalesSe ha descrito parkinsonismo por alta exposición a manganeso y también por plomo. En la sustancia negra (SN) de pacientes con EP se ha encontrado mayor cantidad de hierro, cobre y zinc que en controles1, y estos metales también están presentes en los depósitos amiloides4. Los metales participan en la formación de placas seniles y ovillos, así como en los procesos de oxidación, homeostasis del calcio y muerte neuronal. El aluminio es especialmente importante porque se ha relacionado epidemiológicamente con la EA, y es una neurotoxina que inhibe más de 200 funciones biológicas, puede inducir la formación de estructuras neurofibrilares y sus niveles están elevados en cerebros con EA. En la mayoría de los estudios epidemiológicos, basados principalmente en cuestionarios de exposición laboral a metales, no se ha hallado asociación entre exposición laboral a plomo, cobre, hierro, mercurio, zinc o manganeso y riesgo de EP1. En cuanto a la EA, estudios de baja calidad no han hallado relación con exposición a plomo ni aluminio3, pero sí con el consumo elevado de aluminio contenido en agua potable en 9 de 13 estudios, confirmada incluso en un estudio prospectivo a 15 años5. El aluminio del agua solo representa una mínima proporción del total ingerido, pero su absorción es mayor. Así, no hay evidencia convincente de que la exposición a metales cause EP o EA, y únicamente el consumo de agua con alta cantidad de aluminio se ha asociado a mayor riesgo de EA.
Disolventes y otros tóxicosLa exposición a disolventes puede ocasionar síntomas neuropsiquiátricos, y en un estudio con resonancia magnética espectroscópica se ha encontrado daño neuronal del núcleo lenticular en sujetos con alta exposición a disolventes hidrocarbonados6. Sin embargo, la gran mayoría de los estudios epidemiológicos no han mostrado asociación entre exposición laboral a disolventes y riesgo de EP o de EA1,3. Tampoco se ha hallado asociación consistente entre exposición a otros tóxicos y riesgo de EP en los escasos estudios en que se ha evaluado1.
Campos electromagnéticosEstudios epidemiológicos realizados en años recientes mostraron un aumento en la incidencia de leucemia en los niños más expuestos a repetidores de televisión o a líneas de alta tensión. El mecanismo biológico por el que los campos electromagnéticos (CEM) podrían ser peligrosos para la salud se desconoce y los estudios en animales han resultado negativos7. Una RS8 concluyó que no hay relación entre exposición laboral a CEM y riesgo de EP. En cambio, un MA de estudios muy heterogéneos mostró asociación con mayor riesgo de EA, tanto en 9 estudios CC (OR combinado 2,03) como en 5 prospectivos (RR combinado 1,62), especialmente en hombres expuestos a altos niveles (≥0,5μT) de CEM de frecuencia extremamente baja (líneas eléctricas)9. Además, un estudio reciente en Suiza encontró una mayor mortalidad asociada a EA en residentes a menos de 50m de líneas alta tensión, correlacionada con la distancia10.
ProfesionesDeterminadas profesiones podrían modificar el riesgo a través de exposición laboral a tóxicos, virus o la realización de mayor ejercicio físico o mental. Se ha descrito mayor o menor riesgo de EP en determinadas profesiones, pero con muchos factores de confusión y datos inconsistentes1. No hay estudios referentes a riesgo de EA.
Hipertensión arterialLa edad y los factores de riesgo vascular actúan sinérgicamente causando degeneración vascular, estrés oxidativo, disfunción mitocondrial y neurodegeneración11. Respecto a la posible asociación entre hipertensión arterial (HTA) y riesgo de EP, hay pocos estudios y los resultados no son consistentes. Un estudio CC12 mostró menor riesgo de EP (OR 0,43) en pacientes hipertensos, y un único estudio prospectivo con seguimiento medio de 18,8 años13 halló sin embargo un riesgo mayor (hazard ratio [HR] 1,62) y solo en mujeres hipertensas. En cambio, numerosos estudios muestran de forma bastante consistente que la HTA en la edad media de la vida (40-64 años) se asocia a mayor riesgo de EA (RR 1,61), pero no en la edad avanzada, en la que la hipotensión es la que se asocia a mayor riesgo de EA14,15. Estos resultados se han confirmado en RS de estudios prospectivos. En una revisión Cochrane y MA16 de 4 ensayos clínicos aleatorizados (ECA) en hipertensos no se observaron diferencias en la incidencia de demencia entre tratamiento con hipotensores y placebo tras un seguimiento medio de 3 años, pero el diseño no permitió evaluar su eficacia en la prevención de demencia. Otro MA de ECA halló una incidencia de demencia algo menor (HR 0,87) en pacientes tratados. En resumen, no hay evidencia consistente de asociación entre HTA y riesgo de EP. Hay evidencia consistente de que la HTA en la edad media (no en edad avanzada) se asocia a mayor riesgo de EA, pero no se ha podido confirmar que el tratamiento de la HTA reduzca la incidencia de EA15.
Diabetes mellitusLa diabetes mellitus (DM) puede influir en el riesgo de EP o EA por varios mecanismos: enfermedad cerebrovascular isquémica en el contexto de un síndrome metabólico, efectos tóxicos de la hiperglucemia sobre las neuronas y resistencia a la insulina que se asocia a hiperinsulinemia, que tiene efecto vasoactivo y afecta al metabolismo del amiloide beta (Aβ)11. No hay evidencia clara de asociación entre DM y EP: 5 estudios CC no mostraron asociación, y de 4 estudios prospectivos, 2 mostraron mayor riesgo de EP en DM, uno no asociación y otro menor riesgo1. En cuanto a la EA, hay evidencia de mayor riesgo en pacientes con DM y en sujetos con niveles altos de insulina incluso sin DM. De 8 estudios prospectivos, en 3 se halló mayor riesgo de EA en DM y en 5 no asociación (RR combinado 1,39)17. En el Cardiovascular Health Study se observó un efecto sinérgico con el alelo ApoE4. Así, en pacientes con DM tipo 2 (DM2) portadores de ApoE4 el riesgo de EA fue mayor que con cada factor de riesgo por separado, y superior al riesgo aditivo: RR 1,62 en DM2, RR 2,50 en portadores de ApoE4 y RR 4,99 en DM2+ApoE418. En el estudio WHICAP en mujeres, niveles altos de insulina se asociaron a mayor riesgo de EA (HR 1,7 cuartil superior vs inferior)19, y niveles altos de péptido C (marcador de hiperinsulinemia) se asociaron a mayor riesgo de demencia a 10 años en no diabéticas (OR 3,2 cuartil superior vs inferior)20. Ningún ECA ha analizado el efecto del tratamiento de la DM2 sobre la incidencia de EA21.
Colesterol y estatinasLas estatinas tienen propiedades antiinflamatorias y antioxidantes, reducen la formación de Aβ y tienen efecto protector de las neuronas DA en modelos animales. La hipercolesterolemia se asoció ligeramente a menor riesgo de EP en 3 estudios CC, mientras que en 4 estudios prospectivos solo se observó una ligera reducción del riesgo de EP en algunos subgrupos (por ejemplo, solo en mujeres o solo en hombres de 71-75 años con LDL elevado) e incluso en un estudio se observó un riesgo mayor en menores de 55 años22. Por otro lado, en estudios retrospectivos parece existir menor incidencia de EP en usuarios de estatinas. En el caso de la EA, sí que se ha observado una asociación consistente entre colesterol elevado en la edad media de la vida y mayor riesgo de EA, pero no en edad avanzada, según una RS de 18 estudios prospectivos23. En cambio, el uso de estatinas no reduce el riesgo de EA, según un MA de estudios CC y cohortes24, y 2 ECA también han demostrado que la administración de estatinas en edad avanzada no reduce el riesgo de EA25.
Índice de masa corporalLa obesidad es un factor de riesgo vascular y puede contribuir a los procesos neurodegenerativos. En un estudio longitudinal en mujeres, un mayor índice de masa corporal se asoció a menor volumen hipocampal26. Los escasos estudios que han analizado la posible relación entre índice de masa corporal y riesgo de EP han mostrado resultados conflictivos. En cuanto al riesgo de EA, un MA de 15 estudios prospectivos23 mostró que tanto el sobrepeso (RR 1,35) y la obesidad (RR 2,04) como el infrapeso (RR 1,96) en la edad media, pero no en edad avanzada, se asocian a mayor riesgo de enfermedad, como ocurre también con la HTA y la hipercolesterolemia.
DietaCiertos alimentos se han asociado a mayor o menor riesgo de EP en estudios CC, pero no hay ninguna asociación concluyente. Curiosamente, se ha observado un mayor riesgo de EP (RR 1,8 quintil superior vs inferior) asociado al consumo de leche solo en hombres en 2 estudios prospectivos. Se desconoce el motivo y no se ha observado con otros lácteos ni con el consumo de calcio y vitamina D1. En cuanto a la EA, diversos estudios prospectivos indican que en general la dieta mediterránea se asocia a un deterioro cognitivo más lento y a menor riesgo de EA, sin evidencia suficiente para hacer recomendaciones dietéticas específicas27,28. Los ácidos grasos omega-3 han mostrado efecto neuroprotector en modelos animales de EP29. Sin embargo, en un único estudio CC12 no se halló relación entre consumo de omega-3 y riesgo de EP. Dietas ricas en DHA, que tiene propiedades antioxidantes, reducen la patología amiloide y mejoran la cognición en modelos animales de EA30. Algunos estudios epidemiológicos sugieren que una mayor ingesta de pescado y omega-3 reducen el riesgo de demencia, pero los resultados son inconsistentes y a corto plazo. El estudio Rotterdam no mostró diferencias en cuanto a riesgo de EA en consumidores de pescado vs no consumidores tras una media de 10 años31. Una RS Cochrane no halló ECA que permitan confirmar o refutar la utilidad de los ácidos grasos omega-3 para prevenir la EA32. No se ha encontrado asociación entre la ingesta de determinadas vitaminas y minerales y riesgo de EP o de EA, excepto indicios de riesgo de EP levemente menor con una mayor ingesta de vitamina E y de riesgo de EP levemente mayor con una mayor ingesta de hierro en algunos de los estudios1. En general, los factores dietéticos no parecen tener un papel importante.
Ácido úricoEs un potente antioxidante y potencialmente neuroprotector. La hiperuricemia se asoció a menor riesgo de EP (RR 0,80) en un MA de 3 estudios prospectivos, y a una progresión clínica más lenta. La historia de gota también se asoció a menor riesgo de EP en un estudio CC (OR 0,69) y en uno prospectivo (RR 0,7). Está en marcha un ECA fase 2 con inopina, un precursor que aumenta los niveles de ácido úrico1. En cuanto a EA, estudios CC han mostrado resultados inconsistentes: los niveles de ácido úrico en suero o LCR pueden ser mayores o menores en pacientes con EA33.
HiperhomocisteinemiaLa homocisteína se considera neurotóxica, pues causa depleción de neuronas DA in vitro, induce alteraciones motoras en ratas, causa hiperaflujo de calcio intracelular, inhibe la neurogénesis hipocampal en adultos, causa disfunción de la barrera hematoencefálica, genera especies reactivas de oxígeno, activa la microglía, aumenta la fosforilación de APP y tau y aumenta el Aβ en plasma y cerebro. Su papel en la EP es incierto, pues la levodopa aumenta sus niveles. La hiperhomocisteinemia no se asoció a riesgo de EP en 3 estudios prospectivos34 pero sí a mayor riesgo de EA en 18 de 22 estudios prospectivos y varios CC35. La normalización de los niveles de homocisteína mediante la toma de complejo B en mayores sanos con niveles altos no mostró mejoría cognitiva en un estudio36.
TabacoLa nicotina estimula las neuronas DA, inhibe la formación de fibrillas de alfa-sinucleína y mejora los síntomas de la EP1. También puede mejorar la función cognitiva estimulando los receptores nicotínicos. Por otro lado, el tabaco acelera la atrofia cerebral, reduce la perfusión, aumenta el estrés oxidativo y ocasiona infartos silentes e inflamación. En autopsias de fumadores se han observado menos placas seniles pero más cambios neurofibrilares37. En la EP es el factor ambiental que ha mostrado una asociación inversa más consistente en estudios CC y prospectivos1, con menor riesgo de EP sobre todo en fumadores activos (RR 0,27-0,56 respecto a no fumadores) y también en ex fumadores (RR 0,5-0,80), y hay relación con la dosis y con el tiempo de cesación. Se ha sugerido que esta asociación podría deberse en parte a sesgos de información, a que los fumadores mueren antes y estarían infrarrepresentados entre los casos de EP prevalentes o a que los sujetos con EP son menos propensos a fumar por factores genéticos comunes. Sin embargo, en estudios de gemelos los no afectos fumaban más que los afectos, y los hijos de 2 padres fumadores tienen menos riesgo de EP que los de 2 padres no fumadores (RR 0,73). Varios ECA con parches de nicotina no han mostrado mejoría sintomática en pacientes con EP. En cambio, fumar se asocia a mayor riesgo de EA, con un OR 1,59 en fumadores activos vs no fumadores en un MA de 23 estudios prospectivos, sin diferencia entre ex fumadores y no fumadores37.
AlcoholEl alcohol puede contribuir al estrés oxidativo, y su exceso causa daño cognitivo temporal o permanente y se asocia a atrofia cerebral. Por otro lado, también ha mostrado un efecto neuroprotector y antioxidante en modelos animales de EP y en cultivos celulares38. En cuanto a riesgo de EP, la mayoría de los estudios CC y prospectivos han mostrado tendencia no significativa a menor riesgo con OR<1, especialmente con la cerveza1, y como ocurría con el tabaco, en un estudio de gemelos el individuo no afecto bebía más que el afecto. La asociación es más evidente en el caso de la EA. El consumo moderado de alcohol se asoció a menor riesgo de EA (RR 0,57) en un MA de 23 estudios longitudinales38, y en el Cardiovascular Health Study el consumo de 1-6 bebidas/semana se asoció a un menor riesgo de EA (OR 0,46 vs abstención), sin beneficio con un consumo mayor, y a un riesgo aumentado de EA con >14 bebidas/semana (OR 1,22). La mayoría de los estudios muestran beneficio con el vino, y algunos también con otros tipos de bebida. Así, es posible que el consumo de alcohol se asocie levemente a un menor riesgo de EP, sin descartar un efecto de confusión residual por tabaco o café, mientras que sí hay una clara asociación entre el consumo moderado de alcohol y un menor riesgo de EA. En conjunto, los estudios observacionales apoyan el consumo moderado de alcohol (≤1 bebida al día en mujeres y ≤2 en hombres) para reducir el riesgo de enfermedad cardiovascular y de deterioro cognitivo sin riesgo significativo de efectos adversos.
Café y téLos antagonistas de los receptores A2A de adenosina mejoran el parkinsonismo en modelos animales y en ECA. La cafeína es un antagonista A2A, y se considera neuroprotectora, pues puede bloquear la toxicidad por MPTP en modelos animales de EP1 y reducir la producción de Aβ en modelos de EA39. El té verde ha mostrado efecto antiapoptótico en modelos celulares. En la EP, casi todos los estudios han mostrado un efecto protector del café1 (RR 0,69 consumo vs no consumo), según un MA de 8 estudios CC y 5 prospectivos. Este beneficio desaparece en mujeres en terapia hormonal sustitutiva (THS) por una interacción. Respecto al té hay menos estudios, que en general han mostrado menor riesgo de EP o no asociación. En un estudio en Singapur, el consumo elevado de té negro se asoció a un menor riesgo de EP que persistió tras ajustar con cafeína, por lo que se cree que el beneficio se debe a otro componente. La evidencia es más débil para la EA, y apenas hay datos sobre el té. Una RS de 2 CC y 2 cohortes mostró menor riesgo de EA con el consumo de café, con gran heterogeneidad (RR combinado 0,7)40. En el estudio CAIDE, beber 3-5 tazas al día en la edad media se asoció a reducción del 64% en el riesgo de demencia o EA en edad avanzada.
Ejercicio físicoEl ejercicio físico mejora la conducta y la pérdida neuronal DA inducida por tóxicos en modelos murinos de EP, y mejora el aprendizaje, la neurogénesis, el volumen hipocampal y reduce la carga Aβ en modelos de EA, quizá por una mayor expresión de factores neurotróficos41. Los escasos estudios CC, sujetos a factores de confusión, en general no muestran asociación entre ejercicio físico y riesgo de EP. En 3 estudios prospectivos se observó un menor riesgo de EP (RR 0,7 quintil superior vs inferior de horas MET/semana) solo en hombres que realizaban ejercicio vigoroso. Ningún estudio ha hallado relación con ejercicio moderado o recreativo1. En cambio, la evidencia es bastante consistente para la EA. Una RS de 16 estudios prospectivos mostró menor riesgo de EA (RR 0,55) en los grupos de mayor vs menor actividad física, o bien mayor riesgo de EA (RR 1,82) en los sedentarios15. No se conoce si esta asociación se debe a que los que tienen mejor función cognitiva participan más, ni qué tipo de ejercicio es más beneficioso ni la duración e intensidad necesarios. Algunos ECA han mostrado que sujetos mayores sedentarios que empiezan a hacer ejercicio mejoran la velocidad de procesamiento mental, pero no se ha evaluado si ello reduce o retrasa la incidencia de EA.
InfeccionesEn 1963 se propuso la hipótesis infecciosa a raíz de la epidemia de encefalitis letárgica que ocasionó parkinsonismo a principios del siglo xx y que fue atribuida al mismo virus de la pandemia de gripe de 1918. Posteriormente se halló una mayor incidencia de EP entre los nacidos en los años de las pandemias de gripe entre 1890 y 1930. La exposición intrauterina a toxinas bacterianas induce pérdida de neuronas DA en ratas1, e incluso infecciones periféricas pueden acelerar la neurodegeneración activando microglía42. Estudios CC han analizado la presencia de anticuerpos contra diversos virus en suero y LCR, sin observar diferencias entre EP y controles en la mayoría de ellos1. En algunos estudios, el haber pasado el sarampión en la infancia se asoció a menor riesgo de EP, y la difteria o el crup, a mayor riesgo. En el caso de la EA, se han sugerido infecciones del sistema nervioso central o sistémicas por HSV1, C. pneumoniae y espiroquetas como posibles agentes etiológicos pero con evidencia muy limitada y poco consistente43. En ratones que inhalan C. pneumoniae se han observado depósitos de Aβ; también se acumula Aβ y tau fosforilada en neuronas infectadas por HSV-1 in vitro, y se han hallado anticuerpos y antígenos en áreas del cerebro afectadas por la EA44. En general, los datos disponibles no permiten afirmar que haya evidencia concluyente de relación entre infecciones y EP o EA.
Antiinflamatorios no esteroideosEn las enfermedades neurodegenerativas hay una respuesta inflamatoria, como causa o como consecuencia de la neurodegeneración. Los antiinflamatorios no esteroideos (AINE) protegen de la pérdida neuronal por MPTP en modelos animales de EP1, y reducen el acúmulo de Aβ y tau y mejoran la conducta en modelos murinos de EA45. Por otro lado, se ha hallado mayor cantidad de placas neuríticas en usuarios crónicos de AINE46. El uso prolongado de AINE se asoció a menor riesgo de EP en un MA de 3 cohortes (RR 0,74), y también en otro MA de 2 cohortes y 5 CC (OR 0,85 para AINE, OR 0,75 para ibuprofeno), sin evidencia de beneficio para el ácido acetilsalicílico1. Asimismo, el uso prolongado de AINE también se asoció a menor riesgo de EA en estudios prospectivos (RR 0,79) y no prospectivos (OR 0,51) según una RS47. Un MA mostró menor riesgo de demencia en usuarios de ibuprofeno o naproxeno, aunque no cuando el deterioro cognitivo se usaba como variable principal48. Diversos ECA con AINE o inhibidores COX-2 no han conseguido demostrar un efecto neuroprotector en pacientes con EA establecida. Recientemente, el estudio ADAPT49 ha mostrado que el uso prolongado de AINE (más de 2-3 años) reduce la incidencia de EA.
Traumatismo craneoencefálicoEl traumatismo craneoencefálico (TCE) puede desencadenar una cascada inflamatoria que interfiere en los mecanismos de reparación celular. La disrupción del transporte axonal produce acumulación de APP en animales y en seres humanos. Estudios autópsicos en sujetos con historia de TCE han hallado un aumento de placas seniles y ovillos neurofibrilares. Probablemente el TCE también reduce la reserva cognitiva50. En 9 estudios CC se halló mayor riesgo de EP (OR 1,4-11,7) en sujetos con antecedente de TCE, pero no en otros 13 estudios CC ni en los escasos estudios prospectivos1. Existe un sesgo de mayor tendencia de los pacientes con enfermedades crónicas a recordar pequeños TCE. Sin embargo, en estudios de gemelos los que tenían antecedentes de TCE tenían más riesgo de EP y el inicio de la enfermedad era más precoz. También se ha observado mayor riesgo de EA (RR 2,32-4,51) en soldados con antecedente de TCE grave, pero que no se ha confirmado en otros estudios48. El TCE leve no se asocia a EA.
Estrógenos y terapia hormonal sustitutivaEl β-estradiol reduce la depleción DA inducida por tóxicos in vitro y en modelos animales51. Esta depleción DA es menor en los animales hembra. Los estrógenos son antioxidantes, promueven el crecimiento y la supervivencia de las neuronas colinérgicas, el metabolismo no amiloidogénico de la APP y aumentan la actividad colinérgica52. La THS se ha asociado a menor riesgo de EP en algunos estudios, pero en la mayoría no51. En muchos de ellos no se ha valorado el tabaco u otros factores de confusión. Existe una interacción con la cafeína, que reduce el riesgo de EP pero en usuarias de THS lo aumenta1. Niveles elevados de estradiol se asociaron a un incremento del riesgo de demencia del 43% en mujeres en el estudio Rotterdam de seguimiento de enfermedades crónicas53. El uso de THS no ha demostrado un beneficio consistente sobre la cognición y el riesgo de demencia en mujeres mayores de 65 años.54. El efecto de la THS sobre el riesgo de EA depende de si se trata de estrógenos solos o combinados con progestágenos, y de la edad en que se usen. En el estudio WHIMS, en mujeres mayores de 65 años el riesgo de EA fue mayor (HR 1,76) con THS combinada (estrógenos y progestágenos), no se modificó con estrógenos solos y fue menor si se iniciaba el tratamiento unos años antes55, por lo que se cree que existe una ventana perimenopáusica en la que los estrógenos serían protectores y a partir de los 65 años aumentarían el riesgo56. Hay ECA en curso para confirmar dicha hipótesis.
Antagonistas de los canales de calcioLa activación mantenida de los canales de calcio en las células DA puede acelerar el envejecimiento y predisponer a la EP. En la EA, el Aβ altera los niveles de calcio en las neuronas, lo que a su vez acelera la agregación de Aβ. Algunas dihidropiridinas tienen una acción más selectiva sobre los canales de calcio de tipo L (LTCC), que están muy expresados en neuronas. En modelos animales, nimodipino protege de la neurotoxicidad por MPTP e isradipino protege de la degeneración DA. Otros antagonistas de los canales de calcio (ACC) como flunarizina o cinarizina pueden causar parkinsonismo al tener además un efecto antidopaminérgico57. Isradipino redujo el daño neurotóxico por Aβ en cultivos celulares y modelos animales58. Por otro lado, nimodipino, a pesar de su acción sobre los LTCC, estimula la secreción de Aβ por otra vía. Un estudio CC mostró menor riesgo de EP en consumidores de ACC, pero otro estudio CC y 2 estudios prospectivos no hallaron asociación59. Se está evaluando el efecto de isradipino en pacientes con EP. Algunos estudios epidemiológicos sugieren que los antagonistas de los LTCC reducen el riesgo de EA o frenan su progresión, pero grandes ECA con nimodipino no han mostrado beneficio en la EA. No hay evidencia consistente de que los ACC reduzcan el riesgo de EP o de EA.
AnemiaEn un estudio CC se observó mayor prevalencia de anemia crónica en pacientes con EP que en controles (OR 2). Una hemoglobina baja también se relacionó con mayor riesgo de demencia (HR 1,94) en 2 estudios prospectivos, y con mayor riesgo de demencia en mujeres en uno de 2 estudios CC60. Aunque se han sugerido varias hipótesis para intentar explicar la relación, existen pocos datos al respecto y no se pueden emitir conclusiones.
Alteraciones tiroideasEl cuadro clínico del hipotiroidismo puede confundirse con un parkinsonismo. Un estudio CC no halló asociación entre hipotiroidismo y EP61. Las hormonas tiroideas participan en la regulación de Aβ. La relación entre alteraciones tiroideas y riesgo de EA es compleja, y tanto el hipertiroidismo como, en menor grado, el hipotiroidismo subclínico, se han relacionado con mayor riesgo de EA62.
Reserva cognitivaUna buena reserva cognitiva permite funcionar a niveles normales a pesar de cambios neurodegenerativos. En una RS que incluyó 22 estudios longitudinales, el riesgo de demencia fue menor en sujetos con nivel alto de escolarización, logros ocupacionales, cociente intelectual alto y actividades de ocio mentalmente estimulantes (OR 0,54), y mayor en sujetos con reserva cognitiva baja (OR 1,85). Otra RS también halló mayor riesgo de EA en individuos con baja escolaridad en 13 estudios CC (RR 2,4) y en 6 cohortes (RR 1,59). En el proyecto Kungsholmen se conformó un índice con diferentes componentes sociales (estado marital, amistades, tener hijos, convivencia) y se observó un gradiente decreciente de riesgo de demencia a medida que el índice era mayor63. Intervenciones cognitivas en mayores sanos mejoran algunas medidas de función cognitiva a corto plazo según una RS Cochrane de 36 ECA, pero no se ha evaluado el efecto sobre el riesgo de EA de ninguna intervención concreta15.
Depresión y estrésEl antecedente de depresión y el número de episodios depresivos se asocian a mayor riesgo de EA en los estudios epidemiológicos, aunque no se conoce por qué mecanismo. También se ha sugerido que podría ser un pródromo de la enfermedad, pero es poco probable pues la depresión puede estar ya presente muchos años antes del inicio de la EA; además, en un estudio autópsico se observó que la presencia de depresión no modificaba el grado de patología ni la relación de la patología con la EA64. Asimismo, en otro estudio autópsico el estrés psicológico crónico se asoció a mayor probabilidad de demencia o deterioro cognitivo al final de la vida pero no a patología de tipo Alzheimer.65
Algunos polimorfismos (SNP) de genes relacionados con el metabolismo de la DA o de tóxicos externos parecen modular el efecto de algunos factores de riesgo. Sin embargo, en un estudio CC multicéntrico no se hallaron interacciones significativas entre SNP en 15 de estos genes y exposición a disolventes, pesticidas y metales66. En la EA la interacción gen-ambiente está menos estudiada4. En estudios epidemiológicos se han descrito interacciones entre el genotipo ApoE4 y colesterol, alcohol, tabaco y factores sociales.
Estudios experimentales en modelos animales de EP sugieren que algunos factores de riesgo ambientales podrían actuar ya en los primeros años de vida, o incluso en el embarazo, sobre el desarrollo de la EP67. Los tóxicos pueden causar daño estático pero también progresivo, como la exposición aguda a MPTP, que produce pérdida neuronal progresiva y una reacción inflamatoria permanente. En estudios en animales la exposición previa a un tóxico aumenta la susceptibilidad a un mayor daño, por lo que un segundo daño tóxico o el envejecimiento podrían determinar la degeneración selectiva de la SN. También se ha demostrado que infecciones intrauterinas pueden interferir en el desarrollo de las neuronas DA fetales por inflamación mediada por TNF-α en líquido amniótico en modelos murinos. Datos epidemiológicos sugieren que el aumento de riesgo de EP intrafamiliar puede deberse no solo a factores genéticos sino también a factores ambientales compartidos. Un estudio poblacional en familias con EP halló un RR de EP de 6,7 para hermanos, 3,2 para hijos y 2,7 para sobrinos; el riesgo de hijos y de sobrinos fue similar (y diferente al de hermanos) lo que sugiere que estas 2 cohortes distintas tienen riesgo similar por exposición ambiental similar en el mismo periodo de su vida68.
La importancia relativa de los factores ambientales se ha subrayado en un reciente estudio que estimó que la mitad de los casos de EA serían atribuibles a 7 factores de riesgo potencialmente modificables15, en el caso de que fueran independientes. Se calculó que los que más contribuyen al riesgo de EA serían, en este orden, baja reserva cognitiva, tabaco, sedentarismo, depresión, obesidad, HTA en edad media y DM, y cada factor contribuiría al riesgo de EA entre un 2 y un 20%. Existen algunos ECA en marcha para evaluar el efecto de estrategias multidimensionales de reducción de factores de riesgo (ejercicio físico y cognitivo, nutrición) sobre la incidencia de EA. Por el momento, estrategias efectivas pueden ser campañas educativas para mejorar la reserva cognitiva de la población, campañas antitabaco y potenciar el ejercicio físico y los hábitos de vida saludables.
ConclusionesDiversos factores ambientales contribuyen significativamente al riesgo de EP y EA. Algunos de ellos podrían actuar ya desde etapas tempranas de la vida o interaccionar con otros factores genéticos. Estrategias poblacionales de modificación de estos factores podrían potencialmente evitar algunos casos de EP o de EA.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Este trabajo fue presentado como ponencia en la XII Reunión Anual del Grupo de Estudio de Neurología del Trabajo en la LXIII Reunión Anual de la SEN el 18 de diciembre de 2011.