La enfermedad neurológica representa una parte importante en las unidades de cuidados intensivos pediátricos (UCIP) y es causa de morbimortalidad. El objetivo de este trabajo es analizar la evolución funcional del niño crítico con enfermedad neurológica.
Material y métodoEstudio retrospectivo descriptivo, de niños con enfermedad neurológica ingresados en una UCIP durante 3 años (2012-2014), valorando pronóstico vital y funcional, al alta y al año del ingreso, según las Categorías de estado general y cerebral pediátrico (CEGP-CECP) y la Escala de estado funcional (FSS). Los resultados se comparan con nuestros datos previos (años 1990-1999) y con los del estudio multicéntrico internacional PANGEA.
ResultadosSe estudió a 266 niños. La mortalidad fue del 3%, sin que los modelos PRISM-II y PIM2 muestren capacidad predictiva. La salud funcional refleja empeoramiento clínicamente significativo al alta de UCIP, en el 30% según CEGP, en el 15% según CECP y en el 5% según FSS. Transcurrido un año, la funcionalidad mejora según CEGP-CECP, pero no según FSS. Los niños sin enfermedad neurológica de base presentan afectación funcional en mayor porcentaje, que se mantiene en el tiempo. Comparada con nuestros datos previos, la mortalidad global y neurocrítica disminuye (5,60 vs. 2,1%; p = 0,0003 y 8,44 vs. 2,63%; p = 0,0014, respectivamente). En relación con el estudio multicéntrico PANGEA, tanto la mortalidad como el empeoramiento funcional cerebral del niño neurocrítico son menores en el estudio actual (1,05 vs. 13,32%; p < 0,0001 y 10,47 vs. 23,79%; p < 0,0001, respectivamente).
ConclusionesAlrededor de un tercio de los niños críticos muestran enfermedad neurológica. Un porcentaje importante, sobre todo de niños sin enfermedad neurológica basal, presenta repercusión funcional clínicamente significativa al alta de UCIP y transcurrido un año. La repercusión en el pronóstico funcional del niño crítico apoya la importancia de la neuromonitorización y neuroprotección, medidas necesarias para mejorar la asistencia del niño crítico y la valoración evolutiva de la salud funcional.
Neurological diseases explain a considerable proportion of admissions to paediatric intensive care units (PICU), and are a significant cause of morbidity and mortality. This study aims to analyse the functional progression of children with critical neurological conditions.
Material and methodsRetrospective descriptive study of children admitted to PICU with neurological diseases over a period of 3 years (2012-2014), assessing vital and functional prognosis at PICU discharge and at one year according to the Pediatric Cerebral and Overall Performance Category scales (PCPC-POPC) and the Functional Status Scale (FSS). The results are compared with our previous data (1990-1999), and those of the international multicentre PANGEA study.
ResultsA total of 266 children were studied. The mortality rate was 3%; the PRISM-III and PIM2 models did not show predictive ability. Clinically significant worsening was observed in functional health at discharge in 30% of the sample, according to POPC, 15% according to PCPC, and 5% according to FSS. After one year, functional performance improved according to PCPC-POPC, but not according to FSS. Children with no underlying neurological disease had a higher degree of functional impairment; this was prolonged over time. We observed a decrease in overall and neurocritical mortality compared with our previous data (5.60 vs. 2.1%, P=.0003, and 8.44 vs. 2.63%, P=.0014, respectively). Compared with the PANGEA study, both mortality and cerebral functional impairment in neurocritical children were lower in our study (1.05 vs. 13.32%, P<.0001, and 10.47% vs. 23.79%, P<.0001, respectively).
ConclusionsNearly one-third of critically ill children have neurological diseases. A significant percentage, mainly children without underlying neurological diseases, had a clinically significant functional impact at PICU discharge and after a year. Neuromonitoring and neuroprotection measures and the evaluation of functional progression are necessary to improve critical child care.
La enfermedad neurológica, tanto primaria como secundaria a la enfermedad crítica extraneurológica, constituye un importante problema en las unidades de cuidados intensivos pediátricos (UCIP) y es determinante en el pronóstico funcional1,2. La frecuencia y diversidad de la neuropatología pediátrica y la necesidad de optimizar las medidas de neuroprotección justifican la organización de la asistencia neurointensiva. Dado el pequeño volumen de la mayoría de las UCIP, no se puede justificar la creación de unidades neurocríticas, por lo que el modelo más adecuado se basa en la formación de equipos multidisciplinares coordinados por intensivistas pediátricos y neuropediatras3,4, como es el caso del Hospital Universitario Miguel Servet (HUMS) de Zaragoza.
El desarrollo y evolución de los cuidados intensivos pediátricos han mejorado las tasas de supervivencia5. Su objetivo primordial ha pasado de «salvar vidas» a «salvar vidas funcionales», en situación óptima. Los estudios de valoración pronosticaban cambiada su «focalidad»: de la mortalidad a la morbilidad: «estado funcional y calidad de vida»6-8. El concepto más adecuado para la valoración funcional en niños es el de «salud funcional». En un intento de acotar la inevitable subjetividad de la valoración funcional, se desarrollan múltiples escalas. Las Categorías del estado global y cerebral pediátrico (CEGP-CECP) (tabla 1), basadas en la impresión del observador, son válidas y fidedignas, y, pese a sus limitaciones, han sido empleadas en múltiples estudios pediátricos9-12. En 2009, se publicó una nueva escala: Escala de estado funcional (FSS) (tabla 2), que permite una valoración más desglosada, bien definida, adecuada en amplio rango de edad, y con la ventaja de aumentar la objetividad, comparada con el sistema CECP-CEGP. Se contemplan 6 capacidades funcionales: estado mental, sensorial, comunicación, función motora, alimentación y respiración, con 6 niveles de funcionalidad: 1) normal, 2) disfunción leve, 3) disfunción moderada, 4) disfunción grave, 5) disfunción muy grave y 6) fallecimiento (nivel añadido a la escala original, para equipararla a las clásicas CECP-CEGP13-15.
Categorías de estado cerebral y global pediátrico (CECP- CEGP)9
| Categoría CECP | Descripción |
|---|---|
| 1. Normal | Capacidades de acuerdo con la edad. Preescolar: desarrollo apropiado. Escolar: el niño acude regularmente a las clases |
| 2. Incapacidad ligera | Capaz de actuar de acuerdo con su edad. Presenta enfermedad neurológica menor que está controlada y no interfiere con las funciones diarias (p. ej., convulsiones). Preescolar: puede presentar mínimos retrasos de desarrollo, pero más del 75% de las capacidades para realizar las actividades de la vida diaria están por encima del percentil 10. Escolar: el niño acude regularmente a clase, pero su nivel no es el adecuado para su edad, o fracasa por dificultades cognitivas |
| 3. Incapacidad moderada | Capacidades por debajo de su edad. Presenta enfermedad neurológica no controlada que limita gravemente la actividad. Preescolar: muchas de las actividades presentan un desarrollo inferior al 75% del percentil 10. Escolar: puede desarrollar actividades de la vida diaria, pero acude a clases especiales por presentar dificultades cognitivas o de aprendizaje |
| 4. Incapacidad grave | Preescolar: el desarrollo de las actividades para la vida diaria están por debajo del 75% del percentil 10, el niño depende excesivamente de otras personas para realizar actividades de la vida diaria. Escolar: la disminución puede ser tal que sea incapaz de acudir a clase, o dependa de otros para realizar las actividades de la vida diaria. Tanto los preescolares como los escolares pueden presentar movimientos anormales, incluyendo movimientos involuntarios de decorticación o descerebración como repuesta al dolor |
| 5. Coma. Estado vegetativo | No está consciente. No conoce. No tiene contacto verbal ni psicológico con el ambiente |
| 6. Muerte | Muerte |
| Categoría CEGP | Descripción |
|---|---|
| 1. Normal | Actividades apropiadas a su edad. Los problemas médicos o físicos no interfieren con la actividad normal |
| 2. Incapacidad ligera | Problemas médicos o físicos menores que originan pequeñas limitaciones que son compatibles con una vida normal (p. ej., asma). Nivel preescolar: puede presentar incapacidades que son compatibles con una vida futura independiente (p. ej., amputación única) y es capaz de realizar más del 75% de las actividades de la vida diaria propias de su edad |
| 3. Incapacidad moderada | Las condiciones médicas y físicas son limitantes. Nivel preescolar: no es capaz de realizar algunas de las actividades de la vida diaria. Nivel escolar: es capaz de realizar muchas de las actividades de la vida diaria, pero está físicamente incapacitado (p. ej., no puede participar en competiciones deportivas) |
| 4. Incapacidad grave | Nivel preescolar: es incapaz de realizar muchas de las actividades de la vida diaria. Nivel escolar: es dependiente de otros para muchas de las actividades de la vida diaria |
| 5. Coma. Estado vegetativo | No está consciente. No conoce. No tiene contacto verbal ni psicológico con el ambiente |
| 6. Muerte | Muerte |
Escala de estado funcional (FSS)
| Categoría FSS | Descripción |
| Estado mental | |
| 1. Normal | • Periodos de sueño y vigilia normales• Capacidad de respuesta social dignaSueño: estado de descanso y sin sobrerreacción (llanto, agitación) a los ruidos del entorno. Vigilia: conciencia con el comportamiento apropiado para la edad. Los niños en este estado deben ser adecuadamente conscientes, estar alerta y ser sensibles de sí mismos y del medio ambiente |
| 2. Disfunción leve | • Somnoliento pero despierta al ruido, al tacto o al movimiento: duerme mucho tiempo si se le deja solo, pero es capaz de ser excitado al estimularlo con ruido, tacto, cambio de posición• Los periodos de reducida capacidad de respuesta social son más frecuentes de lo que es apropiado para su edad. Disminución de la capacidad de respuesta a las propuestas sociales o no se centra ni sigue el cruce de una persona u objeto en su línea de visión |
| 3. Disfunción moderada | Letárgico o irritableLetárgicos, somnolientos, lentos, con inusual falta de energía. Son excitables, pero son menos sensibles o regresan a un estado somnoliento si la estimulación no es frecuenteIrritables de forma inconsolable, a menudo con aumento de la sensibilidad a la estimulación. A menudo reaccionan a los estímulos con un grito agudo |
| 4. Disfunción grave | Mínimo excitación al estímulo (estupor): alteración de la conciencia marcada por la disminución de las reacciones a los estímulos ambientales. Pueden abrir los ojos y concentrarse, pero no mantener ninguna reacción significativa al entorno físico. Contacto con los ojos mínimo o ausente. Responden a estímulos nocivos con movimientos semiintencionales (es decir, mal organizados) o de retirada |
| 5. Disfunción muy grave | Ausencia de respuesta o coma o estado vegetativoInconscientes. Coma: estado profundo de inconsciencia del cual no se puede despertar; no sienten ni responden a los estímulos externos o necesidades internas. Vegetativos: no tienen evidencia de conciencia de sí mismos ni del entorno; pueden tener la vigilia intermitente, manifestada por los ciclos de sueño-vigilia. No hay evidencia de respuestas conductuales sostenidas, reproducibles, con propósito o voluntarias al estímulo visual, auditivo, táctil, o a estímulos nocivos |
| 6. Fallecimiento | |
| Categoría FSS | Descripción |
| Estado sensorial | |
| 1. Normal | Audición y visión intactasLa audición intacta se demuestra por el movimiento de los ojos o la cabeza hacia el estímulo sonoro en la habitaciónLa visión intacta se evidencia por el movimiento de la mirada para centrarse en la persona u objeto que se cruza en su campo visual |
| 2. Disfunción leve | Sospecha de pérdida de la audición o de la visiónExiste la sospecha de pérdida de audición o visión: la localización del sonido o el centrado de la mirada son inconsistentesLa capacidad de respuesta al tacto no se vea afectada |
| 3. Disfunción moderada | Falta de reacción a estímulos auditivos o visualesExiste falta de pruebas positivas de audición o de visión, como lo demuestra la falta de enfoque o de localización del sonidoLa capacidad de respuesta al tacto no se ve afectada |
| 4. Disfunción grave | Sin reacción a estímulos auditivos y visualesExiste falta de pruebas de audición o visión, como lo demuestra la falta de seguimiento y localización del sonidoLa capacidad de respuesta al tacto no se vea afectada |
| 5. Disfunción muy grave | Respuesta anormal al tactoTienen respuesta anormal al tacto o al dolor, como lo demuestra la ausencia de movimientos intencionales, o semiintencionales Puede haber retirada como respuesta de la médula |
| 6. Fallecimiento | |
| Categoría FSS | Descripción |
| Comunicación | |
| 1. Normal | Vocalización apropiada para la edad y expresiones o gestos faciales interactivosLos lactantes emiten sonidos ante la presencia de personas conocidas Los niños utilizan palabras para transmitir las necesidades. Las expresiones faciales y gestos interactivos son un proceso de comunicación no verbal, a menudo estrechamente asociado con las emociones |
| 2. Disfunción leve | Disminución de vocalización o de la expresión social (facial o verbal) |
| 3. Disfunción moderada | Ausencia de comportamiento para llamar la atenciónNo demuestran comportamiento para llamar la atención, o no pueden comunicar sus necesidades |
| 4. Disfunción grave | Sin manifestación de malestarNo lloran o solo manifiestan mínimo grito ante procedimientos dolorosos o incómodos |
| 5. Disfunción muy grave | Ausencia de comunicación: no hay comunicación con expresiones faciales, posturales ni de voz. No hay comunicación con respecto a necesidades fisiológicas o psicológicas |
| 6. Fallecimiento | |
| Categoría FSS | Descripción |
| Función motora | |
| 1. Normal | • Movimientos corporales coordinados y• Control muscular normal y• Conocimiento de la acciónCoordinan movimientos con el control muscular normal. Son conscientes de la acción y su propósito. Ejemplos: sostén de objetos, transferencia de una mano a otra, succión del pulgar, escritura, juego con juguetes |
| 2. Disfunción leve | • Un miembro funcionalmente deterioradoPérdida parcial o completa de la funcionalidad de la extremidadPuede ser secundario a dispositivos médicos tales como restricciones, vendas, o moldes; o debido a problemas físicos, tales como deformidades, debilidad, rigidez, espasticidad, o trastornos del movimientoLa debilidad se demuestra cuando no son capaces de mover la extremidad contra gravedad, mientras sostienen un objeto o contra una resistencia. Pueden ser capaces de realizar las actividades apropiadas para la edad normal, pero con un mayor esfuerzoLa rigidez se demuestra cuando uno o más miembros aumentan la resistencia al movimiento pasivo, pero aún se mantiene en su posición normal. La estimulación no da lugar a flexión, sino a extensión o arqueoLa espasticidad es un incremento de forma anormal del tono muscular con movimientos involuntarios. Los reflejos de las extremidades son exagerados. Hay resistencia a la flexión y el cuello se extiende demasiado |
| 3. Disfunción moderada | • 2 o más extremidades funcionalmente deterioradasPérdida parcial o completa de funcionalidad de 2 o más extremidades*Se incluye aquí también la ataxia |
| 4. Disfunción grave | • Mal control de la cabeza-hipotonía cervicalDisminución del control de la cabeza: disminución de la capacidad para mantener la cabeza erguida a 90°. Si el tronco se apoya, la cabeza cae hacia atrás, de lado a lado o de frente. No es capaz de llevarla a posición vertical cuando se sienta o de mantenerla en línea media cuando está en supino-prono |
| 5. Disfunción muy grave | Paralizado/ descerebración / decorticaciónLa parálisis es la pérdida de la función motora voluntaria, no es el tono muscular anormal. El estado mental puede estar preservado o alteradoLa postura de descerebración consta de extensión rígida de todas las extremidades con rotación interna, dedos de los pies flexionados hacia abajoLa postura de decorticación consiste en la flexión rígida de las extremidades superiores con puños cerrados y la extensión de extremidades inferiores |
| 6. Fallecimiento | |
| Categoría FSS | Descripción |
| Alimentación | |
| 1. Normal | Todos los alimentos por vía oral tomados con la edad y ayuda adecuadasNo hay alimentación parenteral o alimentación por sondaMétodos de alimentación apropiados para su edad. El número de calorías no es parte de esta categoría |
| 2. Disfunción leve | Alimentos orales con aumento de la densidad o comida hipercalóricaNo hay alimentación parenteral o sonda gástrica o intestinal. Soluciones de glucosa del 5% o menos no se incluyen en alimentación parenteralEl aumento de la densidad de los alimentos son fórmulas especiales o aditivos/suplementos a la dieta |
| 3. Disfunción moderada | Necesidad de ayuda con la alimentación inapropiada para la edadAlimentación por parte del cuidador o con ayuda cuando se espera la alimentación independiente |
| 4. Disfunción grave | Sonda de alimentación con o sin la nutrición parenteralLa nutrición parenteral incluye la nutrición intravenosa a través de una vena periférica o central con una concentración de glucosa superior al 5%. Por lo general, incluye lípidos y proteínas. La alimentación por sonda incluye naso/orogástrica, transpilórica y gastro/duoodenostomía |
| 5. Disfunción muy grave | Todo nutrición parenteral |
| 6. Fallecimiento | |
| Categoría FSS | Descripción |
| Estado respiratorio | |
| 1. Normal | Respira aire sin alta concentración de oxígeno y sin soporte artificialEl niño respira en el aire de la habitación sin necesidad de ayuda artificial incluyendo aspiración, oxígeno o soporte mecánico |
| 2. Disfunción leve | Precisa oxígeno a través de cualquier dispositivo (cánulas, mascarilla), o aspiración de la vía respiratoria |
| 3. Disfunción moderada | Traqueotomía |
| 4. Disfunción grave | CPAP (presión positiva continua) para todo o parte del día o asistencia respiratoria mecánica durante parte del día, que se puede administrar a través de una mascarilla o traqueotomíaSoporte mecánico incluye dispositivos de ventilación de presión positiva o negativa, con 2niveles de presión |
| 5. Disfunción muy grave | Soporte ventilatorio mecánico para todo el día y la noche |
| 6. Fallecimiento | |
El objetivo del trabajo es estudiar al niño crítico con neuropatología, primaria o secundaria, valorando su pronóstico funcional mediante las categorías CEGP-CECP y la nueva escala FSS y comparar estos datos con los de nuestro estudio en los años 1990-199916 y con el estudio internacional PANGEA17, estudio prospectivo transversal que analiza la prevalencia y el pronóstico de la enfermedad neurológica aguda en 126 UCIP de los 6continentes, entre 2011 y 2012.
Material y métodoSe lleva a cabo un estudio retrospectivo descriptivo y analítico observacional de los 266 niños ingresados en una UCIP de nivel III entre enero de 2012 y diciembre de 2014, con enfermedad neurológica primaria o secundaria. Los pacientes se dividen en 4grupos: A) niños con enfermedad neurológica de base que ingresan en UCIP por motivo no neurológico; B) niños con enfermedad neurológica de base que ingresan en UCIP a consecuencia de una agudización de dicha entidad; C) niños sin enfermedad neurológica de base que ingresan en UCIP debido a cuadro neurológico agudo; D) niños sin enfermedad neurológica de base que, ingresados en UCIP por un motivo «extraneurológico», presentan daño neurológico secundario. Se valora el pronóstico de estos pacientes referido a mortalidad y morbilidad. Se estudia, además, la utilidad de los modelos Pediatric Risk of Mortality, versión III (PRISM-III) y Pediatric Index of Mortality, versión 2 (PIM2) como predictores de mortalidad, basados en una serie de parámetros clínicos y analíticos al ingreso en UCIP (tabla 2 y tabla 3)18,19. La valoración de la morbilidad se basa en la evaluación funcional a través de las escalas CEGP-CECP y FSS en el plazo de un año tras el alta de UCIP. Los 6 ítems que constituyen la nueva escala FSS, que permiten una valoración más desglosada y objetiva, hacen más compleja la presentación de los datos. Por ello, se decide su recodificación en el análisis del estudio: se calcula la media de la puntuación de los 6 ítems y se genera una nueva variable: FSSglobal. La media de los ítems referidos a funciones neurológicas sirve para calcular la escala FSSneurológica, con lo que se obtienen 2 opciones neurológicas: «FSSneuro1», que incluye los 4 primeros ítems de la escala, y «FSSneuro2», referida solo a los 3 primeros ítems, con valor puramente cognitivo. Con base en ambas escalas, el resultado de la puntuación clasifica la situación en: 1) adecuada situación funcional (valoración normal o discapacidad leve), o 2) situación funcional desfavorable (discapacidad moderada, grave o muy grave). Para analizar la repercusión del ingreso en UCIP sobre el estado funcional, se compara la valoración al alta y tras una año del ingreso en UCIP con la situación basal, considerando empeoramiento funcional clínicamente significativo el paso de una situación de «adecuada» a «desfavorable salud funcional».
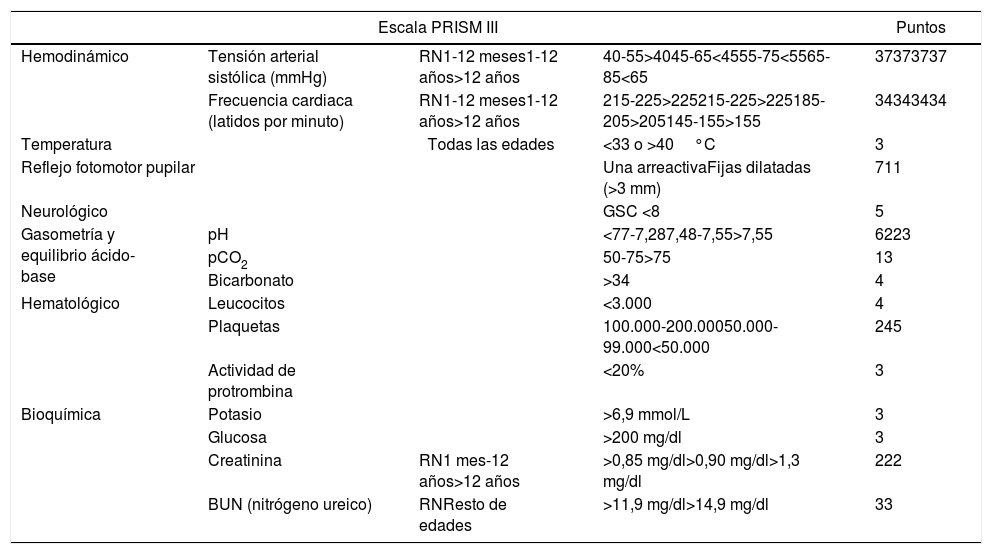
Escala de predicción de mortalidad PRISM III18
| Escala PRISM III | Puntos | |||
|---|---|---|---|---|
| Hemodinámico | Tensión arterial sistólica (mmHg) | RN1-12 meses1-12 años>12 años | 40-55>4045-65<4555-75<5565-85<65 | 37373737 |
| Frecuencia cardiaca (latidos por minuto) | RN1-12 meses1-12 años>12 años | 215-225>225215-225>225185-205>205145-155>155 | 34343434 | |
| Temperatura | Todas las edades | <33 o >40°C | 3 | |
| Reflejo fotomotor pupilar | Una arreactivaFijas dilatadas (>3 mm) | 711 | ||
| Neurológico | GSC <8 | 5 | ||
| Gasometría y equilibrio ácido-base | pH | <77-7,287,48-7,55>7,55 | 6223 | |
| pCO2 | 50-75>75 | 13 | ||
| Bicarbonato | >34 | 4 | ||
| Hematológico | Leucocitos | <3.000 | 4 | |
| Plaquetas | 100.000-200.00050.000-99.000<50.000 | 245 | ||
| Actividad de protrombina | <20% | 3 | ||
| Bioquímica | Potasio | >6,9 mmol/L | 3 | |
| Glucosa | >200 mg/dl | 3 | ||
| Creatinina | RN1 mes-12 años>12 años | >0,85 mg/dl>0,90 mg/dl>1,3 mg/dl | 222 | |
| BUN (nitrógeno ureico) | RNResto de edades | >11,9 mg/dl>14,9 mg/dl | 33 | |
Anotar la peor puntuación de las primeras 24 h.
Cálculo de la probabilidad de muerte:
Logit PRISMIII = (0,207×PRISM) - (0,005×edad en meses) - 0,433×1 (si postoperatorio) - 4,782
Probabilidad de muerte = e LogitPRISM /(1 + eLogitPRISM), siendo e = 2,7183
Estos resultados se comparan con los de estudios previos llevados a cabo en la UCIP del HUMS, entre los años 1990 y 199916, y con los datos del estudio multicéntrico internacional PANGEA17.
En la estadística descriptiva, las variables cuantitativas se presentan mediante indicadores de tendencia central (media o mediana) y de dispersión (desviación estándar o rango intercuartílico), previa comprobación de distribución normal mediante el test de Kolmogorov-Smirnov. Las variables cualitativas se presentan mediante distribución de frecuencias o porcentajes de cada categoría. En la estadística analítica-comparativa, se determina si las variables se distribuyen según la ley normal, empleando las pruebas de Kolmogorov-Smirnov si n ≥ 30 y Shapiro-Wilk si n < 30. Dado que las variables analizadas no siguen una distribución normal, se aplican, para la estadística analítica univariante, pruebas no paramétricas. Para estudiar la relación entre una variable cualitativa de varias categorías y un variable cuantitativa, se utiliza el test no paramétrico de Kruskal-Wallis. El análisis estadístico se realiza mediante el programa informático SPSS 18.0. El nivel de significación empleado en todo el análisis es 0,05 (α = 0,05). El estudio fue aprobado por el Comité de Ética de Investigación Clínica de Aragón.
ResultadosDurante el periodo de recogida de datos, de los 1.178 ingresos recibidos en la UCIP del HUMS, 323 (27,5%) corresponden a los 266 niños con enfermedad neurológica de base como motivo de ingreso o que la presentan en la evolución en UCIP. Los 266 niños se distribuyen en los 4 grupos del siguiente modo: A) 53 niños (20,3%) con enfermedad neurológica de base que ingresan por motivo no neurológico; B) 84 niños (31,6%) con enfermedad neurológica de base que ingresan por una agudización de dicha enfermedad; C) 107 niños (40,2%) sin enfermedad neurológica de base que ingresan por cuadro neurológico agudo y D) 22 niños (8,3%) sin enfermedad neurológica de base que, ingresados por motivo «extraneurológico», presentan daño neurológico secundario. Para el análisis estadístico se hace referencia a pacientes; se analiza el primer episodio en el caso de pacientes con varios ingresos en UCIP. La mediana de edad es de 58 meses (RQ 94). De los 266 pacientes, 163 son varones (61,3%) y 103, mujeres (38,7%). La mediana de estancia en UCIP es de 2 días (RQ 2) (tabla 4).
Escala de predicción de mortalidad PIM219
| Puntos | ||
|---|---|---|
| A. Ingreso programado | SíNo | 10 |
| B. Ingreso en UCIP para recuperación quirúrgica o de un procedimiento | SíNo | 10 |
| C. Ingreso en UCIP tras intervención quirúrgica con circulación extracorpórea | SíNo | 10 |
| D. Enfermedades de alto riesgoSi existe alguna de las siguientes enfermedades (registrar cuál) 1. Parada cardiaca previa al ingreso (intra- o extrahospitalaria). Requiere la constatación de ausencia de puso arterial o necesidad de compresiones torácicas. No incluye los antecedentes personales de haber sufrido una parada cardiaca 2. Inmunodeficiencia combinada grave 3. Leucemia o linfoma tras la primera inducción 4. Hemorragia cerebral espontánea (por aneurisma o malformación arteriovenosa). No incluye la hemorragia cerebral traumática o la hemorragia intracraneal no parenquimatosa 5. Miocardiopatía o miocarditis 6. Síndrome de corazón izquierdo hipoplásico (a cualquier edad, siempre y cuando se precisara una intervención de tipo Norwood o similar en el periodo neonatal para mantener la vida del paciente) 7. Infección por VIH (virus de la inmunodeficiencia humana) 8. Ingreso en UCIP por fallo hepático (agudo o crónico). Incluye el ingreso en UCIP tras trasplante hepático por insuficiencia hepática aguda o crónica) 9. Enfermedad neurodegenerativa (requiere historia de deterioro neurológico progresivo o un diagnóstico en el que esta situación ocurra inevitablemente) | SíNo | 10 |
| E. Enfermedad de bajo riesgo.Si el paciente ingresa en UCIP por cualquiera de las siguientes enfermedades (registrar cuál): 1. Asma 2. Bronquiolitis 3. Laringitis 4. Síndromede apnea obstructiva del sueño (incluye a los pacientes ingresados tras adenoamigdalectomía en los que la presencia de apnea obstructiva del sueño es el motivo de ingreso en la UCIP 5. Cetoacidosis diabética | SíNo | 10 |
| F. Respuesta pupilar a la luz No se debe recoger un resultado anormal si es probablemente causado por fármacos, toxinas o traumatismo ocular | Ambas pupilas >3mm y fijasOtra/desconocido | 10 |
| G. Exceso de bases en sangre arterial o capilar (mmol/L) | Anotar valorDesconocido | 0 |
| H. PaO2. | Anotar valorDesconocido | 0 |
| I. FiO2en el momento de medición de la PaO2 | Anotar valorDesconocido | 0 |
| J. Presión arterial sistólicaSu valor será 0 si el paciente está en parada cardiorrespiratoria y 30 si la hipotensión es tal que no puede ser medida | Anotar valorDesconocido | 120 |
| K. Ventilación mecánica durante la primera hora de ingreso (incluye presión no invasiva) | SíNo | 10 |
Cálculo de la probabilidad de muerte:
Logit PIM2 = [−0,9282×valor de A] + [−1,0244×valor de B] + [0,7507×valor de C] + [1,6829×valor de D] + [−1,5770×valor de E] + [3,0791×valor de F] + [0,104×valor de G en valor absoluto] + [0,2888×(valor de I×100/valor de H)] + [0,01395×(valor de J - 120) en valor absoluto] + [1,3352×valor de K] - 4,8841.
Probabilidad de muerte = e LogitPIM2/(1+eLogitPIM2), siendo e = 2,7183.
La mortalidad general en UCIP en este periodo es de 2,1% (25 fallecidos del total de 1.178 ingresos), mientras que la mortalidad en la muestra del estudio es del 3% referida a pacientes y del 2,5% referida a episodios (tabla 5). La mortalidad estimada según PIM2 es del 5,99% y según PRISM-III del 24,5%. Para aquellos pacientes que fallecen en su ingreso en UCIP, el riesgo de mortalidad estimada al ingreso en UCIP es del 85,47 y del 64,46%, según PRISM-III y PIM2, respectivamente, frente al 22,64 y al 4,18% para los que sobreviven.
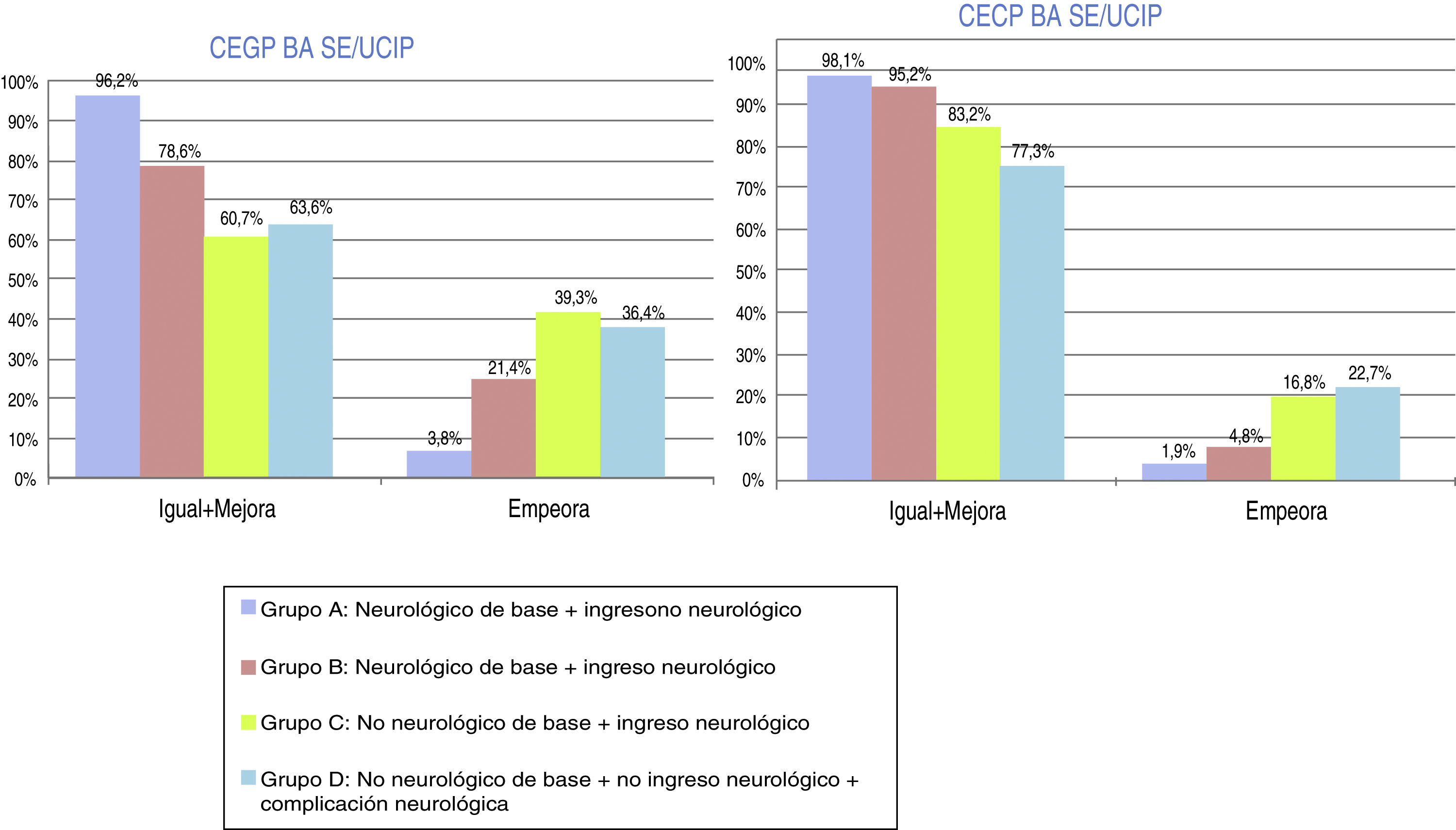
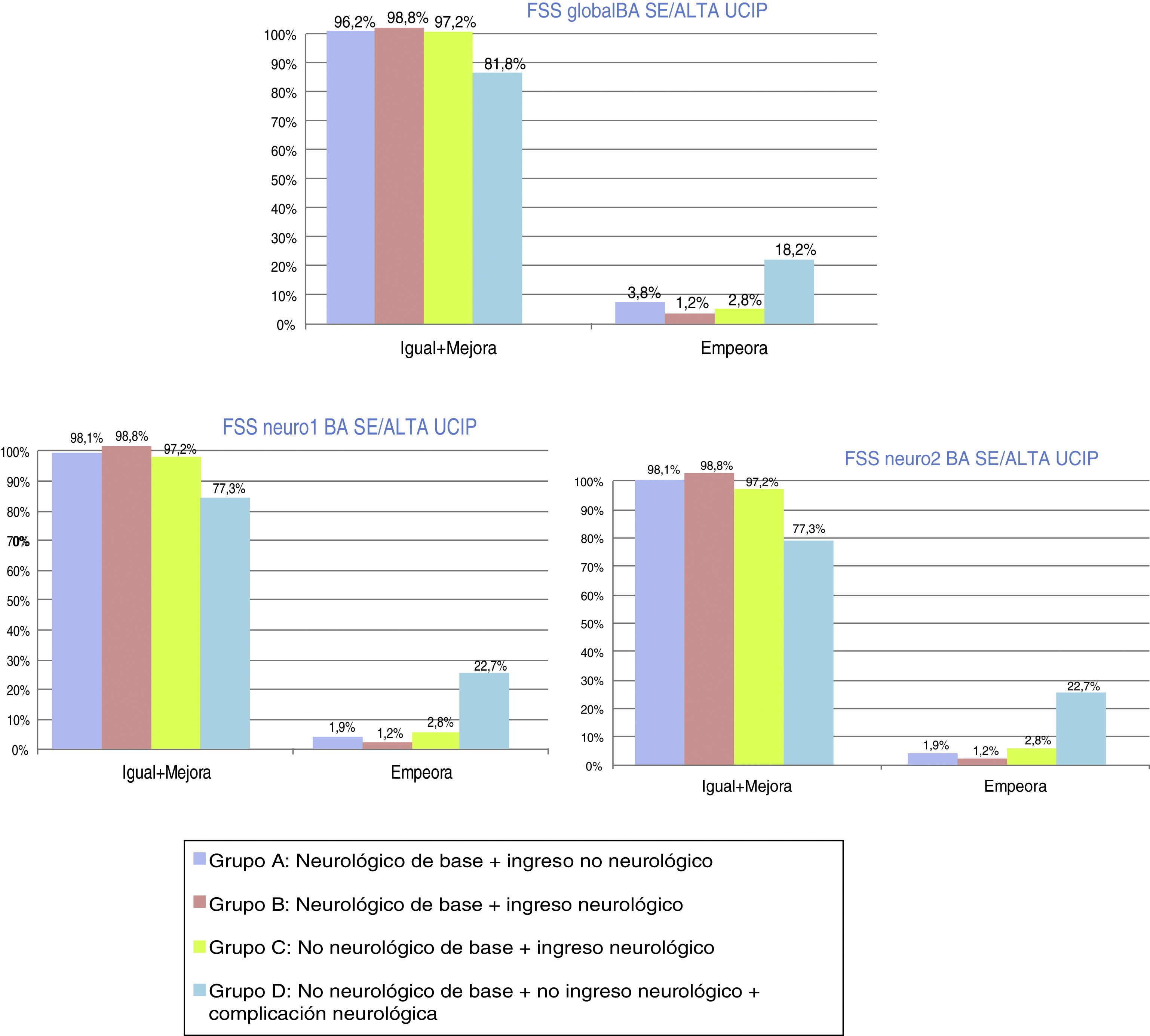
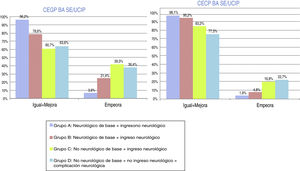
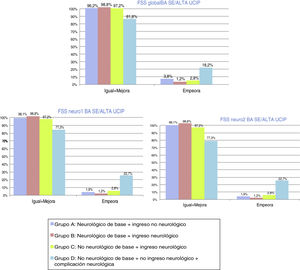
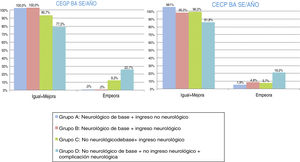
En cuanto a la evolución funcional global (CEGP) al alta de UCIP, clínicamente significativa, el 73,7% de la muestra se mantiene igual-mejora y el 26,3% empeora. Respecto a la evolución funcional cerebral (CECP) clínicamente significativa, el 89,5% de la muestra se mantiene igual-mejora, el 10,5% empeora. La distribución por grupos se representa en la figura 1. La valoración al alta de UCIP, según la nueva escala FSS, muestra resultados más optimistas que las clásicas CEGP-CECP. En la evolución global clínicamente significativa al alta de UCIP (FSSglobal), el 96,2% de la muestra se mantiene igual-mejora y el 3,8% empeora. La evolución funcional cerebral (FSSneuro1) y cognitiva (FSSneuro2) al alta de UCIP reflejan la misma evolución: el 96,2% de la muestra se mantiene igual-mejora, el 3,8% empeora. La figura 2 indica la distribución por grupos de la evolución al alta según la escala FSS recodificada (FSSglobal, FSSneuro1 y FSSneuro2).
Evolución-pronóstico funcional global, mediante las Categorías de estado global y cerebral pediátrico (CEGP-CECP) tras ingreso en Unidad de Cuidados Intensivos Pediátricos. Distribución por grupos. Evolución al alta de UCIP: igual-mejora o empeora.
Grupo A: N = 53; grupo B: N = 84; grupo C: N = 107; grupo D: N = 22.
Evolución-pronóstico funcional global, mediante la Escala de estado funcional recodificada (FSSglobal, FSSneuro1 y FSSneuro2) tras ingreso en Unidad de Cuidados Intensivos Pediátricos. Distribución por grupos. Evolución al alta de UCIP: igual-mejora o empeora.
Grupo A: N = 53; grupo B: N = 84; grupo C: N = 107; grupo D: N = 22.
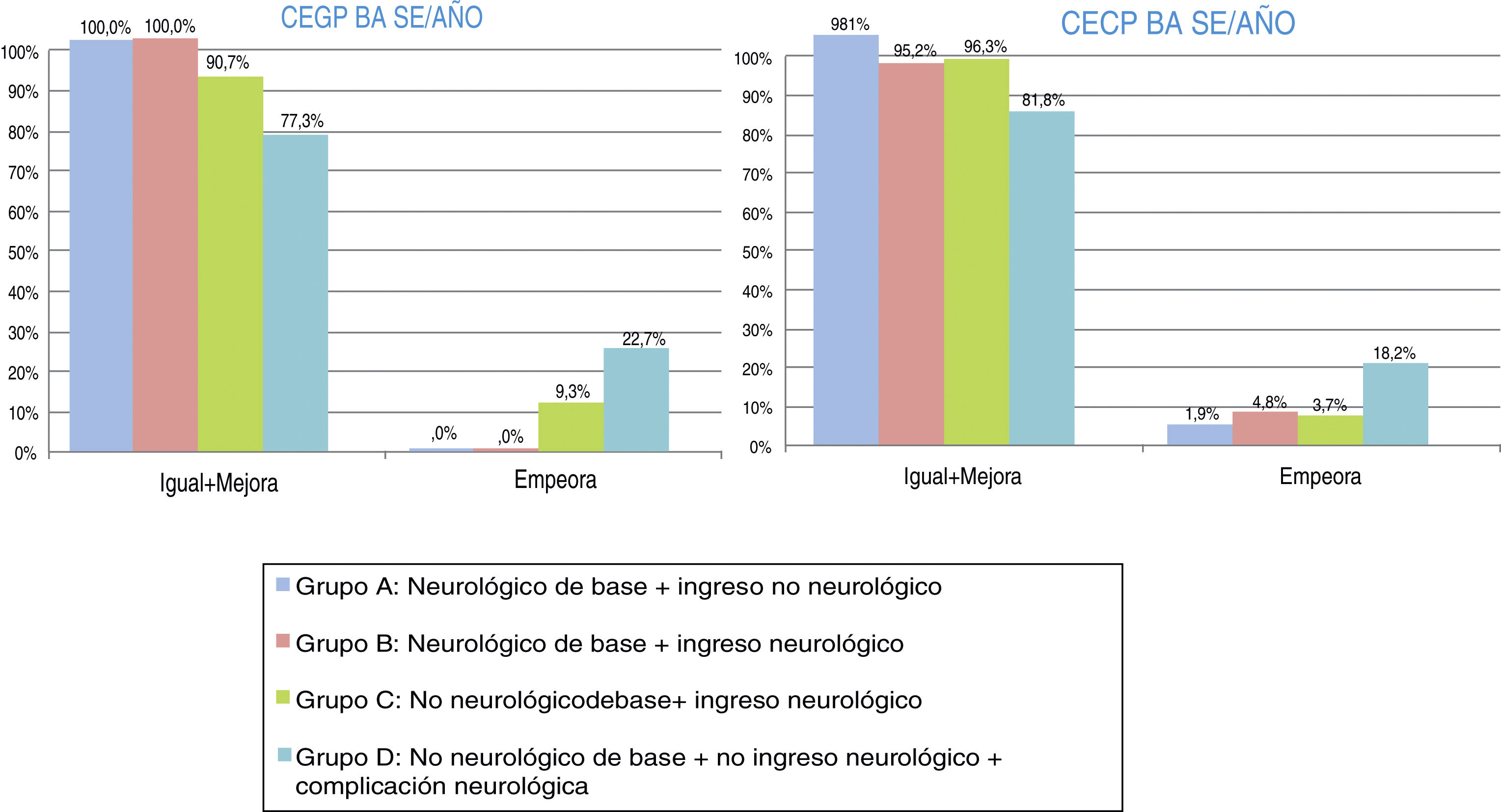
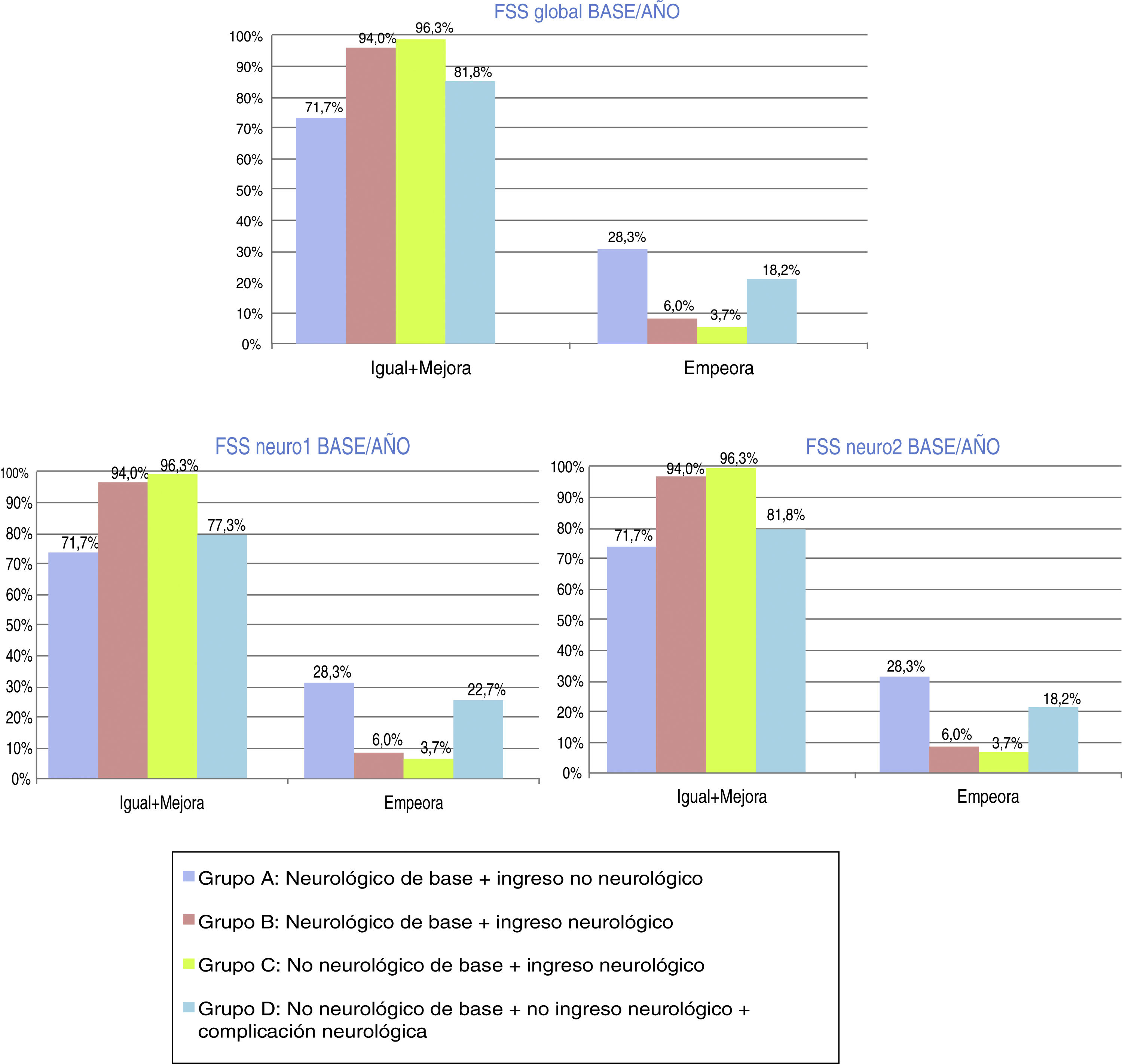
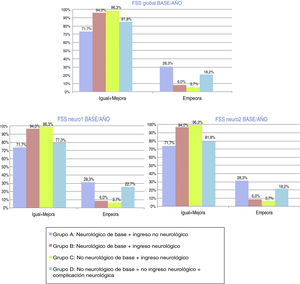
En la evolución funcional global (CEGP) clínicamente significativa tras un año del alta de UCIP, el 94,3% de la muestra se mantiene igual-mejora y el 5,6% empeora. En la valoración funcional cerebral (CECP) clínicamente significativa tras un año del alta de UCIP, el 93,6% de la muestra se mantiene igual, el 1,5% mejora y el 4,9% empeora. En la evolución funcional global clínicamente significativa tras un año del alta de UCIP, mediante escala FSSglobal, el 89,5% de la muestra se mantiene igual-mejora y el 10,5% empeora. En la valoración funcional cerebral clínicamente significativa tras un año del alta de UCIP, según la escala FSSneuro1, el 89,1% de la muestra se mantiene igual o mejora y el 10,9% empeora. En cuanto a la valoración funcional cognitiva clínicamente significativa tras un año del alta de UCIP, según la escala FSSneuro2, el 89,5% de la muestra se mantiene igual o mejora y el 10,5% empeora. Las figuras 3 y 4 muestran la distribución, por grupos, de la evolución funcional transcurrido un año del alta de UCIP, según las clásicas CEGP-CECP y las 3versiones de la escala FSS.
Evolución-pronóstico funcional global, mediante las Categorías de estado global y cerebral pediátrico (CEGP-CECP) tras ingreso en Unidad de Cuidados Intensivos Pediátricos. Distribución por grupos. Evolución transcurrido un año tras el alta: igual-mejora o empeora.
Grupo A: N = 53; grupo B: N = 84; grupo C: N = 107; grupo D: N = 22.
Evolución-pronóstico funcional global, mediante la Escala de estado funcional recodificada (FSSglobal, FSSneuro1 y FSSneuro2) tras ingreso en Unidad de Cuidados Intensivos Pediátricos. Distribución por grupos. Evolución transcurrido un año tras el alta de UCIP: igual-mejora o empeora.
Grupo A: N = 53; grupo B: N = 84; grupo C: N = 107; grupo D: N = 22.
La valoración del niño crítico con enfermedad neurológica en la UCIP del HUMS, mediante el desarrollo de estudios seriados desde 1990, permite valorar la evolución en los últimos años, comparando su incidencia y pronóstico vital y funcional. Algunos resultados comparativos deben interpretarse con cautela, ya que el estudio actual hace referencia a «pacientes» para optimizar los resultados referentes al pronóstico a medio-largo plazo, mientras que los estudios previos se refieren a «episodios» y no a «pacientes».
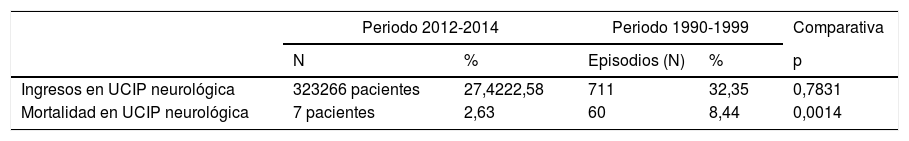
Desde el 15 de mayo de 1990 hasta el 31 de diciembre de 1999, ingresaron 2.198 niños en la UCIP del HUMS. Hubo 711 ingresos (32,34%) con algún tipo de problema neurológico, porcentaje similar al periodo actual (27,42%: 323 episodios sobre 1.178 totales). La tabla 6 muestra la comparativa del estudio actual con lo recogido en el periodo 1990-1999. La mortalidad general en UCIP ha disminuido significativamente (5,60 vs. 2,1%; p = 0,0003), al igual que la mortalidad del niño crítico neurológico (8,44 vs. 2,63%; p = 0,0014).
Comparativa del estudio actual con el periodo 1990-1999
| Periodo 2012-2014 | Periodo 1990-1999 | Comparativa | |||
|---|---|---|---|---|---|
| N | % | Episodios (N) | % | p | |
| Ingresos en UCIP neurológica | 323266 pacientes | 27,4222,58 | 711 | 32,35 | 0,7831 |
| Mortalidad en UCIP neurológica | 7 pacientes | 2,63 | 60 | 8,44 | 0,0014 |
| Ingresos y mortalidad por diagnósticos | Comparativa | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Motivo de ingreso | Mortalidad | Motivo de ingreso | Mortalidad | Motivo de ingreso | de mortalidad | |||||
| N | % | N | % | N | % | N | % | p | p | |
| TCE | 103 | 38,72 | - | - | 255 | 35,86 | 80 | 3,64 | 0,41 | 0,000 |
| Convulsiones | 49 | 18,42 | - | - | 119 | 16,74 | 57 | 2,59 | 0,53 | 0,000 |
| Encefalopatía aguda | 54 | 20,3 | 25 | 2,12 | 105 | 14,77 | 190 | 8,64 | 0,04 | 0,000 |
| Hidrocefalia-disfunción DVP | 68 | 25,56 | 15 | 2,11 | 0,000 | |||||
| Posneurocirugía tumoral | 23 | 9,5 | - | - | 70 | 9,85 | 2 | 1,09 | 0,66 | 0,0003 |
| Posneurocirugía total | 66 | 24,81 | - | - | 127 | 17,86 | 2 | 1,57 | 0,01 | 0,30 |
| PCR | 11 | 4,1 | 4 | 36,36 | 24 | 3,38 | 7 | 29,17 | 0,57 | 0,92 |
DVP: derivación ventrículo-peritoneal; PCR: parada cardiorrespiratoria; TCE: traumatismo craneoencefálico,
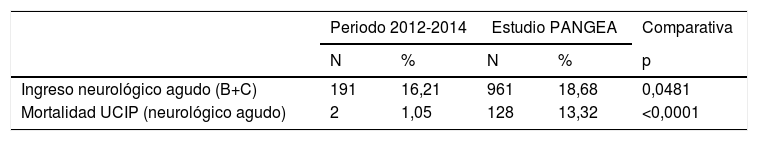
La tabla 7 muestra la comparativa del estudio PANGEA (niños neurocríticos) y los grupos B y C del análisis actual. Desde el 29 de noviembre de 2011 hasta el 24 de julio de 2012, en estudio transversal en 4fechas, ingresaron en las UCIP que componían el estudio 5.145 pacientes. De ellos, 961 presentaban enfermedad neurológica aguda (18,70%), comparados con los 191 de los grupos B y C (16,21%) (p = 0,0481) del estudio actual. Tanto la mortalidad como el empeoramiento funcional cerebral, clínicamente significativo, son mayores en el estudio PANGEA.
Comparativa del estudio actual de la UCIP del HUMS con el estudio PANGEA
| Periodo 2012-2014 | Estudio PANGEA | Comparativa | |||
|---|---|---|---|---|---|
| N | % | N | % | p | |
| Ingreso neurológico agudo (B+C) | 191 | 16,21 | 961 | 18,68 | 0,0481 |
| Mortalidad UCIP (neurológico agudo) | 2 | 1,05 | 128 | 13,32 | <0,0001 |
| Técnicas de neuromonitorización y tratamiento (respecto a los ingresos neurológicos agudos en UCIP) | |||||
|---|---|---|---|---|---|
| N | % | N | % | p | |
| Monitorización PIC | 14 | 7,33 | 144 | 14,98 | 0,005 |
| Electroencefalograma | 36 | 18,85 | 388 | 40,37 | <0,0001 |
| Tomografía computarizada | 85 | 44,50 | 578 | 60,15 | 0,0001 |
| Resonancia magnética | 31 | 16,23 | 457 | 47,55 | <0,0001 |
| Ventilación mecánica | 76 | 39,79 | 540 | 56,19 | <0,0001 |
| Anticomicial | 42 | 21,99 | 409 | 42,56 | <0,0001 |
| Anti-HTIC 1.er nivel | 22 | 11,52 | 191 | 19,88 | 0,0066 |
| Anti-HTIC 2.° nivel | 2 | 1,05 | 90 | 9,37 | <0,0001 |
| Salud funcional cerebral (CECP) basal, al alta de UCIP y evolución al alta de UCIP respecto a la situación basal (igual-mejora/empeora) | |||||
|---|---|---|---|---|---|
| N | % | N | % | p | |
| CECP basal buena (1-2) | 165 | 86,39 | 637 | 75,38 | 0,001 |
| CECP alta UCIP buena (1-2) | 145 | 75,92 | 393 | 49 | <0,0001 |
| Evolución CECP: empeora | 20 | 10,47 | 201 | 23,79 | <0,0001 |
anti-HTIC: antihipertensión intracraneal; CECP: Categorías estado cerebral pediátrico; CEGP: Categorías estado global pediátrico; PIC: presión intracraneal; UCIP: Unidad de Cuidados Intensivos Pediátricos.
La lesión cerebral es factor fundamental de morbimortalidad del niño crítico2. Los resultados muestran una visión global de la asistencia neurológica en UCIP del HUMS en los 3años recogidos. Aproximadamente un tercio (27,5%) de los ingresos en UCIP presentaban enfermedad neurológica. La mortalidad global estaba sobre el 2%. Si bien es clara la diferencia de puntuación obtenida mediante los modelos PRISM-III y PIM2 entre los que viven y los que fallecen, no se puede establecer significación estadística. Destaca la mortalidad (45,4%) tras recuperación de una parada cardiorrespiratoria, similar a lo descrito en la bibliografía (25-50%)14, reflejo de la importancia de la difusión de la formación en RCP. El cerebro es el órgano más vulnerable a la hipoxia e isquemia, y responsable, en gran medida de la evolución y pronóstico posreanimación20-22.
El concepto de morbilidad más adecuado es el de «salud funcional», valorado mediante escalas como las clásicas categorías CEGP-CECP9,11,12, o la nueva escala FSS13,15. Este estudio valora 2posibilidades de evolución tras el ingreso, al alta y transcurrido un año: mantenerse igual-mejorar o empeorar respecto a la situación basal.
Si bien más del 70 y del 85% de la muestra presentaba adecuada evolución funcional, global (CEGP) y cerebral (CECP) al alta de UCIP, respectivamente, el intento de optimizar el tratamiento intensivo pediátrico debe focalizarse en ese porcentaje de niños para los que el ingreso en UCIP supone empeoramiento funcional clínicamente significativo, dada su repercusión en los años de vida salvados23. Destaca la importante repercusión funcional entre los pacientes sin neuropatología de base, que parten, en casi el 100% de casos, de buena situación funcional.
La escala FSS indica una valoración más optimista al alta de UCIP, con una adecuada evolución funcional, global y neurológica, en más del 95% de la muestra.
Transcurrido un año del alta de UCIP, la evolución presenta mejoría funcional (CEGP-CECP), reflejo de la plasticidad, capacidad de recuperación y de la importancia de la rehabilitación. Sin embargo, no se alcanza un 100% de evolución favorable. Los pacientes sin enfermedad neurológica de base con daño cerebral secundario son los que muestran, transcurrido un año, menor porcentaje de recuperación: persiste alrededor de un 20% de pacientes con mala evolución funcional (CEGP-CECP). Según la nueva escala FSS, pese a ser más optimista al alta de UCIP, el porcentaje de adecuada evolución funcional es discretamente menor que al alta de UCIP, sobre todo en los pacientes del grupo A, quizá por la evolución degenerativa de su enfermedad de base. Coincidiendo con la valoración mediante CEGP-CECP, es evidente el mantenimiento de la repercusión funcional en el grupo D.
Comparado con nuestros datos previos (1990-1999)16, el porcentaje de pacientes que ingresa por motivo neurológico se ha mantenido estable, con aumento de los ingresos totales en UCIP. La mortalidad global y del paciente neurocrítico han disminuido. En ello son fundamentales los avances en prevención y tratamiento de la hipertensión intracraneal24, fluidoterapia isotónica en el intento de disminuir la hiponatremia yatrógena23,25, la craniectomía descompresiva26-28 y el uso precoz de corticoide a altas dosis29,30. El estudio previo no analiza el pronóstico funcional, por lo que no podemos establecer si este descenso de mortalidad supone empeoramiento funcional, tal y como muestran algunos estudios actuales31,32.
Comparado con el estudio internacional PANGEA17, el porcentaje de pacientes con enfermedad neurológica aguda es similar. La mortalidad y repercusión funcional cerebral son superiores a la del paciente neurológico agudo de la muestra del estudio. Esta importante diferencia se justifica porque el estudio PANGEA incluye unidades de todo el mundo, entre las que están incluidos países en diferente grado de desarrollo, lo que explica también la situación funcional cerebral (CECP) desfavorable de la que parten un porcentaje importante de los pacientes respecto al estudio actual. Esta situación basal desfavorable, unida a la alta frecuencia de situación post-PCR como motivo de ingreso, explican la mayor mortalidad.
Los datos del estudio multicéntrico PANGEA han sido recientemente publicados de nuevo33 y ponen de manifiesto la importancia significativa del daño neurológico agudo en la salud pediátrica a nivel mundial, dada su incidencia así como su sustancial contribución en términos de morbimortalidad. Por tanto, es fundamental el desarrollo de nuevos trabajos que permitan la optimización de técnicas de neuromonitorización y el desarrollo de nuevas terapias.
La neurovigilancia y la neuroprotección son de vital importancia en el manejo de todo niño crítico23, en los que es fundamental el trabajo multidisciplinar. La valoración de la salud funcional general y cerebral de forma objetiva y sistemática al alta de UCIP y su control evolutivo constituyen 2 de las labores fundamentales de este equipo. Y para que dicha valoración se realice de forma objetiva, es fundamental el empleo de escalas como CEGP-CECP y FSS.
En el HUMS trabajamos en equipo multidisciplinar, con protocolos consensuados y en permanente actualización y autoevaluación, para minimizar la variabilidad y optimizar la calidad asistencial del niño neurocrítico, en un proceso de mejora que no tiene punto final.
Conflicto de interesesLa realización de este trabajo no presenta ningún tipo de conflicto de intereses.