La escala autoadministrada de Evaluación de Signos y Síntomas Neuropáticos de Leeds (S-LANSS) es un instrumento diseñado para identificar a pacientes con dolor de características neuropáticas.
ObjetivoEvaluar la validez y fiabilidad de la versión española del S-LANSS.
MétodosSe incluyó un total de 182 pacientes con dolor crónico para evaluar la validez discriminante y convergente del S-LANSS, incrementándose la muestra hasta 321 pacientes para valorar la validez de constructo y la fiabilidad de la escala. Se utilizó como variable criterio la versión validada al español del ID-Pain. Todos los participantes cumplimentaron el cuestionario ID-Pain, el S-LANSS, y la Escala Numérica del Dolor. La validez discriminante se evaluó mediante el análisis del área bajo la curva de características operativas para el receptor, y la sensibilidad y especificidad. La validez de constructo se evaluó mediante un análisis factorial y mediante el análisis del odds-ratio de cada ítem del S-LANSS respecto a la puntuación total. La validez convergente y la fiabilidad se valoraron con la R de Pearson y el alfa de Cronbach respectivamente.
ResultadosEl punto de corte óptimo del S-LANSS fue ≥12 puntos (área bajo la curva=0,89; sensibilidad=88,7; especificidad=76,6). El S-LANSS presentó un factor y, además, cada ítem contribuyó significativamente a la puntuación total positiva del S-LANSS (p<0,05). El S-LANSS mostró una relación significativa con el ID-Pain (R=0,734) y un alfa de Cronbach de 0,71.
ConclusiónLa versión española del S-LANSS es válida y fiable para identificar pacientes con dolor crónico con características neuropáticas.
The self-administered Leeds Assessment of Neuropathic Symptoms and Signs (S-LANSS) scale is a tool designed to identify patients with pain with neuropathic features.
ObjectiveTo assess the validity and reliability of the Spanish-language version of the S-LANSS scale.
MethodsOur study included a total of 182 patients with chronic pain to assess the convergent and discriminant validity of the S-LANSS; the sample was increased to 321 patients to evaluate construct validity and reliability. The validated Spanish-language version of the ID-Pain questionnaire was used as the criterion variable. All participants completed the ID-Pain, the S-LANSS, and the Numerical Rating Scale for pain. Discriminant validity was evaluated by analysing sensitivity, specificity, and the area under the receiver operating characteristic curve (AUC). Construct validity was assessed with factor analysis and by comparing the odds ratio of each S-LANSS item to the total score. Convergent validity and reliability were evaluated with Pearson's r and Cronbach's alpha, respectively.
ResultsThe optimal cut-off point for S-LANSS was ≥12 points (AUC=.89; sensitivity=88.7; specificity=76.6). Factor analysis yielded one factor; furthermore, all items contributed significantly to the positive total score on the S-LANSS (P<.05). The S-LANSS showed a significant correlation with ID-Pain (r=.734, α=.71).
ConclusionThe Spanish-language version of the S-LANSS is valid and reliable for identifying patients with chronic pain with neuropathic features.
El dolor es definido como una experiencia sensorial y emocional desagradable asociada a un daño tisular real o potencial, o bien descrita en términos de tal daño1. Es una condición que altera en gran medida la calidad de vida de las personas2,3. El dolor agudo presenta diferencias respecto al crónico, siendo este último un reto para el diagnóstico médico en términos etiológicos y fisiopatológicos2. Según la fisiopatología, el dolor puede ser clasificado como nociceptivo o neuropático, definiéndose este último como cualquier dolor causado por una lesión o enfermedad del sistema nervioso somatosensorial4.
La prevalencia del dolor neuropático no está totalmente esclarecida ya que todavía no se ha conseguido establecer de forma fiable el porcentaje de pacientes con esta condición, aunque en España se estima que aproximadamente 2 millones de personas lo sufren5. Por otro lado, diversos estudios recientes han determinado que en atención primaria la incidencia del dolor neuropático puede llegar al 25% de los pacientes que consultan por dolor crónico, mientras que el motivo de consulta del 51% de los pacientes atendidos en unidades de dolor es por dolor neuropático6,7.
Actualmente disponemos de varios instrumentos documentales para la evaluación del dolor neuropático validados en diferentes idiomas, como pueden ser el cuestionario de Douleur Neuropathique 4 (DN4), la escala PainDETECT, el cuestionario ID-Pain, y la escala de Evaluación de Signos y Síntomas Neuropáticos de Leeds (Leeds Assessment of Neuropathic Symptoms and Signs [LANSS])8-14. En referencia a la escala de dolor LANSS, cabe mencionar que fue creada por Bennett con el objetivo de identificar a pacientes con dolor de características neuropáticas y que se trata de una escala validada al español13,15. Sin embargo, esta escala presenta alguna limitación ya que requiere realizar un examen clínico por parte de un médico, aunque dicha exploración sensitiva solo consta de 2 pruebas (alodinia, valorada con el roce de un algodón, e hiperalgesia mecánica, evaluada con un monofilamento), y también precisa de un aumento del tiempo necesario para la evaluación del paciente16. Posiblemente teniendo en cuenta esta problemática, Bennett creó la escala autocumplimentada LANSS (S-LANSS)17. Esta escala solventa las limitaciones de la escala LANSS debido a que se trata de un instrumento autoadministrado, lo que evita el requerimiento de un médico para su cumplimentación, y además podría implicar incluso menos tiempo puesto que consta del mismo número de ítems que la escala original17.
Por otro lado, la escala S-LANSS ha demostrado ser un instrumento válido y fiable para el diagnóstico de sujetos que sufren de dolor con características neuropáticas en diferentes idiomas17-20, pero actualmente no se dispone de una versión validada al español. Existen cuestionarios previamente validados al español para identificar a pacientes con dolor de características neuropáticas, como pueden ser el DN411, el PainDETECT14, o el ID-Pain12, no obstante, los autores consideramos que el S-LANSS presenta las siguientes ventajas frente a estos cuestionarios: 1) se trata de una escala autoadministrada mientras que el DN4 requiere de un médico para su aplicación, lo que además implica más tiempo; 2) contiene menos ítems que el PainDETECT, reduciendo de este modo el tiempo de aplicación, y 3) respecto al ID-Pain, el S-LANSS contiene ítems de autoevaluación de alodinia e hiperalgesia dirigidos a la región dolorosa, lo que podría repercutir en una identificación más precisa de la fisiopatología del dolor del paciente.
Por todo esto, el objetivo de este estudio fue la creación de la versión española de la escala S-LANSS, así como demostrar su validez y fiabilidad para identificar a los pacientes con dolor crónico con características neuropáticas.
MétodosInstrumentosDescripción de la escala autoadministrada de Evaluación de Signos y Síntomas Neuropáticos de Leeds (S-LANSS)El S-LANSS es una escala de autoadministración que identifica dolor con características neuropáticas17. Este instrumento comprende 7 ítems, 5 de ellos referentes al dolor padecido durante la última semana y 2 ítems en relación con signos clínicos, en los cuales el paciente debe autoexplorarse con el objetivo de dilucidar la presencia de alodinia e hiperalgesia. Todos los ítems presentan respuestas dicotómicas (sí/no). La puntuación total oscila entre 0 y 24 puntos, sugiriendo dolor neuropático una puntuación igual o superior a 12.
Descripción del ID-PainEl ID-Pain comprende 6 ítems de autocumplimiento, cuya finalidad es diferenciar dolor nociceptivo y dolor con características neuropáticas. Todos los ítems hacen referencia al dolor experimentado en la última semana y se responden de forma binaria (sí/no). En caso de respuesta afirmativa, los ítems son valorados con 1 punto, a excepción del ítem número 6 que se puntúa con –1, por lo que la puntuación total de este cuestionario oscila entre –1 y 5 puntos. La versión validada al español del ID-Pain estableció que una puntuación igual o superior a 3 indica presencia de dolor con características neuropáticas y además, posee aceptables propiedades psicométricas (sensibilidad: 0,81; especificidad: 0,84)12.
Descripción de la Escala Numérica del DolorLa Escala Numérica del Dolor (END) fue empleada para la evaluación de la intensidad del dolor percibido por el paciente durante la última semana. Esta escala se encuentra numerada del 0 al 10, debiendo marcar el paciente el número que mejor represente la intensidad de su dolor. Una puntuación de 0 indica «ausencia de dolor», mientras que una puntuación de 10 refleja «peor dolor imaginable». Existe evidencia que demuestra la fiabilidad y validez de la END en la medición de la intensidad del dolor21,22.
PacientesComo requisito indispensable, todos y cada uno de los participantes de este estudio debieron leer la hoja de información y firmar el consentimiento informado. Los criterios de selección fueron los siguientes: 1) hombres y mujeres mayores de 18 años; 2) pacientes con dolor crónico (más de 3 meses) con una puntuación en la END de al menos 3 puntos, y 3) capacidad de leer y comprender el español. Además, a todos los pacientes se les aplicó el cuestionario ID-Pain con el objetivo de atribuirles un diagnóstico de dolor con o sin componente neuropático; a falta de un consenso unánime, los autores decidimos establecer esta manera de diagnóstico como prueba de referencia o variable criterio debido a que el ID-Pain se encuentra validado para este propósito12.
Los pacientes con cáncer de etiología desconocida, pacientes con presencia de comorbilidades que puedan confundir el diagnóstico, así como pacientes con fibromialgia fueron excluidos del estudio. Además, cualquier condición psicológica, déficit cognitivo y/o consumo de sustancias de abuso o fármacos que, según el criterio del especialista, puedan comprometer la comprensión por parte del paciente de la escala S-LANSS fueron motivo de descarte para la participación en el estudio.
Diseño del estudioEl diseño consistió en un estudio observacional y transversal, en el que participaron los servicios médicos de la unidad del dolor del Hospital Universitario de La Paz (Madrid, España) y el servicio de fisioterapia del Centro de Atención Primaria Miraflores (Alcobendas, Madrid, España). Además, cabe mencionar que esta investigación fue aprobada por el Comité de Ética de Investigación Clínica del Hospital Universitario La Paz (número de registro, HULP: PI-2072).
Se realizó un muestreo consecutivo de todos los pacientes que acudieron a los 2 centros anteriormente mencionados. Todos aquellos que cumplieron los criterios de selección, en primer lugar fueron diagnosticados con presencia de dolor nociceptivo o con características neuropáticas según la variable criterio. A continuación, se dirigió a los pacientes a una sala independiente, donde un investigador cegado al diagnóstico establecido por el ID-Pain les aplicó la escala END y les invitó a autocumplimentar (sin ningún tipo de ayuda) los siguientes datos: 1) variables demográficas y antropométricas (edad, sexo, altura y peso), y 2) el S-LANSS.
El tamaño muestral se calculó con la intención de realizar un adecuado análisis factorial, por lo que se estableció un mínimo de 10-15 pacientes por ítem (número total entre 70-105 pacientes, ya que la escala se compone de 7 ítems)23. Teniendo en cuenta que además la escala S-LANSS pretende discernir entre dolor con y sin características neuropáticas, consideramos oportuno la inclusión de al menos 70 pacientes con presencia de dolor con características neuropáticas y 70 con dolor nociceptivo, con lo que finalmente se determinó un tamaño muestral de al menos 140 pacientes.
Adaptación lingüísticaEl creador del S-LANSS, el Dr. Michael Bennett, dio su autorización para traducir dicha escala al español. El proceso de adaptación lingüística del S-LANSS al español se realizó conforme a las recomendaciones convencionales para traducir y adaptar culturalmente cuestionarios basados en medidas informadas por los pacientes descritas por Wild et al.24. Para ello, en primer lugar 2 hispanoparlantes nativos bilingües tradujeron al español la versión inglesa original del S-LANSS de forma independiente, pretendiendo preservar el significado original de cada ítem, así como procurando emplear un lenguaje lo más clarificador posible. Un panel de expertos en dolor (con dominio del inglés y el español) evaluó, aprobó y fusionó ambas traducciones de la escala. A continuación, 2 angloparlantes nativos bilingües, los cuales desconocían la versión original, retrotradujeron el S-LANSS al inglés. Una vez alcanzado este momento, el panel de expertos se encargó de comparar las 2 retrotraducciones de la escala con la original, cerciorándose de que se mantenía la equivalencia semántica. En última instancia, la versión traducida al español del S-LANSS fue valorada, en términos de claridad y factibilidad de uso, mediante un estudio piloto compuesto por 30 sujetos con dolor crónico. Con base en los resultados de esta prueba piloto se modificó el instrumento, concluyendo de este modo el proceso de adaptación lingüística. La versión definitiva empleada en este estudio puede observarse en el anexo A.
PsicometríaEl análisis de las propiedades psicométricas del S-LANSS se enfocó a los criterios de validez y fiabilidad. A continuación se detalla de forma exhaustiva la inferencia realizada:
ValidezEntre los diferentes tipos de validez, se optó por estudiar los siguientes:
- –
Validez discriminante: para valorar este parámetro se comparó la capacidad del S-LANSS para diagnosticar dolor con características neuropáticas frente a la variable criterio (diagnóstico efectuado mediante el ID-Pain). En primer lugar, se evaluó el área bajo la curva de características operativas para el receptor (curva COR), con la intención de determinar la proporción de pacientes clasificados correctamente. El mayor valor que puede obtener este parámetro es 1, por lo que cuanto más cercano sea el resultado a este valor, mejor utilidad diagnóstica presentará. La precisión diagnóstica se considera alta para un resultado superior a 0,9, moderada entre 0,71-0,9, baja entre 0,51-0,7 y dependerá totalmente del azar con valores menores o iguales a 0,525.
Una vez establecido el punto de corte óptimo mediante el índice de Youden, se calcularon los siguientes indicadores en pruebas diagnósticas para dicha puntuación: la sensibilidad, la especificidad, el valor predictivo positivo (VPP), el valor predictivo negativo (VPN), la razón de probabilidad positiva (RPP), y la razón de probabilidad negativa (RPN).
Adicionalmente, mediante el índice de concordancia kappa de Cohen, se calculó el grado de acuerdo entre el diagnóstico establecido por el ID-Pain y el del S-LANSS basado en el punto de corte óptimo previamente calculado. Conforme los criterios establecidos por Landis y Koch26, un índice de kappa se clasifica en: casi perfecto (>0,80), sustancial (>0,60 y ≤0,80), moderado (>0,40 y ≤0,60), discreto (>0,20 y ≤0,40), e insignificante (≤0,20).
- –
Validez de constructo: para verificar la unidimensionalidad de la escala se empleó un análisis factorial exploratorio con un tipo de rotación Oblimin. El método de extracción del número de factores se determinó mediante el criterio de Kaiser (con un autovalor mayor o igual a 1) y el gráfico de sedimentación27. La homogeneidad de varianza fue evaluada mediante la prueba de Bartlett, mientras que la idoneidad de los datos para realizar un análisis factorial se valoró a través de la prueba de Kaiser-Meyer-Olkin (KMO). La prueba de Bartlett permite contrastar la hipótesis de que la matriz de correlaciones es una matriz identidad, por lo que debería ser <0,0528. La prueba KMO mide el grado de multicolinealidad, cuyos valores varían entre 0 y 1, con la siguiente interpretación: excelente 0,9-1; bueno 0,8-0,9; aceptable 0,7-0,8; mediocre 0,6-0,7; malo 0,5-0,6; inaceptables <0,529.
Por otro lado, también se analizó la relación existente entre cada ítem del S-LANSS con la variable criterio, así como con la puntuación total de la propia escala, estableciendo el odds ratio. De esta forma se pretende confirmar la contribución de cada ítem a la validez discriminativa, a la validez de constructo y a la puntuación total de la escala.
- –
Validez convergente: con la ayuda del coeficiente de correlación de Pearson, se analizó la validez convergente entre el S-LANSS y el ID-Pain. Un valor en dicho coeficiente superior a 0,60 refleja una correlación fuerte; entre 0,30 y 0,60 refleja una correlación moderada, y por debajo de 0,30, una correlación débil o muy débil30.
Se utilizó el estadígrafo alfa de Cronbach para determinar la consistencia interna de la escala S-LANSS. Para considerar un cuestionario internamente consistente, los valores de este estadígrafo deben ser mayores de 0,731.
Además, se realizó un análisis descriptivo de las características demográficas y de la intensidad del dolor de la muestra. Las variables continuas se presentaron como media±desviación estándar (DE), con intervalo de confianza (IC) del 95%, mientras que las categóricas se presentaron como número (n) y porcentaje (frecuencia relativa, %). Se optó por pruebas paramétricas (distribución normal) para la comparación entre grupos con base en el teorema central del límite, ya que el tamaño muestral de ambos grupos fue superior a 3032,33. Por lo tanto, se utilizó la prueba t-Student para las variables cuantitativas y la prueba Chi-cuadrado para las cualitativas. Un valor de p<0,05 se aceptó como estadísticamente significativo. El análisis de los datos se llevó a cabo con la versión 21.0 del software estadístico SPSS (SPSS Inc., Chicago, IL, EE.UU.).
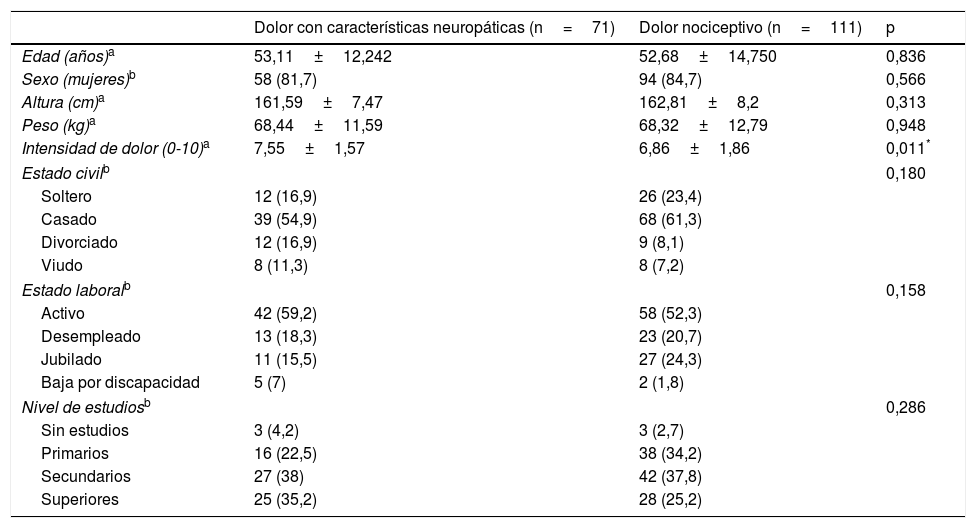
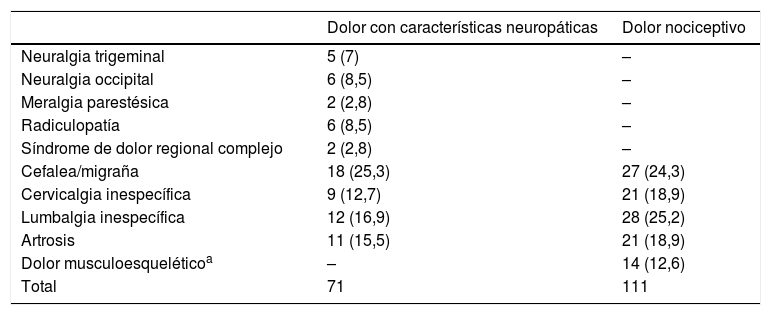
ResultadosSe incluyó un total de 182 pacientes con dolor crónico, con una media de edad de 52,85±13,79 años y con una mayor proporción de mujeres (83,5%). Con la ayuda del ID-Pain se clasificó la muestra, resultando un total de 71 pacientes asignados al grupo de dolor con características neuropáticas y 111 asignados al grupo de dolor sin características neuropáticas (nociceptivo). Ambos grupos mostraron similares características sociodemográficas, por lo que se consideraron homogéneos ya que no existieron diferencias estadísticamente significativas (p>0,05). Por el contrario, el grupo con características neuropáticas presentó una mayor intensidad de dolor que el grupo de dolor nociceptivo. Las características sociodemográficas y clínicas de los 2 grupos de dolor pueden observarse en la tabla 1. La etiología del dolor que presentaban los pacientes puede observarse en la tabla 2. Cabe mencionar que esta muestra (n=182) se empleó para evaluar la validez discriminante, la validez convergente y algún aspecto perteneciente a la validez de constructo (relación de cada ítem del S-LANSS respecto a la puntuación total del ID-Pain).
Características sociodemográficas e intensidad de dolor de los pacientes que sufren de dolor con y sin características neuropáticas
| Dolor con características neuropáticas (n=71) | Dolor nociceptivo (n=111) | p | |
|---|---|---|---|
| Edad (años)a | 53,11±12,242 | 52,68±14,750 | 0,836 |
| Sexo (mujeres)b | 58 (81,7) | 94 (84,7) | 0,566 |
| Altura (cm)a | 161,59±7,47 | 162,81±8,2 | 0,313 |
| Peso (kg)a | 68,44±11,59 | 68,32±12,79 | 0,948 |
| Intensidad de dolor (0-10)a | 7,55±1,57 | 6,86±1,86 | 0,011* |
| Estado civilb | 0,180 | ||
| Soltero | 12 (16,9) | 26 (23,4) | |
| Casado | 39 (54,9) | 68 (61,3) | |
| Divorciado | 12 (16,9) | 9 (8,1) | |
| Viudo | 8 (11,3) | 8 (7,2) | |
| Estado laboralb | 0,158 | ||
| Activo | 42 (59,2) | 58 (52,3) | |
| Desempleado | 13 (18,3) | 23 (20,7) | |
| Jubilado | 11 (15,5) | 27 (24,3) | |
| Baja por discapacidad | 5 (7) | 2 (1,8) | |
| Nivel de estudiosb | 0,286 | ||
| Sin estudios | 3 (4,2) | 3 (2,7) | |
| Primarios | 16 (22,5) | 38 (34,2) | |
| Secundarios | 27 (38) | 42 (37,8) | |
| Superiores | 25 (35,2) | 28 (25,2) | |
Los valores se expresan como media±DE y n (%).
Clasificación de la etiología de los pacientes con dolor crónico según la variable criterio ID-Pain
| Dolor con características neuropáticas | Dolor nociceptivo | |
|---|---|---|
| Neuralgia trigeminal | 5 (7) | – |
| Neuralgia occipital | 6 (8,5) | – |
| Meralgia parestésica | 2 (2,8) | – |
| Radiculopatía | 6 (8,5) | – |
| Síndrome de dolor regional complejo | 2 (2,8) | – |
| Cefalea/migraña | 18 (25,3) | 27 (24,3) |
| Cervicalgia inespecífica | 9 (12,7) | 21 (18,9) |
| Lumbalgia inespecífica | 12 (16,9) | 28 (25,2) |
| Artrosis | 11 (15,5) | 21 (18,9) |
| Dolor musculoesqueléticoa | – | 14 (12,6) |
| Total | 71 | 111 |
Los valores se expresan como n (%).
Para el análisis de la validez de constructo y de la fiabilidad de la escala S-LANSS, se incrementó la muestra en 139 pacientes mediante el empleo de bases de datos previas a este estudio. Estas bases de datos estuvieron constituidas en su totalidad por pacientes con dolor crónico inespecífico de cuello. Con todo ello, la muestra resultante para estos análisis fue de 321 pacientes con dolor crónico. Esta muestra presentó un porcentaje de mujeres del 82,5% y una edad media de 48,85±14,94 años.
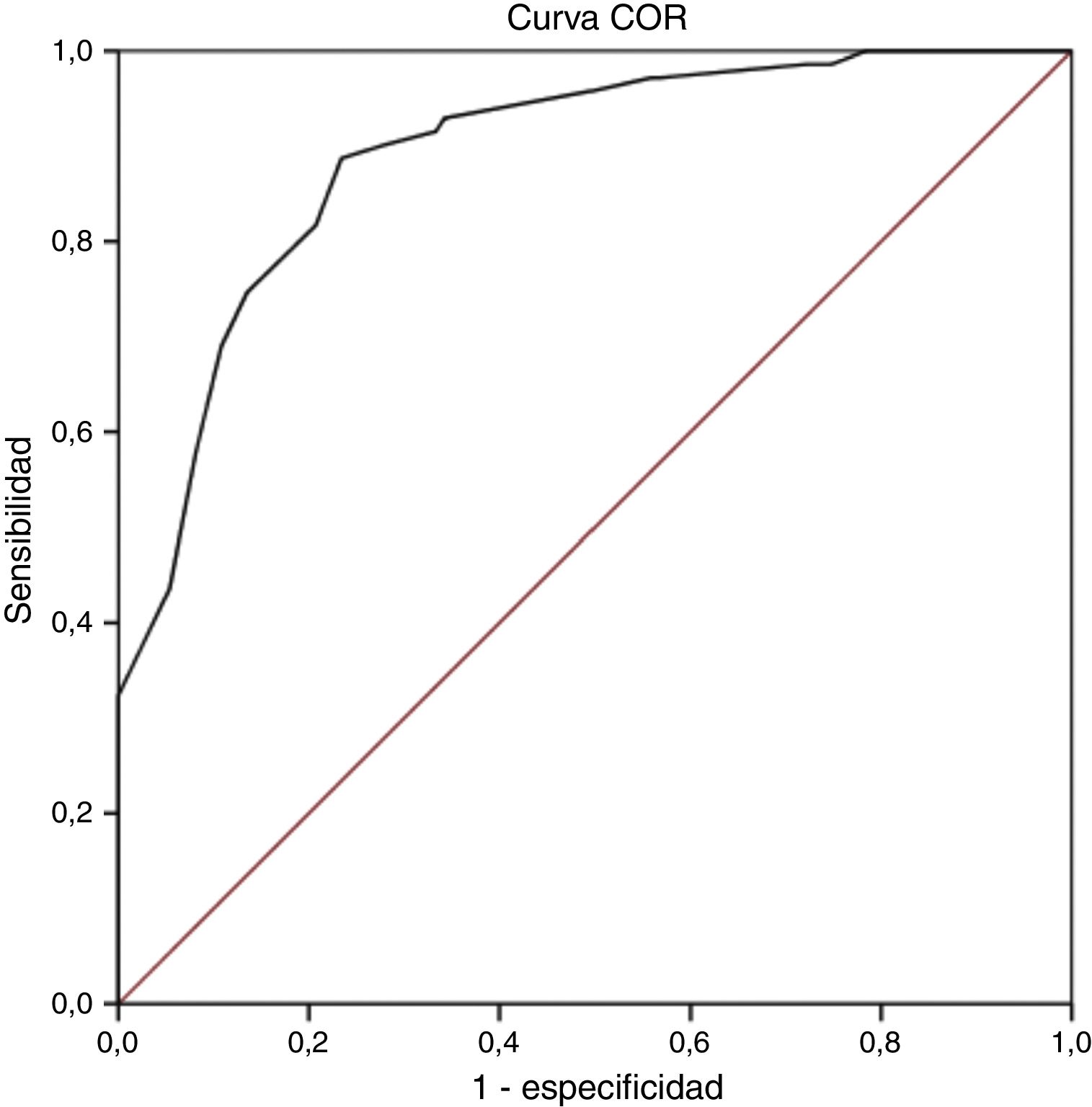
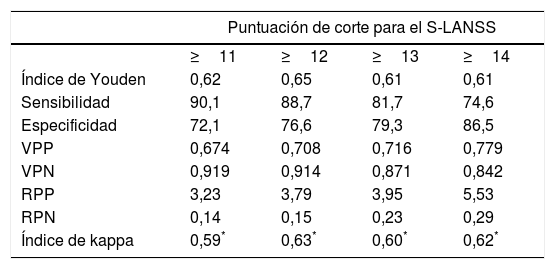
Validez discriminanteEl análisis de la curva COR mostró que el punto de corte óptimo tomando como variable criterio el diagnóstico establecido por el cuestionario ID-Pain fue un valor ≥12 puntos en la escala S-LANSS. Se obtuvo un valor COR de 0,89 (IC del 95%: 0,85-0,94; p<0,001; fig. 1), lo que indica una probabilidad moderada de acierto en el diagnóstico pero muy próxima a una probabilidad alta (>0,9). Además, dicho punto de corte presentó el mayor índice de Youden con un 0,65, siendo el más alto encontrado en el análisis y por lo tanto el que reflejó los valores más elevados de sensibilidad y especificidad, con un 88,7 y un 76,6% respectivamente. Por último, el grado de acuerdo en el diagnóstico con la escala ID-Pain basándonos en este punto de corte fue sustancial, como así lo indica la puntuación obtenida en el índice de kappa (κ=0,63; p<0,001). En la tabla 3 pueden observarse los indicadores en pruebas diagnósticas para los diferentes valores de corte de la puntuación total de la escala S-LANSS que obtuvieron un índice de Youden >0,6.
Indicadores de pruebas diagnósticas de la versión española del S-LANSS para aquellos puntos de corte con un índice de Youden superior a 0,6
| Puntuación de corte para el S-LANSS | ||||
|---|---|---|---|---|
| ≥11 | ≥12 | ≥13 | ≥14 | |
| Índice de Youden | 0,62 | 0,65 | 0,61 | 0,61 |
| Sensibilidad | 90,1 | 88,7 | 81,7 | 74,6 |
| Especificidad | 72,1 | 76,6 | 79,3 | 86,5 |
| VPP | 0,674 | 0,708 | 0,716 | 0,779 |
| VPN | 0,919 | 0,914 | 0,871 | 0,842 |
| RPP | 3,23 | 3,79 | 3,95 | 5,53 |
| RPN | 0,14 | 0,15 | 0,23 | 0,29 |
| Índice de kappa | 0,59* | 0,63* | 0,60* | 0,62* |
RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
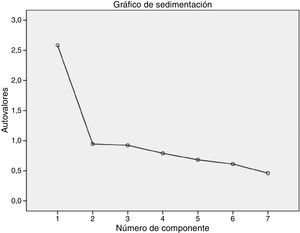
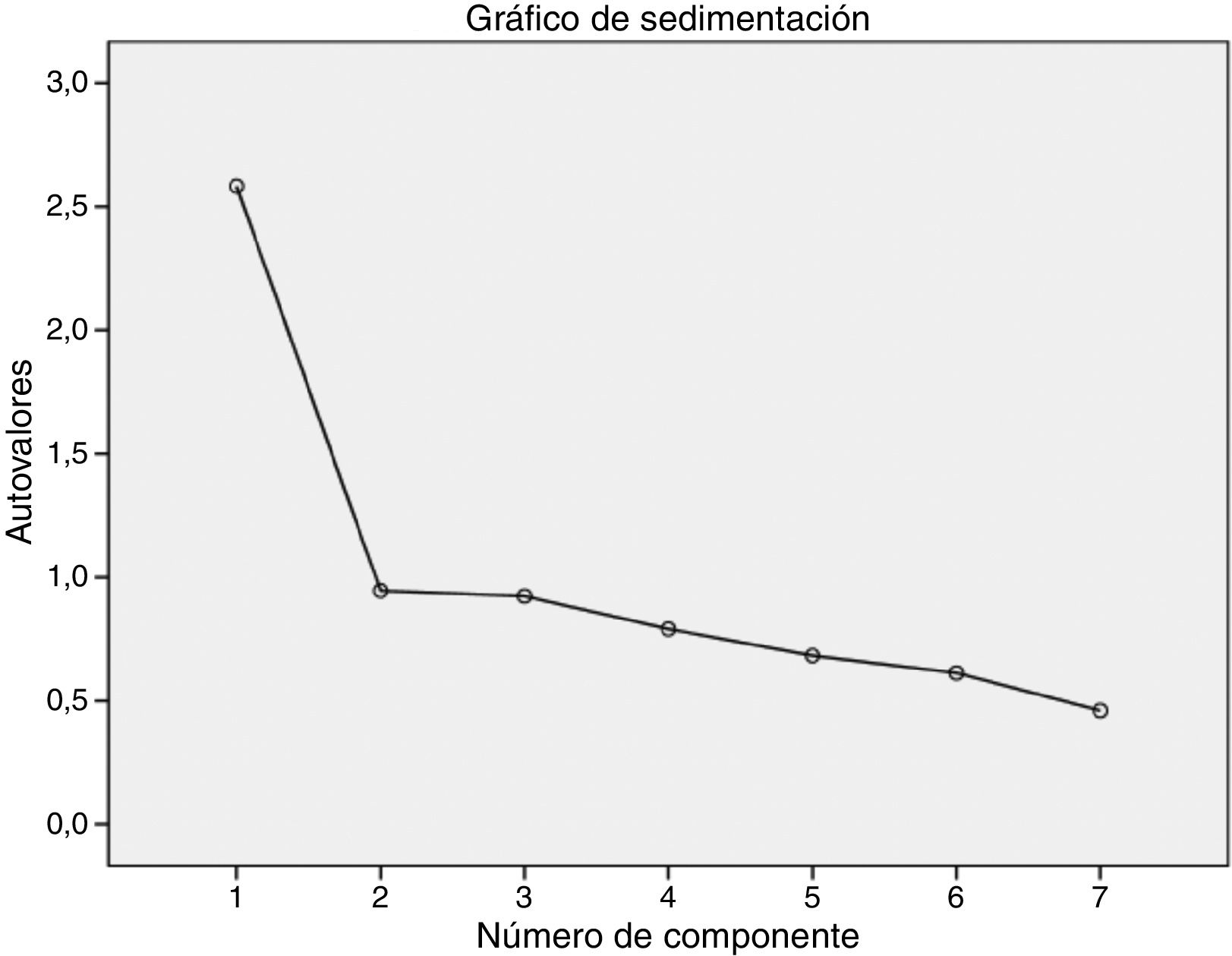
La estructura factorial del instrumento estuvo constituida por un único factor de acuerdo con los resultados obtenidos en el análisis factorial exploratorio. La solución de un factor se estableció mediante el empleo de un análisis de componentes principales con una rotación Oblimin que explicó el 36,9% de la varianza, aunque dicha rotación no se aplicó como consecuencia de la existencia de solo un factor. Además, los resultados obtenidos para la prueba de esfericidad de Bartlett y la de KMO pusieron de manifiesto la pertinencia de realizar el análisis factorial34. Concretamente, la prueba de esfericidad de Bartlett fue considerablemente significativa (Chi-cuadrado=337,881; p<0,001), mientras que para la prueba de KMO se encontró un valor de 0,774, lo que refleja un grado de multicolinealidad de los datos aceptable. Por último, el gráfico de sedimentación respaldó de forma gráfica la determinación de un factor (fig. 2). El peso factorial de los diferentes ítems obtenido en el análisis factorial exploratorio puede apreciarse en la tabla 4.
Peso factorial resultante para cada ítem de la versión española del S-LANSS conforme el análisis factorial exploratorio mediante el método de componentes principales
| Ítem del S-LANSS | Factor único |
|---|---|
| 1. En el área donde usted tiene dolor, ¿también tiene sensación de «pinchazos» o sensación de picor u hormigueo? | 0,591 |
| 2. ¿Cambia de color la zona dolorida (quizá se ve enrojecida), cuando usted siente dolor? | 0,425 |
| 3. En el área donde usted tiene dolor, ¿su piel presenta una sensibilidad anormal al tacto? Por ejemplo, al acariciar ligeramente la piel se producen sensaciones desagradables o dolorosas | 0,610 |
| 4. ¿El dolor aparece de repente y en ráfagas sin razón aparente, aunque esté completamente quieto? Estas sensaciones se podrían describir como «descargas eléctricas» o ráfagas | 0,493 |
| 5. En el área donde usted tiene dolor, ¿siente calor o un dolor quemante (quemazón)? | 0,655 |
| 6. Frótese suavemente con el dedo índice el área que le duele y después realice lo mismo en un área sin dolor (por ejemplo, en un área de piel alejada o en el lado opuesto a la zona del dolor). ¿Cómo siente ese frotamiento en la zona de dolor? | 0,756 |
| 7. Presione suavemente con su dedo un área que le duela y luego presione de la misma forma en otra área que no le duela (la misma zona sin dolor que seleccionó en la pregunta anterior). ¿Cómo siente la presión en el área de dolor? | 0,661 |
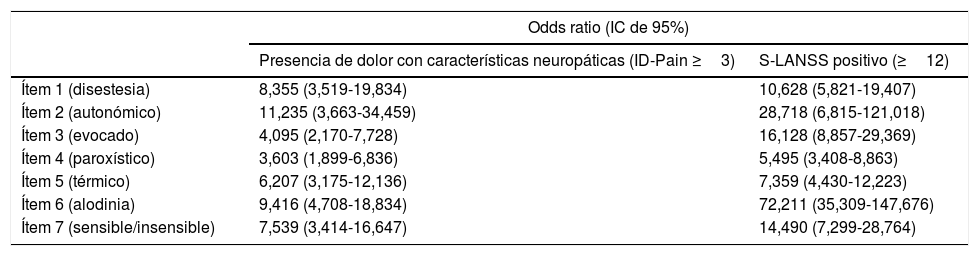
Se evaluó de manera independiente la relación entre cada ítem con la puntuación total de la escala S-LANSS y con la variable criterio (ID-Pain). Cabe mencionar que para calcular el odds ratio (IC 95%) de detectar dolor con características neuropáticas para cada ítem respecto a la puntuación total del S-LANSS, se dicotomizó esta última considerándose positivos aquellos casos en los que el valor final fue mayor o igual al punto de corte óptimo establecido en este mismo estudio (12 puntos). Los resultados confirmaron la contribución de cada ítem a la puntuación total de la escala, así como su validez de constructo y discriminante, puesto que todos ellos se relacionaron significativamente con una puntuación total positiva tanto en el S-LANSS como en el ID-Pain (tabla 5).
Probabilidad de detectar dolor con características neuropáticas de cada ítem del S-LANSS respecto a la propia escala y a la variable criterio
| Odds ratio (IC de 95%) | ||
|---|---|---|
| Presencia de dolor con características neuropáticas (ID-Pain ≥3) | S-LANSS positivo (≥12) | |
| Ítem 1 (disestesia) | 8,355 (3,519-19,834) | 10,628 (5,821-19,407) |
| Ítem 2 (autonómico) | 11,235 (3,663-34,459) | 28,718 (6,815-121,018) |
| Ítem 3 (evocado) | 4,095 (2,170-7,728) | 16,128 (8,857-29,369) |
| Ítem 4 (paroxístico) | 3,603 (1,899-6,836) | 5,495 (3,408-8,863) |
| Ítem 5 (térmico) | 6,207 (3,175-12,136) | 7,359 (4,430-12,223) |
| Ítem 6 (alodinia) | 9,416 (4,708-18,834) | 72,211 (35,309-147,676) |
| Ítem 7 (sensible/insensible) | 7,539 (3,414-16,647) | 14,490 (7,299-28,764) |
IC: intervalo de confianza.
Se obtuvo un coeficiente de correlación de Pearson entre la puntuación total del S-LANSS (sin atender a puntos de corte) y la del ID-Pain de 0,734 (p<0,001). Por lo tanto, la relación existente entre ambos cuestionarios fue fuerte, pudiéndose determinar la existencia de una validez convergente adecuada.
FiabilidadEl análisis de la consistencia interna de la escala fue aceptable ya que se obtuvo un coeficiente alfa de Cronbach para la correlación ítem-total de 0,71 (IC del 95%: 0,66-0,76). Este resultado pone de manifiesto que la escala S-LANSS es fiable a la hora de clasificar a pacientes con dolor crónico.
DiscusiónEl presente estudio se diseñó para realizar una completa validación al español y comprobar la fiabilidad de la escala S-LANSS. Concretamente, evaluó la validez discriminante, la validez de constructo y la validez convergente de la escala. Los resultados muestran que la escala es válida y fiable para su uso clínico en población adulta de habla española con dolor crónico.
Actualmente, existen diversos métodos diagnósticos para identificar a pacientes con dolor neuropático y algunos de ellos son muy avanzados, como por ejemplo el láser de potenciales evocados35. A pesar del desarrollo en esta área, todavía se considera que no existe una «prueba de oro» o gold standard para el diagnóstico del dolor neuropático35. Por todo esto, el diagnóstico por parte de un especialista se considera el criterio más aceptado. De este modo, el empleo de instrumentos documentales podría ser de utilidad para ayudar al clínico tanto a orientar su diagnóstico como a realizar su toma de decisiones36. Teniendo esto en cuenta, la versión española del S-LANSS dota a los sanitarios clínicos españoles de más herramientas en la difícil tarea de establecer un diagnóstico sobre el dolor del paciente. Además, al tratarse de una versión autocumplimentada podría permitir al clínico centrar la exploración clínica de acuerdo con los resultados de esta escala, lo que podría repercutir en la adopción de tratamientos más acordes con las características del dolor del paciente. No obstante, es imprescindible recalcar que ningún test de screening puede sustituir en la actualidad al diagnóstico realizado por un especialista (basado en historia clínica, exploración física y pruebas complementarias).
En la validez discriminante, el punto de corte óptimo para el diagnóstico de pacientes con dolor de características neuropáticas fue de 12 puntos o más, indicando una probabilidad moderada-alta de acierto en el diagnóstico. Es importante recalcar que este punto de corte óptimo coincide con el encontrado en las versiones validadas previamente17-19, con la única excepción de la versión cumplimentada mediante el formato cuyo punto de corte óptimo fue de 10 o más17. Sin embargo, este último aspecto no debería tenerse en cuenta puesto que nuestro propósito fue validar una escala de autocumplimentación. Además, la versión española del S-LANSS mostró una sensibilidad del 88,7% y una especificidad del 76,6%. Estos datos son superiores a los presentados en una reciente revisión sistemática sobre la capacidad de los cuestionarios para la detección del dolor neuropático8. Sin embargo, cabe destacar que dicha revisión no incluyó la validación de la versión griega del S-LANSS como consecuencia de su posterior publicación20. No obstante, al comparar los principales indicadores de pruebas diagnósticas obtenidos en este estudio con el resto de validaciones disponibles en otros idiomas17,18,20, podemos observar que la versión en español del S-LANSS presenta claramente el mayor nivel de sensibilidad, con un 88,7%. Los autores hipotetizamos que la obtención de una sensibilidad tan elevada podría deberse al empleo del cuestionario ID-Pain como variable criterio, ya que ambos cuestionarios mostraron una fuerte relación, mientras que el resto de validaciones del S-LANSS utilizaron como criterio el diagnóstico. Respecto a la especificidad, la versión española obtuvo un valor del 76,6%, el cual es muy similar a los encontrados en las previas versiones validadas del S-LANSS (un 76% en la versión inglesa original17 y un 80% en la versión en turco18), a excepción de la versión griega, que presentó una especificidad del 95,2%20. Los motivos por los cuales la versión validada al griego del S-LANSS mostró una sensibilidad tan alta se escapan al conocimiento de los autores.
Por otro lado, los resultados de esta investigación reflejaron la existencia de un factor, así como la contribución de cada ítem a la puntuación total de la escala con una validez discriminante similar a la observada en otras versiones, especialmente en la versión original17,18. De este modo, la presencia de características clínicas como alodinia y disfunciones autonómicas parecen ser las más determinantes a la hora de identificar a pacientes con dolor de características neuropáticas.
La consistencia interna de la escala S-LANSS en español demostró ser aceptable, con un alfa de Cronbach de 0,71. Este resultado se sitúa en la misma línea que el observado en las versiones validadas previamente (versión inglesa original=0,7617; versión árabe=0,7219; versión turca=0,7418; versión griega=0,6720). No obstante, cabe destacar que el presente estudio es el que mayor muestra utilizó para valorar este estadígrafo, con un total de 321 pacientes.
En referencia a la intensidad del dolor percibida por el paciente, los resultados de este estudio reflejaron una mayor intensidad del dolor con características neuropáticas en comparación con el dolor sin componente neuropático. Al revisar la literatura, encontramos controversia al respecto puesto que existen investigaciones que confirman este hallazgo37-40, y otras que reflejan una ausencia de diferencias17-19. Es importante mencionar que algunos estudios emplearon la END mientras que otros utilizaron la escala visual analógica, pudiendo este aspecto influir en las diferencias encontradas entre estudios. Sin embargo, pese a la discrepancia entre los distintos estudios mencionados, estas diferencias no fueron clínicamente relevantes41-45.
Existen algunas limitaciones en esta investigación que deben ser informadas. En esta validación se ha utilizado el cuestionario ID-Pain adaptado al español como variable criterio para el diagnóstico del dolor con características neuropáticas. El Grupo de Especial Interés en Dolor Neuropático de la Asociación Internacional para el Estudio del Dolor recomienda que el diagnóstico del dolor neuropático debería establecerse a través de la historia clínica, del examen clínico exhaustivo y/o de test diagnósticos apropiados que confirmen o descarten la presencia de lesión del sistema somatosensorial46. Por lo tanto, futuros estudios deberían validar la versión española del S-LANSS tomando como variable criterio el diagnóstico de un especialista ya que, mientras no se definan de manera universal y consensuada los criterios para considerar a un dolor neuropático, este diagnóstico es el empleado en la toma de decisiones clínicas y en la selección de la muestra en ensayos clínicos47. Otra limitación radica en que la fiabilidad test-retest no fue evaluada, impidiendo conocer el comportamiento de la escala en el tiempo. Además, los resultados obtenidos no pueden extrapolarse a pacientes con dolor agudo/subagudo, así como a población pediátrica o adolescente puesto que la muestra estuvo constituida por pacientes mayores de 18 años con dolor crónico. Finalmente, los autores consideramos que a pesar de los esfuerzos por dicotomizar el tipo de dolor de los pacientes, muchos de ellos podrían presentar dolor de tipo mixto, lo que podría afectar a los resultados observados. Este última limitación podría minimizarse mediante el empleo de una escala visual analógica en la que el especialista indique su grado de seguridad en el diagnóstico del tipo de dolor, del mismo modo que se ha realizado en otros estudios17,48. No obstante, cabe destacar que la población de estudio se encontró constituida por pacientes con patologías muy heterogéneas, muchas de las cuales pueden presentar dolor de tipo mixto como es el caso de las lumbalgias y cervicalgias. Por ello, consideramos que los resultados obtenidos en este estudio podrían diferir en el caso de emplear una muestra con patologías con dolor más claramente definido como neuropático o nociceptivo.
En conclusión, los resultados de este estudio muestran que la versión española del S-LANSS es válida y fiable para identificar pacientes con dolor crónico con características neuropáticas, por lo que podría recomendarse su uso en la práctica clínica. Se necesitan futuras investigaciones que evalúen la probabilidad de acierto diagnóstico de esta escala frente al criterio de un especialista, así como su fiabilidad test-retest.
Conflicto de interesesTodos los autores del presente trabajo declaran no tener conflicto de intereses relacionados con el presente manuscrito.
Los autores de este manuscrito queremos agradecer el esfuerzo prestado a la Dra. María Ángeles Mangas Guijarro, a Dña. Gema Yagüe de Antonio y al Dr. Manuel Lara Lara por su colaboración en la participación del panel de expertos, así como por su ayuda en el reclutamiento de la muestra. También nos gustaría agradecer al Dr. Michael Bennett por la creación de la escala, así como por su consentimiento para traducir y validar el S-LANSS al español.






![Curva de eficacia diagnóstica (curva de características operativas para el receptor [COR]) de la versión española del S-LANSS. Curva de eficacia diagnóstica (curva de características operativas para el receptor [COR]) de la versión española del S-LANSS.](https://static.elsevier.es/multimedia/02134853/0000003300000008/v1_201810011012/S0213485316302249/v1_201810011012/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)