La evidencia de que la recanalización y la reperfusión del lecho vascular distal de pacientes adecuadamente seleccionados son fundamentales para lograr un buen pronóstico funcional ha disparado el interés y la investigación sobre el tratamiento endovascular del ictus isquémico agudo.
DesarrolloLa fibrinólisis intravenosa (i.v.) es el tratamiento de elección en pacientes con ictus isquémico agudo, aunque presenta ciertas limitaciones. El tratamiento endovascular supone una alternativa prometedora con ventajas teóricas sobre el tratamiento i.v., como una mayor frecuencia de recanalización y mayor ventana terapéutica. Las estrategias de reperfusión endovascular incluyen fibrinólisis intraarterial con fármacos o tratamiento mecánico con dispositivos que permiten extracción, aspiración, disrupción o atrapamiento del trombo en la pared. El ideal del tratamiento integral del ictus agudo sería aportar especificidad al paciente individual: tratar una oclusión arterial con unas colaterales y con una fisiología de la isquemia cerebral aguda determinadas. Con todos estos datos, ante cualquier paciente podremos decidir la mejor estrategia terapéutica y pasar de un enfoque del paciente basado únicamente en el tiempo a un enfoque basado también en la fisiopatología; por lo tanto, distintos pacientes tendrían diferentes ventanas terapéuticas. La situación del tratamiento endovascular en España es heterogénea y precisa de recursos materiales y humanos para conseguir su implantación en todo el territorio.
ConclusionesEl tratamiento endovascular del ictus supone una nueva herramienta terapéutica para lograr la reperfusión de una forma segura en los pacientes no candidatos a alteplasa o que no han conseguido reperfundir con el fibrinolítico i.v.
The evidence that recanalization and reperfusion of the distal vascular bed in appropriately selected patients is crucial to achieve good functional outcome has triggered interest and research into endovascular treatment of acute ischemic stroke.
DevelopmentIntravenous (iv) thrombolytic therapy is the treatment of choice in patients with acute ischemic stroke, however, it has certain limitations. Endovascular treatment is a promising alternative with theoretical advantages over iv therapy, such as an increased frequency of recanalization and longer therapeutic windows. Endovascular reperfusion strategies include intra-arterial fibrinolysis with drugs, or endovascular mechanical devices for thrombectomy or thrombus disruption, thromboaspiration, or thrombus entrapment in the vessel wall. The ideal of comprehensive treatment of acute stroke would provide specificity to treat an individual patient: with specific arterial occlusion and collaterals and a determined physiology of acute cerebral ischemia. With all this information, we would decide the best therapeutic strategy for the patient, and move from just a time-based approach to include a pathophysiology approach as well, and thus different patients could have different therapeutic windows. The endovascular treatment situation in Spain is heterogeneous and requires human and material resources to enable it to be implemented throughout the country.
ConclusionsEndovascular treatment of stroke is a new therapeutic tool for achieving reperfusion safely in patients ineligible for Alteplase or who have failed reperfusion with an iv fibrinolytic.
El ictus es la primera causa de mortalidad de las mujeres, la segunda de los varones y la primera causa de discapacidad y dependencia del adulto. Tras un periodo de nihilismo frente al manejo del infarto cerebral agudo, la fibrinólisis intravenosa (i.v.) con alteplasa (activador recombinante del plasminógeno tisular, rtPA) supuso un gran cambio en el abordaje terapéutico de estos pacientes. El tratamiento endovascular del ictus supone una alternativa prometedora en pacientes no candidatos a rtPA o que no han mejorado con la fibrinólisis i.v. La evidencia de que la recanalización de pacientes adecuadamente seleccionados es fundamental para lograr un buen pronóstico funcional ha disparado el interés y la investigación sobre esta nueva terapia endovascular.
Fibrinólisis intravenosa: “tiempo es cerebro”La era moderna del tratamiento revascularizador para el ictus isquémico agudo comenzó a mediados de los años noventa con el estudio del National Institute of Neurological Disorders and Stroke (NINDS)1 en las primeras 3 h desde el inicio de los síntomas. El análisis conjunto de los ensayos clínicos con rtPA i.v. confirmó el beneficio clínico observado en las primeras 3 h y señaló un beneficio adicional a partir de las 3 h en algunos pacientes2. La posibilidad de obtener un beneficio clínico a los 3 meses disminuía conforme aumentaba el tiempo desde el inicio del ictus al inicio del tratamiento. El beneficio del rtPA i.v. entre 3 y 4,5 h fue confirmado en el estudio ECASS III en un subgrupo de pacientes3. La fibrinólisis i.v. rtPA fue el primer tratamiento aprobado para el ictus agudo que trataba de forma efectiva la oclusión vascular que producía el ictus. Es un tratamiento fácil de aplicar, rápido y que no requiere experiencia técnica o un equipamiento especializado; únicamente precisa de una valoración clínica adecuada del paciente por un experto y una tomografía computarizada (TC) craneal que descarte hemorragia. No es necesario objetivar oclusión de una arteria cerebral para su aplicación, primando un abordaje basado en la rapidez de inicio del tratamiento. Sin embargo, la fibrinólisis i.v. con rtPA dista de ser el tratamiento perfecto para todos los pacientes. En primer lugar, no es aplicable a todos, tanto por la estrecha ventana terapéutica como por exclusión debida a parámetros analíticos, por ejemplo. En segundo lugar, las tasas de recanalización con rtPA i.v. en oclusiones de arterias proximales varían desde menos de un 10% para oclusión de arteria carótida interna hasta un 30% en arteria cerebral media proximal4,5. En tercer lugar, el beneficio clínico obtenido en el estudio NINDS muestra un aumento absoluto del 12% en el número de pacientes sin o con mínima discapacidad entre el grupo placebo y el grupo tratado con rtPA a los 3 meses. Este beneficio, aunque subestimado ya que no incluye a los pacientes que mejoran parcialmente, todavía se puede mejorar con estrategias más efectivas dado el gran impacto de la patología cerebrovascular. Es ya una evidencia que la recanalización conlleva mejor pronóstico y menor mortalidad6. Por todo ello, se buscan nuevas estrategias que consigan una reperfusión más completa que conlleve un mejor pronóstico funcional a largo plazo.
Tratamiento neurovascular intervencionista: del “tiempo es cerebro” a la importancia de la recanalización del vaso y la reperfusión distalExisten tres tipos de estrategias de reperfusión, la más conocida es la recanalización de una arteria ocluida o reperfusión anterógrada, aunque hay otras estrategias alternativas, como la reperfusión global o aumento de flujo, que pretende aumentar el flujo sanguíneo cerebral para perfundir el lecho vascular distal a la oclusión vía colateralidad leptomeníngea y/o colaterales del polígono de Willis, como el dispositivo Neuroflo7.
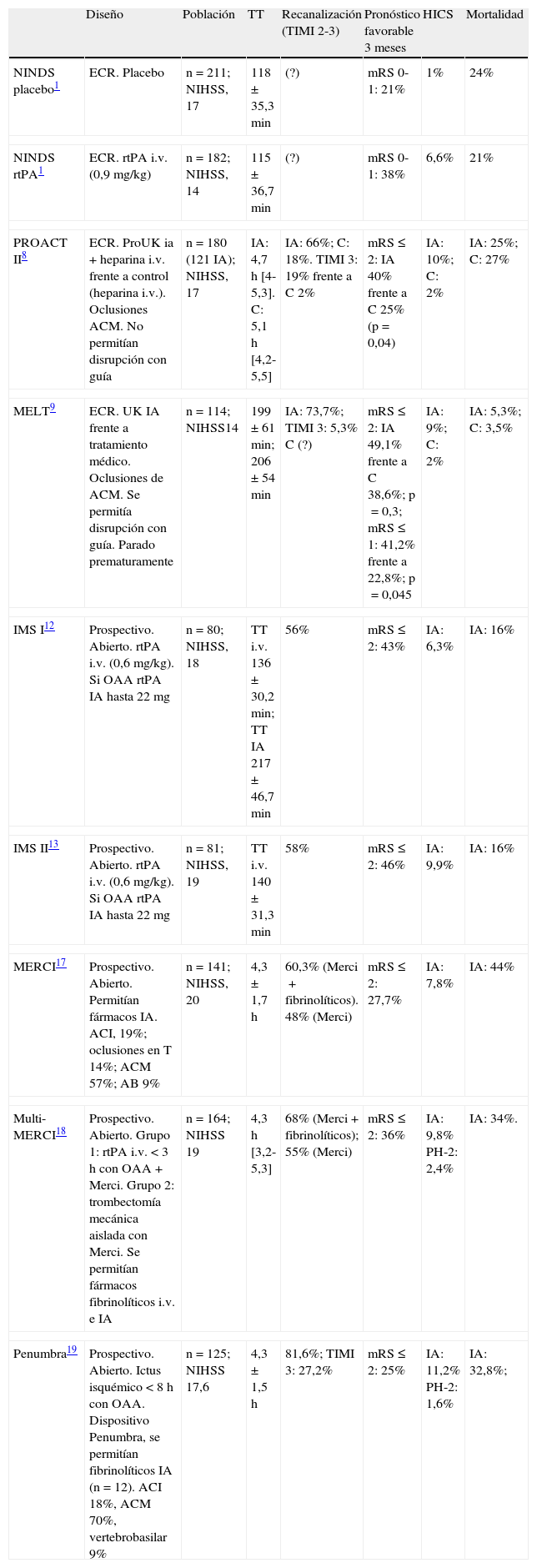
Las estrategias de reperfusión endovascular incluyen fibrinólisis intraarterial con fármacos, extracción o tratamiento mecánico con dispositivos que permiten aspiración o disrupción del trombo, o un atrapamiento del trombo en la pared (stents). En la tabla 1 se reflejan los principales estudios.
Principales estudios en el tratamiento endovascular del ictus.
| Diseño | Población | TT | Recanalización (TIMI 2-3) | Pronóstico favorable 3 meses | HICS | Mortalidad | |
| NINDS placebo1 | ECR. Placebo | n=211; NIHSS, 17 | 118±35,3 min | (?) | mRS 0-1: 21% | 1% | 24% |
| NINDS rtPA1 | ECR. rtPA i.v. (0,9 mg/kg) | n=182; NIHSS, 14 | 115±36,7 min | (?) | mRS 0-1: 38% | 6,6% | 21% |
| PROACT II8 | ECR. ProUK ia+heparina i.v. frente a control (heparina i.v.). Oclusiones ACM. No permitían disrupción con guía | n=180 (121 IA); NIHSS, 17 | IA: 4,7 h [4-5,3]. C: 5,1 h [4,2-5,5] | IA: 66%; C: 18%. TIMI 3: 19% frente a C 2% | mRS ≤ 2: IA 40% frente a C 25% (p=0,04) | IA: 10%; C: 2% | IA: 25%; C: 27% |
| MELT9 | ECR. UK IA frente a tratamiento médico. Oclusiones de ACM. Se permitía disrupción con guía. Parado prematuramente | n=114; NIHSS14 | 199±61 min; 206±54 min | IA: 73,7%; TIMI 3: 5,3% C (?) | mRS ≤ 2: IA 49,1% frente a C 38,6%; p=0,3; mRS ≤ 1: 41,2% frente a 22,8%; p=0,045 | IA: 9%; C: 2% | IA: 5,3%; C: 3,5% |
| IMS I12 | Prospectivo. Abierto. rtPA i.v. (0,6 mg/kg). Si OAA rtPA IA hasta 22 mg | n=80; NIHSS, 18 | TT i.v. 136±30,2 min; TT IA 217±46,7 min | 56% | mRS ≤ 2: 43% | IA: 6,3% | IA: 16% |
| IMS II13 | Prospectivo. Abierto. rtPA i.v. (0,6 mg/kg). Si OAA rtPA IA hasta 22 mg | n=81; NIHSS, 19 | TT i.v. 140±31,3 min | 58% | mRS ≤ 2: 46% | IA: 9,9% | IA: 16% |
| MERCI17 | Prospectivo. Abierto. Permitían fármacos IA. ACI, 19%; oclusiones en T 14%; ACM 57%; AB 9% | n=141; NIHSS, 20 | 4,3±1,7 h | 60,3% (Merci+fibrinolíticos). 48% (Merci) | mRS ≤ 2: 27,7% | IA: 7,8% | IA: 44% |
| Multi-MERCI18 | Prospectivo. Abierto. Grupo 1: rtPA i.v. < 3 h con OAA+Merci. Grupo 2: trombectomía mecánica aislada con Merci. Se permitían fármacos fibrinolíticos i.v. e IA | n=164; NIHSS 19 | 4,3 h [3,2-5,3] | 68% (Merci+fibrinolíticos); 55% (Merci) | mRS ≤ 2: 36% | IA: 9,8% PH-2: 2,4% | IA: 34%. |
| Penumbra19 | Prospectivo. Abierto. Ictus isquémico < 8 h con OAA. Dispositivo Penumbra, se permitían fibrinolíticos IA (n=12). ACI 18%, ACM 70%, vertebrobasilar 9% | n=125; NIHSS 17,6 | 4,3±1,5 h | 81,6%; TIMI 3: 27,2% | mRS ≤ 2: 25% | IA: 11,2% PH-2: 1,6% | IA: 32,8%; |
ACI: arteria carótida interna; ACM: arteria cerebral media; C: control; ECR: ensayo clínico aleatorizado; HICS: hemorragia intracerebral sintomática; IA: intraarterial; i.v.: intravenoso; mRS: escala de Rankin modificada; NIHSS: National Institutes of Health Stroke Scale; OAA: oclusión arterial angiográfica; PH-2: transformación hemorrágica tipo hematoma parenquimatoso tipo 2; ProUK: prourocinasa; rtPA: activador del plasminógeno tisular recombinante; TIMI: Thrombolysis In Myocardial Infarction; TT: tiempo al tratamiento; UK: urocinasa.
La fibrinólisis intraarterial presenta ventajas de acceder directamente al vaso ocluido, poder infundir el fibrinolítico dentro del trombo con una menor dosis y conseguir una mayor frecuencia de recanalización. Los estudios aleatorizados PROACT II8, MELT9, junto con datos del PROACT I, han demostrado una menor frecuencia de muerte o dependencia a largo plazo en pacientes con oclusión de arteria cerebral media (ACM) tratados con fibrinólisis intraarterial, en comparación con controles (el 58,5 frente al 69,2%; p=0,03; odds ratio [OR]=0,58; intervalo de confianza [IC] del 95%, 0,36-0,93)10. No obstante, la tasa de recanalización de estos estudios confirma que el tratamiento fibrinolítico intraarterial no es la solución definitiva para el desafío de recanalizar rápida y completamente una arteria cerebral ocluida.
El tratamiento combinado de fibrinólisis i.v. con rtPA, seguido de tratamiento intraarterial, se ha denominado tratamiento combinado o de transición (bridging). Los estudios EMS11, IMS I12 e IMS II13 evaluaron su eficacia con dosis de rtPA menores. Varios estudios publicados apoyan también la seguridad de tratamiento intraarterial tras dosis plena de rtPA i.v.14–16, y muestran una frecuencia de recanalización mayor en el grupo combinado, sin diferencias en mortalidad, cualquier tipo de hemorragia o hemorragia cerebral sintomática.
En cuanto a dispositivos mecánicos, los dispositivos MERCI17,18 y Penumbra19 tienen la indicación para tratamiento endovascular del ictus. No obstante, hay otros muchos dispositivos disponibles, como los stents intracraneales autoexpandibles20, algunos recuperables, que consiguen mayor tasa de recanalización con seguridad y eficacia.
Aunque existen series de casos publicados, ante la escasez de datos controlados, se tiende a comparar los distintos estudios. Sin embargo, ni las poblaciones ni los objetivos de cada estudio son comparables. La explicación de por qué se observa poco beneficio clínico pese a la alta frecuencia de recanalización en los estudios de dispositivos mecánicos podría estar en las diferencias en la localización del trombo y la carga de trombo total, severidad basal y el tiempo transcurrido desde el inicio de los síntomas.
En general, son pacientes con una severidad del ictus mayor, tratados con un tiempo mayor, y aunque el beneficio clínico es moderado, conseguimos abrir la ventana terapéutica hasta 8 h, tratando a pacientes más graves con seguridad y mayor frecuencia de recanalización (tabla 1).
La frecuencia de recanalización del vaso ocluido varía con el método de tratamiento empleado: recanalización espontánea (21%), fibrinólisis i.v. (46,2%), fibrinólisis intraarterial (63,2%), tratamiento combinado i.v./ intraarterial (67,5%), tratamiento mecánico (83,6%)6. El pronóstico clínico a los 3 meses es favorable (mRS ≤ 2) en el 8% de los pacientes que no recanalizan, en el 33% de las reoclusiones y en el 50% de las recanalizaciones estables. La mortalidad a los 3 meses es del 42, el 33 y el 8% respectivamente21. Sin embargo, la relación entre reperfusión y pronóstico clínico no es siempre proporcional, ya que otros factores como la intensidad y la duración de la isquemia, la severidad del ictus, la circulación colateral, la presión de perfusion cerebral, la localización de la lesión y su volumen son determinantes en el pronóstico clínico. Por lo tanto, la reperfusión se puede seguir de mejoría, empeoramiento o muerte por edema cerebral o hemorragia intracerebral22.
Los problemas actuales de la evidencia disponible sobre revascularización endovascular son la falta de estudios aleatorizados, pequeñas muestras de pacientes, ausencia de controles adecuados y falta de criterio principal de valoración de eficacia. Los estudios se realizan con diferentes pautas de anticoagulación periprocedimiento, o diferentes pautas de antiagregación durante o tras el procedimiento en el caso de colocación de un stent. Además, se deberían homogeneizar las definiciones como, por ejemplo, la de recanalización con la escala Thrombolysis In Myocardial Infarction (TIMI), que valora la recanalización del vaso ocluido, pero es diferente de la reperfusión global del lecho distal23.
Hay estudios que limitan el tratamiento endovascular a una única técnica: sólo fibrinolítico, o sólo un dispositivo endovascular. La realidad del paciente con ictus agudo es que es posible que haya que utilizar varios dispositivos y se precisa una destreza técnica importante.
El ideal del tratamiento integral del ictus agudo sería aportar especificidad al paciente individual al tratar una oclusión arterial determinada, con unas características etiológicas determinadas (trombo fresco, ateromatosis previas, disección carotídea), con unas colaterales determinadas, con un precondicionamiento isquémico determinado y con una fisiología de la isquemia cerebral aguda determinada. Con todos estos datos, ante un paciente podremos decidir la mejor estrategia terapéutica y pasar de un enfoque basado en el tiempo a un enfoque basado en la fisiología cerebral y, por tanto, distintos pacientes tendrán diferentes ventanas terapéuticas.
La penumbra isquémica es el tejido cerebral isquémico que está funcionalmente dañado y en riesgo de infarto, pero con el potencial de que se salve por la reperfusión, junto o con otras estrategias. De no reperfundir, se recluta en el core del infarto. La neuroimagen multimodal, resonancia magnética (RM) multiparamétrica y TC de perfusión, puede ayudar en la selección de los pacientes mediante la valoración de la penumbra isquémica. La RM evalúa el mismatch entre el core del infarto en la imagen potenciada en difusión (Dwi) y la región hipoperfundida en la imagen potenciada en perfusión (Pwi)24. La región de penumbra isquémica está mantenida por las colaterales del paciente. Aunque existe cierta controversia, ya que la Dwi puede contener áreas de penumbra y la Pwi puede sobrestimar la penumbra, el mismatch Dwi/Pwi es una estrategia ampliamente utilizada y disponible, con el potencial de guiar la selección de pacientes candidatos a tratamiento revascularizador con extensión de la ventana terapéutica. Otras formas de estimar la penumbra son el mismatch clínica-Dwi o angio-RM-Dwi25. La TC de perfusión ha probado ser una alternativa a la RM multimodal para la selección de pacientes para tratamiento trombolítico. Hay en marcha estudios controlados y aleatorizados con selección de pacientes mediante neuroimagen multimodal, como el MR Rescue (MR Imaging and Recanalization of Stroke Clots Using Embolectomy) o el DAWN (Dwi and CTP Assessment in the Triage of Wake-Up and Late Presenting Strokes Undergoing Neurointervention), con resultados preliminares muy interesantes26.
Situación actual del neurointervencionismo en EspañaEn el artículo publicado en este número de Neurología, Cruz Culebras et al27 presentan los datos preliminares del tratamiento endovascular del ictus en la Comunidad de Madrid. Se presentan unos resultados muy interesantes: en 41 pacientes con NIHSS mediana de 17, se consigue recanalización total o parcial en el 78% de los casos, con el 2,4% de transformación hemorrágica sintomática, una mortalidad general del 19,5% (mayor en los que no recanalizaron) y beneficio clínico (mRS ≤ 2) en el 53,6%. Es un grupo heterogéneo de pacientes y el protocolo del procedimiento endovascular no está estandarizado entre los distintos hospitales. Tampoco hay una forma consensuada de selección de los pacientes con neuroimagen multiparamétrica. No obstante, es un inicio muy atractivo, que nos debe hacer recapacitar a los profesionales sobre la posibilidad real de aplicar el tratamiento endovascular a pacientes con ictus isquémico y oclusión de gran vaso de una forma segura y eficaz.
Se muestra a 41 pacientes en un periodo de 4 años, con lo que se puede decir que este tipo de tratamiento endovascular no se realiza de forma sistemática en esta comunidad; en ella hay un plan de ictus de tratamiento endovascular en marcha, pero en la actualidad sólo un hospital de Madrid dispone de guardia de neurointervencionismo. La situación actual en España acerca de la instauración del tratamiento endovascular del ictus no está resuelta, aunque algunas comunidades autónomas lo han iniciado, existen grandes diferencias entre comunidades. En algunos hospitales el tratamiento forma parte de la práctica clínica diaria, pero la realidad es que en la mayoría se realiza de forma puntual, sin un protocolo establecido, a costa de un esfuerzo personal y el riesgo legal de los profesionales implicados. Mientras en el resto de Europa y Estados Unidos el tratamiento endovascular del ictus forma parte de la rutina diaria del tratamiento de estos pacientes, en España todavía tenemos camino por recorrer.
En España, todavía existen áreas geográficas en las que el paciente con ictus no es valorado por un neurólogo de guardia, no puede ingresar en una unidad de ictus, no recibe tratamiento i.v. con rtPA o lo recibe más tarde porque la guardia del neurólogo es localizada. Es frecuente que no se disponga de neuroimagen multiparamétrica 24 h al día para ayudar en la selección de los pacientes y no hay suficientes neurointervencionistas formados para realizar los procedimientos, o en los lugares en los que sí que se dispone de ellos, no se ha establecido una guardia médica. Para mejorar esta realidad, el Plan de Atención Sanitaria al Ictus y la Estrategia Nacional de Ictus han sentado las bases para que esta realidad mejore a corto plazo. Será fundamental proporcionar los recursos materiales y humanos necesarios y la colaboración entre diferentes especialistas para que esta realidad funcione y seamos capaces de aportar beneficio a nuestros pacientes con ictus y contribuir a la evidencia científica.
ConclusionesCon la evidencia actual, podemos decir que la recanalización y la reperfusión en un paciente con ictus isquémico agudo y oclusión de gran vaso conllevan mejor pronóstico clínico y menor mortalidad. Las técnicas de imagen actuales nos permiten ver de una forma rápida y fiable el vaso ocluido y, en ocasiones, la etiología, las colaterales e incluso la fisiopatología de la isquemia cerebral en ese paciente concreto. Se ha de realizar tratamiento con alteplasa sin demora, siempre que esté indicado, pero no podemos ignorar el resto de la información que nos ofrecen las técnicas de imagen. El tratamiento endovascular del ictus supone una nueva herramienta para lograr la reperfusión de una forma segura en los pacientes no candidatos a alteplasa o que no han conseguido reperfundir con ella. No obstante, queda mucho camino por recorrer, y son necesarios ensayos clínicos aleatorizados y controlados, para conseguir un mayor grado de evidencia que avale el beneficio del tratamiento endovascular del ictus isquémico agudo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.