El objetivo del presente trabajo es contrastar la influencia que presentan los síntomas motores y no motores en la calidad de vida de los pacientes con enfermedad de Parkinson (EP), y observar la asociación entre ambos tipos de síntomas.
Material y métodosEstudio transversal que incluye 103 pacientes con EP (55 hombres y 48 mujeres). La calidad de vida fue estudiada con la escala 39-Item Parkinson's Disease Questionnaire (PDQ-39). También se administró la escala Unified Parkinson's Disease Rating Scale (UPDRS I-IV), agrupando diferentes ítems para analizar la presencia de temblor, rigidez, bradicinesia y síntomas axiales para definir los subgrupos clínicos. Para valorar los síntomas no motores, administramos la non-motor symptoms scale (NMSS). Se hicieron estudios de correlación entre las diferentes escalas para ver la influencia sobre la calidad de vida de síntomas motores y no motores.
ResultadosSe observaron correlaciones entre las puntuaciones en el PDQ-39 Summary Index (PDQ-39_SI) y la NMSS (cc: 0,56; p<0,001), UPDRS III (cc: 0,44; p<0,001) y con la UPDRS IV; (cc: 0,37; p<0,001). La mayor relación correspondía a los síntomas cognitivos y del estado de ánimo. Existe relación directa entre la puntuación en la NMSS y los síntomas axiales (cc: 0,384; p<0,01); bradicinesia (cc: 0,299; p<0,01) y en menor medida rigidez (cc: 0,194; p<0,05). No se observó ninguna relación entre la presencia de temblor y la puntuación en la NMSS.
ConclusiónHay un mayor peso de los síntomas cognitivos y del estado de ánimo sobre la calidad de vida de los pacientes con EP. Hay al menos 2 fenotipos claramente diferenciados uno con predominancia de síntomas axiales donde hay una gran afectación de síntomas no motores y un fenotipo tremórico con una significativa menor presencia de los mismos.
The aim of the present study is to analyse the influence that motor and non-motor symptoms have on the quality of life (QoL) of patients with Parkinson's disease (PD), and to study the relationship between the two types of symptoms.
Material and methodsThis cross-sectional study included 103 patients with PD (55 men and 48 women). Quality of life was measured on the PDQ-39 scale. The UPDRS scale (I-IV) was also used, and different items were grouped to analyse the presence of tremor, rigidity, bradykinesia, and axial symptoms. The non-motor symptoms scale (NMSS) was administered to assess non-motor symptoms. We performed correlation analyses between different scales to analyse the influence of motor and non-motor symptoms on QoL.
ResultsCorrelations were observed between the PDQ-39 summary index (PDQ39_SI) and the NMSS (correlation coefficient [cc], 0.56; p<.001), UPDRS III (cc, 0.44; p< .001) and UPDRS IV (cc, 0.37; p<.001) scores. The strongest correlation was between cognitive symptoms and mood. The analysis pointed to a direct relationship between the NMSS score and axial symptoms (cc, 0.384; p<.01), bradykinesia (cc, 0.299; p<.01), and to a lesser extent, rigidity (cc, 0.194; p<.05). No relationship was observed between presence of tremor and the NMSS score.
ConclusionCognitive symptoms and mood exert the most influence on QoL of patients with PD. We found at least two phenotypes; one with predominantly axial symptoms, with significant involvement of non-motor symptoms, and a tremor-associated phenotype in which these symptoms are less prevalent.
La enfermedad de Parkinson (EP) es una enfermedad crónica y neurodegenerativa para la que no existe tratamiento curativo1. Diferentes estudios2-9 han evaluado la repercusión de distintas terapias sobre la calidad de vida de los pacientes con EP mostrando efectos beneficiosos a pesar de la ausencia de tratamiento curativo. Para ello, conocer la influencia de los diferentes síntomas en la calidad de vida del paciente con EP adquiere gran relevancia10–13.
En los últimos años se ha dado especial importancia a la presencia de los síntomas no motores como los trastornos del sueño, los cognitivos y los trastornos del estado de ánimo entre otros10–14. Hasta la fecha los síntomas más frecuentes y con más impacto han sido los trastornos del sueño, principalmente la presencia de un sueño fragmentado y la nicturia y entre los trastornos del ánimo, fundamentalmente la depresión10,12,13,15. Entre los síntomas motores, la presencia de inestabilidad, trastornos de la marcha y las complicaciones motoras en forma de fluctuaciones son los que más afectan a la calidad de vida11.
Por otro lado, es importante evaluar la distribución de los síntomas motores y no motores en un mismo paciente y definir los subgrupos clínicos en función de la agrupación de ambos tipos de síntomas y ver qué impacto tienen sobre la calidad de vida, tanto individualmente como conjuntamente. Estudios preliminares describen una mayor presencia de deterioro cognitivo en los fenotipos con más síntomas axiales (habla, expresión facial, rigidez axial, reflejos posturales, bradicinesia global, postura, levantarse desde una silla, trastornos de la marcha)16,17. También el grado y distribución de la asimetría de los síntomas motores puede influir en la presencia de algunos síntomas no motores18.
El objetivo principal del presente trabajo es contrastar la influencia que ambos síntomas motores y no motores tienen sobre la calidad de vida, y por otro lado, observar la distribución y asociación de ambos síntomas con el fin de definir los distintos subgrupos con diferente perfil clínico.
Pacientes y métodosEstudio de tipo transversal que incluyó un total de 103 pacientes ambulatorios (55 hombres y 48 mujeres) diagnosticados de EP según los criterios del Banco de Cerebros de Londres19. Los pacientes fueron estudiados en consulta, por las tardes de las 16:30 a las 18:00 horas, de manera consecutiva por 3 neurólogos (JCGE, BT y KB) adscritos a la Unidad de Trastornos del Movimiento del hospital de Cruces entre febrero del 2010 y julio del 2012. La edad media fue de 66,49±9,96 años y la duración de la enfermedad fue de 7,93±11,6 años de enfermedad, el estadio Hoehn & Yahr medio fue de 2,2±0,61 (tabla 1). Previamente a la entrevista, se les administró un documento en el que se explicó detalladamente los objetivos del estudio, con la garantía de confidencialidad de todos los datos obtenidos. Un consentimiento informado aprobado por el comité de ética local fue requerido antes de la inclusión de los pacientes en la base de datos elaborada para la ocasión. Pacientes con sospecha de parkinsonismos atípicos, o de otro origen fueron excluidos del estudio. También fueron excluidos aquellos que no podían responder de manera adecuada a los cuestionarios clínicos (por ejemplo, pacientes con severos trastornos del lenguaje o con demencia). Los pacientes participantes debían de tener una edad mínima de 18 años, sin límite de edad superior.
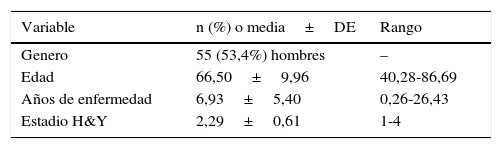
Valores de la media, desviación estándar (DE) y rango de género, edad, duración y estadio Hoehn & Yahr (H&Y) de la enfermedad de muestra poblacional de pacientes con enfermedad de Parkinson
| Variable | n (%) o media±DE | Rango |
|---|---|---|
| Genero | 55 (53,4%) hombres | – |
| Edad | 66,50±9,96 | 40,28-86,69 |
| Años de enfermedad | 6,93±5,40 | 0,26-26,43 |
| Estadio H&Y | 2,29±0,61 | 1-4 |
Se registraron datos demográficos como la fecha de nacimiento, fecha y edad al diagnóstico, años de la enfermedad en el momento de la entrevista, género y medicación dopaminérgica.
La calidad de vida fue estudiada mediante el uso de la escala PDQ-3920 en su versión en español (The 39-Item Parkinson's Disease Questionnaire). El PDQ-39 summary index (PDQ-39_SI) tiene un rango de 0-100 con rangos más altos indicando peor función. Se analizaron por separado cada una de las 8 dimensiones en las que se descompone dicha escala (movilidad, actividades de la vida diaria, estado emocional, estigmatización de la enfermedad, soporte social, estado cognitivo, comunicación y malestar corporal). También se administró la escala Unified Parkinson's Disease Rating Scale (UPDRS I-IV)21 usada para valorar el estado mental, actividades de la vida diaria, situación motora y complicaciones de la medicación dopaminérgica. Los valores de la subescala UPDRS I van de 0-16, en la UPDRS II de 0-52, en la UPDRS III de 0-108 y en la UPDRS IV de 0-44, una puntuación más alta indica una peor condición clínica. Agrupamos los siguientes ítems de la escala UPDRS III con el fin de estudiar los síntomas motores: temblor de reposo en las 4 extremidades (20r+20l+21r+21l), rigidez en las 4 extremidades (24r+24l+25r+25l), bradicinesia en las 4 extremidades (26r+26l+27r+27l+28r+28l+29r+29l). Finalmente agrupamos los ítems que reflejan los síntomas axiales de dicha escala (18+19+23+30+31+32+33+34).
Para valorar los síntomas no motores, administramos la non-motor symptoms scale (NMSS)22, es una escala específicamente desarrollada para pacientes con EP que consta de 30 ítems agrupados en 9 dominios que analizan diferentes aspectos clínicos, excluidos los motores, de la EP. Estos dominios son cardiovascular (2 ítems), sueño/fatiga (4 ítems), animo/cognitivo (6 ítems), problemas de percepción/alucinaciones (3 ítems), atención/memoria (3 ítems), urinario (3 ítems), función sexual (2 ítems) y miscelánea (4 ítems). Cada ítem es puntuado en función de la severidad (0-3) y de la frecuencia (0-4).
Análisis estadísticoSe calcularon la media y desviación estándar para cada una de las variables cuantitativas. En el caso de variables cualitativas se calcularon las proporciones. La normalidad y homogeneidad de las variables fueron confirmadas mediante el test de Kolmogorov-Smirnov y test de Levene respectivamente. Para explorar las relaciones entre la escala PDQ-39_SI y el resto de variables se empleó el análisis de los coeficientes de correlación de Pearson. Posteriormente se empleó un análisis de regresión lineal múltiple para identificar las variables predictoras de la calidad de vida en pacientes con EP, sin incluir la escala UPDRS II. Se empleó el software SPSS-12 para Windows (SPSS Inc, Chicago, IL, EE. UU.).
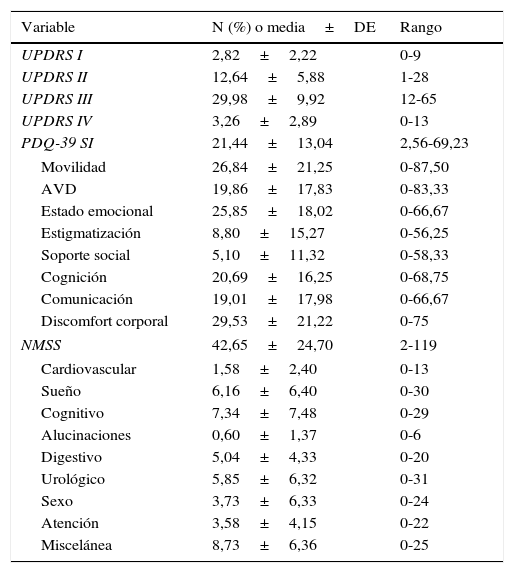
ResultadosDescripción de los principales síntomas no motores mediantenon-motor symptoms scaleDentro de los síntomas no motores el dominio más frecuentemente reportado es el de miscelánea (97 pacientes, 94,2%) que engloba la presencia de dolor, déficit de olfacción, trastornos de la sudoración y cambios en el peso. En una frecuencia alta se registraron los trastornos del sueño (91 pacientes, 88,3%), urinarios (84 pacientes, 81,6%), gastrointestinales (84 pacientes, 81,6%) y ánimo/cognitivo (83 pacientes, 80,6%). Los trastornos de atención (78 pacientes, 75,7%), los síntomas en la esfera cardiovascular (56 pacientes, 54,4%) y los sexuales (40 pacientes, 38,8%) aunque frecuentes se sitúan en un rango inferior al de anteriores dimensiones. Los síntomas no motores menos frecuentemente reportados son los que afectan la percepción y las alucinaciones (26 pacientes, 25,2%). En la tabla 2 se pueden apreciar las puntuaciones en cada dimensión de la escala NMSS y en la de calidad de vida PDQ-39.
Valores de la media, desviación estándar (DE) y rango de las escalas de la muestra poblacional de pacientes con enfermedad de Parkinson
| Variable | N (%) o media±DE | Rango |
|---|---|---|
| UPDRS I | 2,82±2,22 | 0-9 |
| UPDRS II | 12,64±5,88 | 1-28 |
| UPDRS III | 29,98±9,92 | 12-65 |
| UPDRS IV | 3,26±2,89 | 0-13 |
| PDQ-39 SI | 21,44±13,04 | 2,56-69,23 |
| Movilidad | 26,84±21,25 | 0-87,50 |
| AVD | 19,86±17,83 | 0-83,33 |
| Estado emocional | 25,85±18,02 | 0-66,67 |
| Estigmatización | 8,80±15,27 | 0-56,25 |
| Soporte social | 5,10±11,32 | 0-58,33 |
| Cognición | 20,69±16,25 | 0-68,75 |
| Comunicación | 19,01±17,98 | 0-66,67 |
| Discomfort corporal | 29,53±21,22 | 0-75 |
| NMSS | 42,65±24,70 | 2-119 |
| Cardiovascular | 1,58±2,40 | 0-13 |
| Sueño | 6,16±6,40 | 0-30 |
| Cognitivo | 7,34±7,48 | 0-29 |
| Alucinaciones | 0,60±1,37 | 0-6 |
| Digestivo | 5,04±4,33 | 0-20 |
| Urológico | 5,85±6,32 | 0-31 |
| Sexo | 3,73±6,33 | 0-24 |
| Atención | 3,58±4,15 | 0-22 |
| Miscelánea | 8,73±6,36 | 0-25 |
NMSS: Non Motor Symptoms Scale; PDQ-39: The 39 Item Parkinson's Disease Questionnaire; UPDRS: Unified Parkinson's Disease Scale.
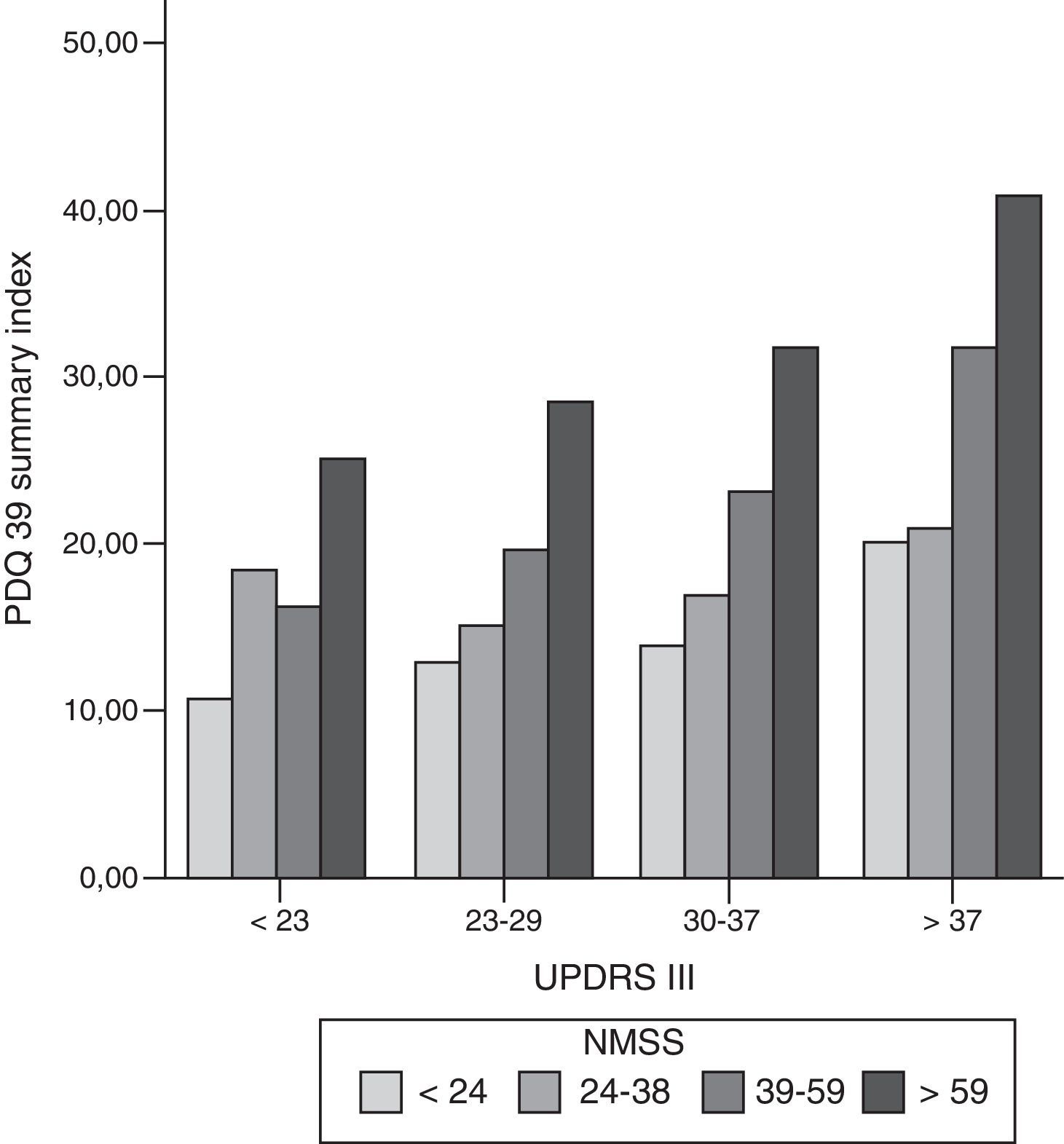
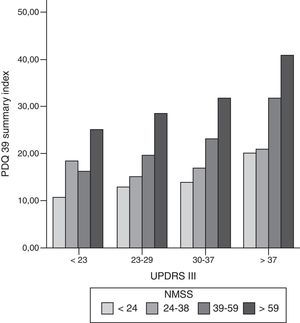
Se observan correlaciones significativas altas entre las puntuaciones en el PDQ-39_SI y las escalas de síntomas no motores (NMSS; cc: 0,56; p<0,001), de síntomas motores (UPDRS-III; cc: 0,44; p<0,001) y con la escala que mide complicaciones motoras de los fármacos dopaminérgicos (UPDRS IV; cc: 0,37; p<0,001) (fig. 1). Dentro de las dimensiones en las que se divide la escala NMSS, destacan por tener las mayores correlaciones con PDQ-39_SI: ánimo/cognitivo (cc: 0,54; p<0,001) y sueño/fatiga (cc: 0,44; p<0,001). Las dimensiones con un coeficiente de correlación más bajo con la puntuación en la escala PDQ39 son miscelánea (cc: 0,17; ns) y las dimensiones síntomas urinarios (cc: 0,24; p=0,017), sexual (cc: 0,24; p: 0,017) y atención (cc: 0,24; p=0,015).
Diagrama de barras en el que se muestra la relación entre los síntomas motores (UPDRS III), síntomas no motores (NMSS) y calidad de vida (PDQ-39 summary index). Se han dividido en cuartiles homogéneos el número de pacientes las puntuaciones en la escala UPDRS III y NMSS. Se puede ver en cada cuartil motor (UPDRS III) como se mantiene la proporción en la puntuación de al escala PDQ-39, con ligero incremento en las puntuaciones de la calidad de vida según empeora la situación motora.
NMSS: Non-motor symptoms scale; PDQ-39: Parkinson's Disease Questionnaire; UPDRS: Unified Parkinson's Disease Rating Scale.
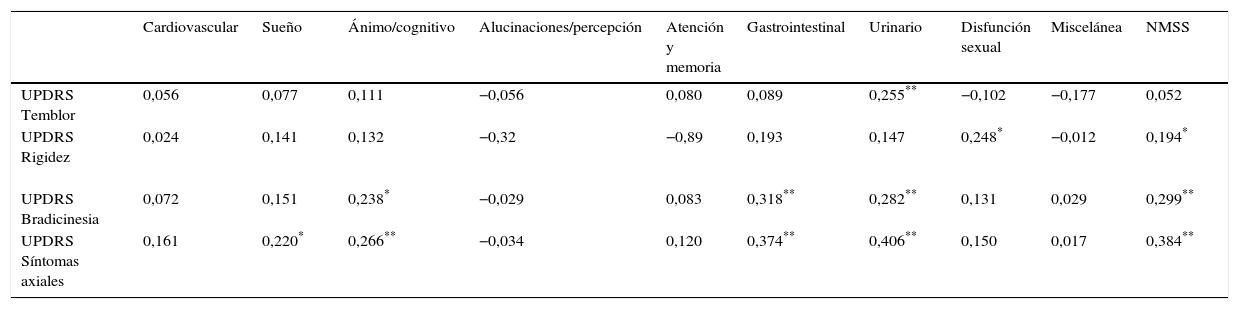
Una vez agrupados los ítems de la UPDRS III en ítems que reflejan rigidez, temblor, bradicinesia y síntomas axiales, se observó una correlación positiva entre la puntuación en la escala NMSS y síntomas axiales (cc: 0,384; p<0,01); bradicinesia (cc: 0,299; p<0,01) y en menor medida rigidez (cc: 0,194; p<0,05). No observó ninguna relación entre los síntomas no motores medidos con esta escala y la presencia de temblor. La bradicinesia y los síntomas axiales se correlacionaron significativamente con las dimensiones gastrointestinal, urinaria y ánimo/cognitivo de la escala NMSS (tabla 3). La rigidez y el temblor apenas tienen correlaciones positivas con las diferentes dimensiones que conforman la NMSS.
Tabla en la que se muestra la matriz de correlaciones entre las puntuaciones en la escala NMSS y sus diferentes dimensiones y la puntuación en los síntomas motores: temblor, bradicinesia, rigidez y síntomas axiales en la UPDRS III
| Cardiovascular | Sueño | Ánimo/cognitivo | Alucinaciones/percepción | Atención y memoria | Gastrointestinal | Urinario | Disfunción sexual | Miscelánea | NMSS | |
|---|---|---|---|---|---|---|---|---|---|---|
| UPDRS Temblor | 0,056 | 0,077 | 0,111 | −0,056 | 0,080 | 0,089 | 0,255** | −0,102 | −0,177 | 0,052 |
| UPDRS Rigidez | 0,024 | 0,141 | 0,132 | −0,32 | −0,89 | 0,193 | 0,147 | 0,248* | −0,012 | 0,194* |
| UPDRS Bradicinesia | 0,072 | 0,151 | 0,238* | −0,029 | 0,083 | 0,318** | 0,282** | 0,131 | 0,029 | 0,299** |
| UPDRS Síntomas axiales | 0,161 | 0,220* | 0,266** | −0,034 | 0,120 | 0,374** | 0,406** | 0,150 | 0,017 | 0,384** |
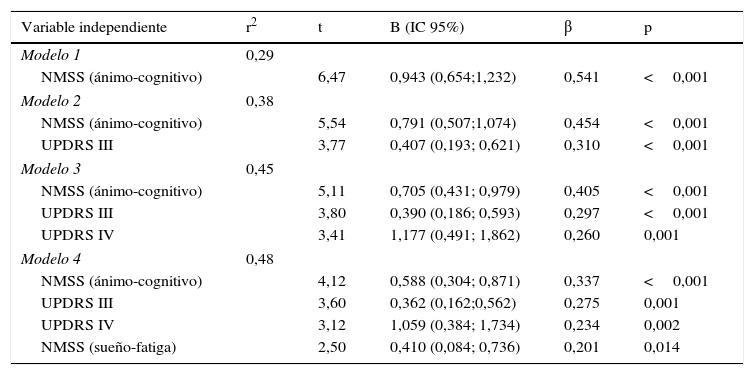
Después de introducir las variables en un modelo de regresión lineal, desglosando las puntuaciones de la escala NMSS en las diferentes dimensiones en las que se descompone y utilizando como variable dependiente la puntuación PDQ-39_SI se encontró que 4 variables justificaban en 48,2% de la puntuación obtenida en la escala PDQ-39_SI (F=22.555; p<0,001), las 4 variables son en orden de importancia NMSS (ánimo/cognitivo), UPDRS III, UPDRS IV y NMSS (sueño/fatiga). Los residuos se analizaron de manera independiente y se observó que seguían una distribución normal (tabla 4).
Tabla de análisis mediante regresión múltiple, determinando el impacto de los diferentes síntomas motores y no-motores en la calidad de vida de los pacientes con enfermedad de Parkinson. B (IC 95%) coeficiente de regresión no estandarizado, ß (IC 95%) coeficiente de regresión estandarizado, Unified Parkinson's Disease Rating Scale (UPDRS), Non-Motor Symptoms Scale (NMSS)
| Variable independiente | r2 | t | B (IC 95%) | β | p |
|---|---|---|---|---|---|
| Modelo 1 | 0,29 | ||||
| NMSS (ánimo-cognitivo) | 6,47 | 0,943 (0,654;1,232) | 0,541 | <0,001 | |
| Modelo 2 | 0,38 | ||||
| NMSS (ánimo-cognitivo) | 5,54 | 0,791 (0,507;1,074) | 0,454 | <0,001 | |
| UPDRS III | 3,77 | 0,407 (0,193; 0,621) | 0,310 | <0,001 | |
| Modelo 3 | 0,45 | ||||
| NMSS (ánimo-cognitivo) | 5,11 | 0,705 (0,431; 0,979) | 0,405 | <0,001 | |
| UPDRS III | 3,80 | 0,390 (0,186; 0,593) | 0,297 | <0,001 | |
| UPDRS IV | 3,41 | 1,177 (0,491; 1,862) | 0,260 | 0,001 | |
| Modelo 4 | 0,48 | ||||
| NMSS (ánimo-cognitivo) | 4,12 | 0,588 (0,304; 0,871) | 0,337 | <0,001 | |
| UPDRS III | 3,60 | 0,362 (0,162;0,562) | 0,275 | 0,001 | |
| UPDRS IV | 3,12 | 1,059 (0,384; 1,734) | 0,234 | 0,002 | |
| NMSS (sueño-fatiga) | 2,50 | 0,410 (0,084; 0,736) | 0,201 | 0,014 | |
Los trastornos del sueño/fatiga y del ánimo/cognitivo aparecen en el 88,3 y 80,6% de los pacientes con EP de nuestra serie y son los síntomas no motores que más impacto tienen sobre la calidad de vida. Esta información ya fue expuesta en trabajos de nuestro grupo10,15,23. La novedad del presente trabajo es que son analizados de una manera «holística», utilizando escalas específicas de síntomas no motores como la NMSS22 y contrastando su peso con el de los síntomas motores reflejados en la UPDRS III y IV. Se podría concluir que los síntomas cognitivos y del estado de ánimo son los que más influyen sobre la calidad de vida de los pacientes con EP, por encima incluso de los síntomas motores10,12,24. De estos últimos, son los síntomas axiales como la inestabilidad y los trastornos de la marcha y las fluctuaciones motoras los que más deterioran la calidad de vida de estos pacientes11.
Dentro de los síntomas no motores la apatía es muy prevalente (del 16-48%)25 que además tiene un impacto sobre la calidad de vida de los pacientes con EP26 y está a su vez relacionada igualmente con los síntomas axiales27.
Tras el análisis de los resultados hemos identificado que hay un subgrupo clínico con presencia de síntomas axiales como inestabilidad y trastornos de la marcha que tienen una mayor presencia de síntomas no motores con mayor apatía, trastornos del estado de ánimo y síntomas disautonómicos como alteraciones del aparato digestivo y urinario. La rigidez y el temblor tienen menor relación con la presencia de síntomas no motores. Los pacientes con inestabilidad de la marcha y dificultad para andar tienen mayor deterioro cognitivo y motor al compararlo con pacientes con EP sin estas características16,28,29. La progresión de ambos tipos de síntomas, cognitivos y axiales de la marcha, parecen no depender de vías dopaminérgicas como demuestra la poca o ausencia de respuesta a fármacos con acción dopaminérgica y sí a la neurodegeneración de núcleos y estructuras colinérgicas como el núcleo pedúnculopontino30,31 en el caso de los trastornos de la marcha y el núcleo basal de Meynert y la corteza cerebral en el del deterioro cognitivo32,33. Incluso habría un diferente perfil de deterioro en relación con los años de enfermedad, más lineal en los síntomas axiales, claramente diferentes de aquellos que dependen más del déficit dopaminérgico como la bradicinesia o la rigidez que tienen un perfil temporal más exponencial con mayor deterioro en los primeros años de la enfermedad34. Observamos también una clara relación entre síntomas disautonómicos como disfunción urinaria o digestiva en pacientes con mayor presencia de síntomas axiales35. No hemos encontrado relación entre los síntomas cardiocirculatorios y los síntomas axiales aunque hay trabajos que describen una relación entre ambos tipos de síntomas36. Los pacientes con un cuadro clínico tremórico tienen menos síntomas no motores, no habiendo correlación significativa entre la puntuación en la escala NMSS y los ítems de la UPDRS III que valoran este ítem. Los pacientes de este subgrupo tienen menor afectación del sistema nervioso vegetativo como lo demuestran los estudios de SPECT MIBG cardiaco37, menor incidencia de deterioro cognitivo16 y menor frecuencia de trastornos del sueño como trastorno de conducta del sueño REM, lo que refleja diferente diana del proceso neurodegenerativo.
Es necesario indicar que la principal limitación del estudio es que no se han incluido pacientes con estadio clínico avanzado debido a su incapacidad por alteración grave del lenguaje o demencia a contestar a las cuestiones recogidas, ello impide el estudio de la distribución de los síntomas en la EP muy avanzada.
Como conclusión, nuestro trabajo aporta, desde un abordaje global y utilizando escalas específicas para la valoración de manera cuantitativa de los síntomas no motores, 2 aportaciones: la primera es que el mayor peso de la calidad de vida de los pacientes con EP recae en síntomas cognitivos y del estado de ánimo y en menor medida en los trastornos del sueño. Los síntomas motores aunque influyen lo hacen en menor medida. La segunda aportación es que hay al menos 2 subgrupos clínicos claramente diferenciados, uno con predominancia de síntomas axiales donde hay una gran afectación de síntomas no motores como los cognitivos, del sistema nervioso vegetativo o del sueño, y otro tremórico con una significativa menor presencia de todos estos síntomas.
Creemos importante esta subdivisión a la hora de valorar la eficacia terapéutica de nuevos fármacos ya que sobre ambos subgrupos puede subyacer una menor afectación de vías dopaminérgicas al compararse con los cuadros clásicos de EP en los que predomina la bradicinesia.
FinanciaciónEl presente estudio no ha recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ha sido presentado en la reunión anual ordinaria de la Sociedad Española de Neurología del año 2013 en Barcelona, en comunicación tipo póster.