La esclerosis múltiple (EM) es una enfermedad inflamatoria crónica del sistema nervioso central (SNC) que se caracteriza por presentar desmielinización, remielinización y pérdida axonal que afecta mayoritariamente a pacientes jóvenes1.
El 85% de las EM son formas remitentes-recurrentes (EMRR) que cursan a brotes. Se define «brote» como la aparición de nuevos síntomas o el empeoramiento de alguno previo que dura más de 24 h sin factor precipitante.
El síndrome clínico aislado (SCA) consiste en un primer episodio de síntomas neurológicos con patrón de enfermedad desmielinizante y que podría evolucionar posteriormente a una EMRR. Para establecer el diagnóstico de EMRR es necesario cumplir los criterios de diseminación en tiempo y espacio. La revisión más actual de los mismos es la que se resume en los criterios de Mc Donald 2010.
Los síntomas más característicos que se producen en esta enfermedad son, dependiendo de zona del SNC que esté afectada, y por orden de frecuencia, los sensitivos, alteración de la agudeza visual, los motores, los troncoencefálicos, los cerebelosos y los medulares2. Por otro lado, los pacientes con EM presentan síntomas autonómicos en un 79% de los casos. El sistema más comúnmente afectado es el urinario (65%), que está relacionado en un 50% de los hombres con la disfunción eréctil. Le siguen el sudomotor (35%), el gastrointestinal (33%) y solo en el 8% de los casos hay afectación cardiovascular (CV)3. Dentro de estos últimos, uno de los menos descritos es la disfunción del ventrículo izquierdo (VI)4.
Se han descrito casos en la literatura de disfunción aguda del VI en EMRR4. Presentamos un caso de shock cardiogénico en una paciente con SCA.
Mujer de 28 años, sin patología previa ni antecedentes familiares de interés, que consultó por hipoestesia proximal en el miembro inferior izquierdo y cefalea opresiva holocraneal de 4 días de evolución. Asociaba sensación vertiginosa, náuseas y vómitos. En las últimas 24 h se añadió hemihipoestesia facial derecha.
En la exploración neurológica destacaba inicialmente asimetría facial con borramiento del surco nasogeniano derecho, una leve hipoestesia proximal en cara lateral de miembro inferior izquierdo, ataxia de la marcha con tándem imposible con una puntuación en la Expanded Disability Status Scale (EDSS) de 3,5 (S2, C3).
En la resonancia magnética nuclear (RM) cerebral se identificaron 2 lesiones desmielinizantes: una ovoidea periventricular izquierda perpendicular al eje y de aspecto crónico y una segunda lesión hemibulbar derecha de bordes bien definidos de 7mm captante de gadolinio. En la RM holomedular no se encontraron lesiones. Se detectaron bandas oligoclonales (BOC) en el líquido cefalorraquídeo (LCR) que estaban ausentes en suero.
El resto de los estudios realizados fueron anodinos, descartando otras etiologías infecciosas, autoinmunes, etc., y dado que no cumplía criterios de Mc Donald 2010, se diagnosticó de SCA. Se administró tratamiento con 5 bolus de metilprednisolona por vía intravenosa (iv) con una resolución clínica completa a los 10 días de tratamiento (EDSS 0).
A los 15 días del primer brote, presentó de forma aguda disnea y cefalea intensa asociada a sudoración profusa que la despertó del sueño nocturno. En la exploración física de urgencias se evidenció taquicardia sinusal (135 lpm), hipotensión (60/30mmHg), saturación de O2 del 95% con O2 con FiO2 del 50%, insuficiencia respiratoria franca, trabajo respiratorio y crepitantes bilaterales generalizados.
Dentro de las exploraciones complementarias, el electrocardiograma presentaba una disminución difusa del segmento ST. En la ecocardiografía transtorácica se observó una hipocontractibilidad basal y media del VI con una función global sistólica severamente reducida que no superaba el 25%, un patrón diastólico de precarga elevada e insuficiencia mitral funcional significativa. La biopsia cardíaca realizada no mostró signos de miocarditis, por lo que se le diagnosticó de shock cardiogénico por disfunción aguda del VI por probable tako-tsubo invertido y se administró metilprednisolona 1 g por vía iv durante 3 días, además de intubación orotraqueal, catéter de Swan-Ganz y balón de contrapulsación aórtica.
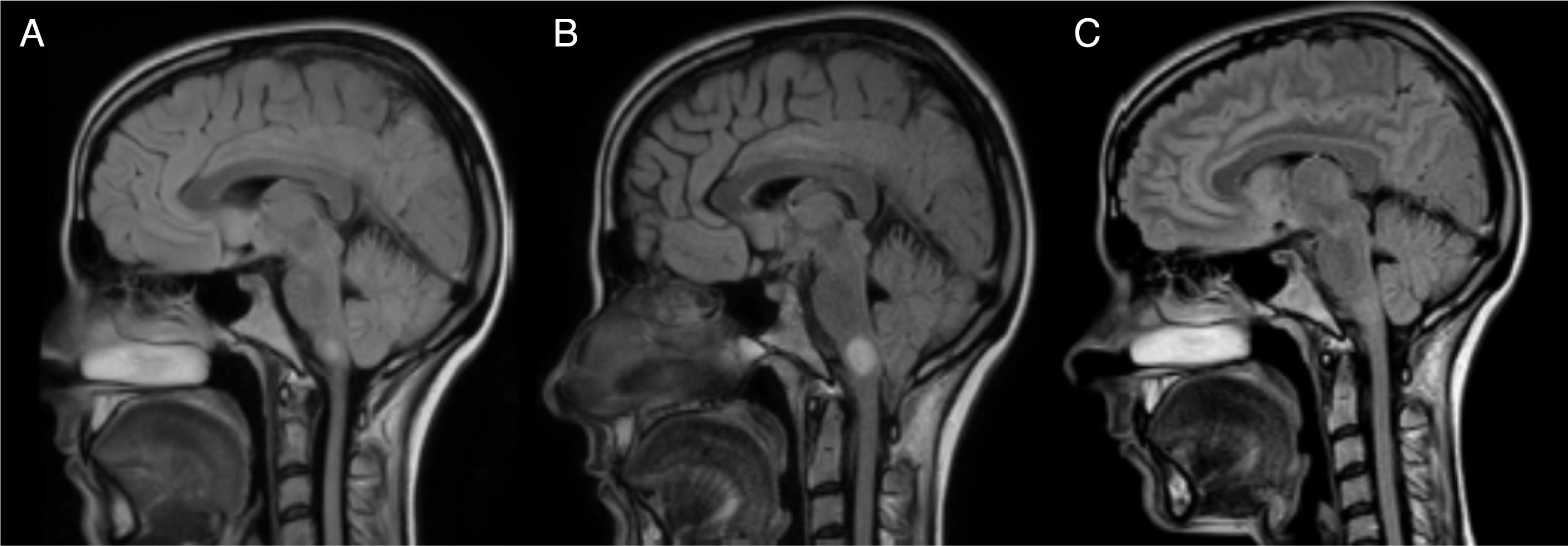
A las 12h del cuadro cardiológico agudo, la paciente presentaba un cuadro vertiginoso severo con ataxia asociada que le impedía la deambulación autónoma precisando doble apoyo (EDSS 6,5). Se le realizó una nueva RM cerebral y holomedular de control, que mostraba un aumento de tamaño de la lesión hemibulbar derecha hasta 13mm (figs. 1 y 2), por lo que se decidió realizar 5 ciclos de plasmaféresis. La paciente presentó una evolución favorable, persistiendo nistagmo en posición primaria de la mirada, oscilopsia, abasia y ataxia de la marcha (EDSS 3,5). A lo largo de los meses, fue mejorando progresivamente, quedando mínima oscilopsia en la mirada extrema.
Evolución de la lesión hemibulbar derecha. En la RM B, realizada con un mes de diferencia de la RM A y a los 15 días del shock cardiogénico, se aprecia el aumento de tamaño de la lesión hemibulbar derecha que pasa de medir 7 a 13mm. En la RM C, realizada un año después de la B, se puede apreciar la remielinización de la lesión.
Tras un año de seguimiento, la paciente no ha presentado nuevos brotes ni nuevas lesiones en RM. Se mantiene con un EDSS de 2 (troncoencéfalo 2) y asintomática a nivel cardiológico con resolución del edema cardíaco y recuperación completa de la función ventricular. Se han realizado varias RM cerebrales con la práctica desaparición de la lesión bulbar (fig. 1). Además se ha realizado una nueva punción lumbar con persistencia de BOC en LCR.
Son pocos los casos publicados en la bibliografía de disfunción del VI en EM (tabla 1). Todavía es más inusual la disfunción del VI tras el primer brote (SCA). En la revisión realizada solo hemos encontrado 2 casos5,6, que inicialmente cumplen estas características. Sin embargo, y a diferencia de nuestra paciente, los 2 casos previos publicados presentan una importante carga lesional en RM cumpliendo criterios de EMRR de McDonald 20107. Además, dichos pacientes presentaron un segundo brote en un corto período, por lo que pudieron ser diagnosticados de EM clínicamente definida.
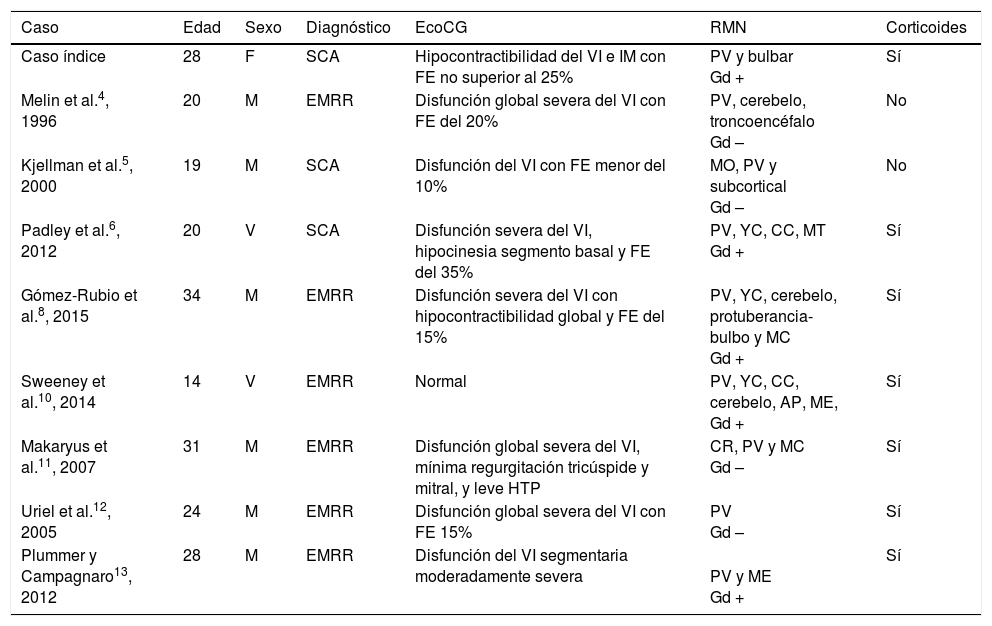
Características clínicas de los casos de disfunción del VI en EM
| Caso | Edad | Sexo | Diagnóstico | EcoCG | RMN | Corticoides |
|---|---|---|---|---|---|---|
| Caso índice | 28 | F | SCA | Hipocontractibilidad del VI e IM con FE no superior al 25% | PV y bulbar Gd + | Sí |
| Melin et al.4, 1996 | 20 | M | EMRR | Disfunción global severa del VI con FE del 20% | PV, cerebelo, troncoencéfalo Gd – | No |
| Kjellman et al.5, 2000 | 19 | M | SCA | Disfunción del VI con FE menor del 10% | MO, PV y subcortical Gd – | No |
| Padley et al.6, 2012 | 20 | V | SCA | Disfunción severa del VI, hipocinesia segmento basal y FE del 35% | PV, YC, CC, MT Gd + | Sí |
| Gómez-Rubio et al.8, 2015 | 34 | M | EMRR | Disfunción severa del VI con hipocontractibilidad global y FE del 15% | PV, YC, cerebelo, protuberancia-bulbo y MC Gd + | Sí |
| Sweeney et al.10, 2014 | 14 | V | EMRR | Normal | PV, YC, CC, cerebelo, AP, ME, Gd + | Sí |
| Makaryus et al.11, 2007 | 31 | M | EMRR | Disfunción global severa del VI, mínima regurgitación tricúspide y mitral, y leve HTP | CR, PV y MC Gd – | Sí |
| Uriel et al.12, 2005 | 24 | M | EMRR | Disfunción global severa del VI con FE 15% | PV Gd – | Sí |
| Plummer y Campagnaro13, 2012 | 28 | M | EMRR | Disfunción del VI segmentaria moderadamente severa | PV y ME Gd + | Sí |
AP: área postrema; CC: cuerpo calloso; CR: corona radiata; EMRR: esclerosis múltiple remitente recurrente; FE: fracción de eyección; Gd –: no captación de gadolinio; Gd +: captación de gadolinio; IM: insuficiencia mitral; M: mujer; MC: médula cervical; ME: médula espinal; MO: médula oblongata; MT: médula torácica; PV: periventricular; SCA: síndrome clínico aislado; V: varón; YC: yuxtacortical.
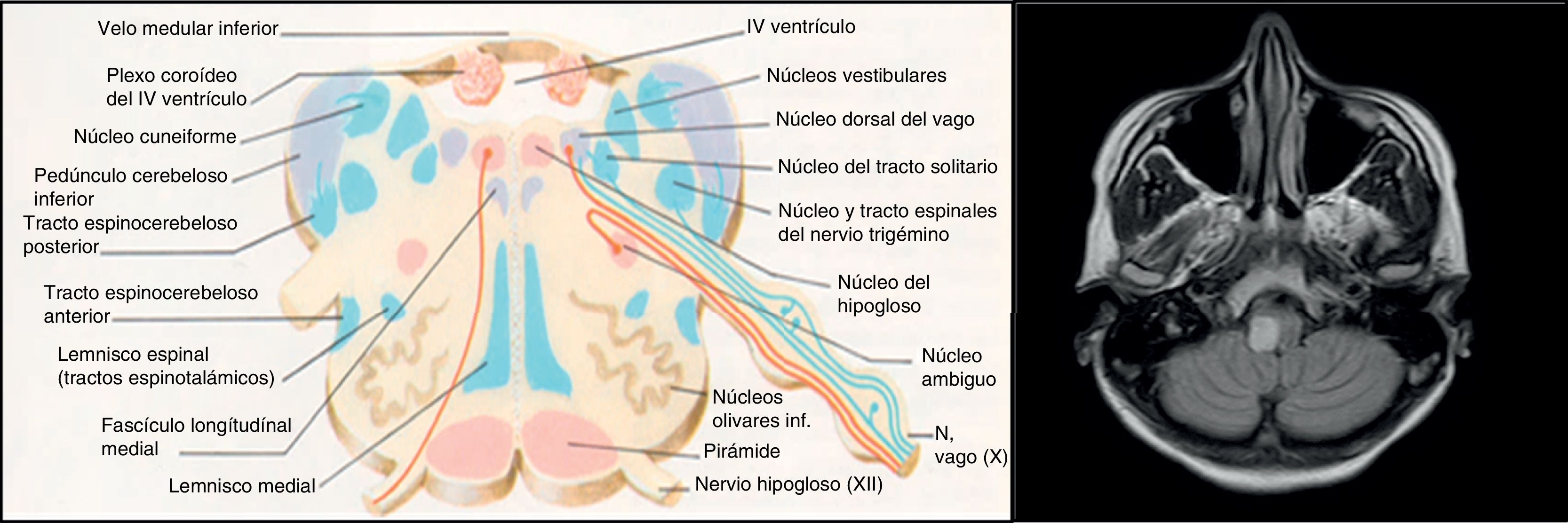
Existen controversias sobre la etiopatogenia de la disfunción del VI en la EMRR. Hay numerosas teorías que proponen una explicación para el desarrollo del edema agudo de pulmón neurogénico provocado por la disfunción del VI en EM. Las 4 hipótesis más relevantes serían la etiología disinmune, la metabólica, la disfunción autonómica y, en último lugar, la descarga catecolaminérgica por estrés. En la primera se ha propuesto que una infección viral activaría la respuesta inmunitaria en la EM a nivel de SNC, pudiendo afectar a nivel cardíaco produciendo una miocarditis que resultaría en una disfunción del VI8. En nuestro caso, no se detectó una infección viral activa ni signos de miocarditis en la biopsia del músculo cardíaco. La segunda teoría propone una disminución de los fosfatos de alta energía (fosfocreatina y ATP) en los pacientes con EM sin ninguna manifestación clínica cardíaca, que sugeriría una afectación subclínica9. La tercera hipótesis está relacionada con la localización de las placas de desmielinización, ya que, las lesiones situadas en el núcleo del tracto solitario, el área postrema y la médula caudal, que funcionan como conexiones simpáticas entre el hipotálamo y la médula10, podrían alterar esta vía. La localización bulbar de la lesión que presenta nuestra paciente no es uno de los territorios que más se repite en la literatura. Sin embargo, al encontrarse cercana al núcleo dorsal del vago implicado en el control autonómico, podría explicar la disfunción autonómica en nuestra paciente, de igual forma que en el caso de Gómez-Rubio et al. Según dichos autores, la disfunción autonómica podría dar lugar a la descarga catecolaminérgica que precipitaría el shock cardiogénico. Bajo este concepto se define el síndrome de tako-tsubo, también conocido como síndrome de disfunción apical transitoria o miocardiopatía por estrés. Los mecanismos por el que la disfunción autonómica daría lugar a insuficiencia ventricular aguda reversible serían el vasoespasmo, la disfunción microvascular y el daño miocárdico directo por catecolaminas6. A diferencia del nuestro, el caso publicado por dichos autores es una EMRR con importante carga lesional en RM.
Por otro lado, existen estudios que hablan de disfunción del VI en EMRR, la cual no se relaciona con la edad ni con la puntuación en la escala EDSS14. La afectación del VI también se ha encontrado en enfermos con EM secundariamente progresiva, por lo que no es una comorbilidad exclusiva de la EMRR15.
En nuestra paciente, el tratamiento inicial con corticoides a altas dosis por vía iv no fue suficiente para controlar la evolución de la lesión bulbar, por lo que, y ante la evolución clínica, se precisaron 5 ciclos de plasmaféresis. A pesar de que dicha evolución sería más característica de la encefalitis aguda diseminada, la persistencia de BOC en el LCR descartaría dicha opción. Sobre la base de nuestra revisión, ninguno de los casos publicados se trató con plasmaféresis.
Se desconoce si esta complicación puede variar el curso natural de la enfermedad. En nuestro caso, existe una disociación entre la gravedad inicial producida por la lesión troncoencefálica y la evolución de la enfermedad, dado que no ha resultado un factor de mal pronóstico tras un año de seguimiento. Sin embargo, queda patente la necesidad de diagnóstico y tratamiento intensivo y precoz, tanto de las complicaciones cardíacas como del brote en estos casos.