El Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología publicó en el año 2006 el Plan de Atención Sanitaria del Ictus (PASI) con el objetivo de elaborar un sistema organizado de atención al ictus que dé respuesta a las necesidades de cada enfermo y optimice la utilización de los recursos sanitarios. Este plan pretendía garantizar la equidad en la atención sanitaria del paciente con ictus. La Estrategia Nacional en Ictus del Sistema Nacional de Salud aprobada en el año 2008 recogió en gran medida el tipo de modelo organizativo sanitario del PASI. Sin embargo, en el tiempo transcurrido desde su publicación, han aparecido nuevos avances en el tratamiento de la fase aguda del infarto cerebral que obligan a realizar una revisión del mismo.
FuentesUn comité de 19 neurólogos especialistas en patología neurovascular y representativos de las diferentes comunidades autónomas han revisado el PASI con el objetivo de incorporar los nuevos avances del tratamiento en la fase aguda del infarto cerebral. Esta revisión se ha basado en una revisión de la literatura científica y en la experiencia acumulada con el plan anterior.
DesarrolloEl nuevo modelo organizativo propuesto debe hacer hincapié en las características de los diferentes niveles asistenciales con la potenciación de Hospitales de Referencia, establecer nuevos criterios de activación del Código Ictus menos restrictivos que contemplen las nuevas posibilidades terapéuticas, establecer medidas organizativas para la implantación del intervencionismo neurovascular y permitir la utilización del recurso técnico de la telemedicina.
The Spanish Stroke Group published the “Plan for stroke healthcare delivery” in 2006 with the aim that all stroke patients could receive the same degree of specialised healthcare according to the stage of their disease, independently of where they live, their age, gender or ethnicity. This Plan needs to be updated in order to introduce new developments in acute stroke.
MethodsA committee of 19 neurologists specialised in neurovascular diseases representing different regions of Spain evaluated previous experience with this Plan and the available scientific evidence according to published literature.
BackgroundThe new organised healthcare system must place emphasis on the characteristics of the different care levels with promotion of Reference Stroke Hospitals, set up less restrictive Stroke Code activation criteria that include new therapeutic options, establish new standard measures for endovascular treatment and develop tele-medicine stroke networks.
La enfermedad cerebrovascular constituye uno de los principales problemas socio-sanitarios en España. Es la primera causa de mortalidad en la mujer y la segunda global, además de la primera causa de discapacidad en el adulto y la segunda causa de demencia. Este problema claramente se verá agravado dentro de unos años en relación con el progresivo envejecimiento de la población española. Aproximadamente el 75% de los ictus afectan a pacientes mayores de 65 años y se ha calculado que para el año 2025 1.200.000 españoles habrán sobrevivido a un ictus, de los cuales más de 500.000 tendrán alguna discapacidad.
El ictus es una enfermedad compleja, que requiere atención inmediata y que se beneficia de asistencia especializada. La intervención de neurólogos con experiencia en enfermedades cerebrovasculares mejora la evolución de los pacientes con ictus y reduce los costes del proceso1,2. Un estudio realizado en hospitales españoles evidenció que la evaluación por un neurólogo de pacientes con ictus en las primeras 6 horas se asocia a 5 veces menos riesgo de mala evolución3. El estudio PRACTIC4,5 confirmó que la atención neurológica reduce de forma estadísticamente significativa la mortalidad y las complicaciones intrahospitalarias de los pacientes con ictus, aumenta el porcentaje de pacientes independientes y disminuye la probabilidad de sufrir una recurrencia vascular. Los hallazgos de estos estudios hechos en España son similares a los obtenidos en otros países6,7.
Además de resultar evidente el beneficio que produce en los pacientes que han sufrido un ictus la atención neurológica precoz y especializada, también ha sido claramente demostrado las ventajas de organizar los cuidados médicos y de enfermería en una Unidad de Ictus (UI). La atención en una UI se asocia con una disminución en la probabilidad de muerte o incapacidad en todos los subgrupos de pacientes, excepto en los pacientes con disminución del nivel de conciencia8,9, beneficios que se mantienen a largo plazo.
A la luz de la evidencia científica expuesta anteriormente, se comprende que el objetivo ideal en la atención al ictus sea conseguir que todos los pacientes puedan ser atendidos precozmente por un neurólogo con experiencia en enfermedades cerebrovasculares, y aquellos que lo requieran puedan beneficiarse de ingresar en una UI. Sin embargo, en la actualidad todavía una mayoría de pacientes con ictus son atendidos en hospitales que no disponen de neurólogos de guardia y por tanto son privados de la mejor práctica médica para su patología10.
Parte del beneficio que la atención precoz produce hoy día en los pacientes con ictus se debe a la administración del tratamiento trombolítico. La trombólisis intravenosa es un tratamiento altamente efectivo cuando se administra en las primeras horas de un ictus isquémico11–13. Sin embargo, menos del 5% de los pacientes reciben en la actualidad esta terapia14. Aunque son varias las causas que explican estos bajos porcentajes, sin duda el retraso en la llegada al hospital es en la mayoría de los casos el factor limitante. Actualmente existe una regulación oficial para administrar trombólisis en el ictus que impide hacerlo por rutina más allá de las 3 horas de evolución, y aunque el límite se ha ampliado hasta las 4,5 horas, este aumento no mejorará llamativamente los porcentajes de enfermos tratados si los sistemas sanitarios no trabajan para intentar disminuir las latencias en la atención del ictus. Aunque el Código Ictus (CI) ha disminuido mucho esta demora15, la experiencia demuestra que todavía puede disminuirse más14. Además, la trombólisis es más efectiva cuanto antes se administre; la probabilidad de recuperación es 3 veces superior si se inicia en los primeros 90 minutos. Por tanto, si se tuviera en cuenta sólo una cuestión de ahorro de tiempo, los pacientes con diagnóstico clínico de ictus deberían ser trasladados lo antes posible a un hospital con UI. La administración de trombólisis por médicos que no han recibido una formación previa en trombólisis así como tener poca experiencia se relaciona con un mayor índice de complicaciones y mortalidad16–18. Ante estas evidencias, los sistemas sanitarios se han esforzado por mejorar el transporte urgente de los pacientes hacia hospitales adecuados para el tratamiento del ictus. Sin embargo, estas medidas no siempre consiguen alcanzar a toda la población (especialmente en regiones geográficamente extensas o de difícil orografía), aumentan la demora del tratamiento y provocan una alta proporción (48%) de traslados innecesarios19. La telemedicina es un recurso técnico que ha demostrado su eficacia en mejorar estos datos.
El Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV) de la Sociedad Española de Neurología (SEN) publicó en el año 2006 un Plan de Atención Sanitaria del Ictus (PASI) con el objetivo de elaborar un sistema organizado de atención al paciente con ictus que dé respuesta a las necesidades de cada enfermo y optimice la utilización de los recursos sanitarios. Este plan pretende garantizar la equidad en la atención sanitaria del paciente con ictus independientemente del lugar y de la hora del día. La Estrategia Nacional en Ictus del Sistema Nacional de Salud aprobada en el año 2008 recogió en gran medida el tipo de modelo organizativo sanitario del PASI.
Sin embargo, el tratamiento del ictus en su fase aguda ha incorporado nuevos avances que hacen necesaria una actualización de los modelos organizativos anteriores. Este modelo organizativo actualizado debe hacer hincapié en las características de los diferentes niveles asistenciales con la potenciación de los Hospitales de Referencia (HR), establecer nuevos criterios de activación del CI menos restrictivos que contemplen las nuevas posibilidades terapéuticas, establecer medidas organizativas para la implantación del intervencionismo neurovascular (INV) y permitir la utilización del recurso técnico de la telemedicina. Además, es imprescindible facilitar circuitos de traslado previamente definidos y coordinados con los Servicios de Urgencias Extrahospitalarios2,20.
Niveles asistencialesEl reconocimiento del ictus como un importante problema de salud pública21,22 hace necesario que los recursos sanitarios se organicen de forma eficiente con el fin de asegurar la accesibilidad a los tratamientos y la correcta aplicación de los mismos. El sistema organizativo debe asegurar una atención equitativa, continuada y de calidad para todos los pacientes durante el proceso de su enfermedad. Por ello, debe integrar los avances científico-técnicos conseguidos en el manejo de la enfermedad cerebrovascular, con la implementación de estructuras organizativas adecuadas.
Los hospitales que atienden ictus en su fase aguda han de estar capacitados para asistir a estos pacientes y han de disponer de un circuito de traslados previamente definido y coordinado con el Servicio de Urgencias Extrahospitalarias. Todos los pacientes con sintomatología sugestiva de ictus, permanente o transitoria, han de ser dirigidos inmediatamente a un hospital de agudos preparado para asistir ictus.
Con estos objetivos se establecen, en función de las características de cada centro, tres niveles asistenciales en la red hospitalaria2,20:
- -
Hospital con Equipo de Ictus (EI).
- -
Hospital con UI.
- -
Hospital de Referencia de Ictus.
El conjunto de hospitales de distinto nivel responsables de la atención sanitaria de los pacientes con ictus de una determinada zona geográfica deberán disponer de un protocolo interhospitalario que determine la utilización conjunta y ordenada de los recursos sanitarios, así como el procedimiento de intercambio de pacientes cuando estuviera indicado. El sistema sanitario y los sistemas de emergencia extrahospitalaria han de estar coordinados para que los pacientes que lo requieran sean derivados directamente, o en su caso trasladados, a los hospitales más adecuados para cada tipo de paciente.
El sistema asistencial del ictus debe identificar las funciones que tiene que desempeñar cada tipo de hospital y definir las responsabilidades inherentes a los mismos.
Hospitales con Equipos de IctusLos EI constituyen el nivel básico de atención a los pacientes con ictus. Se definen como un equipo multidisciplinar de especialistas que colaboran en el diagnóstico y tratamiento protocolizados del ictus, coordinado por un neurólogo. Este equipo está basado en su organización y no tiene una ubicación física fija, siendo su objetivo principal prestar una atención integrada y rápida al paciente con ictus agudo. Los EI son una alternativa a las UI para aquellos centros hospitalarios que tengan entre sus servicios la atención de pacientes con ictus, tanto en su fase aguda como en su hospitalización23.
Según las indicaciones del comité de expertos Brain Attack Coalition24 debe haber un sistema lo suficientemente bien organizado como para notificar y activar al equipo lo más rápidamente posible, de manera que, en 15 minutos un miembro del equipo esté a pie de cama. El objetivo de esta activación urgente es iniciar aquellas medidas que requieran de ventanas de actuación más cortas o que deben realizarse en centros de nivel superior.
Entre las recomendaciones que propone la American Stroke Association para la organización del ictus en cada región25 figura que cada centro hospitalario debe reconocer su nivel de asistencia al ictus y deben existir circuitos y protocolos para la derivación de un paciente a uno u otro nivel dependiendo de sus necesidades. Así pues los hospitales con EI deben tener elaborados unos protocolos conjuntos con los hospitales con UI y los HR para derivar a aquellos pacientes que se beneficien de ello26. En los hospitales con EI puede no haber presencia física de un neurólogo durante las 24 horas del día. Por ello, en los protocolos de actuación debe establecerse el procedimiento a seguir para la realización de la trombólisis intravenosa. La derivación a un centro con UI o la organización de sistemas de telemedicina coordinados desde HR son las opciones recomendadas.
En un estudio realizado en hospitales europeos se detectó que menos del 10% de los hospitales que admiten ictus en Europa lo hacen en las óptimas condiciones con respecto a su nivel asistencial y un 40% no alcanzan las mínimas condiciones deseables27. Por esta razón, es importante definir con exactitud qué requisitos mínimos debe cumplir un hospital para poder atender ictus en este nivel más básico. Con el objetivo de identificar estos elementos básicos, se les pidió a expertos en patología cerebrovascular de nuestro país que definieran en una encuesta cuáles deberían ser las condiciones que debía cumplir cada centro para ser considerado de un determinado nivel asistencial28.Teniendo en cuenta este estudio y lo expuesto en la edición anterior del PASI2, se pueden considerar requisitos imprescindibles los mostrados en la tabla 1.
Componentes imprescindibles para la organización de un Equipo de Ictus
| Existencia de un servicio de urgencias |
| Laboratorio y tomografía computarizada disponible las 24 horas todos los días de la semana (24h/7d) |
| Un equipo multidisciplinar, dirigido por un neurólogo |
| Protocolos de actuación escritos |
| Circuitos de derivación establecidos a los hospitales con Unidades de Ictus o a Hospitales de Referencia |
En la encuesta que comentábamos los expertos definieron como requisitos importantes en este tipo de hospitales la existencia de: Servicio de Rehabilitación, trabajadores sociales, un registro de ictus, Unidad de Cuidados Intensivos, programa educativo de pacientes, ecocardiografía, programa de educación profesional, monitorización neurológica y educación comunitaria.
En una encuesta similar realizada entre expertos europeos29 los elementos que se consideraron imprescindibles para un hospital con el nivel más elemental fueron: servicio de urgencias con personal de urgencias entrenado, tomografía computarizada (TC) disponible las 24h al día con prioridad para la realización del mismo a los pacientes con ictus agudo, colaboración con un centro de rehabilitación externo, niveles asistenciales de atención al ictus establecidos en cada comunidad con circuitos de derivación definidos, y programa de prevención. Como podemos ver los requisitos son bastante similares a los nuestros.
Hospitales con Unidad de IctusLa UI es el recurso más eficiente para el tratamiento de la fase aguda del ictus. Este dispositivo asistencial ha demostrado, con un nivel de evidencia I, que reduce la mortalidad, la dependencia y la necesidad de cuidados institucionales en los pacientes con ictus. El beneficio observado es independiente de la edad, sexo y gravedad del déficit neurológico al ingreso30 y es similar para los distintos subtipos etiológicos de ictus31. Este rendimiento asistencial de la UI comprobado en los ensayos es trasladable a la práctica clínica diaria8,32, se mantiene a lo largo del tiempo33 y es coste-efectivo34,35. Basándose en estos datos, diferentes comités de consenso como la American Heart Association25,36, la Declaración de Helsinborg de 200637 y la Sociedad Española de Neurología2,38, han recomendando que todos los pacientes con ictus en fase aguda deben tener garantizado su acceso a una UI debido a que es el recurso que más eficacia ha demostrado para el tratamiento de su proceso. Para cumplir este objetivo la red asistencial de ictus considera el nivel de Hospital con UI.
Este tipo de hospital está dotado con el personal, infraestructura y programas necesarios para estabilizar y tratar a la mayoría de los pacientes con ictus durante su fase aguda. Su característica distintiva es que dispone de una UI. Aún no se dispone de recomendaciones o guías sobre los criterios que deben aplicarse en la distribución territorial de las UI. En los países europeos, se han utilizado indistintamente criterios de población, o de planificación geográfica, con el fin de determinar el número de UI que deben existir para lograr el propósito de que el paciente con ictus agudo tenga asegurada una cama de UI39–41. Trasladando estos criterios a las características de nuestro sistema sanitario junto con los datos epidemiológicos conocidos sobre la incidencia y prevalencia del ictus la recomendación para la distribución de las UI sería:
- -
Distribución poblacional: 1 cama monitorizada en UI por cada 100.000 habitantes.
- -
Distribución geográfica: área definida por una isocrona de 60 minutos atendida por una UI.
Así podría atenderse la cifra media observada en los estudios de 155 ictus/100.000 habitantes/año22,42, con estancias medias en UI para esos pacientes de 3-4 días. Por otra parte también es recomendable tener en cuenta en la planificación geográfica una distribución siguiendo distancias que no originen retrasos de atención en las terapias recanalizadoras (tiempos de traslado no superiores a 1 hora). El uso de la telemedicina sería un sistema complementario a la organización territorial, ya que permitiría realizar tratamiento trombolítico en aquellos hospitales no preparados para esta terapia, y en los que las distancias para el traslado ocasionan exclusiones por tiempos superiores a los recogidos en los criterios de ventana terapéutica.
La UI, dentro de un hospital, es aquella estructura geográficamente delimitada para el cuidado de los pacientes con ictus, que tiene personal y servicios diagnósticos disponibles las 24 horas del día. La UI debe estar adscrita desde el punto de vista organizativo al servicio de Neurología, y su dirección y coordinación debe ser responsabilidad del Coordinador de la UI. Su ubicación geográfica recomendada sería en la planta de Neurología y a ella son trasladados directamente desde Urgencias los pacientes que cumplen con los criterios de ingreso en la misma. La mayoría de los pacientes con ictus, transitorio o establecido, de menos de 24 horas de evolución precisan ingreso en UI38,43. El modelo de UI de cuidados críticos intermedios con monitorización continua no invasiva se está implantando como el más adecuado para el control clínico de pacientes en la fase aguda de la isquemia cerebra36,44,45. El desarrollo de nuevos recursos técnicos y terapéuticos condiciona la conveniencia de extender el modelo de UI monitorizada46. En el momento actual la dotación de monitorización continua en una UI es la más aconsejable para un adecuado control de la fase aguda del ictus.
Los componentes de una UI se han ido estableciendo según los conocimientos obtenidos de los estudios y su trascendencia asistencial se ha determinado siguiendo opiniones de expertos evaluadas a través de encuestas28,29. Se consideran dos categorías, imprescindibles e importantes. En los recursos imprescindibles (tabla 2) aparecen todos los elementos (recursos humanos, infraestructuras, protocolos y técnicas) que son fundamentales para que una UI desarrolle sus funciones.
Componentes imprescindibles de una Unidad de Ictus
| Recursos de personal |
| En la Unidad de Ictus |
| Neurólogo coordinador (miembro del Servicio de Neurología experto en ictus) |
| Neurólogo de guardia de presencia física 24h/7d |
| Enfermería (ratio 1 enfermera/4-6 camas; 8h por turno) |
| En el Hospital |
| Neurorradiólogos (diagnóstico) |
| Neurocirujano accesible |
| Intensivistas |
| Servicio de Rehabilitación |
| Trabajadores sociales |
| Infraestructuras |
| Servicio de Urgencias |
| Existencia de camas específicas para ictus con monitorización multiparámetro no invasiva (ECG, oximetría, presión arterial) |
| Monitorización neurológica |
| Unidad de Cuidados Intensivos |
| Protocolos |
| Programa de trabajo coordinado con otros especialistas |
| Vías clínicas y protocolos diagnóstico-terapéuticos |
| Protocolos de enfermería |
| Protocolos de acceso rápido y preferente a los hospitales de alta tecnología para la aplicación de técnicas diagnósticas y/o terapéuticas muy específicas |
| Técnicas diagnósticas |
| Tomografía computarizada cerebral 24 h/7d |
| Ultrasonografía 24 h/7 d |
| Servicio de laboratorio de urgencias 24 h/7d |
| Ecocardiografía |
| Técnicas terapéuticas |
| Trombólisis intravenosa 24 h/7 d |
| Drenaje ventricular 24 h/7 d |
| Cirugía de la hipertensión intracraneal 24 h/7d |
| Fisioterapia |
Otros componentes que pueden ser útiles en la organización de la UI serían los considerados como importantes: capacidad para disponer de resonancia magnética (RM) 24h/7 días, coordinación con cirugía vascular para realizar endarterectomía carotidea, disponibilidad de terapia ocupacional, telemedicina, programas de formación o educación sanitaria, y el uso de registro informático de pacientes en bancos de datos28.
Hospitales de Referencia de IctusAunque la mayoría de los ictus se pueden resolver desde el punto de vista diagnóstico y terapéutico en los centros que disponen de UI, tal y como han sido definidos antes, hay algunos pacientes que por su complejidad, por su gravedad, o por precisar técnicas avanzadas de monitorización, estudio o tratamiento, han de ser abordados en centros de máximo nivel, llamados HR. Las características de estos centros fueron establecidas por la Brain Attack Coalition47 con todos sus requerimientos, neurocirugía, cirugía vascular, Unidad de Cuidados Intensivos47,48 e intervencionismo neurovascular. Estos dispositivos deben estar asegurados sin límite de fecha u horario (tabla 3). Encuestas recientes28,29 han establecido los requerimientos para este nivel asistencial según la opinión de expertos. Otras han puesto de manifiesto interesantes diferencias de percepción entre profesionales y directores médicos de hospital en lo que a la atención al ictus se refiere49. En estos HR es recomendable que haya disponible un neurólogo con experiencia en ictus, debiendo participar en el apoyo a niveles inferiores mediante instrumentos como la telemedicina, así como organizar programas de educación y formación, dirigidos a ciudadanos y profesionales. Es discutible si es condición indispensable que estén implicados en la investigación, aunque es recomendable47. En todo caso lo más importante para su definición y acreditación debe ser su capacidad asistencial.
Componentes imprescindibles en un Hospital de Referencia de ictus
| Unidad de Ictus |
| Neurólogo con experiencia en ictus 24h/7d accesible |
| Neurocirujano con experiencia en ictus 24h/7d |
| Cirugía Vascular en llamada |
| Unidad de Cuidados Intensivos con experiencia en ictus |
| Intervencionismo neurovascular en llamada disponible 24h/7d |
| Apoyo a niveles inferiores (incluye Telemedicina en casos seleccionados) |
| Programas docentes a ciudadanos y profesionales |
| Investigación |
En este máximo nivel tendrían que ser atendidos todos los pacientes con ictus hemorrágico subsidiarios de tratamiento quirúrgico o endovascular y todos los que llegasen a requerir determinadas técnicas de cuidados intensivos, como monitorización neurológica invasiva; ictus isquémicos candidatos a tratamiento quirúrgico (infartos malignos de la arteria cerebral media [ACM], infartos extensos de territorio vertebro-basilar) y aquéllos candidatos a INV (trombosis de la arteria basilar [AB], oclusión de la arteria carótida interna [ACI] terminal, contraindicación para trombólisis sistémica, o tras fracaso de la misma)45,50–52 (tabla 4) Deben existir acuerdos y protocolos para la transferencia de estos casos desde niveles inferiores, incluyendo criterios de prioridad26,53.
Pacientes susceptibles de ser tratados en un Hospital de Referencia de ictus
| Ictus hemorrágicos candidatos a cirugía o tratamiento endovascular |
| Ictus que requieran determinadas técnicas de monitorización invasiva |
| Ictus isquémicos candidatos a tratamiento quirúrgico (infartos malignos de arteria cerebral media, infartos extensos de territorio vertebro-basilar) |
| Ictus isquémicos candidatos a intervencionismo neurovascular (oclusión basilar, oclusión de arteria carótida intracraneal, contraindicación para trombólisis sistémica, o indicación de recanalización tras fracaso de la anterior) |
A diferencia de los niveles más básicos, la eficacia, eficiencia y coste-efectividad de estos centros no está bien definida, sobre todo porque no lo está la de aquellos elementos asistenciales que los caracterizan, de forma que su evaluación es aún un proceso abierto y paralelo al de la evaluación de las medidas específicas que han de ofrecer, evaluación en la que debieran participar activamente mediante registros y ensayos clínicos27,54–56.
La distribución poblacional o territorial de estos HR es difícil de establecer puesto que intervienen diferentes factores a considerar: número de ictus atendidos, población de referencia, características del área y cartera de servicios de cada hospital. Desde un punto de vista de organización geográfica un modelo de distribución recomendado sería el de contar con un HR por cada área cuyos hospitales atiendan más de 1.000 ictus al año. En cualquier caso debería existir al menos un HR en cada Comunidad Autónoma.
Código IctusClásicamente se ha denominado CI al procedimiento de actuación prehospitalaria basado en el reconocimiento precoz de los signos y síntomas de un ictus, de posible naturaleza isquémica, con la consiguiente priorización de cuidados y traslado inmediato a un hospital con UI u HR, de aquellos pacientes candidatos a beneficiarse de una terapia de reperfusión y de cuidados especiales en una UI57. Los criterios de activación del CI eran relativamente restrictivos dado que los criterios para el tratamiento trombolítico intravenoso eran los del Registro SITS-MOST (Safe Implementation of Thrombolysis in Stroke: a Multinational Multicentre Monitoring Study of Safety and Efficacy of Thrombolysis in Stroke)58.
Las posibilidades terapéuticas del ictus agudo en la actualidad se han ampliado y diversificado, siendo la trombólisis intravenosa un pilar fundamental pero no el único. Está demostrado que el tratamiento que beneficia a más pacientes con un ictus es el ingreso en una UI. Cerca del 80-90% de ictus pueden ingresar en este tipo de unidades, beneficiándose del mismo tanto infartos cerebrales como ataques isquémicos transitorios (AIT) o hemorragias cerebrales31,43.
La generalización del tratamiento trombolítico intravenoso en España comenzó en el año 2003 con el inicio del Registro SITS-MOST que posteriormente se amplió al Registro SITS-ISTR. En él, se incluyeron 1.914 pacientes y los datos de seguridad y eficacia fueron comparables a los resultados globales del registro así como a los datos de los ensayos clínicos59. En estos años la información existente sobre la seguridad y eficacia de este tratamiento ha aumentado enormemente. La experiencia acumulada en trombólisis en las UI españolas ha permitido por una parte aumentar el número de pacientes tratados y por otra poner en duda algunos de los criterios de exclusión. El aumento del número de trombólisis también ha sido consecuencia de la mejor organización asistencial en la fase aguda con la generalización del CI en casi todas las comunidades autónomas y el aumento del número de centros con programa de trombólisis. Los resultados del estudio ECASS-3 han permitido conocer que el t-PA es seguro y eficaz hasta cuatro horas y media desde el inicio de los síntomas60. Diversos estudios han comprobado que la trombólisis en pacientes mayores de 80 años es tan segura como en los menores de 80. Otros criterios también controvertidos han sido los pacientes anticoagulados con unos niveles de INR < 1,7 o el antecedente de diabetes e ictus previo en los que se ha visto que la trombólisis aplicada por neurólogos expertos es segura y eficaz61,62. Como se discutirá más adelante en este trabajo el INV o la telemedicina son otras alternativas que deben considerarse. Por tanto, la conclusión que obtenemos de estos datos es que la complejidad del tratamiento del ictus agudo es muy alta. Esto conlleva una individualización del tratamiento por parte del neurólogo de guardia por lo que los criterios de activación del CI deben ser menos restrictivos.
El principal objetivo del CI es conseguir que el paciente sea estabilizado y trasladado en el menor tiempo posible a un centro adecuado. Están plenamente demostrados los beneficios del CI en cuanto a la mejora en el tiempo y en el número de pacientes tratados con trombólisis63–65.
Características del Código IctusComo primer eslabón en la asistencia de todo cuadro compatible con un ictus, el CI ha de cumplir una serie de características66:
- 1)
Consideración de ictus como emergencia médica: con el CI se da prioridad a aquellos pacientes que puedan ser susceptibles de tratamiento agudo y de una terapia de recanalización y que por extensión, aquéllos que finalmente no lo sean, puedan beneficiarse de otros tratamientos específicos en una UI.
- 2)
Reconocimiento precoz de un posible ictus: mediante formación específica del personal sanitario.
- 3)
Cuidados específicos en la atención del ictus manteniéndolo en una situación clínica adecuada que haga posible el tratamiento más idóneo a su llegada al hospital.
- 4)
Priorización en el traslado, poniendo a disposición el recurso más avanzado y rápido posible.
- 5)
Coordinación con el resto de los eslabones de la cadena asistencial, según el procedimiento operativo de los servicios de emergencias extrahospitalarios.
La activación del CI requiere disponer de un procedimiento que establezca la ordenación y racionalización de los recursos existentes para permitir que aquellos pacientes que sufren un ictus puedan ser atendidos en hospitales con UI en un tiempo inferior a las dos horas desde el comienzo de los síntomas (tablas 5 y 6).
Criterios de activación del Código Ictus
| Paciente independiente (es decir capaz de caminar, asearse y vestirse) |
| Tiempo de inicio de los síntomas menor de 8 horas o de inicio desconocido |
| Focalidad neurológica actual presente en el momento del diagnóstico: presencia de alguno de los síntomas de alarma de ictus de instauración aguda. |
| 1. Entumecimiento, debilidad o parálisis repentina de la cara, el brazo o la pierna de un hemicuerpo |
| 2. Dificultad para hablar o entender |
| 3. Perdida de visión brusca de uno o ambos ojos |
| 4. Cefalea intensa, repentina y sin causa aparente asociada a náuseas y vómitos (no atribuible a otras causas) |
| 5. Dificultad para caminar, pérdida de equilibrio o coordinación |
Para conseguir los objetivos de este procedimiento es necesario:
- 1)
Coordinar la disponibilidad de recursos existentes: centralizando la información, continua y permanentemente, de la disponibilidad o saturación de los distintos centros a través del Centro Coordinador de Urgencias.
- 2)
Centralizar la información de las distintas unidades periféricas sobre la detección de un posible candidato de CI: según está estructurada la asistencia sanitaria en España, las unidades que pueden realizar la detección precoz de estos pacientes son:
- a)
Unidades de Atención Primaria.
- b)
Centros Coordinadores de Urgencias.
- c)
Unidades de los dispositivos de urgencias y emergencias extrahospitalarias.
- d)
Otros (Residencias Geriátricas, etc.).
La detección por parte de las unidades anteriormente mencionadas, de un paciente con signos y síntomas de ictus, que cumpla los criterios de activación del CI, será puesta en conocimiento del Centro Coordinador de Urgencias de forma inmediata. En cualquier caso el paciente con sospecha de ictus debe ser trasladado inmediatamente al centro con UI sin pasar por otros centros sanitarios. Es recomendable que un familiar acompañe al paciente, especialmente si este no se encuentra en condiciones para emitir un consentimiento informado.
- a)
- 3)
Distribución de pacientes y activación de los hospitales con UI: el Centro Coordinador de Urgencias designará el centro receptor más cercano salvo saturación del mismo y realizará su activación informándole de las características del paciente y del tiempo aproximado de llegada. Desde el centro receptor se establecerán los mecanismos que aseguren una recepción directa y adecuada del paciente.
- 4)
Desactivación del CI: cuando el paciente durante el traslado presente algún criterio de exclusión o por la negación del paciente o de su familia a ser trasladado al centro de referencia.
El CI intrahospitalario es el sistema operativo que pone en funcionamiento un equipo de facultativos específico con el objetivo de priorizar al paciente con ictus con la puesta en marcha de actuaciones y procedimientos prefijados en el hospital. Su activación se produce como consecuencia de la detección de un paciente con ictus en el Servicio de Urgencias. Dentro de los procedimientos estandarizados que suelen estar integrados en la vía clínica del centro, se encuentra la valoración directa por los neurólogos de guardia y la práctica de neuroimagen urgente, así como la aplicación de trombólisis cuando está indicada20.
Mención especial requiere el CI hospitalario en pacientes ya previamente ingresados en el hospital por otro motivo que sufren un ictus durante su hospitalización. Este tipo de pacientes presentan unas características especiales con una mayor frecuencia de ictus de origen cardioembólico y mayor mortalidad, pero la mayoría de los casos también se benefician del ingreso en una UI y de las terapias de reperfusión intravenosa o con INV. Son necesarias campañas formativas entre el personal sanitario de los hospitales para que sepan reconocer y actuar ante una sospecha de ictus67,68.
Intervencionismo neurovascularEvidencia actualEl tratamiento trombolítico del ictus isquémico persigue la recanalización precoz de las arterias cerebrales ocluidas, de manera que se restablezca la perfusión cerebral a tiempo para salvar al tejido cerebral isquémico que no ha experimentado un daño irreversible. En la actualidad, sabemos que el t-PA es seguro y eficaz en las primeras 4,5 horas del infarto cerebral. Numerosos estudios recientes demuestran que el tejido cerebral isquémico puede permanecer viable y salvable más allá de las 4,5 horas desde el inicio de los síntomas. La RM y la TC multiparamétrica permiten discriminar entre el tejido lesionado de forma irreversible y el tejido hipoperfundido pero salvable69,70 y de esta forma seleccionar a pacientes que se beneficiarán de recibir tratamiento trombolítico más allá de este intervalo o con horario de inicio de los síntomas desconocido71,72.
La trombólisis intravenosa no consigue inducir la recanalización arterial a tiempo para salvar al tejido cerebral amenazado en un porcentaje amplio de pacientes. En el caso de las oclusiones de la ACM proximal, aproximadamente un 30% de los pacientes experimentarán una recanalización arterial precoz completa. El porcentaje disminuye drásticamente en los pacientes con oclusiones de la ACI terminal, de los cuales sólo uno de cada 10 presentan una recanalización arterial precoz73. Además, numerosos pacientes presentan contraindicaciones a la administración sistémica de t-PA por situaciones de elevado riesgo hemorrágico. Por tanto, es necesario diseñar estrategias terapéuticas de recanalización más eficaces y seguras como las que proporcionan el INV.
El estudio PROACT74 demostró la eficacia y seguridad de la trombólisis intraarterial en las oclusiones de la ACM dentro de las primeras 6 horas desde el inicio de los síntomas. Por su parte, el estudio MELT75, con un diseño similar, obtuvo resultados favorables con uroquinasa intraarterial y el metanálisis de ambos estudios confirmó el efecto favorable de la trombólisis intraarterial en la oclusión de la ACM en las primeras 6 horas76. Aunque no existen estudios controlados que comparen la trombólisis intravenosa con la intraarterial, en comparaciones indirectas el porcentaje de recanalizaciones conseguidas con trombólisis intraarterial (70%) es superior al de la trombólisis intravenosa (34%), especialmente cuando se evalúan los grandes vasos intracraneales12,77,78. El riesgo de HIC sintomática es algo mayor con la trombólisis intraarterial (10%), aunque este incremento puede ser atribuible a la mayor gravedad del ictus y al mayor tiempo transcurrido desde el inicio de los síntomas hasta el tratamiento.
Para disminuir la latencia de tiempo hasta el tratamiento que comporta la trombólisis intraarterial, y ante la existencia de pacientes resistentes a la trombólisis sistémica, se han desarrollado estudios de terapia combinada de reperfusión. En pacientes menores de 80 años y con un déficit neurológico moderado-importante (NIHSS ≥ 10), la combinación del t-PA intravenoso en las 3 primeras horas (0,6mg/kg, con bolus del 15% y el resto durante 30 minutos) seguida del t-PA intraarterial entre 3 y 6 horas (bolus de 2mg seguido de una perfusión de 22mg durante las dos horas siguientes o hasta la recanalización) es segura (6% de HIC sintomáticas)79,80 y alcanza un porcentaje de recanalización superior (73%) aunque sin diferencias significativas en el pronóstico funcional al tercer mes en comparación con el estudio NINDS.
La oclusión de la AB comporta una mortalidad del 85-95% si no existe recanalización. Se definen dos ventanas horarias para el tratamiento trombolítico atendiendo a la forma de presentación de la sintomatología: de 48 horas desde el inicio de los síntomas cuando estos son progresivos o fluctuantes, y de 12 horas cuando el inicio es brusco81. Estudios observacionales no controlados de tratamiento trombolítico intravenoso en la trombosis basilar han obtenido resultados similares a los conseguidos con el INV82. La terapia trombolítica intravenosa en las primeras 6 horas, seguida de trombólisis mecánica ha obtenido resultados satisfactorios83.
Situaciones especialesEn pacientes que han sido recientemente sometidos a cirugía, el INV parece ser una técnica más segura que la trombólisis sistémica. La serie más amplia incluyó 36 pacientes con ictus de diferentes territorios arteriales entre 1-120 horas después de ser sometidos a diversos procedimientos quirúrgicos84. El INV se completó en una media de 4,5 (rango 1-8) horas, con recanalización completa o parcial en el 44% de los casos y un 25% de pacientes con hemorragia en el lugar de la cirugía, 3 de ellas fatales. La mortalidad total en la serie fue del 25%, y un 38% de los pacientes obtuvo una buena recuperación funcional84.
El tratamiento anticoagulante previo al ictus contraindica la administración de trombólisis intravenosa independientemente del INR del paciente según la regulación europea, y en pacientes con INR < 1,7 según la regulación norteamericana. El INV es una opción terapéutica segura en pacientes con ictus agudo previamente anticoagulados85–87. En situaciones clínicas de alto riesgo hemorrágico, como por ejemplo en pacientes anticoagulados con INR >1,9, recuento plaquetar < 100.000/mm3, craniectomía reciente o hemorragia sistémica activa, entre otras88, la trombólisis mecánica constituye la única opción terapéutica. Los estudios MERCI89,90 y Multi MERCI91 fueron diseñados para valorar la eficacia y seguridad de la trombectomía mecánica en pacientes resistentes (15,7%) o con contraindicaciones a la trombólisis sistémica. La revascularización multiplicó por 20 veces la probabilidad de independencia funcional a los 3 meses y redujo en un 72% la mortalidad87. La trombectomía mecánica después de la administración de trombólisis sistémica fue tan segura como la trombectomía mecánica aislada. Los recientes resultados del estudio Penumbra, cuyo mecanismo de acción se basa en la aspiración además de la extracción del trombo, han mostrado una tasa de recanalización del 82%, un porcentaje de hemorragias intracraneales sintomáticas del 11%, una mortalidad del 33% y una puntuación en la escala modificada de Rankin (ERm) ≤ 2 a los 3 meses en el 25% de los pacientes. Hay que tener en cuenta que los pacientes de los estudios de trombólisis mecánica presentaban una morbi-mortalidad esperada pre-procedimiento muy importante, ya que la mediana de la NIHSS basal era 19, y más del 40% tenía oclusión de la ACI terminal o de la AB92.
Sobre la base de los estudios mencionados, diversas sociedades científicas recomiendan la trombólisis farmacológica intraarterial como una opción en pacientes con oclusiones de la ACM en la ventana de 6 horas, o en los pacientes con contraindicaciones para la trombólisis intravenosa. La trombectomía mecánica se menciona como una intervención razonable para la extracción de trombos intra-arteriales en pacientes seleccionados hasta 8 horas45,93–95. Experiencias iniciales con dispositivos de trombectomía tras trombólisis sistémica o intraarterial demuestran la seguridad y alta tasa de recanalización96.
Criterios de derivación a un Hospital de Referencia para tratamiento intervencionista neurovascular o neuroquirúrgicoEl objetivo es identificar a los pacientes tributarios de este tratamiento en el primer nivel asistencial, con la finalidad de ser remitidos directamente al CR y acortar los tiempos de intervención, o en el segundo nivel teniendo en cuenta los resultados de las pruebas complementarias y la respuesta a los tratamientos administrados. Los criterios de alerta para tratamiento intervencionista neurovascular deben combinar por tanto variables clínicas de fácil identificación junto con los resultados de las pruebas diagnósticas accesibles. La activación del protocolo de traslado debe siempre ser llevado a cabo por el neurólogo.
Los criterios de derivación son más amplios en lo relativo a la ventana de tratamiento (hasta 8 horas, incluyendo los ictus de inicio desconocido), pero más restrictivos en cuanto a gravedad (NIHSS ≥10) y en relación con las características de las pruebas diagnósticas basales. No se establece límite de edad, pero no serán candidatos pacientes con co-morbilidad importante y esperanza de vida reducida, ni tampoco aquellos pacientes dependientes (incapacidad para caminar, asearse o vestirse).
De modo general se reconocen tres circunstancias en las que estaría indicado el INV: pacientes en los que la trombólisis sistémica esté contraindicada, aquellos en que los que el INV estaría indicado de modo primario (oclusión de ACI terminal o de la AB) o en aquéllos con fracaso de la trombólisis sistémica.
Se considerará por tanto la posibilidad de derivación de un paciente al HR para tratamiento endovascular cuando el paciente pueda llegar al mismo dentro de la ventana terapéutica en las siguientes situaciones:
- 1)
Ictus del despertar o ictus con horario de inicio desconocido.
- 2)
Trombosis de AB si:
- a)
Tiempo de evolución menor de 12h desde el inicio de los síntomas o hasta 48h si el curso es progresivo, fluctuante o precedido de AIT.
- b)
Excluir si se constata abolición de los reflejos troncoencefálicos o presencia de una hipodensidad extensa en la TC o de una lesión extensa en la secuencia de difusión en RM.
- a)
- 3)
En pacientes tratados con t-PA i.v. en < 4,5 horas desde el inicio de los síntomas, si se cumple alguno de los siguientes supuestos:
- a)
No existe mejoría de la NIHSS durante la infusión del trombolítico (debería activarse el traslado a los 30’ si no hay respuesta).
- b)
No se comprueba recanalización a los 30’ en la monitorización con doppler transcraneal (DTC) o en otras exploraciones angiográficas no invasivas como la angio-TC.
- c)
Existe sospecha de una oclusión de la ACI terminal, de la ACM proximal o de la AB. En estos casos debería activarse el traslado de inmediato.
- a)
- 4)
Pacientes en los que la trombólisis sistémica esté contraindicada:
- a)
Anticoagulación (si INR >1,7 o APTT alargado)
- b)
Plaquetas < 100.000/mm3.
- c)
Tratamiento con heparinas de bajo peso molecular a dosis anticoagulantes.
- d)
Cirugía mayor en los últimos 3 meses.
- e)
Enfermedad o condición que comporte riesgo hemorrágico elevado.
- f)
Ictus en los últimos 3 meses.
- g)
Antecedentes de hemorragia cerebral.
- a)
- 5)
Un NIHSS ≥10, en ausencia de pruebas complementarias que nos proporcionen un diagnóstico vascular fiable, permite predecir una mala respuesta a la trombólisis intravenosa. En estos casos es mandatario iniciar el tratamiento intravenoso y, en caso de carecer de métodos de monitorización vascular, remitir de inmediato al paciente al HR. La actitud será la misma cuando se confirme una oclusión arterial mayor (ACI terminal, ACM o AB) por una técnica de diagnóstico vascular (DTC, angio-TC o angio-RM) independientemente de la gravedad neurológica (NIHSS). Es preciso en cualquier caso una TC craneal que descarte la existencia de signos de infarto extenso (clara hipodensidad en más de un tercio de territorio de ACM o puntuación ASPECTS <797).
Además, serán tributarios de traslado al HR para INV o tratamiento neuroquirúrgico los pacientes con hemorragia subaracnoidea espontánea, las hemorragias lobares y el infarto maligno de la ACM.
Deben existir, en cualquier caso, unos protocolos de derivación del paciente a su hospital de origen, tras un tiempo prudente de observación en el CR.
TelemedicinaDe manera amplia la “telemedicina” puede definirse como la aplicación de las tecnologías de telecomunicación a la información y servicios médicos. La telemedicina comprende todos los aspectos de la práctica médica a distancia, realizada con ayuda del teléfono, fax, correo electrónico o video-conferencia. El término “teleictus” fue acuñado en 1993 para describir la aplicación de la telemedicina facilitando las consultas remotas de pacientes con ictus a expertos en patología vascular cerebral98. Con el tiempo se ha acumulado experiencia en sistema de teleictus en diversas partes del mundo, siendo actualmente una tecnología en clara expansión que ya existe también en nuestro país19. Los sistemas de teleictus acercan la consulta especializada a los centros comarcales y consiguen duplicar el número de pacientes con ictus que reciben atención neurológica especializada urgente, doblar el número de tratamientos trombolíticos, reducir significativamente el tiempo transcurrido hasta el inicio de la trombólisis en unos 50 minutos e incrementar el número de pacientes tratados en las primeras 3 horas; además, reducen en más de un tercio el número de traslados interhospitalarios99. Se considera que el desarrollo de sistemas de teleictus junto con la educación y entrenamiento en esta patología a los profesionales aumenta el uso de t-PA en hospitales comunitarios sin acceso a expertos en este tratamiento19. No obstante debemos tener en cuenta que la telemedicina no sustituye ni alcanza la calidad del servicio prestado en centros especializados.
La telemedicina ha empleado el teléfono y sistemas interactivos vía World Wide Web de teleconferencia, con sistemas de comunicación bidireccionales de alta calidad, que permitan la valoración del paciente y de sus imágenes de TC o RM (tablas 7 y 8). Se ha comprobado que la interpretación de las pruebas de neuroimagen a distancia es fiable100, y se ha confirmado igualmente que los sistemas de video-conferencia, que permiten al neurólogo explorar de manera asistida al paciente, mejoran el porcentaje de decisiones correctas en la indicación del tratamiento trombolítico frente a los sistemas puramente telefónicos (sin imagen)101–103. De hecho, la telemedicina ha demostrado su fiabilidad en la aplicación a distancia de la escala de valoración NIH en los pacientes con ictus, siendo comparable con la puntuación obtenida de manera presencial101,104–106. La concordancia de las observaciones es mejor en los ítems de orientación, lenguaje, disartria motor, mirada, facial, sensibilidad y negligencia que con ataxia u obedecer órdenes107. Además, los sistemas de teleictus también se han mostrado útiles a la hora de guiar el estudio ultrasonográfico con DTC por observadores sin experiencia, aunque con mayor consumo de tiempo en el examen108.
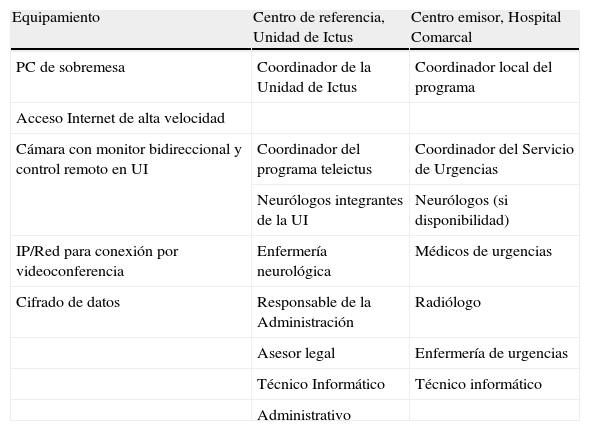
Equipo básico y profesionales de un sistema de teleictus
| Equipamiento | Centro de referencia, Unidad de Ictus | Centro emisor, Hospital Comarcal |
| PC de sobremesa | Coordinador de la Unidad de Ictus | Coordinador local del programa |
| Acceso Internet de alta velocidad | ||
| Cámara con monitor bidireccional y control remoto en UI | Coordinador del programa teleictus | Coordinador del Servicio de Urgencias |
| Neurólogos integrantes de la UI | Neurólogos (si disponibilidad) | |
| IP/Red para conexión por videoconferencia | Enfermería neurológica | Médicos de urgencias |
| Cifrado de datos | Responsable de la Administración | Radiólogo |
| Asesor legal | Enfermería de urgencias | |
| Técnico Informático | Técnico informático | |
| Administrativo |
IP: Internet protocol; PC: personal computer, UI: Unidad de Ictus.
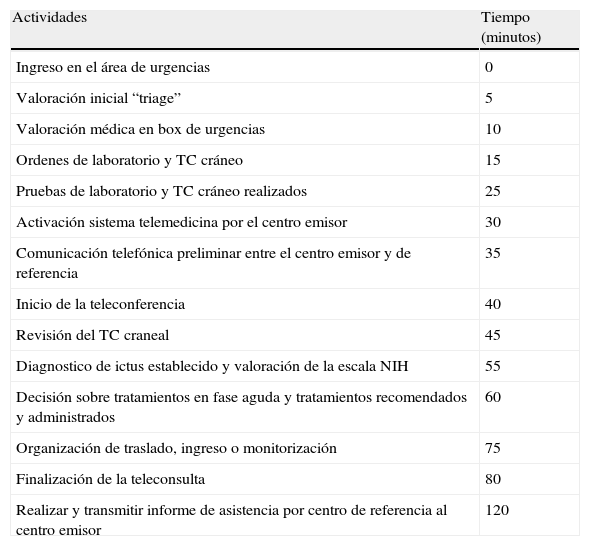
Intervalos de tiempo orientativos para las diferentes actividades de una teleconsulta en ictus
| Actividades | Tiempo (minutos) |
| Ingreso en el área de urgencias | 0 |
| Valoración inicial “triage” | 5 |
| Valoración médica en box de urgencias | 10 |
| Ordenes de laboratorio y TC cráneo | 15 |
| Pruebas de laboratorio y TC cráneo realizados | 25 |
| Activación sistema telemedicina por el centro emisor | 30 |
| Comunicación telefónica preliminar entre el centro emisor y de referencia | 35 |
| Inicio de la teleconferencia | 40 |
| Revisión del TC craneal | 45 |
| Diagnostico de ictus establecido y valoración de la escala NIH | 55 |
| Decisión sobre tratamientos en fase aguda y tratamientos recomendados y administrados | 60 |
| Organización de traslado, ingreso o monitorización | 75 |
| Finalización de la teleconsulta | 80 |
| Realizar y transmitir informe de asistencia por centro de referencia al centro emisor | 120 |
NIH: National Institutes of Health; TC: Tomografía computarizada.
Además de ahorrar tiempo en la administración de trombólisis en el ictus, los sistemas de telemedicina han demostrado ser seguros109–111. No en vano, la trombólisis intravenosa realizada mediante telemedicina, sólo por el hecho de acortar el tiempo necesario hasta el tratamiento, aumenta las posibilidades de que un paciente concreto pueda resultar beneficiado hasta la recuperación sin secuelas112. Este beneficio se ha demostrado incluso en series que incluyen un alto porcentaje de pacientes mayores de 80 años113 y se mantiene a largo plazo114. Las experiencias de distintas áreas de salud que ya disponen de sistemas de teleictus demuestran que los mismos permiten aumentar el número de pacientes tratados con t-PA, y al mejorar globalmente el grado de discapacidad acortan la estancia hospitalaria y la necesidad de cuidados institucionales tras el alta115. Los sistemas de teleictus resultan además doblemente coste-eficientes porque suprimen traslados innecesarios109 o permiten que se hagan diferidos, tras el tratamiento intravenoso, lo que evita traslados más costosos, como los aéreos (helicóptero)116.
Otra utilidad de la telemedicina es que establece un sistema de educación continuada, familiarizando al personal sanitario en el diagnóstico precoz y en el manejo protocolizado del ictus. Esto se ha comprobado en la experiencia alemana, obteniendo medidas de mejoría en pronóstico similares a las de los ensayos aleatorizados de UI113,117. También puede ser útil la valoración de la discapacidad ocupacional, lenguaje o física cuando no sea posible hacerlo in situ, de cara a instaurar medidas de rehabilitación118,119.
Un buen ejemplo de la utilidad de la telemedicina es el proyecto TEMPIS, que en la región alemana de Baviera integra hasta 12 hospitales comarcales, con dos HR y que ha permitido evaluar a más de 9.000 pacientes108,113. En este proyecto el tiempo de evaluación es de 15 minutos incluyendo la exploración física y la valoración de la TC, siendo el tiempo desde el inicio de los síntomas hasta el del tratamiento de 140 minutos. Se observó una recuperación completa o casi completa (ERm < 2) en un 38 y un 34% de los pacientes tratados en los centros comarcales u HR, respectivamente. La tasa de mortalidad en ambos grupos fue similar, próxima al 11% a los tres meses. La tasa de transformación hemorrágica sintomática del 7,8%, comparable a la del estudio NINDS (6,4%). Un estudio reciente muestra el beneficio a largo plazo en los pacientes del estudio aunque es mayor en los HR en el porcentaje de pacientes tratados (5,8 vs 2,4%) y en el tiempo puerta-aguja (57 vs 65 minutos)113.
En España se ha implantado el sistema de telemedicina en Baleares y el proyecto Tele-Ictus Cataluña. Otras regiones españolas tienen pendiente la puesta en marcha de sistemas de teleictus.
La telemedicina introduce nuevas formas de relación entre los profesionales de la salud y facilita el acceso al tratamiento trombolítico. No obstante puede ser objeto de controversia en aspectos legales como la confidencialidad o en aspectos como la evaluación del procedimiento o el control de calidad120. Para proteger tanto a los pacientes como a los profesionales será necesario revisar el marco legal en el que se desarrolla este procedimiento120,121. Dada la complejidad del procedimiento su implementación en cada área sanitaria exige una gran coordinación entre centros hospitalarios y con los servicios de emergencias extrahospitalarias, así como la existencia de un plan de actuación definido y aprobado por los distintos comités éticos clínicos y las autoridades sanitarias.
La telemedicina es una medida eficiente en la asistencia al ictus, contribuye a la equidad geográfica en la prestación de los servicios sanitarios y a la mejora de la calidad asistencial en los pacientes con ictus que acuden al servicio de urgencias de un hospital carente de un neurólogo experto en patología cerebrovascular. Este sistema facilita el acceso a tratamientos de reperfusión en la fase aguda, permite el ahorro de tiempo en la valoración, diagnóstico y tratamiento de los pacientes y facilita la selección de aquellos que precisan derivación a un hospital de referencia. Además, los sistemas de teleictus permiten una más amplia interrelación entre profesionales sanitarios y mejoran su formación continuada. A tenor de las evidencias actuales, para garantizar la equidad territorial en la mejor asistencia al ictus se recomienda el desarrollo de sistemas de Telemedicina en aquellas áreas sanitarias con características geográficas complicadas que dificulten la rápida llegada del paciente al hospital con UI.
Conflicto de interesesLos autores declaran n o tener ningún conflicto de intereses.
Documento de consenso elaborado por un Comité ad hoc del Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV) de la Sociedad Española de Neurología (SEN).