El uso de modelos experimentales en animales permite aumentar el conocimiento sobre la patología del sistema nervioso central. Sin embargo, en la esclerosis múltiple, no existe un modelo que permita una visión general de la enfermedad, de forma que es necesario utilizar una variedad de modelos que abarquen los distintos cambios que se producen.
DesarrolloSe revisan los distintos modelos experimentales que pueden ser utilizados en la investigación en la esclerosis múltiple, tanto in vitro como in vivo. En relación a los modelos in vitro se analizan los distintos cultivos celulares y sus potenciales modificaciones así como los modelos en rodajas. En los modelos in vivo, se analizan los modelos de base inmune-inflamatoria como la encefalitis alérgica experimental en los distintos animales, además de las enfermedades desmielinizantes por virus. Por otro lado, se analizan los modelos de desmielinización-remielinización incluyéndose las lesiones químicas por cuprizona, lisolecitina, bromuro de etidio, así como el modelo de zebrafish y los modelos transgénicos.
ConclusionesLos modelos experimentales nos permiten acercarnos al conocimiento de los diversos mecanismos que ocurren en la esclerosis múltiple. La utilización de cada uno de ellos depende de los objetivos de investigación que planteen.
Experimental animal models constitute a useful tool to deepen our knowledge of central nervous system disorders. In the case of multiple sclerosis, however, there is no such specific model able to provide an overview of the disease; multiple models covering the different pathophysiological features of the disease are therefore necessary.
DevelopmentWe reviewed the different in vitro and in vivo experimental models used in multiple sclerosis research. Concerning in vitro models, we analysed cell cultures and slice models. As for in vivo models, we examined such models of autoimmunity and inflammation as experimental allergic encephalitis in different animals and virus-induced demyelinating diseases. Furthermore, we analysed models of demyelination and remyelination, including chemical lesions caused by cuprizone, lysolecithin, and ethidium bromide; zebrafish; and transgenic models.
ConclusionsExperimental models provide a deeper understanding of the different pathogenic mechanisms involved in multiple sclerosis. Choosing one model or another depends on the specific aims of the study.
El desarrollo de modelos experimentales es un elemento esencial para avanzar en el conocimiento de las enfermedades y en la búsqueda de terapias específicas y efectivas. Esta necesidad se ve dificultada en la esclerosis múltiple (EM) por el hecho de que esta enfermedad solo aparece en el ser humano y que las enfermedades desmielinizantes en animales muestran diferencias importantes sobre cualquier enfermedad humana que comprometa el sistema nervioso central (SNC)1–3. Así, la búsqueda de modelos animales para las enfermedades desmielinizantes ha conducido a modelos in vitro e in vivo, siendo estos últimos inducidos con lesiones químicas, virales o inmunes, además de los animales transgénicos1,4–6. Al no disponer de un modelo equiparable a la EM, la información debe obtenerse de varios de ellos, de forma que el conocimiento de los mecanismos de los distintos modelos existentes permite una aproximación de lo que ocurre en esta enfermedad7.
Aunque la EM es una enfermedad inflamatoria en el origen, la falta de reparación en las lesiones, la remielinización incompleta y la neurodegeneración, son los factores que conducen a la progresión y a la discapacidad. Este aspecto es relevante en el tratamiento de los pacientes con EM, ya que la actual terapéutica solo es efectiva en el control de los mecanismos inmunes y en consecuencia en las fases iniciales de la enfermedad, pero no tienen acción en la remielinización y por lo tanto tampoco en la aparición de secuelas8,9. Es por ello, que la remielinización es el objetivo de nuevas opciones terapéuticas en la EM10 y en esta revisión abordaremos los modelos disponibles que nos permiten disponer de información sobre esa fase de la enfermedad y que permiten establecer diseños de evaluación de fármacos.
DesarrolloModelos in vitroLos modelos in vitro consisten en cultivos celulares de células aisladas del cerebro de mamíferos o de líneas de células inmortalizadas que permiten estudiar las interacciones entre sus células. Estas líneas celulares pueden ser transformadas genéticamente, las cuales son estables y pueden ser sometidas a diversas condiciones experimentales6,11. En el SNC, pueden utilizarse cultivos celulares de microglía (mesodérmica), neuronas, astrocitos y oligodendrocitos además de sus precursores (ectodérmicas). En la EM, los cultivos de células de la microglía permiten extrapolar su papel en la respuesta inmune en el SNC, analizando su respuesta ante diversas señales, como por ejemplo las bioquímicas, y analizando los potenciales mecanismos de activación de estas células6,12,13. Los cultivos de células de linajes ectodérmicos permiten evaluar la cascada de eventos posteriores a la desmielinización, el soporte metabólico en zonas de lesión por parte de los astrocitos, las vías de activación y señalización involucradas en el reemplazo de oligodendrocitos y remielinización de axones afectados. Es especialmente interesante la utilización de cultivos de células precursoras de oligodendrocitos o de células neurales indiferenciadas, ya que nos permiten evaluar los procesos de diferenciación, observar el efecto de factores inflamatorios, testar nuevos compuestos químicos destinados a favorecer la proliferación de los oligodendrocitos6, así como desarrollar estrategias que ayuden a mejorar el proceso de remielinización14. Nuestro grupo ha utilizado estas células para transfectar mutaciones asociadas a la enfermedad de Alexander y conocer los mecanismos de la mielinización en esta enfermedad15. Los cultivos primarios de astrocitos son también interesantes ya que estas células participan en el ambiente local, el cual es imprescindible en el proceso de remielinización, actuando mediante la secreción de factores de crecimiento como el factor de crecimiento derivado de plaquetas o el factor de crecimiento insulínico tipo 1, los cuales han mostrado que promueven la remielinización. La principal desventaja de estos modelos in vitro es que la respuesta de los tipos celulares individuales no tiene por qué reflejar totalmente lo que ocurre en el tejido. Los cultivos de rodajas son modelos in vitro que permiten estudiar las interacciones célula-célula14 y acercarse más a las condiciones in vivo16, así como observar la interacción del sistema inmune con los mecanismos del daño y reparación del SNC1, permitiendo regular las alteraciones en la maduración de los oligodendrocitos y el fallo de la remielinización relacionada a una astrogliosis crónica del SNC5. Los modelos en rodajas presentan ciertas limitaciones, como el procedimiento de obtención de las rodajas, ya que se requieren muestras de 200 a 500 micras de espesor procedentes de animales jóvenes o incluso neonatales, que deben manipularse en laboratorios con condiciones especiales para gas carbógeno17,18.
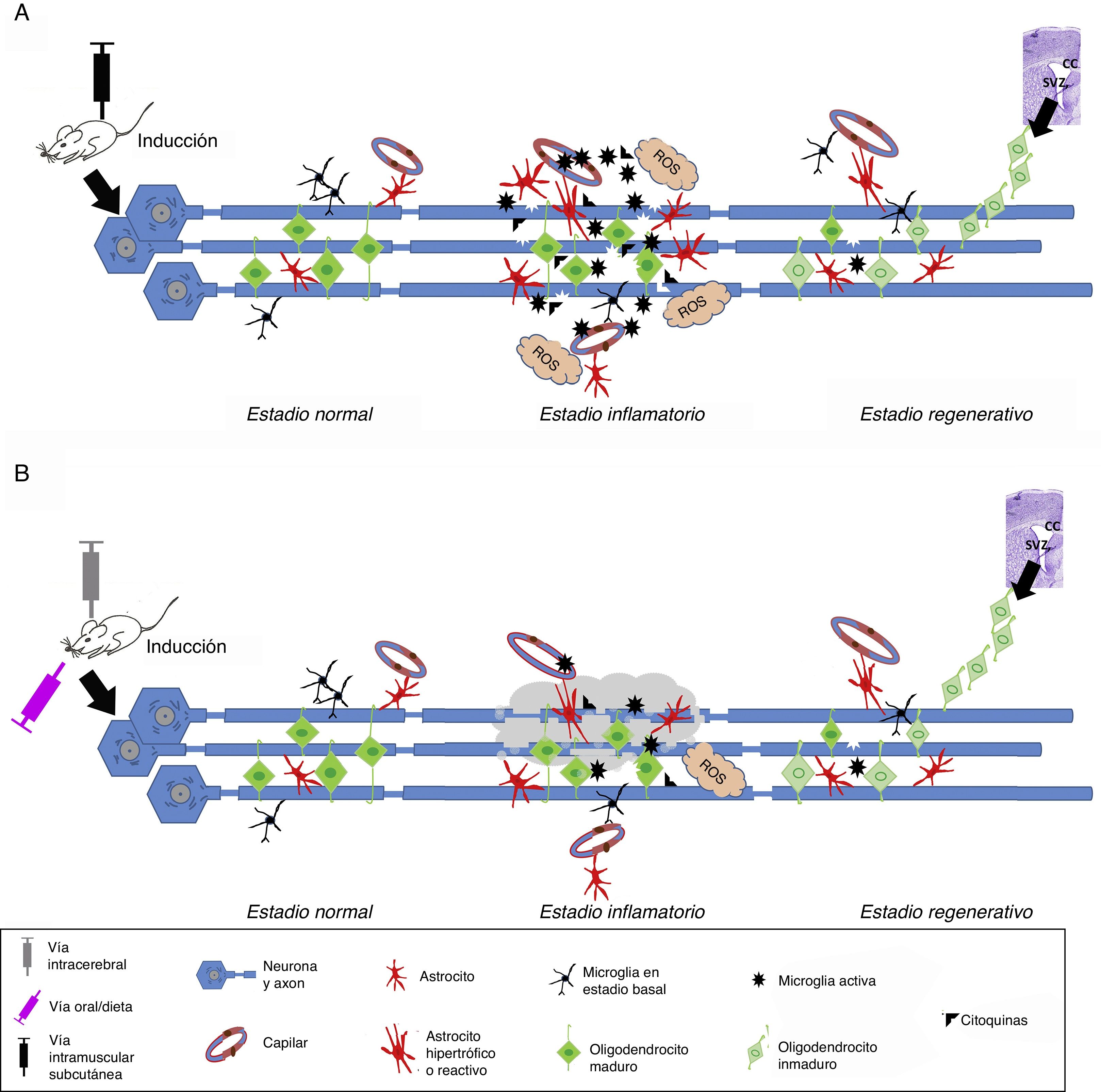
Modelos in vivoLos modelos experimentales in vivo aplicables al conocimiento en la EM pueden clasificarse en tres bloques: 1) modelos autoinmunes y/o inflamatorios (fig. 1A), como la encefalitis alérgica experimental (EAE) y aquellos desencadenados por virus; 2) modelos de desmielinización-remielinización (fig. 1B), incluyéndose las lesiones químicas por cuprizona, lisolecitina, bromuro de etidio, así como el modelo de zebrafish; 3) los modelos transgénicos, los cuales se intentan acercar de manera más similar a la enfermedad14 (tabla 1).
Esquema de inducción en los modelos in vivo. A) Inducción en los modelos autoinmunes y/o inflamatorios. La inducción se realiza por la aplicación del agente inmunoestimulante por vía intramuscular o subcutánea. Una vez iniciado el estadio inflamatorio, se observa un incremento de los niveles de citoquinas proinflamatorias, linfocitos T y microglía activada, provocando a su vez generación de especies reactivas de oxígeno (ROS) y daño en los oligodendrocitos y la mielina, además de provocar una gliosis reactiva y alteración de la pared capilar, generando edema. Transcurrido este estadio, en el proceso regenerativo la cantidad de células activadas (astrocitos y microglía) disminuyen y se observa una migración de progenitores oligodendrogliales, principalmente desde el cuerpo calloso (CC) o la zona subventricular (SVZ), para sustituir las células afectadas e iniciar la remielinización. B) Inducción en los modelos de desmielinización. La inducción se realiza por la aplicación de un agente químico o tóxico por varias vías: oral (dieta), local (intracerebral), intramuscular o subcutánea. Una vez administrado y ya en torrente sanguíneo, el agente tóxico en contacto con los axones produce degeneración mielínica, provocando un microambiente que de forma secundaria induce la activación de células de microglía, generación de ROS, así como la liberación de citoquinas inflamatorias y gliosis reactiva, teniendo como punto final la pérdida de las vainas de mielina y de las células generadoras de mielina (oligodendrocitos). Transcurrido este estadio, en el proceso regenerativo la cantidad de células activadas (astrocitos y microglía) disminuyen y se observa una migración de progenitores oligodendrogliales, principalmente desde el CC o la SVZ, para sustituir las células afectadas e iniciar la remielinización.
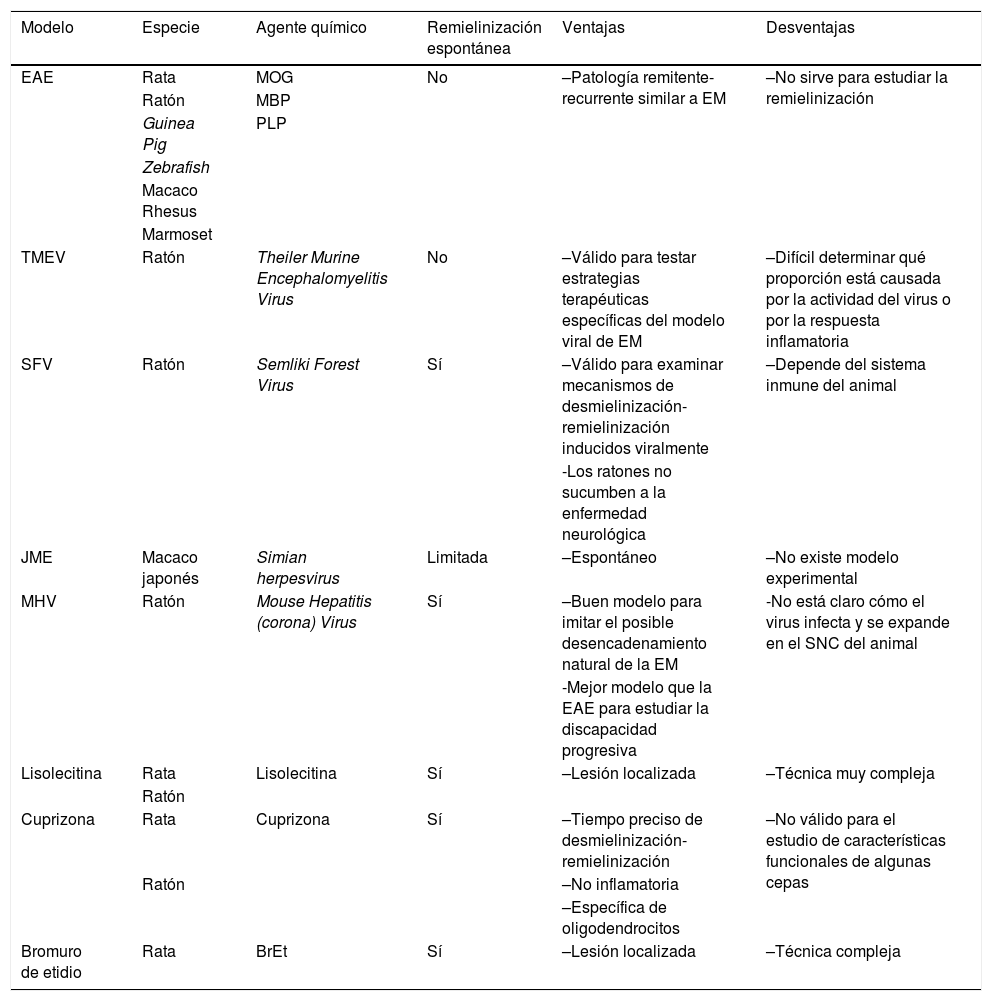
Características principales de los diferentes modelos in vivo, ventajas y desventajas
| Modelo | Especie | Agente químico | Remielinización espontánea | Ventajas | Desventajas |
|---|---|---|---|---|---|
| EAE | Rata | MOG | No | –Patología remitente-recurrente similar a EM | –No sirve para estudiar la remielinización |
| Ratón | MBP | ||||
| Guinea Pig | PLP | ||||
| Zebrafish | |||||
| Macaco Rhesus | |||||
| Marmoset | |||||
| TMEV | Ratón | Theiler Murine Encephalomyelitis Virus | No | –Válido para testar estrategias terapéuticas específicas del modelo viral de EM | –Difícil determinar qué proporción está causada por la actividad del virus o por la respuesta inflamatoria |
| SFV | Ratón | Semliki Forest Virus | Sí | –Válido para examinar mecanismos de desmielinización-remielinización inducidos viralmente | –Depende del sistema inmune del animal |
| -Los ratones no sucumben a la enfermedad neurológica | |||||
| JME | Macaco japonés | Simian herpesvirus | Limitada | –Espontáneo | –No existe modelo experimental |
| MHV | Ratón | Mouse Hepatitis (corona) Virus | Sí | –Buen modelo para imitar el posible desencadenamiento natural de la EM | -No está claro cómo el virus infecta y se expande en el SNC del animal |
| -Mejor modelo que la EAE para estudiar la discapacidad progresiva | |||||
| Lisolecitina | Rata | Lisolecitina | Sí | –Lesión localizada | –Técnica muy compleja |
| Ratón | |||||
| Cuprizona | Rata | Cuprizona | Sí | –Tiempo preciso de desmielinización-remielinización | –No válido para el estudio de características funcionales de algunas cepas |
| Ratón | –No inflamatoria | ||||
| –Específica de oligodendrocitos | |||||
| Bromuro de etidio | Rata | BrEt | Sí | –Lesión localizada | –Técnica compleja |
BrEt: bromuro de etidio;EAE: encefalitis alérgica experimental; JME: Japanese macaque encephalomyelitis; MBP: proteína básica de la mielina; MHV: Mouse Hepatitis (corona) virus; MOG: glicoproteína oligodendroglial de la mielina; PLP: péptido de la proteína proteolipídica; SFV: Semliki forest Virus; TMEV: Theiler's murine encephalomyelitis virus.
La EAE es una aproximación a las características de la EM: inflamación, desmielinización, pérdida axonal y gliosis. La principal diferencia entre la EM y la EAE es que en esta última se requiere una inmunización externa para desarrollarse3,19. Existen diferentes protocolos para inducir la enfermedad pero los más utilizados se basan en la inmunización del animal con un autoantígeno para inducir la activación de sus células T reactivas (EAE activa) o bien en la transferencia de células T autorreactivas a un animal naïve (EAE pasiva)6,20. Para provocar la EAE de manera activa se necesita un adyuvante, siendo el más utilizado el Complete Freund's Adjuvant21, el cual produce una lenta liberación del antígeno procedente del inóculo2 además de utilizar alguna especie de micobacteria, normalmente Bordetella pertussis, la cual provoca una expansión clonal de linfocitos T autorreactivos6, potenciando de esta manera las manifestaciones típicas de EM al favorecer la respuesta inmune humoral22. Aunque la EAE ha sido utilizada para estudiar los mecanismos relacionados con la neuroinflamación y la respuesta inmune, también ha sido utilizada para el estudio de los procesos de desmielinización y remielinización19. Al igual que en la EM, la edad, el género y los factores ambientales tienen una profunda influencia en la susceptibilidad, severidad y curso de la EAE14. Este modelo ha sido testado en diferentes especies con el fin de encontrar aquel que mejor mimetice a la enfermedad en humanos. Así, se han ensayado en primates, como los monos Rhesus, que mostraron parálisis asociada a infiltrados perivasculares y desmielinización en el cerebro y la médula espinal, así como encefalomielitis diseminada23–25. En este caso se desarrollan síntomas clínicos severos hiperagudos, de forma que es un modelo que se acerca más a la variante Marburg. El Marmoset es otra especie a la que se ha inducido la EAE con diferentes procedimientos: a) por medio de un homogenado de materia blanca provocando lesiones que se parecen a las observadas en las autopsias de pacientes26, b) mediante la administración de glicoproteína oligodendroglial de la mielina (MOG) recombinante humana provocando lesiones desmielinizantes más pequeñas pero más duraderas26,27 o c) mediante la inmunización con una dosis subclínica de MOG recombinante de rata seguido de una inyección de TNFα e interferón27,28. Aunque la EAE en primates se asemeja más a la enfermedad en humanos que la de los roedores en relación con los cambios patológicos, existen limitaciones tanto éticas como de coste para su uso, cuando es posible utilizar animales menores27.
Los roedores presentan amplias diferencias con los humanos en cuanto a su sistema inmune pero permiten evaluar el carácter crónico y progresivo de la enfermedad a través de estudios inmunogenéticos, histopatológicos y terapéuticos. En el ratón la EAE es inducida mediante la respuesta inmunológica causada tras la inyección de los antígenos de mielina, como el péptido de la proteína proteolipídica (PLP), la MOG29 y la proteína básica de la mielina (MBP), observándose en estos dos últimos activación de microglía, infiltración perivascular de linfocitos T y B e incluso en algunos casos, se observa daño en la mielina que tiende a correlacionar con los periodos de recaída de la enfermedad30. A su vez, también se han desarrollado modelos en ratón para la neuromielitis óptica31,32. En el modelo de EAE en rata, la enfermedad consiste en la infiltración inflamatoria de las células mononucleares en la médula espinal, cerebelo y bulbo raquídeo33. Asimismo, existen dos modelos de EAE con Guinea pigs (Hartley y línea 13) en las cuales se han desarrollado estudios tras la inducción de EAE. Se ha considerado que la línea 13 podría suponer uno de los modelos que mimeticen mejor la desmielinización producida en la EM, ya que desarrolla una sintomatología caracterizada por recaídas crónicas34. Además existe un modelo de EAE sobre el zebrafish35.
Modelos de enfermedades desmielinizantes viralesExisten modelos que se basan en la utilización de virus para inducir desmielinización en el SNC. El Theiler's murine encephalomyelitis virus es un patógeno exclusivo de ratones36,37 capaz de inducir en estos una enfermedad neurológica desmielinizante por infección de las neuronas, la cual se manifiesta como una encefalitis normalmente subclínica. Tras este primer estadio agudo le sigue una fase crónico-progresiva caracterizada por procesos de desmielinización-remielinización que afecta principalmente a la médula espinal y donde se puede apreciar daño en los macrófagos, microglía, oligodendrocitos y astrocitos2,37–39. Las lesiones en la médula espinal están caracterizadas por una inflamación crónica, la formación de placas confluentes de la primera desmielinización, una extensión variable del daño axonal y remielinización. La desmielinización activa ocurre en sitios donde la microglía está activada y hay infiltración de macrófagos, es decir, que estas lesiones comparten características esenciales con las presentes en EM2.
La cepa no virulenta A7 del Semliki Forest Virus es otro virus neuroinvasivo que, tras ser inoculado periféricamente en ratones susceptibles, induce daño en la mielina del SNC. Esta cepa induce viremia, que dura 3-4 días, tras la cual el virus se elimina de la sangre. En las siguientes infecciones este virus es capaz de atravesar la barrera hematoencefálica infectando neuronas y oligodendrocitos, donde la replicación viral tiene su máximo a los 5-7 días, mientras que la desmielinización se observa entre los 13 y los 17 días. Se sabe que el daño en la mielina depende de la cepa del virus, la edad del portador y del desarrollo del sistema inmune del animal20.
El Japanese Macaque Encephalomyelitis (JME) es una enfermedad desmielinizante asociada a un herpesvirus de simios. JME normalmente aparece en animales adultos jóvenes, y no muestra preferencias por género. Patológicamente, causa áreas multifocales de desmielinización con pérdida de oligodendrocitos y pérdida axonal variable en la materia blanca del cerebro, cerebelo, bulbo raquídeo y médula espinal asociada con infiltrados de macrófagos y linfocitos. Tiene similitudes clínicas, de resonancia magnética y patológicas con la EM, aunque también presenta ciertas diferencias como son la cantidad de neutrófilos y linfocitos en LCR, así como necrosis y hemorragias como parte de la patología. Las lesiones observadas en estos animales son tanto agudas como crónicas40,41.
El Mouse Hepatitis (corona) virus es un virus que puede inducir diversas enfermedades dependiendo de la cepa. La enfermedad neurológica se produce después de una infección intracraneal o nasal con una cepa neurovirulenta. Esta enfermedad se desarrolla en dos fases, la primera de ellas comienza días después de la infección y resulta en una panencefalitis inducida por virus. Tras esta fase los animales se recuperan y pasadas 4 semanas puede comenzar la segunda fase, la cual está caracterizada por una enfermedad neuroparalítica con lesiones inflamatorias desmielinizantes. El virus es eliminado del cerebro al final de la primera fase pero los RNA virales permanecen en los tejidos durante toda la enfermedad6,42.
Una diferencia relevante entre los modelos virales y los modelos EAE es que la desmielinización inflamatoria crónica inducida por virus está asociada a una activación muy importante de la microglía6.
Modelos de desmielinización-remielinizaciónModelos químicos de lesiónLos agentes más utilizados en estos modelos son cuprizona, lisolecitina y bromuro de etidio. Todos ellos son capaces de producir una desmielinización focal tras su administración6. Aún así, los dos primeros son los más utilizados debido a su capacidad de inducir una desmielinización extensa en ciertos lugares del SNC como el cuerpo estriado, el hipocampo, la médula espinal o el nervio óptico, entre otros6,43. La cuprizona es un agente quelante ampliamente utilizado debido a que es capaz de inducir desmielinización en el SNC tras su administración sistémica44. Se ha observado que provoca el desarrollo de lesiones desmielinizantes agudas que pueden evolucionar a un proceso crónico mientras persista su administración. Este modelo tiene la ventaja de que, una vez suprimida la administración, se desencadena un proceso espontáneo de remielinización permitiendo el estudio de ambos mecanismos. Otra de las grandes ventajas es que el compuesto provoca una supresión de células T permitiendo observar los procesos de desmielinización y remielinización, separando los efectos inducidos por la activación del sistema inmune de aquellos debidos al fármaco suministrado6. La lisolecitina, inyectada en la sustancia blanca, induce placas focales de desmielinización debido a la acción directa de la toxina, la cual daña la vaina de mielina2,45. Además es un agente quimioatrayente para monocitos permitiendo que se desencadene una respuesta inflamatoria, pudiendo observarse sus efectos utilizando diferentes animales de experimentación como gatos y conejos, además de ratas y ratones46. Al igual que en otros modelos tóxicos de desmielinización, la fase de destrucción de la mielina es rápidamente seguida de una remielinización, aunque la velocidad y el grado de remielinización son dependientes de la edad2. Por su parte, el efecto tóxico del bromuro de etidio se basa en su interacción con el DNA, afectando principalmente a los astrocitos, por lo que las lesiones producidas son inducidas por la ausencia de factores de soporte liberados por estas células. Con este modelo se ha observado que la remielinización mediada por oligodendrocitos requiere la presencia de astrocitos2,47.
Modelo de mielinización del zebrafishEl zebrafish es un animal de pequeño tamaño, con relativa simplicidad, transparencia óptica en estado embrionario, y cuyo desarrollo embrionario es rápido48, permitiendo observar los axones mielinizados a partir del tercer día, y así analizar los procesos de mielinización y reparación in vivo y en tiempo real49. Además, estos animales alcanzan la madurez sexual de forma muy temprana, son capaces de producir numerosas crías y su mantenimiento es mucho menos costoso que el de otros animales de experimentación. Asimismo, permite la generación de animales transgénicos que expresan proteína verde fluorescente50,51 en OL y OPC, lo que permite analizar la remielinización52,53 y testar tratamientos que la promuevan54.
Modelos con animales transgénicosLos ratones transgénicos en los cuales los genes que codifican para los componentes inmunes se han eliminado o insertado, permiten extrapolar el papel de determinados factores en la patogénesis del daño de SNC. En algunos modelos knockout para proteínas mielínicas se han conseguido reproducir alteraciones relacionadas con la EM5. Asimismo, se han realizado modelos para estudiar la mielinización basados en diferentes ratones mutados donde la mielina se encuentra afectada, como los ratones Shiverer (donde el gen que codifica para MBP está duplicado e invertido), ratón Rumpshaker (donde el gen que codifica para la PLP está mutado) y ratones Jimpy (con una mutación puntual en el gen que codifica para PLP) que desarrollan desmielinización6.
ConclusionesNo existe un modelo único que permita comprender los múltiples factores que pueden intervenir en el desarrollo de la EM y en cada una de sus fases, y por ello los investigadores tratan de acercarse a la enfermedad en aspectos y recursos que pueden ser muy diferentes. La generación de nuevos modelos o la aplicación de nuevas variaciones a los modelos actuales permitirá conocer lo que la enfermedad representa y cómo puede abordarse en terapéutica. Asimismo, los distintos modelos nos permiten extrapolar la respuesta terapéutica a determinadas opciones de tratamiento. La obtención de modelos que se acerquen cada vez más a lo que sucede en la EM, es la primera fase en la búsqueda de los mejores tratamientos para estos pacientes, pero probablemente, el conocimiento obtenido de todos ellos, es lo que realmente nos permitirá entenderla.
En relación a la búsqueda de acciones sobre la desmielinización-remielinización, es indudable el papel de los modelos químicos, aunque no nos permiten una aplicabilidad a lo que realmente representa la enfermedad, de forma que es necesario incorporar otros diseños en función de los objetivos de cada investigación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.