Las microhemorragias cerebrales (MHC) son depósitos de hemosiderina, fagocitados por macrófagos, que se visualizan como imágenes hipointensas en determinadas secuencias de adquisición T2 de resonancia magnética cerebral. Existen muchas incógnitas acerca de su fisiopatología y significado clínico.
DesarrolloRevisión bibliográfica de los principales estudios epidemiológicos, clínicos y anatomopatológicos de MHC en la población general, en pacientes con enfermedad o riesgo vascular y en pacientes con deterioro cognitivo. Descripción de la prevalencia, factores de riesgo, mecanismos fisiopatológicos y posibles implicaciones clínicas de las MHC.
ConclusionesLa prevalencia de las MHC es muy variable (3-27% en la población general, 6-80% en pacientes con enfermedad o riesgo vascular, 16-45% en pacientes con deterioro cognitivo). Las MHC se asocian a la edad, a la enfermedad de Alzheimer y, en particular, a la enfermedad vascular (hemorrágica o isquémica) cerebral. El sustrato patológico es la lipohialinosis (MHC subcorticales) o la angiopatía amiloide cerebral (MHC lobulares). Las MHC contribuyen al deterioro cognitivo, posiblemente a través de una desconexión córtico-subcortical e intracortical, y se asocian a una mayor mortalidad, especialmente de causa vascular. Las MHC aumentan el riesgo de sufrir hemorragia cerebral, especialmente en pacientes con múltiples MHC lobulares (probable angiopatía amiloide cerebral), por lo que el tratamiento anticoagulante podría estar contraindicado en estos pacientes. En pacientes con menor riesgo de sangrado, los nuevos anticoagulantes orales y la realización de un seguimiento combinado —clínico y mediante resonancia magnética— podrían ser útiles en la toma de decisiones.
Brain microbleeds (BMB) are haemosiderin deposits contained within macrophages, which are displayed as hypointense images in some T2-weighted magnetic resonance imaging sequences. There are still many questions to be answered about the pathophysiology and clinical relevance of BMB.
DevelopmentWe conducted a literature review of the main epidemiological, clinical, and anatomical pathology studies of BMB performed in the general population, in patients at risk of or already suffering from a vascular disease, and in patients with cognitive impairment. We analysed the prevalence of BMB, risk factors, and potential pathophysiological mechanisms and clinical implications.
ConclusionsThe prevalence of BMB is highly variable (3%-27% in the general population, 6%-80% in patients with vascular risk factors or vascular disease, and 16%-45% in patients with cognitive impairment). BMB are associated with ageing, Alzheimer disease (AD), and in particular haemorrhagic or ischaemic cerebrovascular disease. The pathological substrate of BMB is either lipohyalinosis (subcortical BMB) or cerebral amyloid angiopathy (lobar BMB). BMB exacerbate cognitive impairment, possibly through cortical-subcortical and intracortical disconnection, and increase the risk of death, mostly due to vascular causes. BMB also increase the risk of cerebral haemorrhage, particularly in patients with multiple lobar BMB (probable erebral amyloid angiopathy). Therefore, anticoagulant treatment may be contraindicated in these patients. In patients with lower risk of bleeding, the new oral anticoagulants and the combination of clinical and magnetic resonance imaging follow-up could be helpful in the decision-making process.
Apenas transcurridas dos décadas desde las primeras descripciones, pocos fenómenos neurorradiológicos han sido objeto de tanta atención y especulación como las microhemorragias cerebrales (en castellano estricto microhemorragias encefálicas, en adelante MHC). Con frecuencia reportadas en los informes de resonancia magnética (RM) cerebral, las MHC generan temor en el paciente e incertidumbre en los profesionales. ¿Son las MHC meros «testigos inocentes» de la enfermedad vascular cerebral o, por el contrario, conllevan implicaciones en cuanto a la sintomatología, el pronóstico y el tratamiento de los pacientes? Sobre la base de ciertos mecanismos fisiopatológicos comunes, se ha llegado a proponer que las MHC podrían ser la conexión fisiopatológica —una suerte de «eslabón perdido»— entre la enfermedad vascular cerebral y la enfermedad de Alzheimer (EA), que vendría a explicar la alta coexistencia de estas dos entidades1.
A través de la revisión de la literatura existente, este artículo tiene por objetivo describir la prevalencia, localización y factores de riesgo de las MHC. Se pretende así avanzar en el conocimiento de la fisiopatología de las MHC, de sus posibles repercusiones clínicas y, eventualmente, de sus implicaciones terapéuticas.
Definición y sustrato patológicoLas MHC son depósitos macrofágicos de hemosiderina que aparecen magnificados como imágenes negras, redondas u ovoideas de menos de 10mm de diámetro tras la aplicación de secuencias de adquisición T2* de RM. Ordenadas de menor a mayor sensibilidad para la detección de las MHC, estas secuencias son las de tipo spin-echo (SE), eco de gradiente (GE), gradient-recalled echo (GRE), GRE eco planar (GRE-EPI) y secuencia de susceptibilidad (SWI). La sensibilidad también aumenta si se aplica la técnica de alta resolución espacial acelerada en 3 dimensiones (3D)2, se aumenta la fuerza del campo magnético, se aumenta el grosor del corte, o se disminuye la distancia entre cortes3. Los criterios para la detección de las MHC han variado con el paso del tiempo, quedando establecidos en 2009, tras una reunión de expertos (tabla 1)4. Una definición precisa del tamaño de las MHC no influye en la detección, aunque su tamaño suele estar estandarizado entre 5 y 10mm en secuencia T2*-GRE5.
Criterios para la identificación de las microhemorragias cerebrales
| Imágenes negras, redondeadas u ovoides Observadas en secuencias T2* de RM cerebral Con efecto de expansión (blooming) No hiperintensas en secuencias T1 o T2 Al menos la mitad de la imagen está rodeada por parénquima cerebral Con características diferentes a los depósitos de hierro, calcio, hueso o vasos sanguíneos La historia clínica excluye un daño axonal difuso traumático |
RM: resonancia magnética.
Adaptada de Greenberg et al.4.
Los primeros estudios necrópsicos de las MHC fueron realizados en cerebros de pacientes que habían fallecido debido a hemorragia cerebral intraparenquimatosa macroscópica (en adelante, hemorragia cerebral [HC]). En estos estudios se constató que los vasos próximos a las MHC presentaban dos patrones bien diferenciados desde el punto de vista histopatológico, que se describen a continuación6.
Lipohialinosis (angiopatía hipertensiva, arteriolosclerosis o lipofibrohialinosis). La lipohialinosis es una afección focal y segmentaria de la pared de los vasos que está relacionada con los factores de riesgo vascular, en especial con la hipertensión arterial (HTA). Suele observarse en las pequeñas arterias perforantes de los núcleos grises subcorticales y de la sustancia blanca profunda, probablemente debido a que esos vasos soportan una mayor presión arterial. La membrana basal se duplica, se rompe la barrera hematoencefálica (BHE) y se deposita material fibrinoide proteináceo bajo la capa íntima. En las lesiones más avanzadas existe además un engrosamiento de la pared del vaso con presencia de fibroblastos, depósito de colágeno (que reemplaza a las células musculares y da lugar al aspecto hialino o transparente de la pared del vaso) y reducción progresiva de la luz. Puede haber aumento de los lípidos intramurales y, en ocasiones, se forman falsos aneurismas (microaneurismas) debido a la rotura de la capa media vascular (aneurismas miliares de Charcot-Bouchard)7,8.
Angiopatía amiloide cerebral (AAC). La AAC se asocia sobre todo a la edad, pero también a la EA, y puede aparecer con un patrón de herencia autosómico dominante. Se caracteriza por el depósito de proteína ß-amiloide (Aß) en las capas media y adventicia de las pequeñas arterias y capilares de las leptomeninges, la corteza y la unión entre la sustancia gris y la sustancia blanca cerebral. El depósito de Aß produce un estrechamiento de la luz, disminuye la reactividad vascular y puede dar lugar a sangrados por rotura directa de la pared del vaso o a través de la formación de microaneurismas9. En cerebros con AAC y HC lobular, es frecuente encontrar macrófagos cargados con hemosiderina o pequeñas hemorragias cerebrales extendidas por toda la corteza cerebral10. En un reciente estudio prospectivo realizado en pacientes con AAC se ha podido demostrar la aparición de nuevas MHC en las zonas con mayor carga de amiloide cerebral11.
Las MHC son, por tanto, el resultado de pequeñas extravasaciones hemáticas debidas a la rotura de la pared de arterias pequeñas, arteriolas o capilares, ya sea debido a lipohialinosis, a microaneurismas o AAC. La lipohialinosis da lugar a MHC localizadas en los ganglios basales, el tálamo, el tronco y el cerebelo, mientras que la AAC da lugar a MHC localizadas en la corteza cerebral, la sustancia blanca periventicular y profunda y el cerebelo. No es raro que la lipohialinosis y la AAC coexistan, sobre todo en las personas ancianas, en cuyo caso pueden encontrarse MHC con un patrón de distribución mixto (lobular y profundo). El mecanismo de las MHC y de las HC es probablemente el mismo. Al igual que las MHC, las HC se originarían a partir de la rotura de una o dos pequeñas arterias, a la que se sumaría la rotura secundaria o «en cadena» de otras arterias7,12.
Existe además una estrecha relación entre las MHC y la enfermedad isquémica cerebral. En estudios necrópsicos las microhemorragias se asocian, en la mayoría de los casos, a pequeñas áreas de necrosis tisular, tanto en presencia de lipohialinosis6,13,14 como de AAC15. En pacientes con enfermedad de Binswanger (EB) se han encontrado MHC en el interior de las lesiones isquémicas, así como lesiones isquémicas rodeando las MHC16.
Los hallazgos hasta aquí descritos, junto con el avance en el conocimiento de los mecanismos implicados en la BHE, han dado lugar a una clasificación más amplia de las MHC17,18:
MHC primarias: aparecen como resultado de la rotura de la pared de arterias pequeñas o de arteriolas (debido a lipohialinosis o a AAC) o como consecuencia de la alteración en alguno de los componentes de la BHE capilar (uniones estrechas, membrana basal, pericitos, astrocitos).
MHC secundarias: serían la consecuencia de la transformación hemorrágica de pequeños infartos isquémicos.
EpidemiologíaLos estudios epidemiológicos han arrojado luz sobre la prevalencia, localización y factores de riesgo de las MHC y han permitido confirmar y ahondar en los mecanismos fisiopatológicos arriba expuestos. Se resumen a continuación los resultados de los principales estudios epidemiológicos que han evaluado de forma sistemática las MHC.
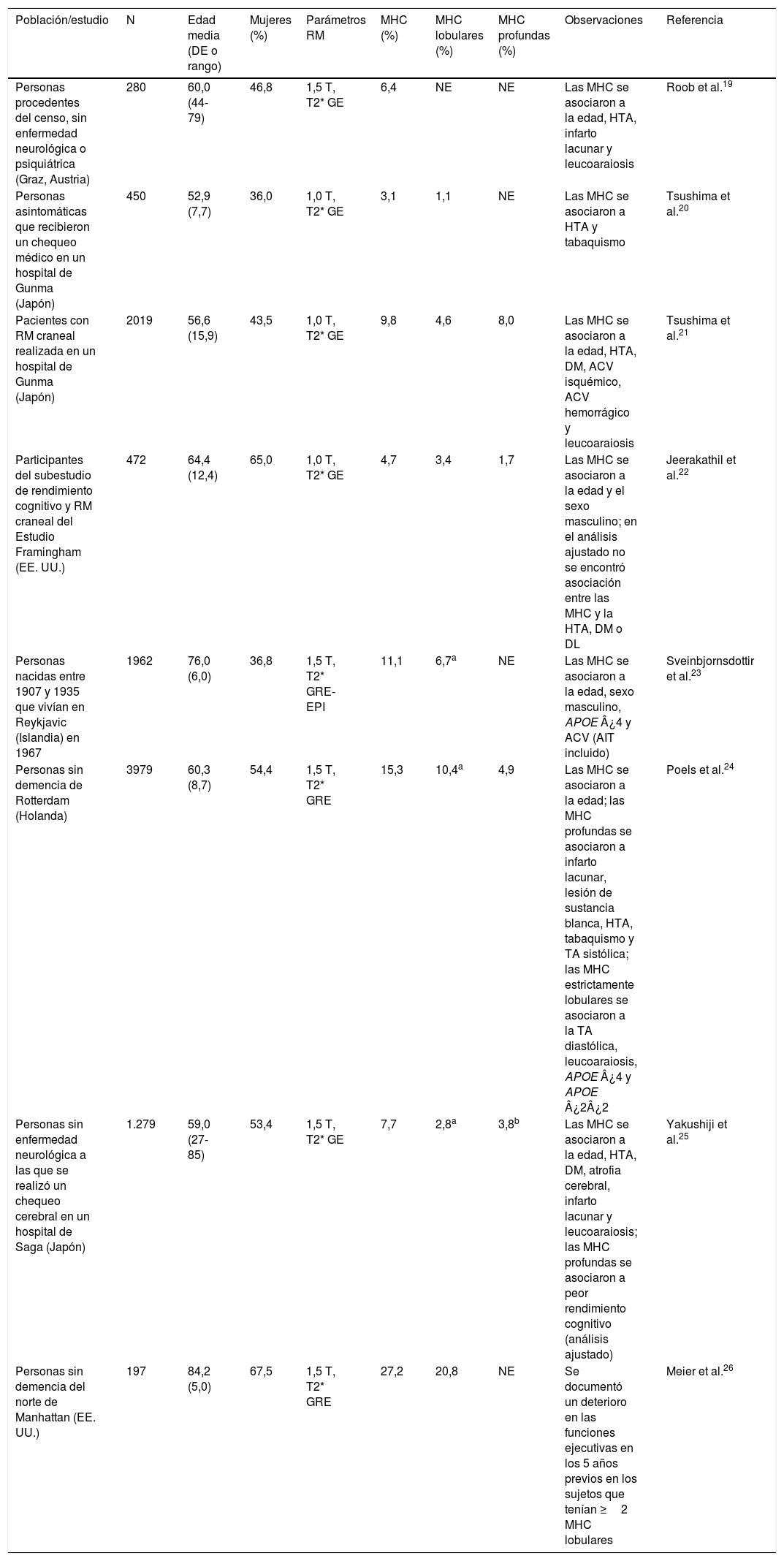
Estudios en la poblaciónEn los estudios realizados en la población o en sujetos sanos se ha obtenido una prevalencia de MHC del 3-27%, variabilidad que se explica por la heterogeneidad demográfica y por las diferencias en la metodología de adquisición y procesamiento de las imágenes de RM19–26. Las MHC se han asociado de forma sólida al envejecimiento, a la HTA y a las lesiones de sustancia blanca (leucoaraiosis). Con menor fuerza se han descrito asociaciones entre la MHC y el sexo masculino, el tabaquismo, la DM, el rendimiento cognitivo y los haplotipos ¿4 y ¿2 del gen de la apolipoproteína E (APOE) (tabla 2).
Estudios de microhemorragias cerebrales realizados en la población o en personas sanas
| Población/estudio | N | Edad media (DE o rango) | Mujeres (%) | Parámetros RM | MHC (%) | MHC lobulares (%) | MHC profundas (%) | Observaciones | Referencia |
|---|---|---|---|---|---|---|---|---|---|
| Personas procedentes del censo, sin enfermedad neurológica o psiquiátrica (Graz, Austria) | 280 | 60,0 (44-79) | 46,8 | 1,5 T, T2* GE | 6,4 | NE | NE | Las MHC se asociaron a la edad, HTA, infarto lacunar y leucoaraiosis | Roob et al.19 |
| Personas asintomáticas que recibieron un chequeo médico en un hospital de Gunma (Japón) | 450 | 52,9 (7,7) | 36,0 | 1,0 T, T2* GE | 3,1 | 1,1 | NE | Las MHC se asociaron a HTA y tabaquismo | Tsushima et al.20 |
| Pacientes con RM craneal realizada en un hospital de Gunma (Japón) | 2019 | 56,6 (15,9) | 43,5 | 1,0 T, T2* GE | 9,8 | 4,6 | 8,0 | Las MHC se asociaron a la edad, HTA, DM, ACV isquémico, ACV hemorrágico y leucoaraiosis | Tsushima et al.21 |
| Participantes del subestudio de rendimiento cognitivo y RM craneal del Estudio Framingham (EE. UU.) | 472 | 64,4 (12,4) | 65,0 | 1,0 T, T2* GE | 4,7 | 3,4 | 1,7 | Las MHC se asociaron a la edad y el sexo masculino; en el análisis ajustado no se encontró asociación entre las MHC y la HTA, DM o DL | Jeerakathil et al.22 |
| Personas nacidas entre 1907 y 1935 que vivían en Reykjavic (Islandia) en 1967 | 1962 | 76,0 (6,0) | 36,8 | 1,5 T, T2* GRE-EPI | 11,1 | 6,7a | NE | Las MHC se asociaron a la edad, sexo masculino, APOE ¿4 y ACV (AIT incluido) | Sveinbjornsdottir et al.23 |
| Personas sin demencia de Rotterdam (Holanda) | 3979 | 60,3 (8,7) | 54,4 | 1,5 T, T2* GRE | 15,3 | 10,4a | 4,9 | Las MHC se asociaron a la edad; las MHC profundas se asociaron a infarto lacunar, lesión de sustancia blanca, HTA, tabaquismo y TA sistólica; las MHC estrictamente lobulares se asociaron a la TA diastólica, leucoaraiosis, APOE ¿4 y APOE ¿2¿2 | Poels et al.24 |
| Personas sin enfermedad neurológica a las que se realizó un chequeo cerebral en un hospital de Saga (Japón) | 1.279 | 59,0 (27-85) | 53,4 | 1,5 T, T2* GE | 7,7 | 2,8a | 3,8b | Las MHC se asociaron a la edad, HTA, DM, atrofia cerebral, infarto lacunar y leucoaraiosis; las MHC profundas se asociaron a peor rendimiento cognitivo (análisis ajustado) | Yakushiji et al.25 |
| Personas sin demencia del norte de Manhattan (EE. UU.) | 197 | 84,2 (5,0) | 67,5 | 1,5 T, T2* GRE | 27,2 | 20,8 | NE | Se documentó un deterioro en las funciones ejecutivas en los 5 años previos en los sujetos que tenían ≥2 MHC lobulares | Meier et al.26 |
ACV: accidente cerebrovascular; APOE: gen de la apolipoproteína E; DE: desviación estándar; DL: dislipidemia; DM: diabetes mellitus; EE. UU.: Estados Unidos de Norteamérica; EPI: echo-planar imaging; GE: gradient echo; GRE: gradient-recalled echo; HTA: hipertensión arterial; MHC: microhemorragias cerebrales; N: tamaño de la muestra; NE: no especificado; RM: resonancia magnética; T: tesla; TA: tensión arterial.
El estudio de mayor tamaño muestral (Estudio de Rotterdam) permitió un análisis diferenciado de las MHC «estrictamente lobulares» (sin MHC profundas asociadas) y de las MHC profundas o infratentoriales, que confirmó la existencia de mecanismos fisiopatológicos diferentes en función de la localización de las MHC: las MHC lobulares se asociaron a los haplotipos ¿4 y ¿2 del gen APOE y la tensión arterial (TA) diastólica elevada, mientras que las MHC subcorticales se asociaron a la presencia de infarto lacunar, al tabaquismo y a la TA sistólica elevada24.
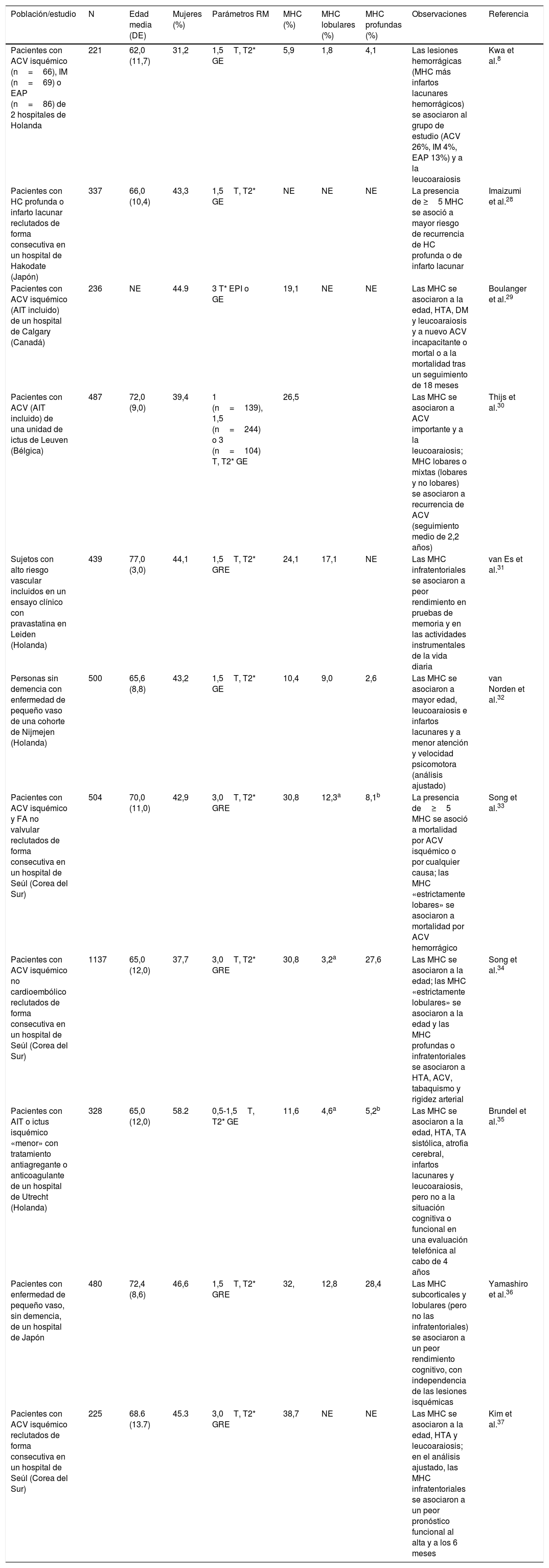
Estudios en pacientes con enfermedad o riesgo vascularLos estudios han sido realizados sobre todo en pacientes con enfermedad cerebrovascular (ECV) y han dado lugar a cifras de prevalencia de MHC muy variables (6-80%), generalmente superiores a las obtenidas en la población (tabla 2). Las prevalencias más altas se encontraron en un estudio realizado en 15 ancianos con HC lobular (80%)27, y en el estudio ya mencionado realizado en ancianos con EB (77%)16, mientras que la prevalencia más baja (6%) se obtuvo en un estudio que incluyó pacientes con enfermedad vascular no cerebral8. Las características y resultados de los estudios de mayor tamaño muestral se resumen en la tabla 38,28–37. La frecuencia de MHC suele ser más elevada en los pacientes con HC que en los pacientes con ECV isquémica38, con independencia de que la HC sea lobular27,39 o subcortical14. Cuando coexisten, las MHC y la HC tienden a localizarse en las mismas regiones14,27,39, pero no es raro observar MHC profundas en pacientes con HC lobular40.
Estudios de MHC realizados en pacientes con enfermedad o riesgo vascular
| Población/estudio | N | Edad media (DE) | Mujeres (%) | Parámetros RM | MHC (%) | MHC lobulares (%) | MHC profundas (%) | Observaciones | Referencia |
|---|---|---|---|---|---|---|---|---|---|
| Pacientes con ACV isquémico (n=66), IM (n=69) o EAP (n=86) de 2 hospitales de Holanda | 221 | 62,0 (11,7) | 31,2 | 1,5T, T2* GE | 5,9 | 1,8 | 4,1 | Las lesiones hemorrágicas (MHC más infartos lacunares hemorrágicos) se asociaron al grupo de estudio (ACV 26%, IM 4%, EAP 13%) y a la leucoaraiosis | Kwa et al.8 |
| Pacientes con HC profunda o infarto lacunar reclutados de forma consecutiva en un hospital de Hakodate (Japón) | 337 | 66,0 (10,4) | 43,3 | 1,5T, T2* GE | NE | NE | NE | La presencia de ≥5 MHC se asoció a mayor riesgo de recurrencia de HC profunda o de infarto lacunar | Imaizumi et al.28 |
| Pacientes con ACV isquémico (AIT incluido) de un hospital de Calgary (Canadá) | 236 | NE | 44.9 | 3 T* EPI o GE | 19,1 | NE | NE | Las MHC se asociaron a la edad, HTA, DM y leucoaraiosis y a nuevo ACV incapacitante o mortal o a la mortalidad tras un seguimiento de 18 meses | Boulanger et al.29 |
| Pacientes con ACV (AIT incluido) de una unidad de ictus de Leuven (Bélgica) | 487 | 72,0 (9,0) | 39,4 | 1 (n=139), 1,5 (n=244) o 3 (n=104) T, T2* GE | 26,5 | Las MHC se asociaron a ACV importante y a la leucoaraiosis; MHC lobares o mixtas (lobares y no lobares) se asociaron a recurrencia de ACV (seguimiento medio de 2,2 años) | Thijs et al.30 | ||
| Sujetos con alto riesgo vascular incluidos en un ensayo clínico con pravastatina en Leiden (Holanda) | 439 | 77,0 (3,0) | 44,1 | 1,5T, T2* GRE | 24,1 | 17,1 | NE | Las MHC infratentoriales se asociaron a peor rendimiento en pruebas de memoria y en las actividades instrumentales de la vida diaria | van Es et al.31 |
| Personas sin demencia con enfermedad de pequeño vaso de una cohorte de Nijmejen (Holanda) | 500 | 65,6 (8,8) | 43,2 | 1,5T, T2* GE | 10,4 | 9,0 | 2,6 | Las MHC se asociaron a mayor edad, leucoaraiosis e infartos lacunares y a menor atención y velocidad psicomotora (análisis ajustado) | van Norden et al.32 |
| Pacientes con ACV isquémico y FA no valvular reclutados de forma consecutiva en un hospital de Seúl (Corea del Sur) | 504 | 70,0 (11,0) | 42,9 | 3,0T, T2* GRE | 30,8 | 12,3a | 8,1b | La presencia de≥5 MHC se asoció a mortalidad por ACV isquémico o por cualquier causa; las MHC «estrictamente lobares» se asociaron a mortalidad por ACV hemorrágico | Song et al.33 |
| Pacientes con ACV isquémico no cardioembólico reclutados de forma consecutiva en un hospital de Seúl (Corea del Sur) | 1137 | 65,0 (12,0) | 37,7 | 3,0T, T2* GRE | 30,8 | 3,2a | 27,6 | Las MHC se asociaron a la edad; las MHC «estrictamente lobulares» se asociaron a la edad y las MHC profundas o infratentoriales se asociaron a HTA, ACV, tabaquismo y rigidez arterial | Song et al.34 |
| Pacientes con AIT o ictus isquémico «menor» con tratamiento antiagregante o anticoagulante de un hospital de Utrecht (Holanda) | 328 | 65,0 (12,0) | 58.2 | 0,5-1,5T, T2* GE | 11,6 | 4,6a | 5,2b | Las MHC se asociaron a la edad, HTA, TA sistólica, atrofia cerebral, infartos lacunares y leucoaraiosis, pero no a la situación cognitiva o funcional en una evaluación telefónica al cabo de 4 años | Brundel et al.35 |
| Pacientes con enfermedad de pequeño vaso, sin demencia, de un hospital de Japón | 480 | 72,4 (8,6) | 46,6 | 1,5T, T2* GRE | 32, | 12,8 | 28,4 | Las MHC subcorticales y lobulares (pero no las infratentoriales) se asociaron a un peor rendimiento cognitivo, con independencia de las lesiones isquémicas | Yamashiro et al.36 |
| Pacientes con ACV isquémico reclutados de forma consecutiva en un hospital de Seúl (Corea del Sur) | 225 | 68.6 (13.7) | 45.3 | 3,0T, T2* GRE | 38,7 | NE | NE | Las MHC se asociaron a la edad, HTA y leucoaraiosis; en el análisis ajustado, las MHC infratentoriales se asociaron a un peor pronóstico funcional al alta y a los 6 meses | Kim et al.37 |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; APOE: gen de la apolipoproteína E; DE: desviación estándar; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EB: enfermedad de Binswanger; ECV: enfermedad cerebrovascular; EPI: echo-planar imaging; FA: fibrilación auricular; FE: funciones ejecutivas; GE: gradient echo; GRE: gradient-recalled echo; HC: hemorragia cerebral; HTA: hipertensión arterial; IM: infarto de miocardio; MHC: microhemorragias cerebrales; N: tamaño de la muestra; NE: no especificado; RM: resonancia magnética; SE: spin-echo; T: tesla; TA: tensión arterial.
Se ha encontrado una clara asociación inversa entre la presencia de MHC y el rendimiento cognitivo31,32,36, y también se ha podido constatar una peor situación funcional basal31,37 y al cabo de 6 meses en pacientes ingresados por de accidente cerebrovascular (ACV) isquémico que además presentaban MHC infratentoriales37. Se ha descrito también un aumento en la recurrencia de ACV, tanto isquémico como hemorrágico, en pacientes que presentan MHC28,30. En un estudio realizado en cerebros con AAC se encontró un mayor riesgo de recurrencia de HC lobar en los pacientes que tomaban antiagregantes y este efecto fue mayor a mayor número de MHC39.
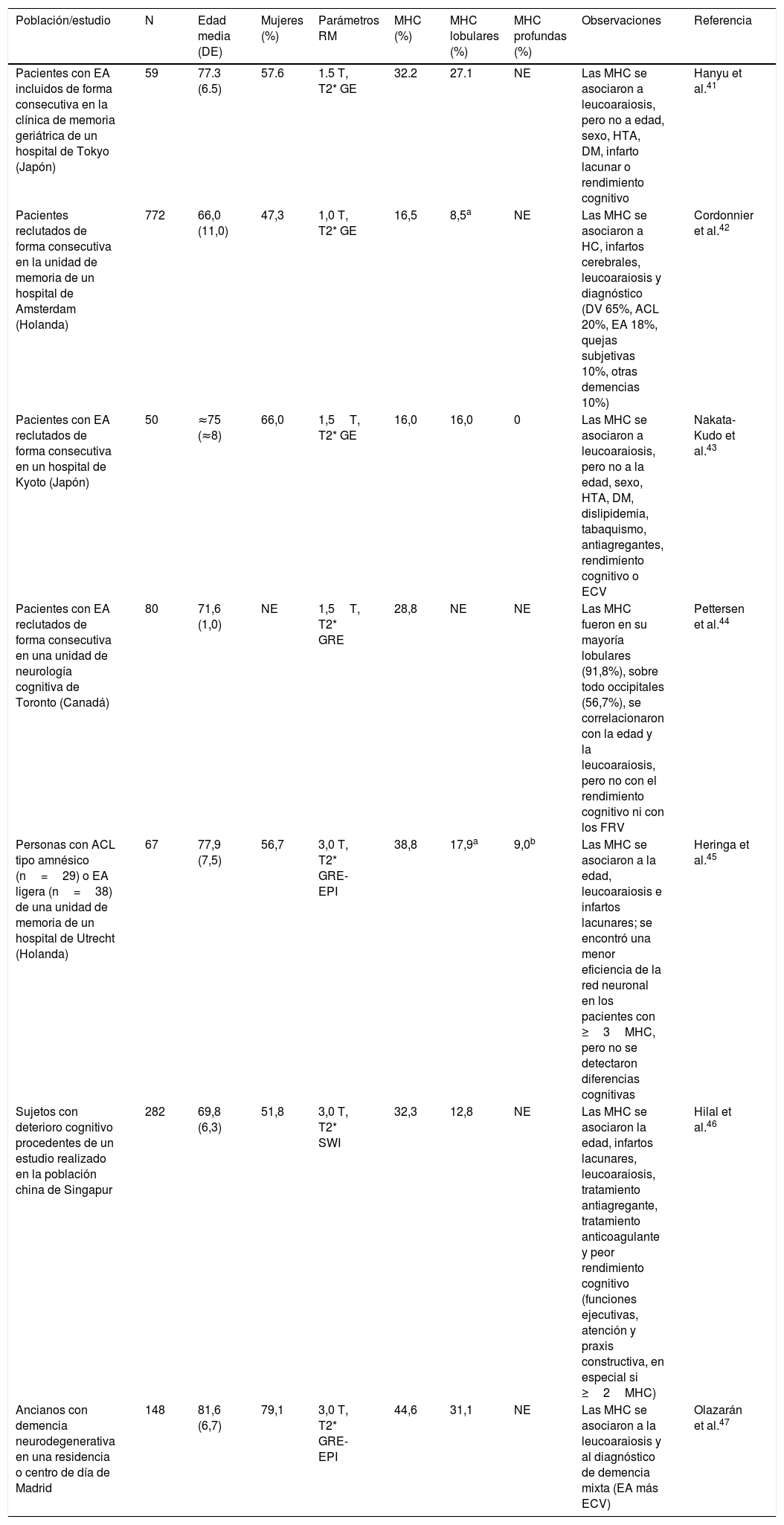
Estudios en pacientes con deterioro cognitivoLa prevalencia de MHC en pacientes con deterioro cognitivo es del 16-45%41–47 (tabla 4), rango intermedio entre los rangos observados en la población general (tabla 2) y en los pacientes con enfermedad o riesgo vascular (tabla 3). Los estudios realizados en pacientes con EA han mostrado una prevalencia de MHC del 16-39%, superior a la observada en otras demencias neurodegenerativas42. La localización de las MHC en la EA es predominante lobular (sustancia gris o sustancia blanca), sin que se haya detectado asociación con los factores de riesgo vascular (FRV), lo cual apoya la existencia de una AAC como sustrato patológico16,43,44. No ha podido demostrarse de forma clara una relación entre MHC y rendimiento cognitivo en la EA44,45. Un estudio en el que se empleó la técnica de RM más sensible (SWI) demostró relación entre las MHC y rendimiento cognitivo, pero la muestra no estaba suficientemente definida desde el punto de vista etiológico46.
Estudios de microhemorragias cerebrales realizados en pacientes con deterioro cognitivo
| Población/estudio | N | Edad media (DE) | Mujeres (%) | Parámetros RM | MHC (%) | MHC lobulares (%) | MHC profundas (%) | Observaciones | Referencia |
|---|---|---|---|---|---|---|---|---|---|
| Pacientes con EA incluidos de forma consecutiva en la clínica de memoria geriátrica de un hospital de Tokyo (Japón) | 59 | 77.3 (6.5) | 57.6 | 1.5 T, T2* GE | 32.2 | 27.1 | NE | Las MHC se asociaron a leucoaraiosis, pero no a edad, sexo, HTA, DM, infarto lacunar o rendimiento cognitivo | Hanyu et al.41 |
| Pacientes reclutados de forma consecutiva en la unidad de memoria de un hospital de Amsterdam (Holanda) | 772 | 66,0 (11,0) | 47,3 | 1,0 T, T2* GE | 16,5 | 8,5a | NE | Las MHC se asociaron a HC, infartos cerebrales, leucoaraiosis y diagnóstico (DV 65%, ACL 20%, EA 18%, quejas subjetivas 10%, otras demencias 10%) | Cordonnier et al.42 |
| Pacientes con EA reclutados de forma consecutiva en un hospital de Kyoto (Japón) | 50 | ≈75 (≈8) | 66,0 | 1,5T, T2* GE | 16,0 | 16,0 | 0 | Las MHC se asociaron a leucoaraiosis, pero no a la edad, sexo, HTA, DM, dislipidemia, tabaquismo, antiagregantes, rendimiento cognitivo o ECV | Nakata-Kudo et al.43 |
| Pacientes con EA reclutados de forma consecutiva en una unidad de neurología cognitiva de Toronto (Canadá) | 80 | 71,6 (1,0) | NE | 1,5T, T2* GRE | 28,8 | NE | NE | Las MHC fueron en su mayoría lobulares (91,8%), sobre todo occipitales (56,7%), se correlacionaron con la edad y la leucoaraiosis, pero no con el rendimiento cognitivo ni con los FRV | Pettersen et al.44 |
| Personas con ACL tipo amnésico (n=29) o EA ligera (n=38) de una unidad de memoria de un hospital de Utrecht (Holanda) | 67 | 77,9 (7,5) | 56,7 | 3,0 T, T2* GRE-EPI | 38,8 | 17,9a | 9,0b | Las MHC se asociaron a la edad, leucoaraiosis e infartos lacunares; se encontró una menor eficiencia de la red neuronal en los pacientes con ≥3MHC, pero no se detectaron diferencias cognitivas | Heringa et al.45 |
| Sujetos con deterioro cognitivo procedentes de un estudio realizado en la población china de Singapur | 282 | 69,8 (6,3) | 51,8 | 3,0 T, T2* SWI | 32,3 | 12,8 | NE | Las MHC se asociaron la edad, infartos lacunares, leucoaraiosis, tratamiento antiagregante, tratamiento anticoagulante y peor rendimiento cognitivo (funciones ejecutivas, atención y praxis constructiva, en especial si ≥2MHC) | Hilal et al.46 |
| Ancianos con demencia neurodegenerativa en una residencia o centro de día de Madrid | 148 | 81,6 (6,7) | 79,1 | 3,0 T, T2* GRE-EPI | 44,6 | 31,1 | NE | Las MHC se asociaron a la leucoaraiosis y al diagnóstico de demencia mixta (EA más ECV) | Olazarán et al.47 |
ACL: alteración cognitiva leve; ACV: accidente cerebrovascular; APOE: gen de la apolipoproteína E; DE: desviación estándar; DM: diabetes mellitus; DV: demencia vascular; EA: enfermedad de Alzheimer; ECV: enfermedad cerebrovascular; EPI: echo-planar imaging; FRV: factores de riesgo vascular; GE: gradient echo; GRE: gradient-recalled echo; HTA: hipertensión arterial; MHC: microhemorragias cerebrales; N: tamaño de la muestra; NE: no especificado; RM: resonancia magnética; T: tesla.
A la hora de estudiar la posible repercusión clínica de las MHC es crucial separar el papel de la ECV isquémica que, como se ha visto, aparece íntimamente asociada a las MHC. En tres estudios poblacionales (AGES-Reykjavik Study, Estudio de Nijmejen y Rotterdam Scan Study) se ha constatado una asociación entre MHC y menor rendimiento en áreas cognitivas distintas de la memoria que persiste tras controlar el efecto de las lesiones isquémicas32,48,49, si bien la magnitud del efecto es pequeña (coeficientes de regresión de 0,20-0,25)33. En un reciente estudio longitudinal retrospectivo se ha encontrado un deterioro en las funciones ejecutivas en sujetos que tenían ≥2MHC lobulares, durante los 5 años previos a la realización de la RM craneal, pero el efecto de las lesiones isquémicas no se controló26 (tabla 2).
Se ha constatado también una asociación entre MHC y peor rendimiento cognitivo en pacientes con ECV37,50 y en pacientes con demencia vascular subcortical51. En un reciente metaanálisis que incluyó 15 estudios de casos y controles (10 de ellos realizados en países asiáticos) se encontró una clara asociación entre las presencia de MHC en cualquier localización (con excepción del tronco) y un menor rendimiento en tareas de atención y funciones ejecutivas. A mayor número de MHC el rendimiento cognitivo es menor y los resultados soportan la corrección o el control del papel de las lesiones isquémicas concomitantes, tanto infartos isquémicos como leucoaraiosis52.
El posible papel sintomático de las MHC en la EA ha sido menos estudiado. No se encontraron diferencias en el rendimiento cognitivo en un estudio en el que simplemente se comparó el rendimiento de los pacientes con EA y MHC frente a aquellos que no las tenían44, ni en otro en el que se analizaron por separado los pacientes que tenían ≥3MHC45. Sin embargo, en un estudio en el que se compararon pacientes con ≥8MHC frente a pacientes que no tenían MHC, se encontraron importantes diferencias en el rendimiento cognitivo (test «Mini-mental» 17 vs. 22, p<0,05) y en los marcadores biológicos de EA en el líquido cefalorraquídeo (Aß42 y p-tau), a pesar de que la duración de la enfermedad en los 2 grupos de pacientes era similar. Tras controlar el efecto de la leucoaraiosis y de la atrofia temporal mesial, el grupo con MHC seguía presentando un peor rendimiento en lenguaje y funciones ejecutivas53. Un estudio que utilizó la secuencia SWI encontró un mayor riesgo de desarrollo de demencia en los pacientes con alteración cognitiva leve que tenían MHC54.
Los posibles mecanismos fisiopatológicos responsables de la expresión clínica de las MHC apenas han sido estudiados. En un estudio realizado en ratones se demostró una disfunción neuronal y astrocítica transitoria en la proximidad de microhemorragias provocadas55. En un estudio de RM de tensor de difusión (DTI) realizado en pacientes con ACL o EA «temprana» se constató una alteración de la sustancia blanca en los pacientes que presentaban ≥3MHC45. A la luz de estos hallazgos podríamos pensar que las MHC contribuyen per se a desconectar las regiones frontales y subcorticales, o las distintas regiones corticales entre sí, dando lugar al déficit cognitivo. Este mecanismo ha sido ya propuesto para las MHC de origen traumático56.
La presencia de MHC se asocia a una mayor mortalidad al cabo de 2-3 años. En una muestra de 1.138 pacientes reclutados de forma consecutiva en una clínica de memoria las MHC se asociaron a un mayor riesgo de fallecimiento, especialmente en el grupo de pacientes con ≥3MHC; en ese grupo el riesgo fue superior al producido por las lesiones isquémicas57. En un estudio realizado en pacientes con ACV isquémico y fibrilación auricular no valvular la presencia de ≥5MHC se asoció a mortalidad por ACV isquémico o por cualquier causa, y la presencia de MHC solo lobulares se asoció a mortalidad por ACV hemorrágico34. En otros estudios las MHC profundas o infratentoriales se asociaron a una mayor mortalidad de causa cardiovascular58,59.
Implicaciones terapéuticasEl valor de las MHC como marcador de daño vascular y factor de riesgo de futura HC o transformación hemorrágica de infarto isquémico ha sido ampliamente demostrado28,60–62 y, aunque con menos fuerza, las MHC se asocian también a un mayor riesgo de episodios cerebrovasculares isquémicos28,30,63,64. Además, la existencia de MHC lobulares aumenta la sensibilidad para la detección de la AAC, sobre todo en pacientes con ACV previo65. Por tanto, la presencia de MHC obliga a un control estrecho de los factores de riesgo vascular (en especial de la HTA) y a una atenta vigilancia de posible incidencia o recurrencia de ACV hemorrágico o isquémico, así como de la posible transformación hemorrágica en pacientes que han padecido ACV isquémico.
Como doble marcador de riesgo isquémico y hemorrágico, las MHC nos sitúan en una delicada situación a la hora de plantear un tratamiento antiagregante o anticoagulante. Los estudios de cohortes demuestran que el tratamiento antiagregante y, en mayor medida, el tratamiento con dicumarínicos, aumentan el riesgo de HC en pacientes con MHC66. En pacientes con HC lobular que presentan además un número elevado de MHC lobulares la anticoagulación está contraindicada, debido a la sospecha de AAC con alto riesgo de resangrado38,65,67. En situaciones menos claras (número escaso de MHC, localización no lobular) deberá tomarse una decisión de forma individualizada, sopesando el riesgo de futuros episodios isquémicos y/o hemorrágicos68. Si se opta por la anticoagulación (por ejemplo, en caso de prótesis valvular metálica), parece razonable utilizar los nuevos anticoagulantes (dabigatrán, rivaroxabán, apixabán), que conllevan menos riesgo de HC. El estudio Clinical Relevance of Microbleeds in Stroke permitirá conocer mejor la utilidad de las MHC para predecir el riesgo de futura HC en pacientes con fibrilación auricular anticoagulados69.
La creciente sensibilidad y disponibilidad de la RM para la detección de MHC ofrece interesantes posibilidades clínicas que se deben investigar. En pacientes anticoagulados la constatación de un empeoramiento clínico, asociado a un aumento en el número de MHC, podría ser un criterio práctico para retirar la anticoagulación70. La presencia de MHC se asocia a un ligero aumento del riesgo de HC en pacientes con ACV isquémico que reciben tratamiento trombolítico, pero no constituyen una contraindicación formal71–73.
ConclusionesLas MHC aumentan con la edad, los FRV (en especial la HTA), la EA y, sobre todo, la ECV. Su sustrato patológico es la lipohialinosis, de localización preferentemente subcortical e infratentorial, y la angiopatía amiloide, de localización preferentemente lobular y cerebelosa. Las MHC y la isquemia cerebral comparten mecanismos fisiopatológicos, y su relación es probablemente bidireccional. Por razones no bien comprendidas un mismo tipo de enfermedad vascular podría producir isquemia, hemorragia o ambas en el paciente individual.
Las MHC aumentan el riesgo de sufrir episodios cerebrovasculares (HC o ACV isquémico) y aumentan la mortalidad, ya sea en sujetos asintomáticos o en pacientes con episodios cerebrovasculares previos, con un riesgo más elevado cuanto mayor es el número de MHC. Las MHC se asocian también a un mayor riesgo de deterioro cognitivo, tanto en la población general como en los pacientes con ECV, pero no está claro en qué medida este efecto es debido a la enfermedad vascular o a una posible EA. Aunque existen menos estudios, hay datos para pensar que las MHC se asocian un peor pronóstico funcional. La repercusión de las MHC en áreas clínicas distintas a la cognitiva (capacidades funcionales, afectividad, conducta, capacidades motoras) merece más investigación.
La observación de MHC en pacientes que presentan episodios cerebrovasculares conlleva importantes repercusiones diagnósticas y terapéuticas. Como marcadores de daño vascular, las MHC obligan a reforzar las medidas preventivas de ACV isquémico y de HC (en especial el control de la TA), desaconsejando, sobre todo si las MHC son numerosas o lobulares, los estudios diagnósticos invasivos (angiografía cerebral) y el manejo agresivo (cirugía cerebral). En pacientes con MHC la instauración de un tratamiento anticoagulante debe estar claramente justificada, dado que existe un mayor riesgo de HC. En pacientes con MHC lobulares podrían estar también contraindicados los fármacos antiagregantes, especialmente si las MHC son numerosas o si existen otros indicios de AAC (HC previa o hemosiderosis cortical).
Los estudios epidemiológicos, clínicos y anatomopatológicos realizados no permiten confirmar un papel fisiopatológico central de las MHC en la ECV o en la EA, sino que invitan a pensar en las MHC como un fenómeno colateral o residual, indicativo de fragilidad capilar. Esta visión encaja con la aparición de edema vasogénico y de nuevas MHC en pacientes que ya presentaban MHC y que fueron expuestos a fármacos que actúan sobre el amiloide cerebral (inmunoglobulina humana, anticuerpos monoclonales, vacunas). Parece razonable, por tanto, seguir excluyendo de los ensayos clínicos con estos agentes a los pacientes que presentan MHC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.