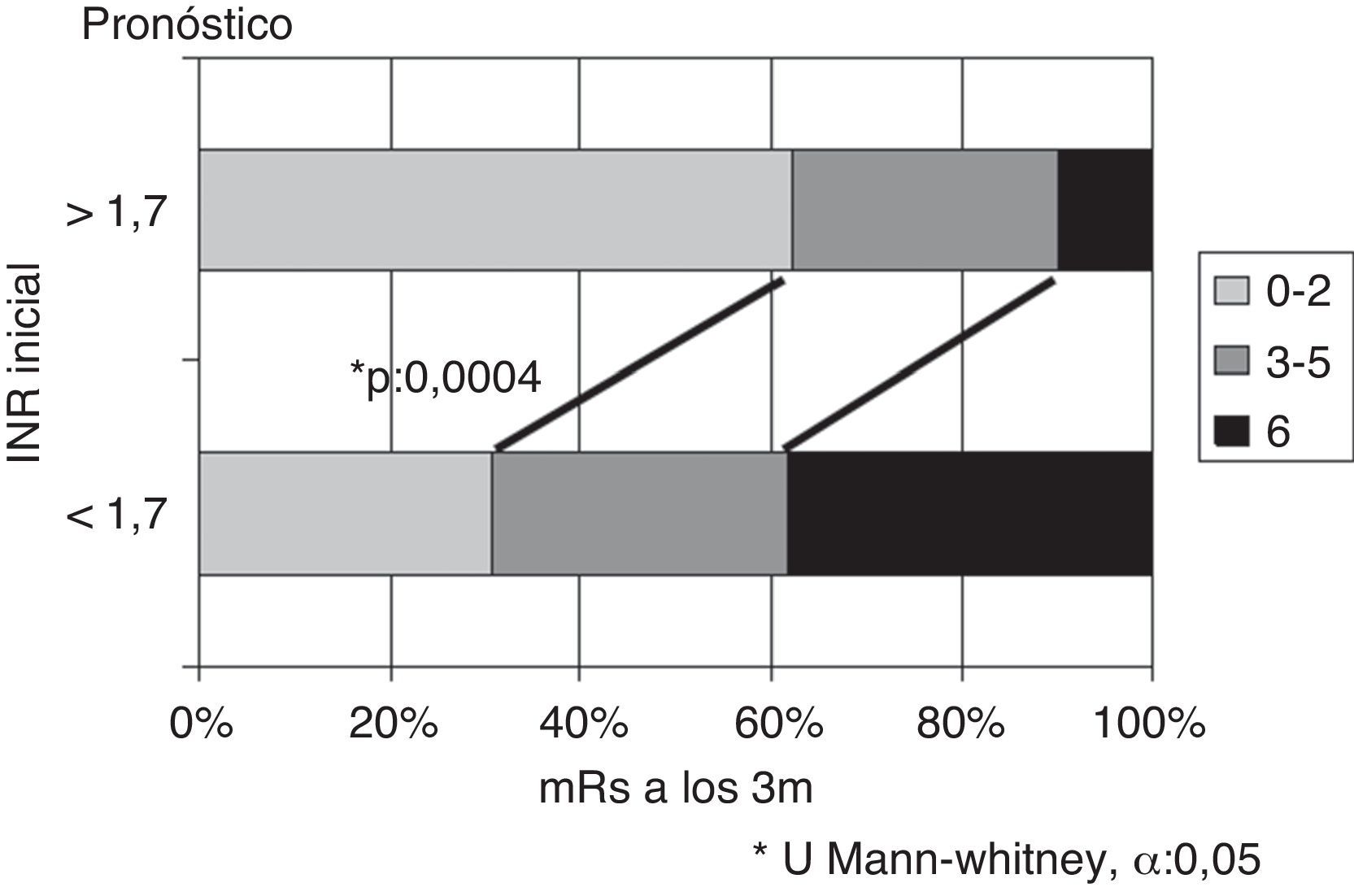Los ictus cardioembólicos tienen peor pronóstico. Su prevención se basa en el tratamiento anticoagulante por vía oral (ACO), cuya principal complicación es el sangrado y, en ocasiones, su ineficacia.
Pacientes y métodosSe ha revisado retrospectivamente a 1.014 pacientes consecutivos que presentaron ictus isquémico entre 2011 y 2013. De ellos, hemos analizado a los 107 pacientes en tratamiento con ACO en el momento del ictus, con especial atención a su etiología, evolución y valor del INR en la fase aguda.
ResultadosLa edad media ± desviación estándar fue de 71,9 ± 10 años. Tomaba ACO desde hacía 5,9 ± 5,5 años el 98,1% por cardiopatía. Setenta y siete pacientes (72%) tenían INR<2 y 30 (28%) un INR ≥ 2. Se encontraban en rango terapéutico 9 pacientes (8,4%). La etiología según TOAST fue cardioembólica en el 88,8% y aterotrombótica en el 1,9%.
Se suspendió la anticoagulación en 48 pacientes (44,9%): 24 por transformación hemorrágica, 23 por infarto extenso y uno por endarterectomía. Se reintrodujo en 24 de ellos (50%), a los 36 días de media; en los restantes, no fue posible por fallecimiento o secuelas severas.
En 9 pacientes (18,7% de potenciales candidatos) se iniciaron nuevos ACO (NACO). La evolución a los 3 meses fue mejor si el INR en la fase aguda > 1,7 respecto al INR ≤ 1,7 (mRS 0-2: 62% vs. 30,8% y fallecimiento 10% vs. 38.4%; p = 0,0004).
ConclusionesAlgunos pacientes con ACO presentan ictus isquémicos, en general cardioembólicos, especialmente si el INR es infraterapéutico. Se pueden reintroducir ACO sin complicaciones, siendo el uso de NACO todavía escaso. A pesar de su ineficacia, la evolución es mejor si INR > 1,7 al inicio del ictus.
Cardioembolic stroke is associated with poorer outcomes. Prevention is based on oral anticoagulant (OAC) therapy. Haemorrhage is the main complication of OACs, which are sometimes ineffective.
Patients and methodsWe retrospectively reviewed 1014 consecutive patients who suffered an ischaemic stroke between 2011 and 2013, analysing those who were receiving OAC treatment at stroke onset (107 patients in total) with special attention to aetiology, outcomes, and INR value in the acute phase.
ResultsThe mean age (SD) was 71.9 (10) years. Patients had been treated with OACs for 5.9 (5.5) years; 98.1% of them were being treated for heart disease. INR was <2 in 77 patients (72%), and 30 patients (28%) had an INR≥2. Nine patients (8.4%) had INR values within the therapeutic range. According to TOAST classification criteria, 88.8% of strokes were cardioembolic and 1.9% were atherothrombotic.
Anticoagulation therapy was discontinued in 48 patients (44.9%) due to haemorrhagic transformation (24 patients), extensive infarction (23), or endarterectomy (1). Therapy was resumed in 24 patients (50%) after a mean lapse of 36 days. This was not possible in the remaining patients because of death or severe sequelae.
New OACs (NOACs) were prescribed to 9 patients (18.7% of all potential candidates). At 3 months, patients with INR>1.7 in the acute phase exhibited better outcomes than patients with INR≤1.7 (mRS 0-2 in 62% vs 30.8%; death in 10% vs 38.4%; P=.0004).
ConclusionsSome patients taking OACs suffer ischaemic strokes that are usually cardioembolic, especially if INR is below the therapeutic range. OACs can be resumed without complications, and NOACs are still underused. Despite cases in which treatment is ineffective, outcomes are better when INR is above 1.7 at stroke onset.
Los ictus isquémicos de etiología cardioembólica constituyen el grupo más frecuente en algunos estudios epidemiológicos, representando entre el 20-30% del total1,2. Los ictus cardioembólicos se asocian, en general, a un mayor déficit neurológico y mayor mortalidad precoz, así como a un peor pronóstico funcional al alta. Por tanto, esto conlleva un grupo de ictus de gran repercusión socioecónomica3.
Su prevención se basa en el tratamiento anticoagulante oral (ACO), como ha sido demostrado en diferentes ensayos clínicos y metaanálisis, disminuyendo el riesgo de ictus en > 60%4, incluso en pacientes > 75 años5,6.
Sin embargo, los ACO clásicos (warfarina, acenocumarol) tienen algunas limitaciones. Se requieren controles periódicos para mantener el «international normalized ratio» (INR) dentro del rango terapéutico, algo que solo se consigue en 60-70%, según estudios poblacionales7. La falta de adherencia al tratamiento y las interacciones con fármacos y alimentos provocan que los usuarios se encuentren con frecuencia en niveles infraterapéuticos7 y, por tanto, con mayor riesgo de ictus8. Asimismo, no están exentos de complicaciones, principalmente en forma de hemorragias de distintas localizaciones, lo que en ocasiones cuestiona su prescripción9. Para conocer el riesgo de hemorragia y valorar el riesgo/beneficio de introducir el tratamiento con ACO, existen escalas como la HAS-BLED10, que parece ser la más útil, especialmente para el riesgo de hemorragias intracraneales11,12.
La aparición de los nuevos anticoagulantes (NACO), sin necesidad de controles periódicos y menor tasa de interacciones, puede ayudar a optimizar la prevención del ictus cardioembólico. En los ensayos clínicos han demostrado no inferioridad en la prevención de eventos isquémicos junto a una menor tasa de complicaciones hemorrágicas13-16. Sin embargo, su mayor coste económico y la falta de antídotos específicos, entre otros aspectos, están frenando su prescripción17.
Nuestro objetivo ha sido realizar un análisis de los pacientes que presentan un ictus isquémico a pesar de estar en tratamiento con ACO, considerando su etiología, la eficacia de dicho tratamiento y su evolución, especialmente en función del valor del INR en la fase aguda.
Pacientes y métodosSe ha revisado de forma retrospectiva a los 1.014 pacientes ingresados en nuestro servicio de neurología con el diagnóstico de ictus isquémico, durante un periodo de 3 años (2011-2013). De ellos, se ha analizado a los pacientes que se encontraban en tratamiento con ACO en el momento de aparición del ictus, para un total de 107 (10,6%). En principio, en todos ellos los familiares aseguraron buen cumplimiento terapéutico.
En cada paciente se han recogido las siguientes variables epidemiológicas: sexo, edad, presencia de factores de riesgo cardiovascular (FRCV: tabaquismo, hipertensión arterial, diabetes mellitus, dislipidemia), presencia de cardiopatía embolígena, puntuación en la escala CHADS218, CHA2DS2VASc19 y HAS-BLED, tiempo bajo tratamiento ACO, valor del INR en fase aguda, etiología (criterios TOAST20) y clasificación topográfica (escala Oxfordshire21). Se registraron el mantenimiento o la suspensión de dicho tratamiento, y su eventual reintroducción en el último supuesto, así como el uso de NACO. Asimismo, se evaluó el pronóstico mediante análisis del estado basal, al alta y a los 3 meses según escala de Rankin modificada de situación funcional (mRS).
Se considera que el paciente se encontraba dentro del rango terapéutico de anticoagulación si el valor de INR era de 2-3 para fibrilación auricular (FA) aislada y 2,5-3,5 en presencia de prótesis valvular metálica.
Se determinó la etiología mediante estudio vascular (eco-Doppler de troncos supraaórticos y angiotomografía computarizada o angio-RM de polígono de Willis) y ecocardiograma transtorácico. Los pacientes estuvieron monitorizados mediante telemetría durante su estancia en la unidad de ictus. En caso de necesidad, se amplió el estudio con ecocardiograma transesofágico (ETE), holter cardíaco de 24h y perfil de autoinmunidad. El ecocardiograma, ya fuera transtorácico o transesofágico, incluía el estudio de la presencia de shunt derecha-izquierda.
Las exploraciones neurológicas para calcular las puntuaciones en la escala de mRS, durante el ingreso y a posteriori, fueron realizadas por los neurólogos de nuestra unidad de ictus.
Estas variables se estudiaron mediante el paquete estadístico Statview 10.0, con análisis uni y multivariante, y nivel de significación α=0,05, con chi al cuadrado para variables univariantes categóricas y valoración de intervalos con no paramétricas U de Mann-Whitney.
En el análisis de regresión, las variables referentes a la evolución fueron ajustadas según edad, FRCV, NIH, Rankin basal y haber recibido tratamiento trombolítico o no. El corte de INR en 1,7 se corresponde a una cifra de referencia para considerar al paciente bajo cierto efecto anticoagulante o no, y tributario a tratamientos de rescate de forma primaria o secundaria. Su análisis y su determinación con curvas ROC eran próximos a este valor.
ResultadosSe han recogido datos de 107 pacientes, con una ratio hombre:mujer de 1,33:1. La estancia media hospitalaria fue de 14,7 días (rango 2-107). La edad media ± desviación estándar en el momento del diagnóstico era de 71,93 ± 10,14 años, sin diferencias significativas entre ambos sexos.
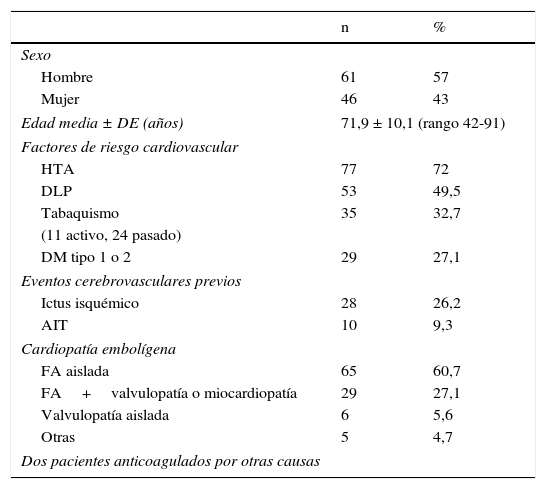
Casi todos los pacientes (98,1%) estaban en tratamiento con ACO por cardiopatía embolígena, la mayoría de ellos con FA (87,8%), ya fuera aislada (n=65) o con otras cardiopatías (n=29; portadores de prótesis mitral y/o aórtica, la mayoría metálicas, o con fracción de eyección baja). Once pacientes (10,3%) tenían alguna de las cardiopatías mencionadas o habían presentado un infarto agudo de miocardio reciente. Finalmente, 2 (1,9%) tomaban ACO por otros motivos (tromboembolismo pulmonar, ictus de repetición con estenosis crítica de arteria carótida interna). Únicamente, 2 pacientes tomaban además tratamiento antiagregante con ácido acetilsalicílico. En cuanto a la presencia de factores de riesgo cardiovascular, casi el 75% refería hipertensión y la mitad dislipidemia. Aproximadamente, un tercio tenía hábito tabáquico (el 31,4% de ellos aún era consumo activo) y un cuarto eran diabéticos tipo 1 o 2. Asimismo, una cuarta parte habían presentado un ictus isquémico previo (no había ninguno con más de uno, tampoco ictus hemorrágicos) y el 9% un accidente isquémico transitorio (AIT) (tabla 1).
Datos demográficos y presencia de factores de riesgo cardiovascular/cardiopatías embolígenas en 107 pacientes con ictus isquémico en tratamiento con ACO
| n | % | |
|---|---|---|
| Sexo | ||
| Hombre | 61 | 57 |
| Mujer | 46 | 43 |
| Edad media ± DE (años) | 71,9 ± 10,1 (rango 42-91) | |
| Factores de riesgo cardiovascular | ||
| HTA | 77 | 72 |
| DLP | 53 | 49,5 |
| Tabaquismo | 35 | 32,7 |
| (11 activo, 24 pasado) | ||
| DM tipo 1 o 2 | 29 | 27,1 |
| Eventos cerebrovasculares previos | ||
| Ictus isquémico | 28 | 26,2 |
| AIT | 10 | 9,3 |
| Cardiopatía embolígena | ||
| FA aislada | 65 | 60,7 |
| FA+valvulopatía o miocardiopatía | 29 | 27,1 |
| Valvulopatía aislada | 6 | 5,6 |
| Otras | 5 | 4,7 |
| Dos pacientes anticoagulados por otras causas | ||
AIT: accidente isquémico transitorio; DLP: dislipidemia; FA: fibrilación auricular; HTA: hipertensión arterial; n: número de pacientes.
La mediana de puntuación en las escalas CHADS2 y CHA2DS2VASc era de 3 y 4, respectivamente. De hecho, el 93,5% tenían una puntuación ≥ 2 (riesgo elevado de ictus) en la escala CHA2DS2VASc. En cuanto al riesgo hemorrágico, la mediana en la escala HAS-BLED era de 2.
En el momento del ictus, los pacientes llevaban una media de 5,86 ± 5,51 años con tratamiento ACO (en 5 pacientes no se pudo saber).
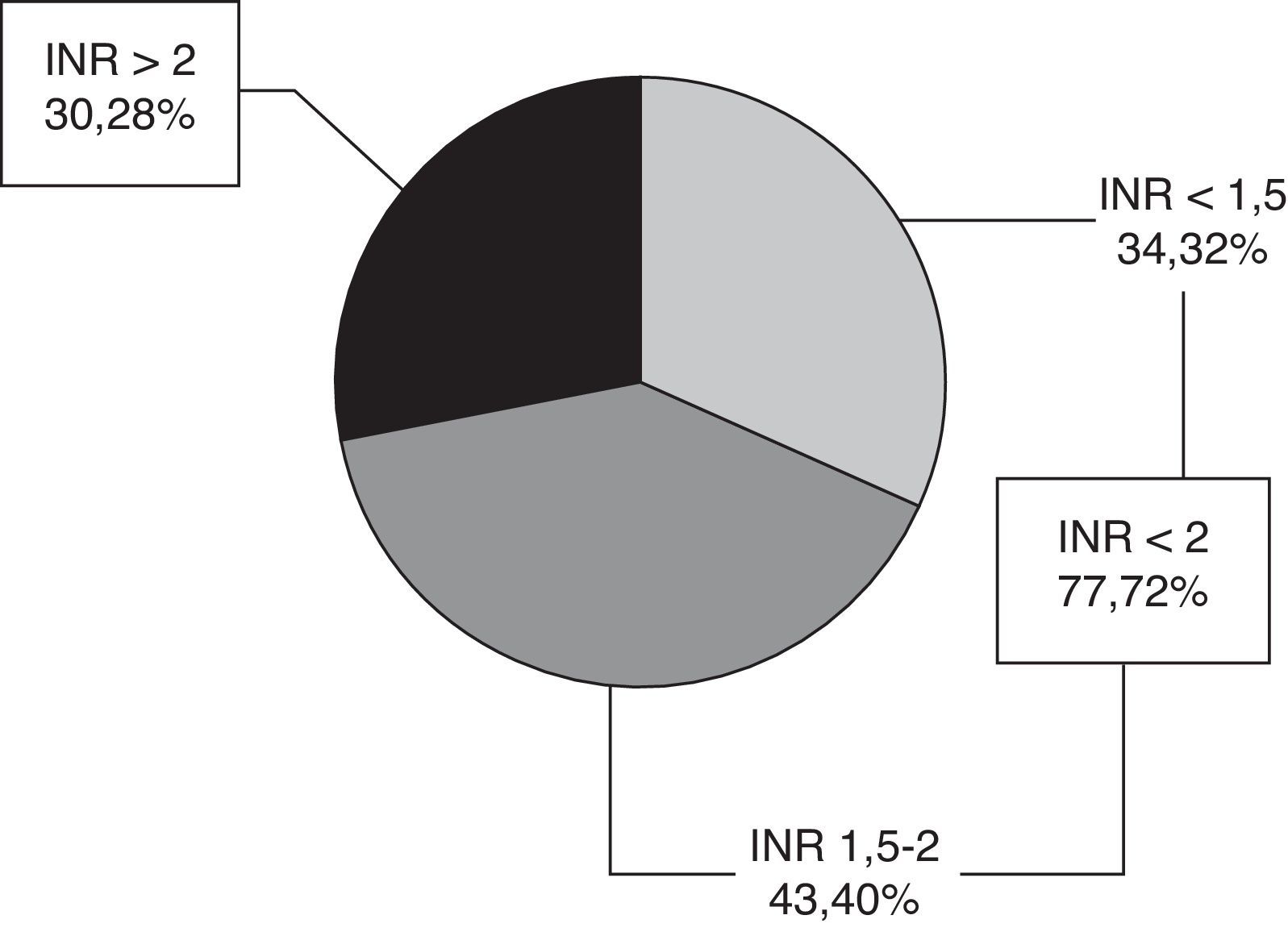
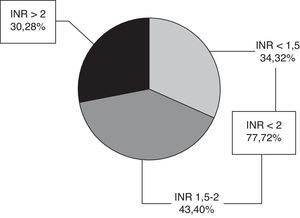
El valor medio del INR en fase aguda fue de 1,94 ± 0,94. Setenta y siete pacientes (72%) tenían INR < 2, 34 INR < 1,5 y 43 INR 1,5-2, y 30 pacientes (28%) un INR ≥ 2 (fig. 1), con un rango 2-5,36. Solo 9 pacientes (8,4%) se encontraban en rango terapéutico en el momento del ictus.
La mediana en la puntuación de la escala NIHSS en el momento inicial fue de 14. En cuanto al territorio afectado, 94 pacientes (87,9%) tenían ictus de circulación anterior y 13 (12,1%) de circulación posterior.
En 32 pacientes se pudo pautar trombólisis por vía intravenosa (INR ≤1,7) y en 10 de ellos se realizó un procedimiento intervencionista de rescate. Por otra parte, en 19 pacientes se hizo dicho procedimiento de forma primaria.
En cuanto a la etiología según criterios TOAST, encontramos 95 ictus de origen cardioembólico (88,8%), 9 de origen indeterminado (5 por doble causa, 4 por estudio incompleto), todos ellos en rango infraterapéutico, 2 aterotrombóticos y uno de causa inhabitual (síndrome antifosfolípido). Se pudo realizar ETE en el 14% de los pacientes, hallándose en algunos casos trombos en orejuela izquierda o sobre prótesis metálicas. En ningún caso se encontraron placas significativas en el arco aórtico ni shunt derecha-izquierda. Topográficamente, la mayoría de los ictus (n=68) se clasificaron como TACI (63,5%), 26 fueron considerados PACI (24,3%) y finalmente 13 como POCI (12,1%).
La principal complicación fue la aparición de transformación hemorrágica en 31 pacientes (29%): solo 7 de tipo PH1/2 y 2 con hemorragia subaracnoidea. Se produjeron en contexto de trombólisis por vía intravenosa y/o mecánica 14 de ellas y únicamente 6 con un INR ≥ 2.
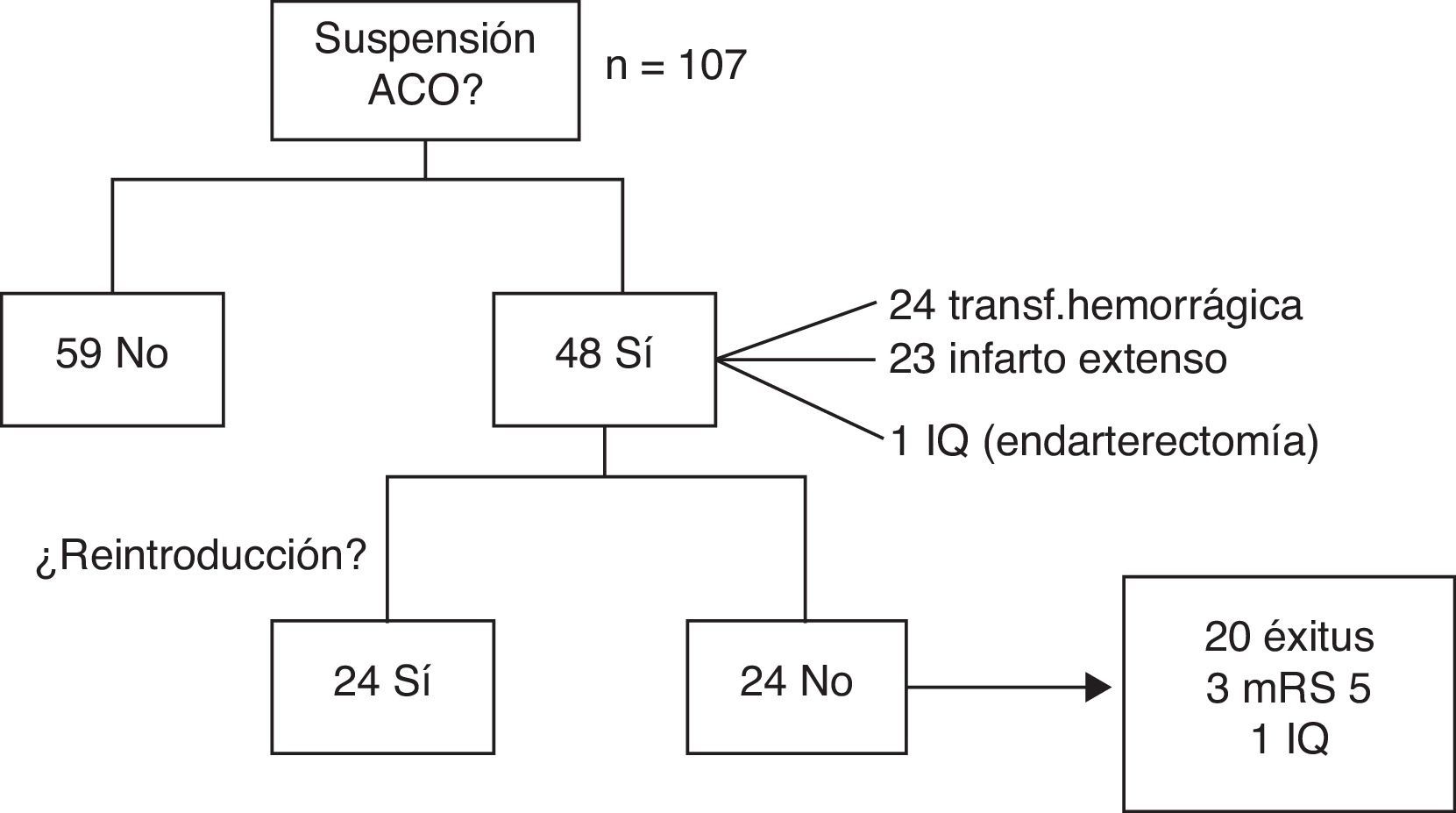
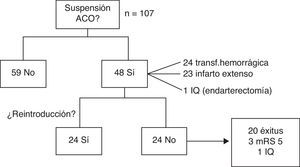
Con respecto al tratamiento ACO, en la fase aguda se decidió mantenerlo en 59 pacientes (55,1%) y suspenderlo en 48 (44,9%), ya fuera por transformación hemorrágica (24), infarto extenso (23) o intervención quirúrgica (1).
De los pacientes en que suspendió la ACO, en 24 (50%) se pudo reintroducir sin incidencias a los 36 días de media (rango 5-180). En el resto, no se pautó de nuevo por: defunción en 20 pacientes (41,7%), 12 de forma secundaria al ictus; en 3 pacientes (6,2%) por puntuación de 5 en la mRS durante el seguimiento, y en un caso por intervención quirúrgica (endarterectomía), atribuyéndose en ese caso el ictus a aterotrombosis (fig. 2).
Se ha modificado el tratamiento con la introducción de NACO en 9 pacientes (6 dabigatrán, 2 rivaroxabán, uno apixabán) de los 48 supervivientes con FA no valvular que potencialmente eran candidatos (18,7%).
Asimismo, valoramos el grado de dependencia al alta y a los 3 meses, clasificando a los pacientes según su puntuación en la escala mRS: independencia para las actividades de la vida diaria (mRS=0-2) o dependencia funcional (mRS=3-5).
Al alta, presentaban dependencia funcional 49 pacientes (45,8%) y 13 pacientes (12,1%) habían fallecido durante el ingreso.
Tras el alta, y a los 3 meses del ictus, se pudo hacer el seguimiento a 89 pacientes (en 5 hubo pérdida de seguimiento). Hubo 12 fallecimientos durante este tiempo (3 relacionados con el ictus, 9 por otras causas). Del resto, 30 individuos (28% de la serie inicial) seguían con dependencia funcional.
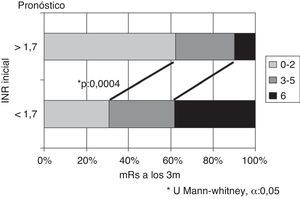
Si se considera el INR en el momento del ictus, se obtienen las mayores diferencias tomando como punto de corte el valor 1,7. Existen diferencias significativas en cuanto a la evolución, siendo mejor en pacientes con INR ≥ 1,7 respecto INR < 1,7, tanto en porcentaje de pacientes con independencia funcional (62% vs. 30,8%) como en menor mortalidad (10% vs. 38,4%), p = 0,0004 (fig. 3). Si se analizan los subtipos topográficos, la distribución en función del INR (< 1,7 vs. ≥ 1,7) dentro de ellos no difiere de forma significativa (TACI 35 vs. 33), PACI (12 vs. 14), POCI (7 vs. 6).
Tomando como punto de corte el valor 2, que representa en la mayoría de los pacientes el límite para considerar que se encuentran en rango terapéutico, también había diferencias significativas a favor del INR ≥ 2 (0,007).
Durante el seguimiento, ninguno de los pacientes presentó un nuevo evento isquémico.
DiscusiónEn el momento del ictus, prácticamente 3 cuartas partes de nuestros pacientes se encontraban en niveles de INR infraterapéuticos. Aunque aseguraron buen cumplimiento en la toma del fármaco, es probable que en algunos no fuera así. En cuanto al resto, es conocida la dificultad de mantenerse en niveles adecuados a pesar de una correcta toma del fármaco7. No ha sido posible conocer el tiempo en rango terapéutico de cada paciente, que hubiera sido una medida más objetiva.
La otra cuarta parte tenía un INR > 2. En todos ellos, excepto un caso, no se encontró otra causa que explicara el ictus. Buena parte de los pacientes contaban con uno o más FRCV, pero esto no se tradujo en hallazgos indicativos de etiología aterotrombótica o indeterminada por doble causa. Por tanto, a pesar de encontrarse en niveles terapéuticos, presentaron un ictus de etiología cardioembólica, atribuible a las cardiopatías de base. Esto contradice otros estudios publicados, en los cuales buena parte de los eventos se explicaban por otras etiologías22.
Cabe destacar que en contados casos se hallaron trombos en orejuela izquierda o sobre prótesis valvulares y en ninguno placas significativas en el arco aórtico o shunt derecha-izquierda, si bien el porcentaje de ETE realizadas es mejorable.
La gran mayoría de los pacientes seguían tratamiento con ACO por FA, especialmente no valvular. La práctica totalidad de ellos tenían justificada su prescripción sobre la base de su puntuación en las escalas CHADS2 y CHA2DS2VASc.
En poco más de la mitad de los pacientes se mantuvo el tratamiento ACO ya de entrada, dado el alto riesgo embolígeno por sus cardiopatías de base. Se retiró en pacientes con transformación hemorrágica o infartos extensos, pero se pudo reintroducir sin incidencias en un término de menos de 6 meses, a excepción de los pacientes fallecidos o con secuelas muy severas. Se recomienda su inicio en 1-2 semanas tras el ictus, excepto pacientes con infartos extensos u otros factores de riesgo para presentar hemorragias, en los que se difiere en espera de evolución clínica y radiológica23. Al mantener o reintroducir la ACO, se tuvo en cuenta la puntuación CHA2DS2VASc respecto a HAS-BLED, con mayor riesgo para eventos isquémicos que para hemorrágicos.
No obstante, a pesar de los recientes estudios y de que en muchos casos se puede considerar que se ha producido un fracaso terapéutico de los ACO, solo en el 18,7% de los supervivientes candidatos se han pautado NACO. En nuestro centro, la prescripción de este tratamiento se hace en consenso con el servicio de hematología. Durante los últimos años, se han ido aprobando los distintos NACO en los protocolos intrahospitalarios, por lo que cada vez se pautan más y es de esperar que la tendencia se mantenga.
En cuanto a su evolución, aproximadamente una cuarta parte falleció entre la fase aguda y los 3 meses de seguimiento, y otra cuarta parte quedó con dependencia funcional a los 3 meses. Estos resultados concuerdan con el peor pronóstico de los ictus cardioembólicos3.
Considerando el INR inicial, tener un valor > 1,7 se asociaba a un mejor pronóstico funcional y vital. En un estudio reciente se observó que un INR ≥ 2 también se asociaba a mejor pronóstico24. En nuestro caso, los pacientes con INR ≥ 2 también tenían mejor pronóstico, pero la diferencia era aún más significativa tomando 1,7 como punto de corte. Curiosamente, muchos pacientes con un INR ≤ 1,7 pudieron recibir trombólisis por vía intravenosa, sin representar un beneficio respecto a los que no.
En la literatura se ha reportado que los pacientes en tratamiento con ACO presentan infartos de menor tamaño respecto a los que no lo toman, estableciendo además una correlación inversa entre el valor del INR al ingreso y el volumen de la lesión en la RM craneal25. En nuestro caso, no se ha medido el volumen y no hemos podido corroborar esta afirmación. Se ha obtenido la cantidad de TACI, PACI y POCI para INR < o ≥ 1,7, repartiéndose de forma homogénea.
Asimismo, se apunta que los ACO acelerarían la trombólisis mediante la inhibición del sistema protrombótico y, por tanto, favoreciendo el sistema fibrinolítico26. De esta manera, se formarían trombos más pequeños y más frágiles; más fácilmente resolubles.
Los procedimientos intervencionistas y las complicaciones en forma de transformación hemorrágica, que también pueden influir en la evolución, se repartieron de forma homogénea en ambos grupos.
Las limitaciones de este estudio son las inherentes a un análisis retrospectivo, aunque tiene la ventaja de contar con un solo centro, lo que disminuye las desviaciones en los protocolos y hace que la aplicación de tratamientos y las evaluaciones sean más homogéneas. Además, al tener en cuenta únicamente enfermos ingresados, no se han podido estudiar pacientes con AIT o ictus con puntuación NIH baja, que se manejan de forma ambulatoria o son trasladados a otros centros. Ello explicaría que en ningún caso hemos encontrado ictus pertenecientes a la categoría LACI y/o de etiología lacunar.
Como conclusión, destacamos que algunos pacientes presentan ictus isquémicos a pesar de estar en tratamiento con ACO, especialmente con un valor de INR infraterapéutico, y estos ictus siguen siendo de causa cardioembólica, lo que plantea el fracaso de este tratamiento.
Se puede reintroducir el ACO sin complicaciones, siendo el uso de NACO todavía escaso. Finalmente, a pesar de la ineficacia del ACO, su evolución es mejor cuando el INR > 1,7 al inicio del ictus.
FinanciaciónNo ha recibido.
Conflicto de interesesNo existen.
Este trabajo ha sido presentado parcialmente como comunicación oral en la LXV Reunión Anual de la Sociedad Española de Neurología.