La búsqueda de una terapia neuroprotectora efectiva para el ictus sigue siendo un reto para investigadores y clínicos. Una de las causas principales por la que a nivel clínico han fracasado terapias eficaces en ensayos experimentales reside probablemente en el desarrollo y modo de evaluación en estudios preclínicos de los agentes neuroprotectores en los modelos animales de isquemia cerebral.
MétodosPara unificar la metodología en la aplicación de los modelos experimentales a nivel nacional y mejorar la investigación en este campo, se ha elaborado un documento entre varios grupos españoles expertos en investigación neurovascular que constituye una guía de recomendaciones para el uso de los mismos.
ResultadosSus aspectos fundamentales se basan en la selección del modelo más adecuado en función del objetivo del estudio, teniendo en cuenta el tipo de especie y la cepa animal, la edad, el sexo y los factores de riesgo. La realización del diseño experimental incluye un grupo sham control y el cálculo previo del tamaño muestral. Otros aspectos muy importantes a seguir son la aleatorización en la asignación de los animales en cada grupo, el análisis ciego de los parámetros estudiados, el registro de la temperatura y flujo sanguíneo cerebral, así como la notificación y causas de animales excluidos en el estudio y la tasa de mortalidad.
ConclusionesEs esencial adquirir compromisos metodológicos para la optimización del empleo de los modelos animales de isquemia cerebral que incremente el rendimiento de hallazgos positivos en la fase preclínica y puedan trasladarse a la práctica clínica.
The progress of effective therapies for stroke has become a challenging task for both researchers and clinicians. Some pitfalls in clinical trials might have their origins in the pre-clinical experimental ischaemic models for the evaluation of potential neuro-protective agents.
MethodsWe aim to standardise the methods for the development of stroke animal models throughout Spain, to produce document with appropriate recommendations and best practice in order to improve experimental methods in the field of stroke research.
ResultsMembers of several experienced stroke research groups prepared a guide with recommendations in the application of focal cerebral ischaemic models. The main features of this guide are based on the selection of the most appropriate animal model, taking in account the objective of the study, the species, strain, age, sex of animals, as well as risk factors. The experimental design must include a sham control group and the sample size calculation. Animal randomisation and blind analysis, masked assessment of outcomes, monitoring of body temperature and cerebral blood flow, and the reporting of reasons for excluding animals from the study, as well as the mortality rate, are other main points to fulfil in the application of stroke models.
ConclusionsStandardised methods are essential to increase the success of the pre-clinical findings in the stroke neuroprotection field to be able to translate to the clinical practice.
Siendo el ictus una de las causas más comunes de discapacidad permanente y la primera causa de muerte entre las mujeres españolas1, la búsqueda de terapias efectivas para su tratamiento constituye en la actualidad un enorme reto para investigadores básicos y clínicos. A pesar de que se han evaluado más de 50 agentes neuroprotectores en ensayos clínicos de fase III que evidencian efectos terapéuticos en modelos de isquemia cerebral en ratas, ratones, o jerbos, ninguno de ellos ha mostrado tener en humanos efectos concluyentes2,3. La única terapia aprobada en la actualidad es el tratamiento con el activador tisular del plasminógeno en la fase hiperaguda del ictus isquémico4,5. Sin embargo, y pese a su gran eficacia, el hecho de que deba ser administrado dentro de una estrecha ventana terapéutica no superior a las 4 horas y media desde el inicio de los síntomas y el riesgo al incremento de sangrados cerebrales6, da lugar a que menos del 5% de los pacientes con ictus se beneficien de la terapia trombolítica7. Todo esto hace que sea fundamental identificar nuevos fármacos neuroprotectores o neurorreparadores, útiles para tratar el ictus y entender porqué hemos asistido a tantos fracasos terapéuticos al trasladar fármacos prometedores del laboratorio a la clínica.
Algunas de las causas por las que los neuroprotectores no han mostrado ser efectivos en los ensayos clínicos, probablemente se deban al fallo en el desarrollo y en la evaluación de los modelos animales de isquemia cerebral. Entre los factores críticos a optimizar, porque afectan a la tasa de éxito y a la variabilidad de los modelos, se incluyen, entre otros, la selección de cada modelo experimental en función del objetivo de estudio (para revisión de los tipos de modelos experimentales consultar la cita bibliográfica 8), el uso de anestésicos adecuados, el mantenimiento y seguimiento de animales en un ambiente fisiológico y la observación y el análisis de los resultados eliminando cualquier tipo de sesgo9–11.
En la presente publicación se revisan los aspectos más críticos en el desarrollo de modelos de experimentación animal para el estudio del ictus y se dan a conocer las recomendaciones más importantes en la aplicación de los mismos.
ObjetivoEl objetivo de la “Guía de recomendaciones en la aplicación de modelos animales para el estudio el ictus” es el unificar la metodología en el desarrollo de los modelos experimentales, clarificar y establecer los factores críticos para optimizar los resultados y mejorar la investigación en el campo de la isquemia cerebral a nivel nacional. En ella se recogen las líneas comunes de actuación de los miembros de los distintos laboratorios españoles de experimentación animal que participaron en su elaboración. La guía fue realizada tras la celebración de la reunión Lost in (stroke) translation. Barcelona Think Tank Project (17- 18 de julio de 2009) con el apoyo de la red RENEVAS y constituye un documento para el futuro consenso de actuaciones y recomendaciones basado en los aspectos tratados en la reunión y discusión del comité integrante. En el apartado siguiente se describen los puntos principales que la constituyen.
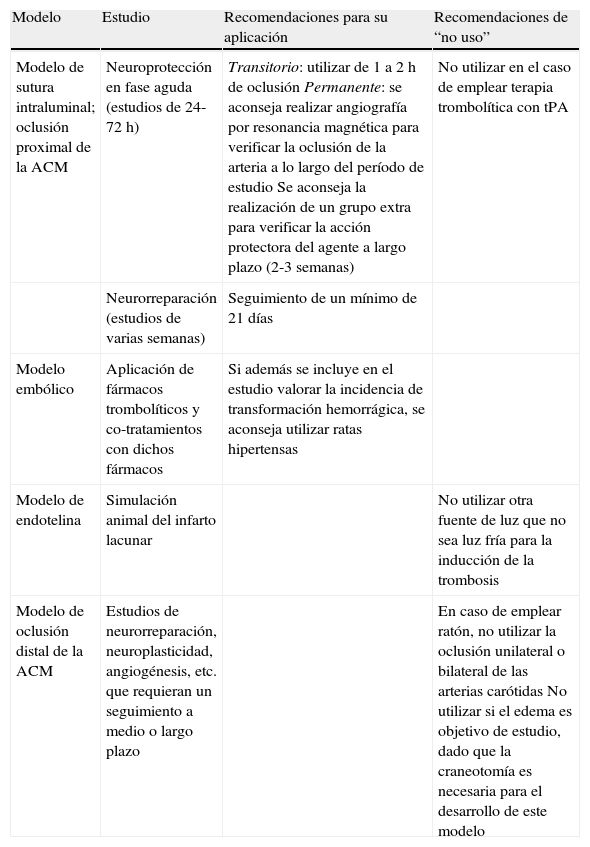
DesarrolloSelección del modelo de isquemia cerebral animal más adecuado a cada estudioEl modelo animal correcto de isquemia cerebral a utilizar dependerá del objetivo del estudio. Principalmente la elección del modelo se basará en el proceso de la fisiopatología isquémica en el que se está interesado y se tendrá en cuenta la reproducibilidad de las variables a estudiar para cada modelo. La selección del modelo dependerá, entre otros factores, del modo de isquemia permanente o transitorio que se aplique, en función de si se está interesado en la fisiopatología de la reperfusión isquémica; de la intensidad de la isquemia cerebral y afectación de las áreas cerebrales que se deseen para el estudio; de la duración del estudio experimental (estudio en fase aguda o crónica) y de la aplicación en la administración de fármacos. En la tabla 1 se describen las recomendaciones más importantes del tipo de modelo a utilizar en función del objetivo de estudio.
Recomendaciones del modelo de isquemia cerebral focal a utilizar según el tipo de estudio
| Modelo | Estudio | Recomendaciones para su aplicación | Recomendaciones de “no uso” |
| Modelo de sutura intraluminal; oclusión proximal de la ACM | Neuroprotección en fase aguda (estudios de 24-72 h) | Transitorio: utilizar de 1 a 2 h de oclusión Permanente: se aconseja realizar angiografía por resonancia magnética para verificar la oclusión de la arteria a lo largo del período de estudio Se aconseja la realización de un grupo extra para verificar la acción protectora del agente a largo plazo (2-3 semanas) | No utilizar en el caso de emplear terapia trombolítica con tPA |
| Neurorreparación (estudios de varias semanas) | Seguimiento de un mínimo de 21 días | ||
| Modelo embólico | Aplicación de fármacos trombolíticos y co-tratamientos con dichos fármacos | Si además se incluye en el estudio valorar la incidencia de transformación hemorrágica, se aconseja utilizar ratas hipertensas | |
| Modelo de endotelina | Simulación animal del infarto lacunar | No utilizar otra fuente de luz que no sea luz fría para la inducción de la trombosis | |
| Modelo de oclusión distal de la ACM | Estudios de neurorreparación, neuroplasticidad, angiogénesis, etc. que requieran un seguimiento a medio o largo plazo | En caso de emplear ratón, no utilizar la oclusión unilateral o bilateral de las arterias carótidas No utilizar si el edema es objetivo de estudio, dado que la craneotomía es necesaria para el desarrollo de este modelo |
Para la selección del modelo será imprescindible la reflexión sobre el tipo de animal a utilizar, siendo de gran relevancia los factores: i) especie, ii) cepa, iii) sexo, iv) edad y v) factores de riesgo. La principal característica a tener en cuenta es que la anatomía neurovascular difiere fuertemente entre las diferentes cepas. El resultado en el tamaño de la lesión isquémica va a variar en gran medida dependiendo de la existencia del mayor o menor número de ramificaciones colaterales que irrigan el territorio de la ACM. Las especies utilizadas por nuestros grupos son las de roedores de rata y ratón. Las cepas de rata más apropiadas para la realización de estos modelos son la cepa Wistar, desaconsejando la utilización de ratas de la subcepa Wistar Kyoto, que desarrollan tamaños de infarto muy pequeños, y la cepa Sprague Dawley (SD). En la subcepa SD-OFA se han detectado problemas en cuanto a la variabilidad entre lotes que afecta al tamaño del infarto.
La importancia del empleo de ratones viene determinada por el uso de animales modificados genéticamente. No se recomienda el uso en concreto de una cepa determinada, aunque es importante tener en cuenta que el volumen de infarto cortical puede variar enormemente entre unas y otras cepas. Por ejemplo, el infarto de ratones FVB puede ser hasta tres veces más pequeño que en ratones BALB/C.
Respecto al sexo, se recomienda replicar el estudio realizado en un determinado grupo del otro sexo al utilizado y valorar al menos el end-point principal del estudio. Esta recomendación se dirige fundamentalmente a los trabajos en los cuales tienen como objetivo establecer el efecto terapéutico de un agente.
Por otro lado, nuestros grupos utilizan animales jóvenes-adultos (250-350g en rata; 8-12 semanas en ratón, 25-30g) en el estudio de la isquemia cerebral. Para el estudio de los factores de riesgo del ictus se aplica estreptotocina en el caso de la diabetes, y para la hipertensión se deben utilizar ratas SHR (spontaneously hypertensive rats) o contemplar el modelo de “2K1C” para la inducción de hipertensión12.
Realización del diseño experimentalLa elaboración del diseño experimental previo a la realización del estudio es imprescindible para el correcto desarrollo de los modelos. Sobre el diseño experimental deberán contemplarse los puntos descritos a continuación:
Grupos experimentales de estudioSe incluirá la realización del grupo experimental sham control. Asimismo, deberán evitarse utilizar controles antiguos para la comparación de resultados y en su caso, se empleará un grupo de animales “testigo” como control de que los end-points de estudio sean reproducibles entre los animales antiguos y los nuevos operados.
Tamaño muestralSe recomienda realizar el cálculo del tamaño muestral a utilizar para cada estudio (utilizar un poder 1- β de 0,8 y un nivel de significancia α de 0,05). Una vez que se hayan aplicado los criterios de exclusión, al menos debe de haber una n=10 de animales válidos en cada grupo experimental.
AleatorizaciónLa asignación de cada animal a un grupo experimental se realizará siempre de forma aleatoria, recomendándose el uso de programas informáticos.
Ocultamiento de la asignación durante el proceso experimentalSe recomienda que el investigador responsable de la inducción de la isquemia/reperfusión y de la toma de decisiones sobre los criterios de punto final desconozca el grupo experimental al cual el animal pertenece.
Ocultamiento del tratamientoEs aconsejable que la administración de un tratamiento por parte del investigador se realice de forma ciega. Se propone llevar a cabo estrategias de codificación de los tratamientos para alcanzar este fin.
Evaluación y análisis ciegos de las variables de estudioSe establece que al evaluar los distintos parámetros de estudio (por ejemplo, volumen de infarto, déficit neurológico…) el investigador encomendado a realizarlo no conocerá el grupo de tratamiento al que pertenece el sujeto de estudio.
Criterios de inclusión y exclusiónSerá de importancia relevante el predefinirlos antes de comenzar el estudio. Se establece que cada grupo tomará la decisión con relación a la elaboración de estos criterios (por ejemplo, la exclusión de animales que no desarrollen un tamaño mínimo de lesión isquémica o una puntuación mínima en el déficit neurológico).
Registro de variables en la realización de los modelosLa medida de la perfusión cerebral en la región irrigada por la ACM mediante flujometría con láser-doppler debe de realizarse de manera inevitable en la utilización de los modelos de isquemia cerebral para asegurar la oclusión y reperfusión de la arteria y corroborar el éxito de la operación. Además se recomienda su utilización en modelos permanentes para corroborar la oclusión homogénea. Los umbrales de flujo cerebral establecidos para considerar aceptable la oclusión y reperfusión de la ACM se indican en la tabla 2, siendo considerados como criterios de inclusión/exclusión.
Umbrales de flujo sanguíneo cerebral establecidos como criterios de inclusión/exclusión en la oclusión y reperfusión de la ACM*
| Modelo de láser-doppler | Reducción del flujo durante la oclusión | Incremento del flujo durante la reperfusión |
| Perimed | 65% sobre el basal | 80% sobre el basal |
| Moor-Lab | 75% sobre el basal | 80% sobre el basal |
La temperatura corporal (uso de una sonda rectal) se registrará siempre y se deberá mantener a 37±0,5°C durante el proceso quirúrgico. El uso de una sonda craneal en el músculo temporal es aconsejable. En cuanto a la gasometría, medición de la presión arterial y frecuencia cardiaca, se registrarán siempre que se requiera intubación del animal, durante el tiempo de anestesia o isquemia. No es estrictamente necesario si la cirugía no es tan agresiva (por ejemplo, no intubación).
Anestesia y analgesiaSe aconseja que se reemplace el uso de anestesia inhalatoria con isofluorano por sevofluorano. Como tratamiento analgésico se recomienda metamizol magnésico, debiendo notificar siempre cuál se ha utilizado.
Condiciones de estabulaciónSe deben emplear ciclos de luz/oscuridad de 12h y mantener a los animales en un ambiente controlado de temperatura (óptimo 22°C) y humedad (óptimo 50%). La red tiene experiencia en las diferencias que la composición de la dieta puede implicar en algunos experimentos, por lo que recomienda alimentar a los animales con una dieta conocida y suministrar agua ad libitum. Retirar la comida el día anterior a la cirugía es algo que la mayoría de nuestros grupos no hace. La posibilidad de determinar la glucemia antes de realizar el procedimiento quirúrgico ha de tenerse en cuenta.
NotificaciónTodos los aspectos contemplados en los puntos anteriores serán notificados en la publicación de un estudio. Se deberá además notificar estrictamente la tasa de mortalidad en el estudio y el número y causas de animales excluidos.
Valoración de los parámetros de estudio, expresión de los resultados y aplicación estadística: tamaño del infarto y evaluación neurológicaPara evitar la variabilidad es deseable que los distintos análisis y procedimientos para la valoración de estos parámetros los realice la misma persona en la medida de lo posible. El cálculo del volumen del infarto deberá hacerse teniendo en cuenta la corrección del edema cerebral y se recomienda calcular y expresar el resultado en infarto cortical e infarto en estriado o subcortical por separado, además del volumen total infartado.
Los autores piensan que no existen tests neurológicos adecuados en la actualidad. De los que disponemos y en función de la fase de estudio, se recomienda realizar el test de Bederson13 o tests basados en el test de Bederson (por ejemplo, escala 0-9,14) para estudios en fase aguda de neuroprotección y valorar la posibilidad de realizar tests funcionales a corto plazo. Para estudios de fase crónica (estudios de neurorreparación) se recomienda el ensayo de escalas neurológicas (por ejemplo,test de Bederson) y la realización de tests funcionales, aconsejándose los tests de Stick Label y Corner test15. Los tests funcionales deberán ser valorados a la misma hora del día en todos los animales del estudio.
Respecto a la expresión de los datos obtenidos se recomienda que en el caso de aquellos con distribución normal se haga mediante la media±desviación estándar o proporcionando el intervalo de confianza 95%; para los no-normales, se aconseja la mediana y el rango intercuartil. En cualquier caso, se ha de asegurar que la distribución sea normal para el uso de tests estadísticos paramétricos. Por otra parte se aconseja que la representación gráfica del volumen de infarto se realice además de en diagrama de barras, mediante la representación por puntos, lo cual permite observar los valores individuales de cada animal.
ConclusionesUna de las causas más importantes que sesgan la evidencia clínica de la eficiencia de las estrategias neuroprotectoras en el campo experimental del estudio del ictus se derivan del diseño, la metodología y la notificación de resultados en la utilización de modelos animales. Para asegurar el éxito traslacional en el avance terapéutico del ictus, reducir eficazmente el número de animales empleados y evitar gastos económicos innecesarios, se requiere el trabajo en equipo de la comunidad científica. Es esencial adquirir compromisos metodológicos para la optimización en el empleo de modelos animales de isquemia cerebral que incremente el rendimiento de hallazgos positivos en el campo científico. El seguimiento de las recomendaciones establecidas en esta guía, tales como la elección del modelo idóneo, el control de la temperatura, la medición del flujo cerebral mediante flujometría con láser doppler y la notificación de la tasa de mortalidad en la publicación de los resultados, aumenta la calidad de los mismos y genera datos preclínicos de gran utilidad que pueden ser llevados a la práctica clínica.
FinanciaciónRENEVAS (RD06/0026/0010) y Laboratorio de Investigación Neurovascular, Institut de Recerca Vall d’Hebron, Barcelona.
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAgracedemos a la Dra. Anna Planas, al Dr. Xiaoying Wang, al Dr. Malcom McLeod, al Dr. Dennis Vivien y a todos los miembros de la Red de Investigación Cooperativa Neurovascular (RENEVAS) que participaron en la reunión Lost in (stroke) translation. Barcelona Think Tank Project (17- 18 de julio de 2009) sus interesantes contribuciones.