La fase premonitoria comprende una amplia esfera de síntomas que anteceden hasta en 48horas al dolor en una crisis de migraña. Este periodo a menudo no es reconocido por el propio paciente y, sin embargo, también merma de forma significativa su calidad de vida.
Al ser el estadio más precoz de una crisis de migraña es fundamental para ayudarnos a comprender puntos clave del origen de la misma.
DesarrolloA lo largo de esta revisión, en forma de pregunta-respuesta, se repasan los principales estudios clínicos que analizan de forma dirigida los síntomas premonitorios, se valora la capacidad predictiva de los mismos, se relacionan estos síntomas con la biología de la migraña, se revisa el papel de la neuroimagen en esta fase y, por último, la relevancia como potencial diana terapéutica que pueda tener en un futuro.
ConclusionesEl estudio de la fase premonitoria nos ha mostrado que el hipotálamo tiene un papel esencial en el origen de una crisis de migraña, y nos hace plantearnos la búsqueda de nuevas dianas en el tratamiento de una crisis de migraña dirigidas a actuar antes del inicio del dolor, un hecho que implicaría un antes y un después en la vida del paciente migrañoso.
The premonitory phase comprises a wide range of symptoms that precede the onset of pain in a migraine episode by up to 48hours. Premonitory symptoms are often not recognised by patients but do have a significant impact on their quality of life. As these symptoms represent the first stage of a migraine attack, they are crucial in improving our understanding of the key points of the origin of migraine.
DevelopmentThis paper uses a question-answer format to review the main clinical studies analysing premonitory symptoms, their predictive capacity, the relationship between these symptoms and the biology of migraine, and the role of neuroimaging in the premonitory phase. Finally, we discuss the relevance of these symptoms as potential therapeutic targets in the future.
ConclusionsThis study of the premonitory phase has demonstrated that the hypothalamus plays an essential role in the origin of migraine attacks. We should consider the search for new targets in acute migraine treatment in order to act before the onset of the pain. This would imply a radical change in the lives of patients with migraine.
Siempre que hablamos de una crisis de migraña la identificamos con dolor de cabeza, ya que habitualmente es la fase más incapacitante de la misma, sin embargo, la cefalea no es, en absoluto, el único síntoma que presenta el paciente. Una crisis abarca una esfera mucho más amplia de manifestaciones clínicas que aumentan de forma significativa la discapacidad del paciente, pudiendo presentarse horas antes de la aparición del dolor, lo que hace que la calidad de vida del paciente se vea mermada muchos más días al mes.
La fase premonitoria de una crisis de migraña es la fase previa al dolor y en la que el paciente presenta los síntomas premonitorios (SP). Estos se definen como «aquellos que anteceden y avisan de una crisis migrañosa con una antelación entre 2 y 48horas, de aparición anterior al aura en la migraña con aura y anterior al inicio del dolor en la migraña sin aura», según la actual Clasificación internacional de cefaleas, CIC-III beta1. Algunos ejemplos de SP son: fatiga, euforia, depresión, aumento de apetito y ansia por alimentos concretos. Se recomienda no emplear términos como pródromos o síntomas de aviso, los cuales se utilizaban con anterioridad para hacer referencia a estos síntomas, por su ambigüedad y uso con otros significados.
Maniyar et al.2 consideran que en esta definición hay 2 aspectos que se han de tener en cuenta. En primer lugar, el síntoma premonitorio no antecede ni avisa de la crisis de migraña, sino que forma parte de ella, y como segundo punto estos síntomas pueden estar presentes en el intervalo entre el inicio del aura y/o dolor y durante las 2horas siguientes. La definición hace esta separación para diferenciar claramente un síntoma premonitorio del aura, pero realmente este vacío no existe, tal y como demuestran estudios prospectivos3, y el aura es claramente distinta desde un punto de vista fisiopatológico. Por ello, plantean que previamente a la versión definitiva se revise esta definición.
Fue Gowers4 en el año 1899 quien describió el primer síntoma premonitorio (somnolencia). Pero no fue hasta el año 1980, con Blau5, cuando se reconoció claramente esta fase e incluso se acuñó el término de «migraña completa» cuando el paciente la presentaba. Se comienza entonces a hablar del potencial papel del hipotálamo en los SP y, con ello, en el origen de la migraña, postulándose ya en contra de la teoría vascular que era la que prevalecía en ese momento.
Aparte de los SP comentados se han descrito otros mucho menos comunes, pero muy llamativos, como los que aparecen en el popular libro Migraña6, donde Oliver Sacks detalla hechos tan peculiares como que uno de sus pacientes, con un carácter normalmente flemático, tenía una tendencia casi incontrolable a reír, bailar o cantar durante unas horas antes del inicio del dolor. También podemos encontrar otros SP como sensación de estrechez de la cabeza, posición ligeramente inclinada hacia delante o cambios en la expresión facial7,8.
¿Por qué es tan importante la fase premonitoria de la migraña? Lo valioso de su estudio radica en que es el estadio más precoz, nos indica las áreas del cerebro implicadas en el inicio de una crisis de migraña y, por tanto, podría ayudarnos en el futuro a encontrar estrategias terapéuticas diseñadas para anticiparse al dolor.
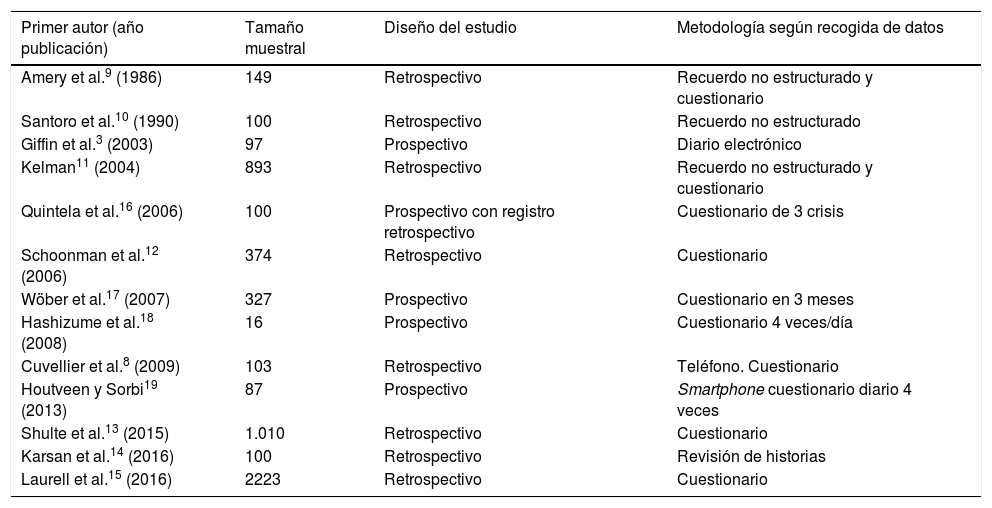
¿Qué nos aportan los estudios clínicos?En la tabla 1 se resumen los estudios clínicos realizados hasta el momento dirigidos al análisis de los SP.
Descripción de los estudios clínicos dirigidos a la evaluación de los síntomas premonitorios
| Primer autor (año publicación) | Tamaño muestral | Diseño del estudio | Metodología según recogida de datos |
|---|---|---|---|
| Amery et al.9 (1986) | 149 | Retrospectivo | Recuerdo no estructurado y cuestionario |
| Santoro et al.10 (1990) | 100 | Retrospectivo | Recuerdo no estructurado |
| Giffin et al.3 (2003) | 97 | Prospectivo | Diario electrónico |
| Kelman11 (2004) | 893 | Retrospectivo | Recuerdo no estructurado y cuestionario |
| Quintela et al.16 (2006) | 100 | Prospectivo con registro retrospectivo | Cuestionario de 3 crisis |
| Schoonman et al.12 (2006) | 374 | Retrospectivo | Cuestionario |
| Wöber et al.17 (2007) | 327 | Prospectivo | Cuestionario en 3 meses |
| Hashizume et al.18 (2008) | 16 | Prospectivo | Cuestionario 4 veces/día |
| Cuvellier et al.8 (2009) | 103 | Retrospectivo | Teléfono. Cuestionario |
| Houtveen y Sorbi19 (2013) | 87 | Prospectivo | Smartphone cuestionario diario 4 veces |
| Shulte et al.13 (2015) | 1.010 | Retrospectivo | Cuestionario |
| Karsan et al.14 (2016) | 100 | Retrospectivo | Revisión de historias |
| Laurell et al.15 (2016) | 2223 | Retrospectivo | Cuestionario |
Según el diseño del estudio, hay que tener en cuenta que la mayoría se han realizado de forma retrospectiva8–15, por lo que el paciente pudo no recordar a priori todos los SP que había presentado, y estos son más difíciles de asociar a cada migraña de manera independiente. Si bien los estudios prospectivos3,16–19 resuelven estas limitaciones, el tamaño muestral es mucho menor.
También tiene relevancia saber cómo fue la metodología del estudio en cuanto a la recogida de datos20. Esta puede ser en forma de diario libre o recuerdo no estructurado, lo cual puede llevar asociado el sesgo de que el paciente olvide rellenarlo todos los días, además de la sobrecarga que esto implica, y si es en forma de cuestionario o checklist el paciente ha de ceñirse a los ítems propuestos, donde puede obviar variables relevantes o, al contrario, podría marcar algunos que por sí mismo no los hubiera relacionado o que habría olvidado. Por otro lado, el uso de smartphones o dispositivos electrónicos, aunque presentan también algunos de los inconvenientes mencionados, sin embargo, permiten realizar un estudio en tiempo real, un hecho importante sobre todo para valorar la capacidad predictiva de estos síntomas.
Teniendo en cuenta lo expuesto, describimos a continuación las principales conclusiones de dichos estudios.
La fase premonitoria puede abarcar una esfera muy amplia de manifestaciones, desde alteraciones anímicas, como euforia e hiperactividad, hasta tristeza y apatía, afectación cognitiva, trastornos gastrointestinales y de apetito, rigidez nucal, bostezos, alteraciones sensoriales (foto, sono u osmofobia), afección dérmica, mareo, visión borrosa, aumento o disminución de la temperatura corporal y sudoración, entre otras. Varios trabajos3,8,11–17 describen los bostezos, la irritabilidad y la apatía, la rigidez nucal, la fotofobia, las náuseas, la fatiga y la dificultad de concentración como los síntomas más frecuentes.
Cuando se valora la prevalencia de los SP, si se consideran los sesgos metodológicos antes comentados, no sorprende observar importantes discrepancias entre diferentes autores. Se describen prevalencias tan pequeñas como del 9%21, pasando por prevalencias del 33-39%10,11,13 hasta otros trabajos donde se sitúa en cifras tan elevadas como 77-92%9,12,15,16. Podríamos sugerir que la prevalencia probablemente se acerque más a las cifras más altas publicadas, si se instruye al paciente de una manera adecuada para su correcto reconocimiento y se realiza una anamnesis de una forma dirigida.
La media de síntomas por paciente es habitualmente 3SP en cada crisis12,15, sin embargo, si se tiene en cuenta la recogida de datos, se han descrito 7 e incluso 12 síntomas de media en cada migraña13,16.
Un punto poco estudiado es si en todas las crisis de migraña el paciente presenta los mismos SP. Quintela et al.16 describen una consistencia de SP, analizando 3 crisis de migraña en cada paciente, de un 63% en al menos 2 crisis y de un 30% en todas ellas. Los SP más consistentes fueron dificultad de concentración, tristeza, ansiedad y bostezos.
Aunque según la definición de la CIC-III beta1, los SP pueden aparecer hasta 48horas antes, se ha estudiado que la media de aparición de estos síntomas se sitúa entre 6 y 10horas11,13,19. También podemos ver un hecho interesante: hay síntomas como la hiperactividad y la euforia que son más característicos en la fase premonitoria más precoz, es decir, más alejados del dolor (25-36horas antes) y otros que se producen mucho más cerca del inicio del mismo (menos de 12horas), como son rigidez nucal, fatiga, irritabilidad19. Esto nos lleva a considerar el concepto de SP no evolutivos y evolutivos22, basados en las características específicas de cada uno. Los síntomas no evolutivos aparecen en el momento más precoz de la fase premonitoria, presentan una intensidad constante y desaparecen horas antes del inicio del dolor. Los SP evolutivos aparecen más próximos al inicio del dolor y se vuelven cada vez más pronunciados según se acerca este. Este fenómeno encaja, como veremos más adelante, con la fisiopatología y la neuroimagen.
Por otra parte, una observación común9–12,15,16 es que hay un perfil de crisis de migraña con mayor presencia de SP. Es aquel paciente que describe un dolor más intenso, con más síntomas acompañantes, factores desencadenantes, síntomas posdrómicos y antecedentes familiares de tipo unilateral, pulsátil, con mayor duración y latencia de respuesta al triptán. Por lo tanto, se hipotetiza que los pacientes con crisis de migraña generalmente precedidas por SP tienen un perfil de migraña más fuerte, lo cual puede implicar un fracaso prematuro de sus sistemas de adaptación antinociceptivos para el medio ambiente y para los acontecimientos estresantes. Respecto a si son más frecuentes según la edad hay discrepancias en la literatura. Varios estudios no encontraron diferencias12,15,16, mientras que otros postulan que son más frecuentes en jóvenes10. Lo mismo ocurre respecto al género, donde o no se han visto diferencias entre mujeres y hombres11,16 o son más frecuentes en las primeras9,12; aunque probablemente al analizar otros factores sea porque en ellas las crisis son más intensas. Respecto a los pacientes que presentan migraña con aura se ha visto que no tienen mayor porcentaje de SP12, pero sí más de media por episodio, son de mayor intensidad y, de forma curiosa, tienen menos síntomas aquellos con escotoma centelleante15.
A su vez, existe también un perfil de paciente que presenta de forma más frecuente un tipo determinado de SP13. Por poner algunos ejemplos, en las mujeres suele haber mayor apetito y náuseas; en los pacientes con aura más osmofobia, bostezos, dificultad de concentración, mareo y náuseas y en los pacientes con síntomas acompañantes al dolor estos suelen estar más presentes antes de este.
Algunos autores16 han observado que los pacientes que están bajo tratamiento preventivo, en concreto con amitriptilina, bloqueadores beta, flunarizina, topiramato y fluoxetina presentan un menor número de SP, sugiriendo un posible «papel protector» de estos, pues no sólo reducen el dolor, sino toda la esfera de síntomas asociados a una crisis de migraña.
Por último, los SP no son específicos de la migraña, ya que se han observado en otros procesos patológicos como por ejemplo en la cefalea en racimos23. Esto no es sorprendente, dado que ambas comparten anatomía y mecanismos fisiopatológicos comunes. Tampoco son específicos de la edad adulta, como demuestran los trabajos de Cuvillier et al. y Karsan et al.8,14, donde nos hablan de la presencia de SP en niños y adolescentes, se describen incluso en un niño de 18 meses14. Estos trabajos muestran prevalencias de SP altas (67-85%), una media de síntomas similar al adulto y añaden un síntoma más característico de esta edad, como son los cambios faciales, fáciles de evidenciar en el niño.
¿Cuál es su capacidad de predicción del inicio del dolor?El principal trabajo que estudia la capacidad de predicción del inicio del dolor en función de los SP se llevó a cabo por Giffin et al.3 en el año 2003. Se evaluaron 97 pacientes considerados «buenos predictores» de sus migrañas, y estos consiguieron predecir correctamente una de sus crisis en el 72% de los casos, el 82% acertaban en más de la mitad de las ocasiones y en el 68%, lo más probable, era que ocurriera en las 6horas siguientes. Los SP más predictores fueron dificultad para hablar (92% de posibilidad de acierto), dificultad para leer y escribir (90%) y bostezar (84%). Los síntomas menos predictores fueron el cansancio, la rigidez nucal, las náuseas y los vómitos. Otro hecho relevante es que si el paciente tenía casi la certeza de que iba a acertar, acertaba en el 95% de las ocasiones.
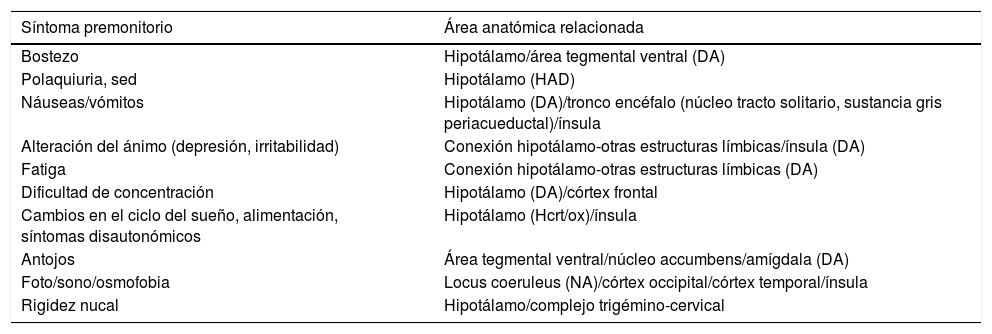
¿Cómo se relacionan los síntomas premonitorios con la biología de la migraña?Cuando tienen lugar los SP en un paciente podemos observar las áreas anatómicas y mecanismos neuroquímicos implicados en el comienzo de una crisis de migraña (tabla 2). Desde un punto de vista práctico estas áreas y mecanismos nos presentan nuevas dianas y plantean nuevos enfoques terapéuticos que pueden aplicarse antes de que la cefalea tenga lugar.
Relación entre el síntoma premonitorio que presenta el paciente y su correlación neuroanatómica
| Síntoma premonitorio | Área anatómica relacionada |
|---|---|
| Bostezo | Hipotálamo/área tegmental ventral (DA) |
| Polaquiuria, sed | Hipotálamo (HAD) |
| Náuseas/vómitos | Hipotálamo (DA)/tronco encéfalo (núcleo tracto solitario, sustancia gris periacueductal)/ínsula |
| Alteración del ánimo (depresión, irritabilidad) | Conexión hipotálamo-otras estructuras límbicas/ínsula (DA) |
| Fatiga | Conexión hipotálamo-otras estructuras límbicas (DA) |
| Dificultad de concentración | Hipotálamo (DA)/córtex frontal |
| Cambios en el ciclo del sueño, alimentación, síntomas disautonómicos | Hipotálamo (Hcrt/ox)/ínsula |
| Antojos | Área tegmental ventral/núcleo accumbens/amígdala (DA) |
| Foto/sono/osmofobia | Locus coeruleus (NA)/córtex occipital/córtex temporal/ínsula |
| Rigidez nucal | Hipotálamo/complejo trigémino-cervical |
DA: dopamina; HAD: hormona antidiurética; Hcrt/ox: hipocretina/orexina; NA: noradrenalina.
En relación con los SP se encuentran fundamentalmente el hipotálamo, el sistema dopaminérgico y la región insular. Estos se describen a continuación:
HipotálamoDado que el hipotálamo es un área anatómica fundamental en los SP, una de las aproximaciones terapéuticas es actuar sobre los neuropéptidos implicados en las diferentes funciones hipotalámicas como las orexinas/hipocretinas24,25, involucrados en la regulación del sueño/vigilia, la alimentación o el estrés. Todo esto puede ser crítico para mejorar la carga alostática y evitar consecuentemente la siguiente migraña. Se define carga alostática26 como la cantidad de actividad cerebral necesaria para gestionar adecuadamente el estrés fisiológico y emocional.
En esta línea, un interesante trabajo de Burstein et al.26 propone que cambios en la homeostasis, como los que ocurren en situaciones de ansiedad, de sobrecarga, alteraciones de la alimentación y del sueño pueden llevar a que el dolor se desarrolle o no, en función del tono o carga alostática del tronco encefálico cuando recibe ese estímulo. De tal forma que, si el tono es alto, las señales nociceptivas son inhibidas y no se desarrolla el dolor. En el extremo contrario estaría el estado migrañoso, donde se entraría en un proceso cíclico y no cedería el mismo. Por este motivo, no siempre los mismos factores desencadenantes, como la fatiga o los cambios de humor, generan en el paciente una crisis de migraña.
El hipotálamo puede explicar muchos de los SP, y a favor de su papel en el origen de la migraña se suma también la alteración del sueño y del patrón hormonal como factor desencadenante, o la existencia de un ritmo circadiano en la misma. Su activación junto con la del tronco del encéfalo, antes de que ocurra el dolor, sugiere un papel protagonista en la etiopatogenia de esta enfermedad.
Respecto a cómo está implicado el hipotálamo en el origen del dolor, existen 2 teorías: una más general, donde hay una alteración en el eje hipotálamo-tronco del encéfalo, implicando una alteración del umbral de activación que permite la transmisión de la señal nociceptiva del tálamo, donde se selecciona, amplifica y prioriza el paso al córtex (en presencia de una suficiente carga alostática); y otra teoría más específica, donde el hipotálamo se conecta con las neuronas parasimpáticas preganglionares del núcleo salival superior, y estas con las neuronas parasimpáticas posganglionares del ganglio esfenopalatino, produciendo vasodilatación con liberación de sustancias proinflamatorias y de ahí la activación última del sistema trigémino-vascular27.
La primera demostración de la activación hipotalámica la realizan Denuelle et al.28, que realiza una H215O tomografía por emisión de positrones a 7 pacientes, en las primeras horas desde el inicio del dolor y después del uso de sumatriptán. Se observa que la activación hipotalámica está al inicio del dolor y persiste a pesar del alivio con el tratamiento, lo que podría explicar la recurrencia cuando deja de hacer efecto el triptán y nos replantea la búsqueda de nuevas dianas terapéuticas en la crisis de migraña.
Sistema dopaminérgicoActualmente en la literatura la relación entre migraña y dopamina (DA) es en cierto modo controvertida, pero hay un consenso en que el paciente con migraña padece una hipofunción dopaminérgica crónica. La disfunción dopaminérgica llevaría a una sobreexpresión de receptores de DA y esto se traduce en que el paciente sea más sensible a la estimulación dopaminérgica y a un control inhibitorio reducido de neuronas trigeminales. Este hecho incrementa la susceptibilidad de activación de estas neuronas en respuesta a estímulos desencadenantes de la migraña25,26.
Una crisis comienza con una baja concentración de DA que estimula los receptores presinápticos (produciendo SP tales como bostezos o somnolencia); posteriormente, se incrementan los niveles del neurotransmisor, lo cual implica una activación al nivel de los receptores postsinápticos (manifestándose con náuseas e hipotensión) hasta llegar a un nivel donde ya es tarde para impedir la activación del sistema trigémino-vascular y con ello el dolor. La DA desempeña un papel en la modulación nociceptora de este sistema, sobre todo a través de los receptores dopaminérgicos (DR) D2.
Cuando los niveles de DA vuelven a su situación basal los pacientes muestran síntomas como la somnolencia y la fatiga, aunque en algunos permanecen elevados presentando euforia y polaquiuria29.
También la implicación dopaminérgica en la migraña está avalada por la respuesta a distintos tratamientos: la domperidona, antagonista DRD2, evita el inicio de la migraña7, pero su efecto es más a nivel periférico, no atraviesa la barrera hematoencefálica (de ahí que no produzca efecto extrapiramidal). Otro antagonista DRD2 que sí atraviesa la barrera es la metoclopramida, la cual evita las náuseas y también el dolor. La apomorfina que es un agonista, sobre todo de DRD4, produce bostezos, náuseas y somnolencia (sin embargo no desencadena dolor, incluso en aquellos pacientes más sensibles), y si se administra de una forma continua, disminuyendo la hipofunción crónica dopaminérgica, invierte el ciclo reduciendo la frecuencia y la intensidad. La flunarizina es un calcioantagonista que se utiliza como tratamiento preventivo en la migraña. Sin embargo, se ha visto que actúa también como antagonista de la DA. En este caso parece ser que el efecto sobre la vía dopaminérgica no es a través de DRD230.
Otro hecho significativo que apoya la implicación de la DA en la fase premonitoria es que las crisis de migraña en los pacientes con enfermedad de Parkinson, el paradigma del déficit dopaminérgico, van desapareciendo según se manifiesta la enfermedad y estos responden mejor a las terapias dopaminérgicas25,29.
ÍnsulaNo se debe considerar la migraña como una enfermedad a nivel insular, pero esta desempeña un papel importante en la integración de muchos procesos dinámicos envueltos en la migraña, como se muestra en el trabajo de Borsook et al.31. La ínsula está relacionada con los cambios cognitivos, la respuesta autonómica, las alteraciones sensitivas, la osmofobia, las náuseas/vómitos, el vértigo asociado a la migraña, las alteraciones del sueño y los cambios anímicos que refieren estos pacientes en las diferentes fases de esta enfermedad, incluyendo la fase premonitoria. El hecho de hacer ejercicio, una correcta hidratación, la disminución del estrés, el correcto ritmo del sueño o el tratamiento con triptanes produce un descenso de la activación del córtex insular. Sin embargo, en los pacientes con abuso de medicación o con migraña crónica se ve un incremento en la actividad de la ínsula. Otro punto para reflexionar es si los cambios funcionales en la ínsula producidos con los años pueden estar relacionados con las diferencias que se ven con la edad del paciente con migraña.
¿Existe relación con los estudios de neuroimagen?Un trabajo que supuso un punto de inflexión en los estudios de neuroimagen de la fase premonitoria de la migraña fue el trabajo de Maniyar et al.32. Se indujo una crisis de migraña tras la infusión con nitroglicerina en 8 pacientes que presentaban de forma habitual SP. Las áreas que se activaron al inicio de la crisis de migraña, observadas por H215O tomografía por emisión de positrones, fueron principalmente: hipotálamo, área tegmental ventral, sustancia gris periacueductal, puente dorsal, putamen, pulvinar y varias áreas corticales, acorde con la presencia de los SP que refería el paciente. Cabe destacar que hubo una activación distinta en la fase premonitoria más precoz con respecto a la fase premonitoria más tardía, viéndose que la activación detectada desaparecía según nos acercábamos al inicio del dolor en áreas como el hipotálamo, el área tegmental ventral, la sustancia gris periacueductal y el putamen; sin embargo, el puente dorsal se mantenía activo en todas las fases y en la ínsula aparecía la activación más próxima a la fase de dolor. Este hecho está probablemente relacionado con lo comentado previamente acerca de la diferencia de síntomas evolutivos versus no evolutivos, completando otra pieza más del puzzle, e insistiendo en que futuras dianas terapéuticas podrían estar dirigidas a estas áreas que se activan en la fase premonitoria más precoz.
En otro trabajo estos mismos autores escogieron a un subgrupo de pacientes que tenían hipersensibilidad fótica (fotofobia durante la fase previa al dolor)33, y observaron una activación del córtex visual independiente del sistema trigeminal, a diferencia de la fase dolor, donde ambos confluyen. Así, estos datos muestran que en presencia de luz el dolor se percibe como más intenso.
Seleccionaron también otro subgrupo de pacientes quienes presentaban náuseas34, donde sí había una conexión con el sistema trigeminal ya desde las fases más tempranas, sugiriendo una relación más compleja. Este hecho puede respondernos a preguntas como por qué algunos pacientes cuando vomitan mejoran del dolor.
Otro trabajo clave en el estudio de neuroimagen durante la fase premonitoria es el realizado recientemente por Shulte y May35. En él se realizó una resonancia magnética funcional a una misma paciente durante 30 días consecutivos. El principal hallazgo fue que, al aproximarse la siguiente migraña (24h antes), existía una activación del hipotálamo, así como una conexión anómala con el núcleo espinal trigeminal y, ya en la fase de dolor, con la protuberancia. Esto apoya la hipótesis del papel del eje hipotálamo-tronco del encéfalo como el verdadero generador de una crisis de migraña, al cambio funcional en la conectividad del hipotalámo-tronco del encéfalo, relegando de este puesto al puente dorsal, como se pensaba previamente.
En esta misma línea ya se había postulado el trabajo de Stankewitz et al.36 años antes. Se demostró por resonancia magnética que los pacientes con migraña presentaban unos niveles más bajos de activación del núcleo espinal trigeminal comparado con controles sanos en situación basal, y que según se acercaba la fase de dolor (preictal) la activación aumentaba hasta equipararse a los controles, descendiendo posteriormente en la fase de dolor. La conclusión de este estudio es que, a partir de la activación del núcleo espinal trigeminal, modulada por el hipotálamo, se podría predecir la siguiente crisis de migraña.
¿Cuál es la relevancia terapéutica de su estudio?Varios trabajos sugieren tratar al paciente en esta fase de la migraña, con el fin de evitar el inicio del dolor. En el trabajo de Waelkens et al.7 usan la domperidona como tratamiento agudo cuando aparecen los SP, mientras que Luciani et al.37 utilizan naratriptán. Las conclusiones de ambos trabajos, con un tamaño muestral aproximado de 20 pacientes, son similares. Se consigue evitar el dolor de forma completa, aproximadamente en 2/3 de los pacientes, y en el tercio restante el dolor que se presentaba era de menor intensidad. Ambos trabajos también destacan que hay un punto temporal, que pasado el mismo el ciclo del dolor ya ha comenzado, un punto llamado de no retorno, que se establece en un mínimo de 2horas, con lo cual el tratamiento debería administrarse antes de este momento. Pero en estos estudios se seleccionó a pacientes que se consideraban buenos predictores para saber en qué momento dar la medicación, con las limitaciones que esto conlleva: no todos los pacientes pueden predecir sus crisis, y es posible que se incluyeran falsos positivos, es decir, pacientes que pensaban que iban a tener una crisis de migraña y realmente estaban equivocados.
Otro trabajo muy interesante en su planteamiento es el Cady et al.38, que dividen a los pacientes (n=76) en 2 grupos; el grupo A, a quienes se les trata con topiramato a diario y con frovatriptán las crisis de dolor, y el grupo B, quienes tomaban frovatriptán en la fase premonitoria. La diferencia en número de días de dolor no fue significativa en ambos grupos, lo que respalda el hecho de que tratar los SP puede evitar el dolor. Si bien, la mayor satisfacción del paciente la referían los del grupo A. Dicho resultado es justificado por los autores por 2 aspectos: hubo un porcentaje mayor de retiradas en este grupo por los efectos adversos del topiramato, no incluyéndose estos pacientes en el análisis final, y la toma de topiramato a diario también reduce la aparición de SP, como antes comentábamos, lo cual supone una mejoría en la calidad de vida de los pacientes.
ConclusionesLa fase premonitoria es el estadio previo al dolor, muchas veces no reconocida por el propio paciente. Pese a ser una etapa hasta el momento poco estudiada es fundamental en la migraña, como sugieren diversos trabajos recientes.
Su análisis nos ha guiado hacia lo que se podría considerar en este momento el «verdadero generador» de una crisis, localizado en el eje hipotálamo-tronco del encéfalo, reforzado tanto por la clínica que describe el paciente como por los estudios de neuroimagen. Además, plantea un cambio en el punto de mira para futuras estrategias terapéuticas. Un objetivo interesante es actuar sobre estas dianas en la fase premonitoria para impedir el inicio de la activación trigeminal, y con ello actuar sobre la aparición del dolor, evitando así el mayor sufrimiento del paciente con migraña.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.