El coeficiente de difusión aparente (ADC) de la resonancia magnética parece relacionarse con el grado de celularidad de los tumores de sistema nervioso central. Su utilidad para diferenciar el grado tumoral y tipo histológico de los tumores es controvertido.
Material y métodosEstudio retrospectivo de los pacientes pediátricos con diagnóstico de tumor de sistema nervioso central desde enero-2008 a diciembre-2013. Se revisan edad, sexo, localización del tumor y anatomía patológica. Las medidas de ADC y ratio ADC (cociente ADC tumoral/ADC tejido sano) se llevaron a cabo por 2 neurorradiólogos expertos, ciegos al diagnóstico histológico. Se calcula el valor ADC y el ratio ADC y se comparan sus valores con los diagnósticos anatomopatológicos.
ResultadosSe incluyen 55 pacientes. La mediana de edad fue 6 años. Los diagnósticos anatomopatológicos fueron: astrocitoma pilocítico (40%), ependimoma anaplásico (16,4%), ganglioglioma (10,9%), glioblastoma (7,3%), meduloblastoma (5,5%), y otros (20%). El 64% fueron de bajo grado (BG) y el 36% de alto grado (AG). La media de ADC fue 1,3 en los de BG y 0,9 en los de AG (p=0,004). La media de ratio ADC fue de 1,5 y 1,2 (p=0,025) respectivamente. No hubo diferencias significativas en el ADC/ratio ADC entre los distintos tipos histológicos.
ConclusionesEl ADC y ratio ADC son una herramienta útil en la diferenciación por imagen del grado tumoral en los tumores cerebrales pediátricos, sin sustituir a la anatomía patológica.
The apparent diffusion coefficient (ADC) in MRI seems to be related to cellularity in brain tumours. Its utility as a tool for distinguishing between histological types and tumour stages remains controversial.
ProceduresWe retrospectively evaluated children diagnosed with CNS tumours between January 2008 and December 2013. Data collected were age, sex, histological diagnosis, and location of the tumour. We evaluated the ADC and ADC ratio and correlated those values with histological diagnoses.
ResultsThe study included 55 patients with a median age of 6 years. Histological diagnoses were pilocytic astrocytoma (40%), anaplastic ependymoma (16.4%), ganglioglioma (10.9%), glioblastoma (7.3%), medulloblastoma (5.5%), and other (20%). Tumours could also be classified as low-grade (64%) or high-grade (36%). Mean ADC was 1.3 for low-grade tumours and 0.9 for high-grade tumours (p=.004). Mean ADC ratios were 1.5 and 1.2 for low and high-grade tumours respectively (p=.025). There were no significant differences in ADC/ADC ratio between different histological types.
ConclusionADC and ADC ratio may be useful in imaging-study based differential diagnosis of low and high-grade tumours, but they are not a substitute for an anatomical pathology study.
Los tumores cerebrales constituyen los tumores sólidos más frecuentes en la infancia. Entre 1980-2012 se registraron en el Registro Nacional de Tumores Infantiles 4.448 casos de tumores de Sistema Nervioso Central en nuestro país1. Constituyen la principal causa de muerte por cáncer en la edad pediátrica.
La edad del paciente y la imagen radiológica son un elemento clave en el diagnóstico de esta patología. Los tumores supratentoriales son más frecuentes en los menores de 2 años, mientras en edades superiores predominan los tumores infratentoriales.
Los estudios de imagen por tomografía computarizada (TC) y resonancia magnética (RM) constituyen la prueba fundamental en el estudio de estos tumores ya que pueden orientar el diagnóstico histológico por la localización, extensión y las características radiológicas2,3. Sin embargo, las técnicas convencionales no permiten diferenciar entre tumores de alto grado (AG) y bajo grado (BG). Las técnicas avanzadas de neuroimagen permiten obtener información radiológica de la fisiopatología y el metabolismo de estos tumores, proporcionando una información muy valiosa para guiar el diagnóstico y planificar un mejor abordaje quirúrgico4.
La difusión, o imagen potenciada en difusión, es una técnica de RM que mide el movimiento browniano de los protones en los distintos tejidos. Diversos estudios sugieren un papel de esta técnica en la diferenciación de los tumores cerebrales y su grado histológico5, e incluso se ha relacionado con el pronóstico de los mismos6,7. El coeficiente de difusión aparente (ADC) es una medida de difusión con una especificidad variable para diferenciar grado de malignidad y tipo histológico en los diferentes estudios publicados.
El objetivo de nuestro trabajo es conocer la utilidad del ADC para diferenciar grado tumoral y tipo histológico en los pacientes pediátricos diagnosticados de una neoplasia de sistema nervioso central en nuestro centro.
Pacientes y métodosSe realizó un estudio retrospectivo de los pacientes menores de 16 años con diagnóstico de tumor del sistema nervioso central en la Unidad de Neurocirugía Pediátrica del Hospital 12 de Octubre, Madrid. Se revisaron las historias clínicas de los pacientes incluidos y se recogieron los datos de edad al diagnóstico, sexo, localización (supratentorial o infratentorial) y el diagnóstico histológico.
Se clasificaron los diagnósticos histológicos de los tumores cerebrales según grado tumoral siguiendo criterios de la Organización Mundial de la Salud (OMS)8,9. Se consideraron tumores de BG los de grado I y II de la OMS, y de AG los de grados III y IV.
El diagnóstico por imagen de los tumores de los pacientes incluidos se realizó en un equipo Philips Achieva de 1,5T. Se obtuvieron secuencias potenciadas en T1, 3D, T2 axial, FLAIR axial, difusión axial, perfusión potenciada en T2 y T1 con contraste.
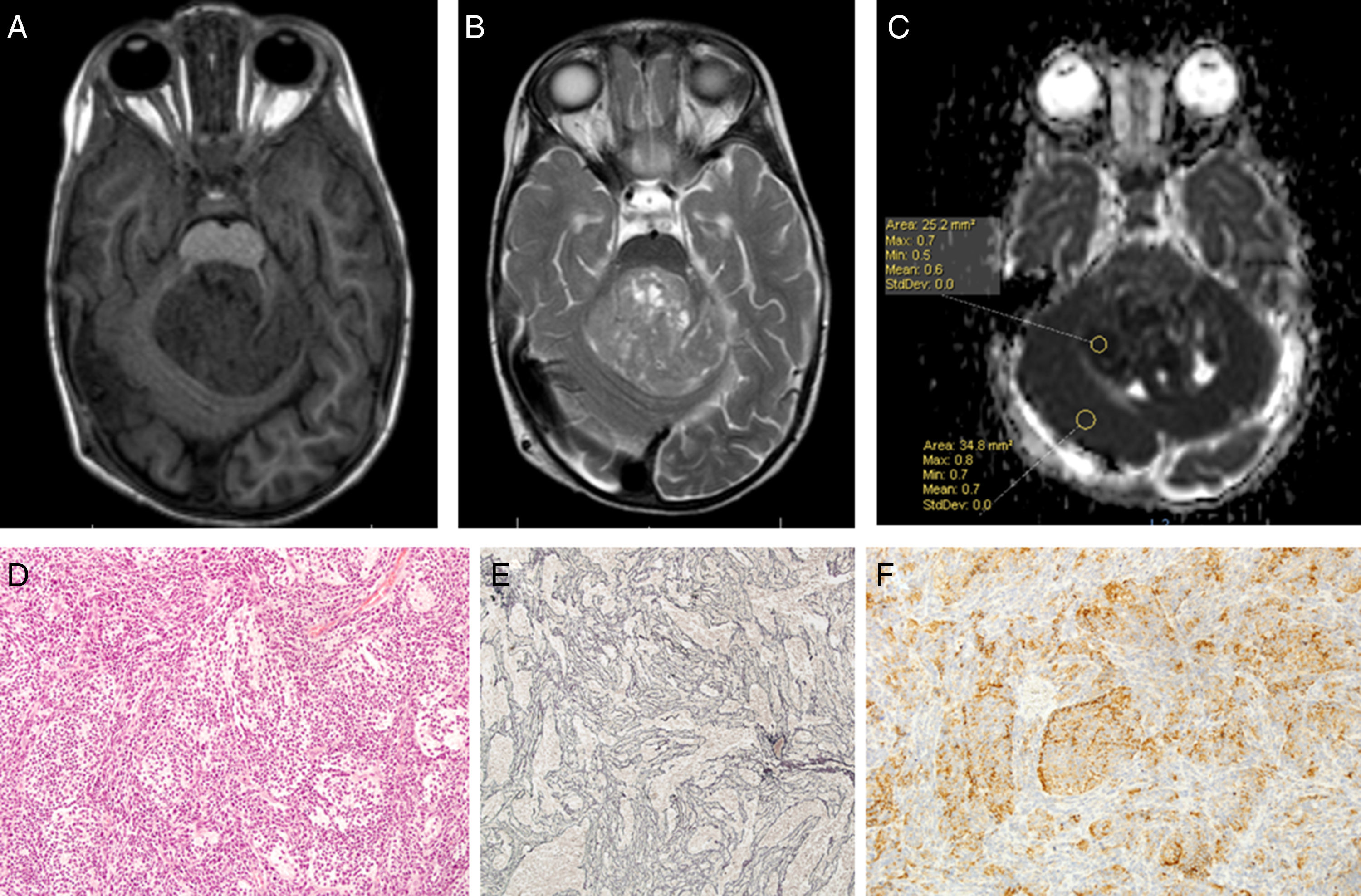
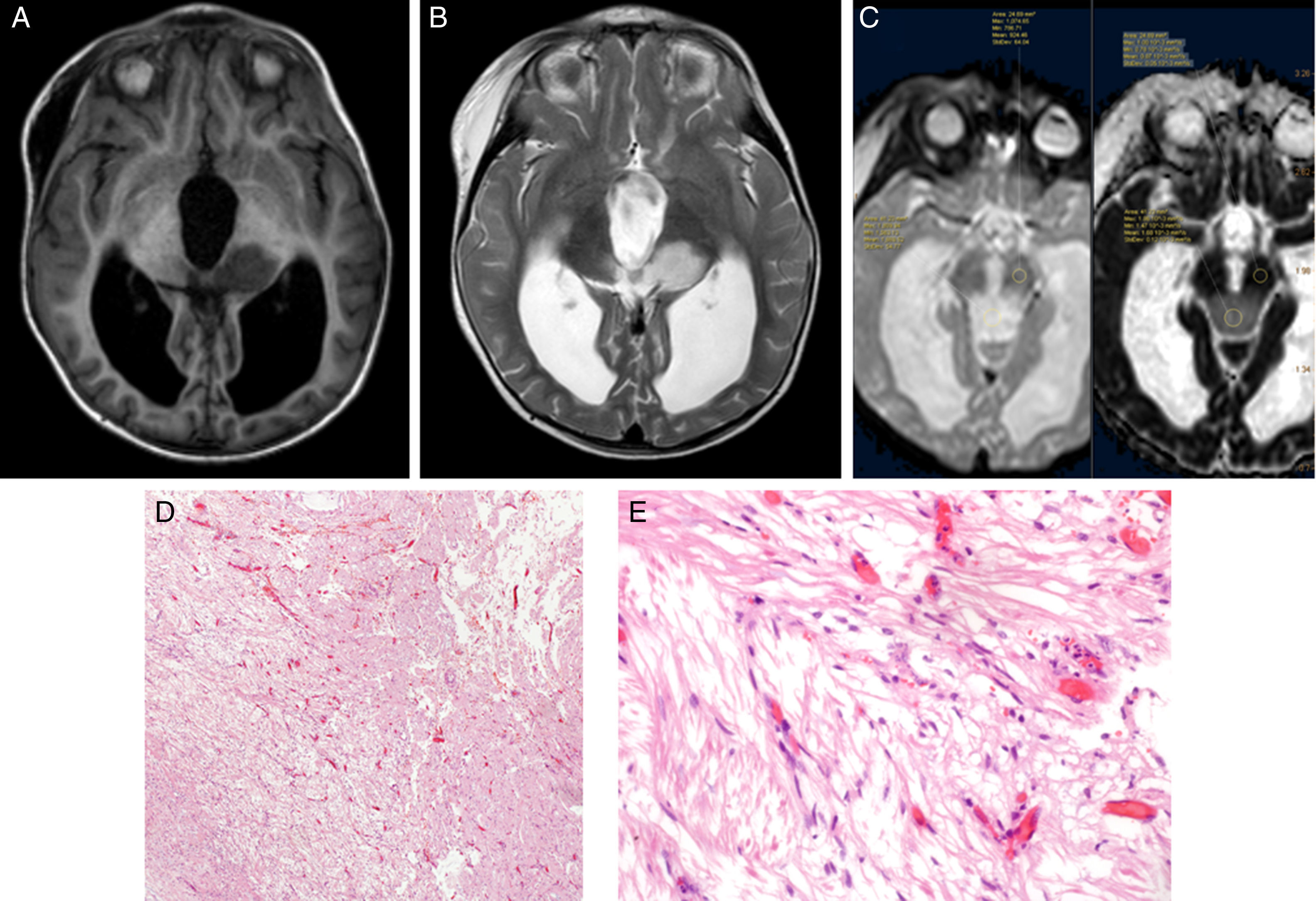
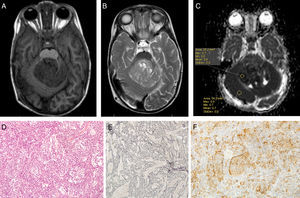
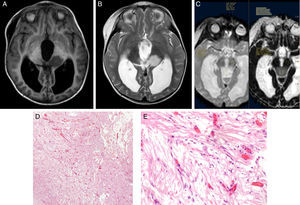
Se construyó el mapa ADC de los pacientes incluidos en el estudio de RM al diagnóstico mediante el software Intellispace de Philips (fig. 6).
Dos radiólogos expertos ciegos al diagnóstico histológico evaluaron las imágenes de los pacientes incluidos. Se determinó el ADC en la porción sólida del tumor, excluyendo zonas posiblemente artefactadas (aquellas que contuviesen calcio, hemosiderina, necrosis o estuviesen en zona de interfase). Sobre la zona elegida se construyó un region of interest (ROI), en el que se determinaron los valores de ADC máximo, mínimo y medio. Posteriormente se construyó un nuevo ROI en sustancia blanca contralateral sana y se midieron valor máximo, mínimo y medio de ADC. El ratio ADC se calculó dividiendo el valor medio de ADC entre el tumor y la sustancia blanca contralateral sana. En la elaboración del presente estudio se han seguido las normas éticas de protección de datos requeridas. Se obtiene consentimiento informado de los padres o tutores legales de los pacientes. Se realiza un manejo anonimizado de los datos en la elaboración del presente manuscrito (fig. 7).
Para el contraste de hipótesis se utilizó el software estadístico SPSS v20 y para la creación de las curvas ROC y establecimiento del punto de corte el software MedCalc v11.
Las comparaciones de los valores de ADC y ratio ADC entre los tumores de BG y AG se realizó utilizando el estadístico U de Mann Whitney para muestras independientes.
La relación de los valores ADC y ratio ADC entre los diferentes tipos histológicos se realizó utilizando la prueba estadística ANOVA.
Las diferencias observadas se consideraron estadísticamente significativas para un valor de p <0,05.
ResultadosEn el periodo de estudio se incluyeron 55 pacientes con un rango de edad comprendido entre los 4 meses y los 16 años (media 5 años, mediana 6 años). El 74,5% fueron varones y el 25,5% mujeres. Los diagnósticos histológicos de los pacientes incluidos fueron astrocitoma pilocítico (grado I) (22 pacientes), ependimoma anaplásico (grado III) (9), ganglioglioma (grado I) (6), glioblastoma (grado IV) (4), meduloblastoma (grado IV) (3), papiloma atípico de plexos coroideos (grado II) (2), pineoblastoma (grado IV) (uno), teratoma maduro (uno), xantoastrocitoma pleomórfico con rasgos anaplásicos(grado II) (uno), carcinoma de plexos coroideos (grado III) (uno), tumor neuroepitelial disembrioplásico (grado I) (uno), hamartoma (uno) y adenoma hipofisario (uno). Dos pacientes no tenían diagnóstico histológico por no haberse realizado cirugía en el momento de la recogida de datos.
Se clasificaron como de BG (grados I-II de la OMS y tumores de naturaleza benigna no incluidos en la clasificación OMS) 34 pacientes, y de AG 19 pacientes. Dos pacientes no pudieron ser clasificados al no disponer del estudio histológico.
En el estudio estadístico del ADC y el ratio se excluyeron otros 9 pacientes por no disponer de la secuencia en difusión en la RM al diagnóstico (3 astrocitomas pilocíticos, 2 de ellos medulares), 3 ependimomas anaplásicos (uno de ellos medular y diseminado), un ganglioglioma, un prolactinoma y un hamartoma.
Para el análisis final de ADC y ratio quedaron 44 pacientes (26 de BG y 18 de AG).
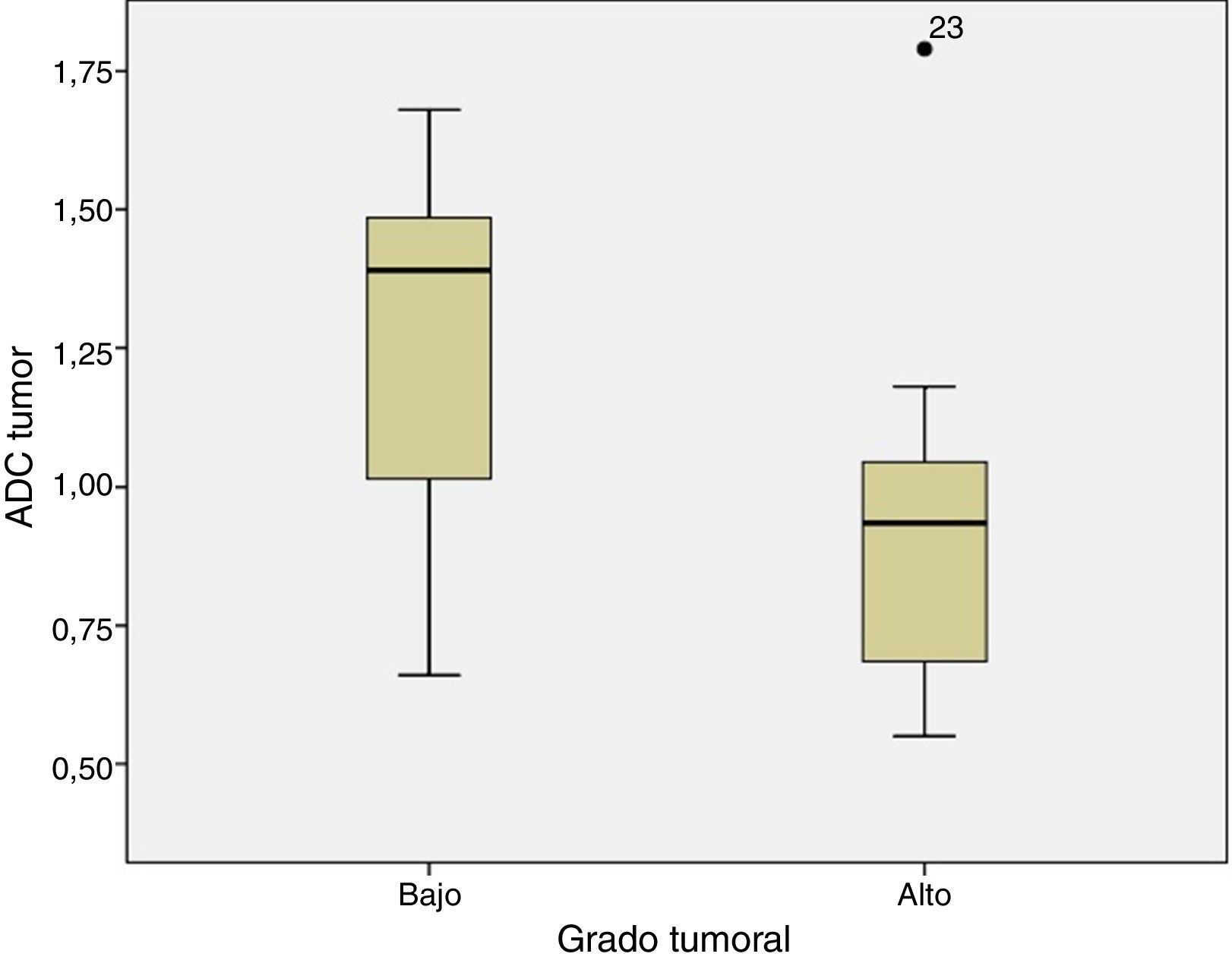
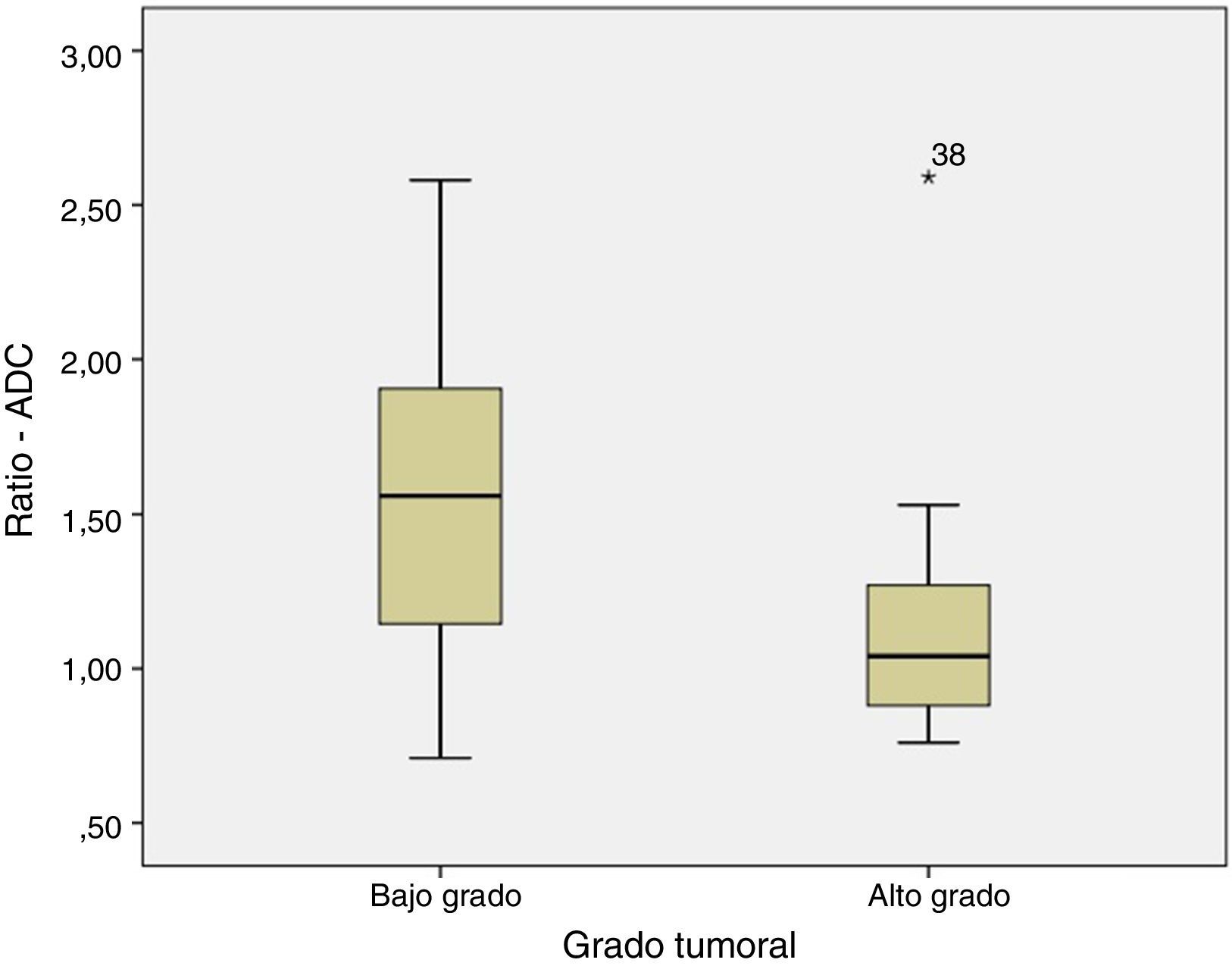
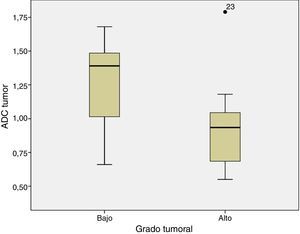
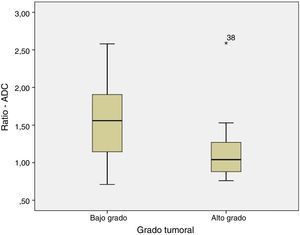
Cuando se compara el estudio ADC de los tumores de BG y AG se observa que el ADC es mayor en los de BG que en los de AG (fig. 1), siendo respectivamente 1,32±0,46 y 0,9±0,29×10−3mm2/s (p=0,004). Lo mismo ocurre cuando se compara el ratio ADC (fig. 2) que fue de 1,56±0,52 y 1,17±0,44×10−3mm2/s en los de BG y AG (p=0,025).
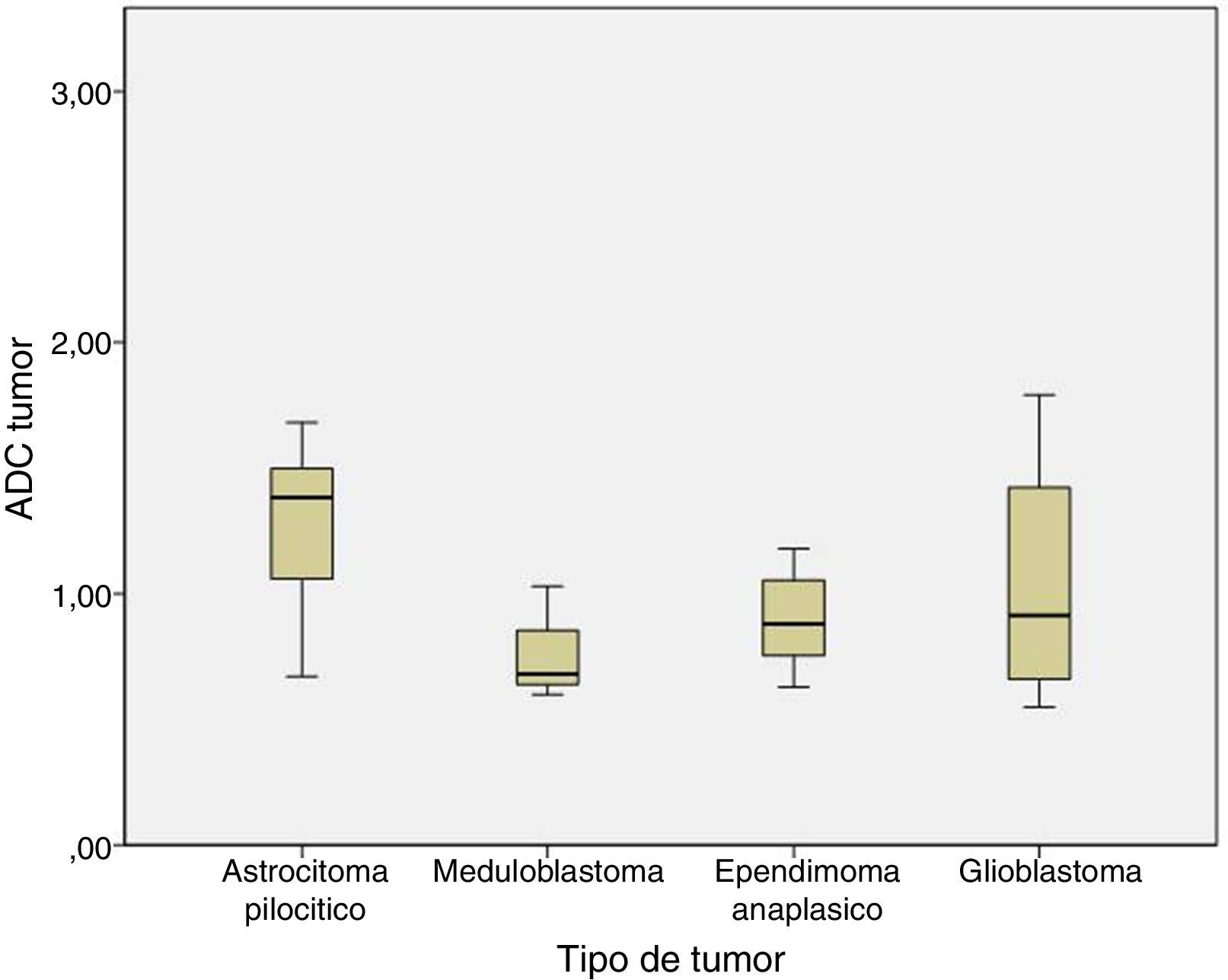
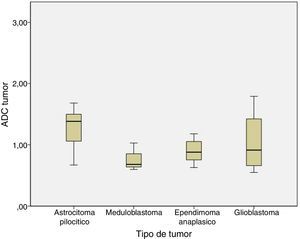
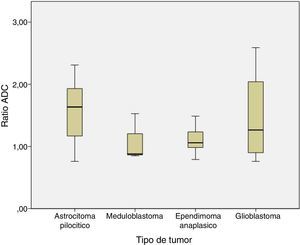
Al analizar las diferencias de ADC y ratio se realizó el análisis entre astrocitoma pilocítico, meduloblastoma, ependimoma anaplásico y glioblastoma. No se encontraron diferencias estadísticamente significativas entre los ADC y ratio de los distintos tipos histológicos. El ADC fue 1,29±0,31 en el astrocitoma pilocítico, 0,77±0,22 en el meduloblastoma, 0,9±0,21 en el ependimoma anaplásico, y 1,04±0,54 en el glioblastoma (p=0,1) (fig. 3).
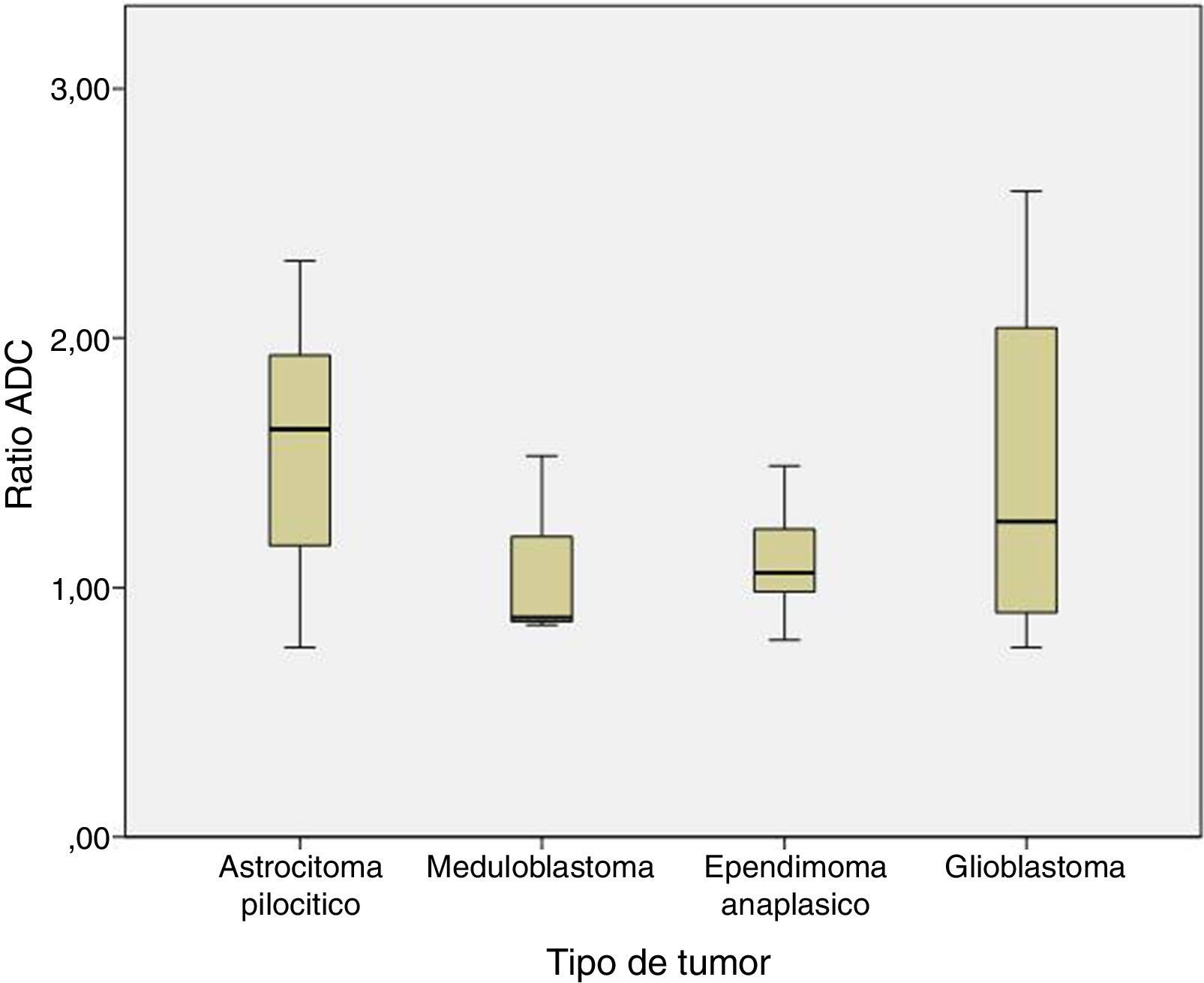
Lo mismo sucedió con el ratio ADC, que fue de 1,58±0,47 en el astrocitoma pilocítico, 1,08±0,38 en meduloblastoma, 1,11±0,22 en ependimoma anaplásico y 1,47±0,8×10−3mm2/s en el glioblastoma (p=0,2) (fig. 4).
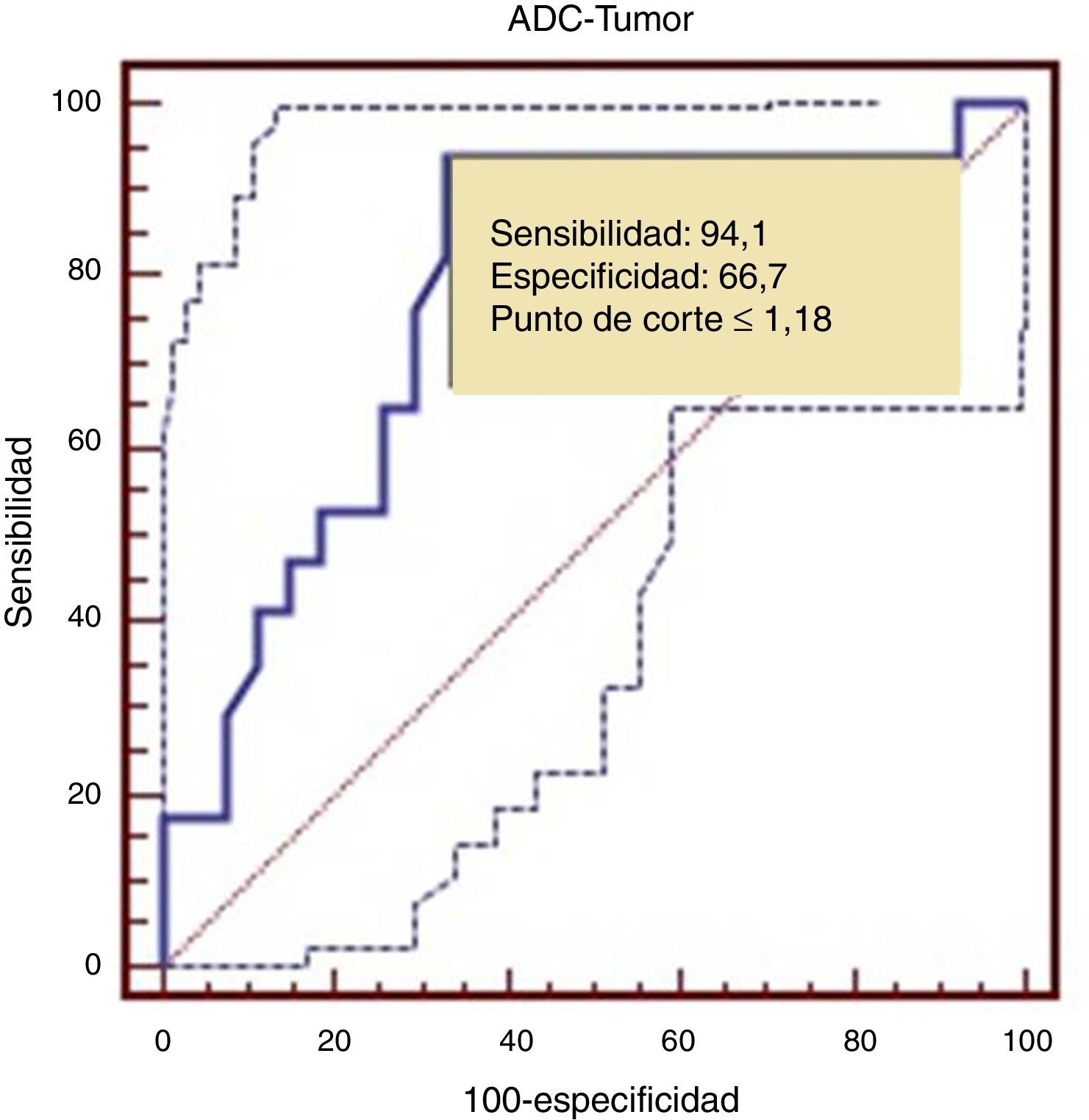
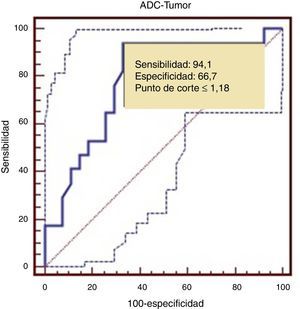
Para establecer un punto de corte entre tumores de BG y AG realizamos una curva Receiver Operating Characteristic (ROC) que determinó un punto de corte de 1,18, con una sensibilidad del 94,1% y una especificidad del 66,7%, con un área bajo la curva de 0,782 (fig. 5).
DiscusiónLa técnica de imagen potenciada en difusión es una técnica de RM que mide el movimiento browniano o libre de los protones, fundamentalmente de los que componen las moléculas de agua en los tejidos. La difusión de las moléculas de agua depende de la estructura microscópica de los tejidos. Las moléculas de agua tienen peor difusión cuanta mayor sea la densidad celular, menor el espacio extracelular y mayor sea la relación núcleo-citoplasma de las células. Así, en SNC, la máxima difusión se produce en el líquido cefalorraquídeo. El brillo en difusión es distinto en sustancia blanca que en sustancia gris porque la estructura de ambos tejidos es diferente.
Sin embargo, no todo lo que brilla en la secuencia de difusión se debe a la difusión de las moléculas de agua, sino que existe un efecto del tiempo de relajación en T2 que se superpone a la difusión. Para disminuir este efecto y cuantificar la difusión de las moléculas de agua se crea mediante un software específico un mapa ADC, que además de paliar el efecto T2, permite determinar la magnitud de la difusión.
Se ha visto que en los tumores cerebrales existe mayor restricción a la difusión en aquellos que presentan mayor celularidad10. Los tumores cerebrales de AG, habitualmente, se caracterizan por mayor celularidad y mayor área nuclear que los tumores de BG.
Se ha descrito en diversos artículos previos la relación inversa entre el ADC y el grado tumoral, así como entre los diferentes tipos histológicos. Sin embargo, los resultados publicados hasta la fecha son controvertidos11–14.
En nuestra serie, tanto el ADC como el ratio, igual que en otras series, permiten diferenciar el grado tumoral, siendo ambos superiores en los tumores de BG que en los de AG. Esto sugiere que los mapas de ADC pueden incorporarse al estudio por imagen previo a la cirugía, ya que orientan hacia el grado tumoral, y por tanto, pueden servir en la planificación de la cirugía, dada la importancia de la amplitud de la resección en este tipo de patología, ya que en muchos de estos tumores, sobre todo en los de AG, la supervivencia está muy influenciada por la presencia de resto tumoral. La sospecha prequirúrgica de un tumor de AG podría orientar al equipo neuroquirúrgico a planificar una cirugía más agresiva si la sospecha es de un tumor de AG, complementando así a la biopsia intraoperatoria.
En lo referente a la diferenciación por tipo histológico, en nuestra serie, aunque los valores de meduloblastoma son inferiores a los de astrocitoma pilocítico y a otros tumores de AG con menor celularidad, las diferencias no son estadísticamente significativas. Esto puede ser en parte por la escasa muestra (solo 3 pacientes fueron diagnosticados de meduloblastoma), como a diferencias metodológicas con otros estudios.
En nuestra muestra existe solapamiento en los valores de ADC y ratio de los 4 tipos histológicos analizados. La mayoría de los autores han encontrado diferencias entre el astrocitoma pilocítico y el meduloblastoma5,12, estableciendo un punto de corte con una especificidad del 100%. En el resto de tumores existe con mayor frecuencia solapamiento14. En nuestra serie existe solapamiento en los valores de ADC entre astrocitoma pilocítico y meduloblastoma. Los valores más bajos de ADC en los astrocitomas pilocíticos son en pacientes con gliomas ópticos, que se ha visto que tienen mayor celularidad y una estructura más compacta15 que los gliomas de BG de otras localizaciones, y un caso de astrocitoma pilocítico con diseminación leptomeníngea (mayor celularidad o agresividad). Entre los meduloblastomas, el valor de ADC que se superpone al de otros tipos histológicos es de 1,08 y corresponde a un meduloblastoma del subtipo de nodularidad extensa. En los meduloblastomas se ha visto que no todos restringen a la difusión sino que depende, además del grado de celularidad, de la cantidad de reticulina que presenta cada subtipo histológico, siendo menor el ADC en el desmoplásico/nodular que en el de nodularidad extensa, ya que el primero restringe más en difusión16,17.
Otras causas posibles para el solapamiento están en relación con la localización del tumor. En los estudios en los que consiguen una especificidad del 100% para diferenciar entre astrocitoma pilocítico y meduloblastoma/PNET suelen limitarse a la fosa posterior, mientras que en nuestro estudio se incluyen los pacientes con tumores tanto infra como supratentoriales.
La metodología podría también explicar diferencias con otros autores. Así, en nuestro trabajo el ROI se establece en la región que más restringe la difusión en la zona sólida del tumor, excluyendo las zonas artefactadas. En otros estudios se ha elegido la zona que capta contraste dentro de la parte sólida18. En nuestro estudio se utilizó un único ROI porque se ha demostrado que no existen diferencias entre utilizar un ROI o la media de 3 ROI19. Por último, los valores de ADC en el cerebro sano en desarrollo disminuyen con la edad12, lo que hace que se prefiera el ADC al ratio en la práctica clínica habitual a la hora de valorar los tumores cerebrales, dejando el ratio ADC para comparaciones en estudios multicéntricos18.
El uso del ADC y del ratio se aplican en el momento prequirúrgico, como en nuestro estudio, ya que los cambios posquirúrgicos pueden alterar la señal de difusión, por tanto no es útil en el diagnóstico de resto tumoral o recidiva precoz20. Sin embargo, sí podría ser útil en el diagnóstico de la enfermedad metastásica o la progresión tumoral en meduloblastoma21.
Nuestros datos sugieren que la utilización del ADC es una herramienta muy útil en el diagnóstico prequirúrgico de los tumores cerebrales y un apoyo importante en el diagnóstico por imagen de RM, aunque no sustituye al diagnóstico histopatológico. Hacen falta más estudios para valorar el alcance real de esta metodología por otra parte, rápida y asequible a todos los equipos de RM disponibles hoy en día.
Conflicto de interesesEl trabajo «Evaluación de la utilidad del Coeficiente de Difusión Aparente (ADC) en Resonancia Magnética para la diferenciación del grado tumoral de los tumores cerebrales pediátricos» no ha recibido financiación.
El trabajo «Evaluación de la utilidad del Coeficiente de Difusión Aparente (ADC) en Resonancia Magnética para la diferenciación del grado tumoral de los tumores cerebrales pediátricos» fue presentado en el VII Congreso de la Sociedad Española de Hematología y Oncología Pediátricas (22-24 mayo 2014), recibiendo el premio a la mejor comunicación oral