La comorbilidad psiquiátrica es común en epilepsia, de ahí la importancia de considerar en qué medida los fármacos antiepilépticos pueden influir en el estado de ánimo. El objetivo de este trabajo es analizar el efecto de lacosamida en la calidad de vida y en la conducta del paciente epiléptico en la práctica clínica.
MétodosEstudio multicéntrico, observacional y prospectivo en pacientes diagnosticados de epilepsia, mal controlados que recibieron tratamiento adyuvante con lacosamida. Mediante 4 visitas durante 12 meses se valoró el impacto del fármaco en la calidad de vida y el estado de ánimo utilizando el cuestionario de calidad de vida QOLIE-10, la escala hospitalaria de ansiedad y depresión (HADS) y la escala de impulsividad de Barratt (BIS-11), además se determinó su eficacia y seguridad.
ResultadosSe incluyeron 55 pacientes, edad media 47,1±18,4 años; porcentaje inicial de comorbilidad psiquiátrica 34,5% y número medio de crisis/mes previo 3,6±4,3. Las escalas QOLIE-10 y HADS reflejaron mejoras estadísticamente significativas en pacientes que partían de una situación basal desfavorable (ansiedad, depresión y/o baja calidad de vida). La escala BIS-11 no detectó la aparición de conductas impulsivas durante el seguimiento. Tras 12 meses de tratamiento el 51,9% de los pacientes estuvo sin crisis, y un 77,8% presentó una reducción≥50%. La mayoría de efectos adversos fueron leves, obligando a retirar el fármaco en 10 casos (18,2%).
ConclusionesLacosamida ofrece un perfil de eficacia y seguridad favorable, y podría constituir una opción terapéutica útil en pacientes con epilepsia y comorbilidad psiquiátrica.
Psychiatric comorbidities are common in epileptic patients, and evaluating the impact of antiepileptic drugs on patients’ moods is therefore essential. The aim of this study is to assess the effects of lacosamide on behaviour and quality of life in people with epilepsy.
MethodsWe conducted a multicentre prospective observational study of poorly-controlled epileptic patients who received lacosamide as an adjuvant treatment. Patients were evaluated on 4 occasions during a 12-month period. The impact of lacosamide on patients’ mood and quality of life was assessed with the Quality of Life in Epilepsy Inventory-10 (QOLIE-10), the Hospital Anxiety and Depression Scale (HADS), and the Barratt Impulsiveness Scale (BIS-11). As a secondary objective, we evaluated the effectiveness and safety of lacosamide.
ResultsWe included 55 patients with a mean age of 47.1±18.4 years. At baseline, 34.5% of the patients had psychiatric comorbidities; the mean number of crises in the previous month was 3.6±4.3. The QOLIE-10 and HADS scales revealed statistically significant improvements in patients with a poor baseline condition (anxiety, depression, and/or poor quality of life). The BIS-11 scale detected no impulsive behaviour during follow-up. After 12 months of treatment, 51.9% of the patients were seizure-free and 77.8% experienced a reduction of at least 50% in seizure frequency. Adverse effects were mild in most cases; lacosamide was discontinued in 10 patients (18.2%).
ConclusionsLacosamide is a safe and effective treatment option for patients with epilepsy and psychiatric comorbidities.
La epilepsia es una enfermedad crónica de gran impacto social. La tasa de prevalencia en España es 14,87 casos por 1.000 habitantes1, y su incidencia en el mundo oscila en 50 casos por 100.000 habitantes y año2. La estigmatización que conlleva, los efectos adversos (EA) de la medicación, la falta de previsibilidad de las crisis y sus consecuencias condicionan la calidad de vida de quienes la padecen. Los pacientes diagnosticados de epilepsia (PDE) tienen además un riesgo elevado de sufrir enfermedades psiquiátricas y un 20-40% padece alguna3, además no suelen expresar espontáneamente estos síntomas, por lo que es necesario disponer de escalas que permitan cuantificarlos y considerar en qué medida los fármacos antiepilépticos (FAE) pueden influir en ellos4.
La lacosamida (LCM) es un FAE de tercera generación utilizado como terapia añadida en epilepsia focal5. Desde el punto de vista conductual es un fármaco seguro en ensayos clínicos, sin embargo son necesarios estudios observacionales, próximos a la práctica clínica, con mayor flexibilidad de dosis y un período de seguimiento superior que permitan confirmar esta información4,6.
El objetivo principal de este trabajo es evaluar el efecto del tratamiento adyuvante con LCM sobre la calidad de vida y el estado de ánimo de los PDE, en condiciones de práctica clínica habitual, en una serie de hospitales de las provincias de Alicante y Murcia. Para ello utilizamos el cuestionario de calidad de vida QOLIE-107, la escala hospitalaria de ansiedad y depresión (HADS)8 y la escala de impulsividad de Barratt (BIS-11)9 con un seguimiento de 12 meses. Como objetivo secundario se analizó la eficacia y tolerabilidad del fármaco.
Pacientes y métodosEstudio multicéntrico, prospectivo, observacional, de un año de seguimiento en el que han participado 11 hospitales de las provincias de Alicante y Murcia: Hospital General de Alicante, Hospital General de Elche, Hospital Vega Baja de Orihuela, Hospital Virgen de la Salud de Elda, Hospital Marina Baja de Villajoyosa, Hospital IMED-Levante de Benidorm, Hospital de Denia-Marina Salud, Hospital Virgen de la Arrixaca de Murcia, Hospital Comarcal del Noroeste de Caravaca de la Cruz y el Hospital Los Arcos del Mar Menor. Se reclutaron entre los meses de febrero de 2013 y julio de 2014 pacientes mayores de 15 años con diagnóstico de epilepsia focal que estuviesen tomando al menos un FAE y precisaran modificarlo añadiendo LCM, de acuerdo con la práctica clínica de cada centro. En la visita basal se recogieron datos epidemiológicos: sexo, edad, comorbilidad, tipo de crisis10, localización de la epilepsia, etiología, tiempo de evolución, frecuencia de crisis/mes en el último año, FAE en el momento de la inclusión y posología, otros fármacos concomitantes, FAE previos y dosis inicial de LCM. En esta visita el paciente rellenó los cuestionarios QOLIE-10, HADS y BIS-11 en sus versiones validadas al castellano7–9. Los pacientes se revisaron a los 3, 6 y 12 meses y en estas visitas se administraron las mismas escalas y se recogió la dosis de LCM, número de crisis, EA y otros FAE que tomaran en ese momento. El estudio cumplió las normas éticas del comité de investigación y todos los pacientes dieron su consentimiento informado por escrito antes de iniciar LCM. El análisis estadístico se realizó con el programa SPSS 19.0, estableciéndose el nivel de significación en el 5%. Se realizó un estudio descriptivo de variables cualitativas y cuantitativas. Las cualitativas se analizaron mediante frecuencias absolutas y porcentajes; las cuantitativas a través de media y desviación estándar o mediana, percentiles 25 y 75 y número de casos válidos. Se utilizó el procedimiento last observation carried forward para el tratamiento de datos no existentes. La evolución de la calidad de vida y el estado de ánimo se estudió mediante el test de Friedman, y la comparación entre la situación inicial y final se analizó mediante el test de Wilcoxon. El análisis de eficacia se midió mediante «pacientes libres de crisis» y «respondedores» (reducción en número de crisis≥50%) y se estudió la evolución de las escalas QOLIE-10, HADS y BIS-11 en estos grupos con el test de Friedman y el test de Wilcoxon, comparándose entre ellos con el test de Mann-Whitney. Se identificaron los EA indicando su porcentaje de aparición y frecuencia mediante tablas y se estudió la evolución de la calidad de vida y el estado de ánimo en función de la presencia de EA mediante el test de Friedman y el test de Wilcoxon, comparándose los grupos mediante el test de Mann-Whitney.
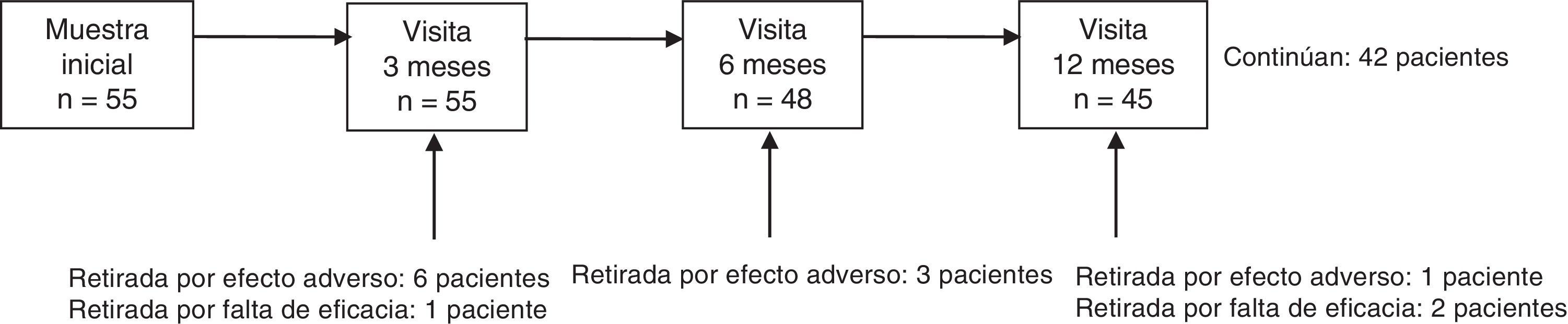
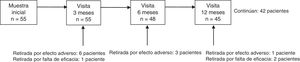
ResultadosSe incluyeron 55 pacientes, edad media 47,1±18,4 años, 53,1% varones. La duración media de la enfermedad fue 16,1±13,8 años, y hasta un 69,1% presentaba otras comorbilidades, siendo la enfermedad psiquiátrica la más prevalente (34,5%). La etiología más habitual de la epilepsia fue sintomática (55,8%), seguida de criptogénica (25%) e idiopática (19,2%). El motivo más frecuente de inclusión fue el mal control de las crisis (75%). El número medio de crisis/mes en los 12 meses previos a iniciar LCM fue 3,6±4,3 crisis (mediana: 2). El número medio de FAE antes de comenzar LCM fue 3,1±2 FAE (mediana: 3). Al inicio del tratamiento el 49,1% de los pacientes utilizaba un FAE, siendo los más habituales levetiracetam (38,2%) y valproato (30,9%), además un 40% tomaba al menos un FAE bloqueante del canal de sodio (tabla 1). La dosis de LCM no varió significativamente a lo largo del seguimiento, siendo a los 12 meses 267,7±94,8mg (rango: 100-400mg). Al finalizar el estudio continuaban con LCM 42 pacientes (76,4%) y se había retirado en 13, 10 de ellos por EA (18,2%) y 3 por falta de eficacia (5,5%). La tasa de retención a los 12 meses fue de 81,8% (IC 95%: 70,7-92,2%). La disposición de los pacientes durante el periodo de estudio se muestra en la figura 1.
Variables clínicas y demográficas de la muestra
| Sexo (varones) | 53,1% |
| Edad media (años) | 47,1±18,4 |
| Tiempo de evolución de la epilepsia (años) | 16,1±13,8 |
| Comorbilidad | |
| Ausente | 30,9% |
| Psiquiátrica | 34,5% |
| Renal, hepática, endocrina | 16,4% |
| Cardiovascular | 14,5% |
| Retraso psicomotor | 3,6% |
| Otras | 21,8% |
| Etiología | |
| Criptogénica | 25% |
| Idiopática | 19,2% |
| Sintomática | 55,8% |
| Vascular | 17,3% |
| EMT | 7,7% |
| Tumoral | 7,7% |
| Infecciosa | 5,8% |
| Traumática | 5,8% |
| MDC | 3,8% |
| Autoinmune | 1,9% |
| Otros | 5,8% |
| Localización | |
| Temporal | 43,1% |
| Frontal | 17,6% |
| Occipital | 7,8% |
| Parietal | 7,8% |
| Generalizada | 9,8% |
| Indeterminada | 13,7% |
| Frecuencia media de crisis al mes | 3,6±4,3 |
| Número de FAE previos | 3,1±2,0 |
| Número medio de FAE al inicio | 1,4±0,9 |
EMT: esclerosis temporomesial; FAE: fármacos antiepilépticos; MDC: malformación del desarrollo cortical.
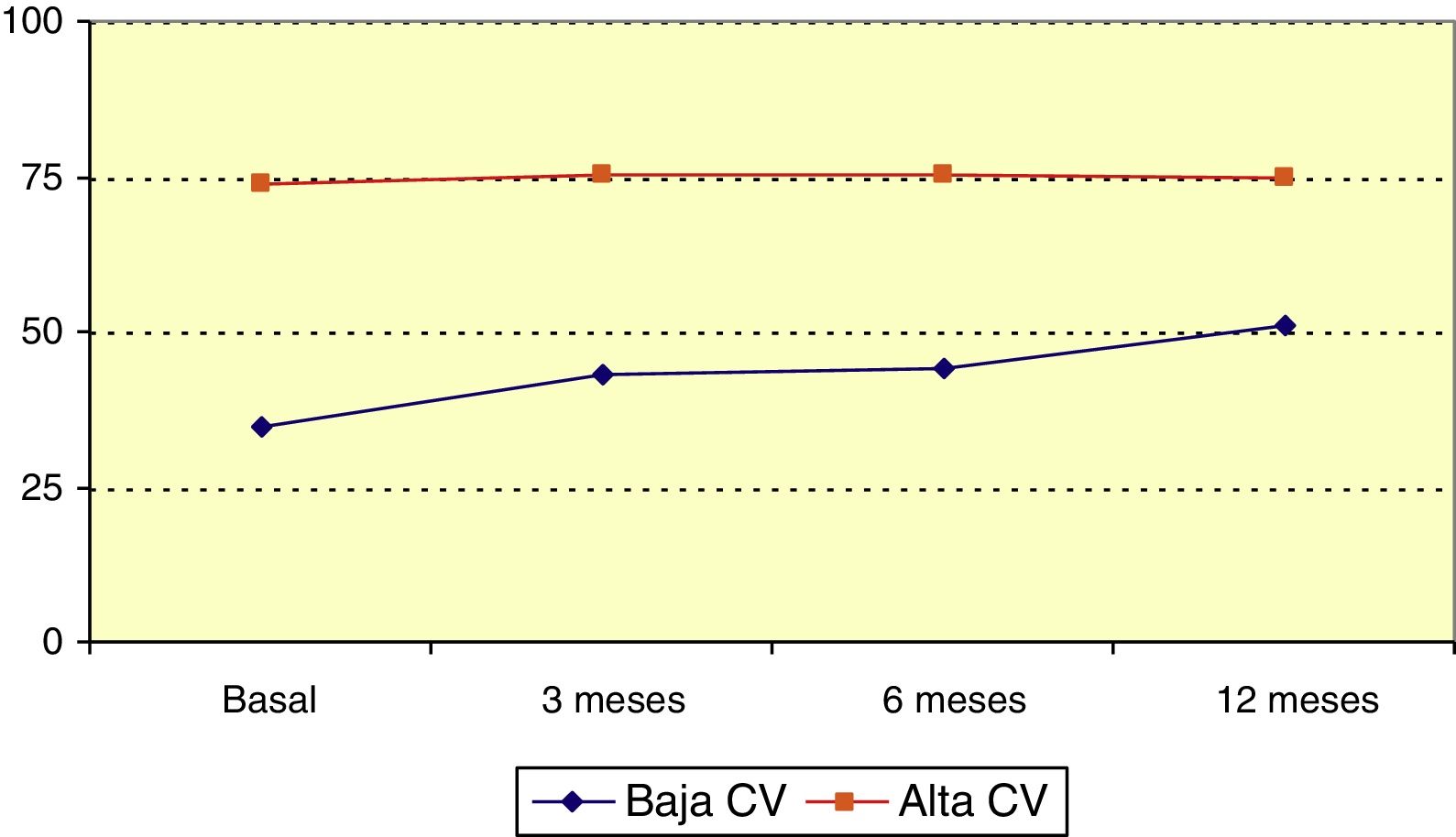
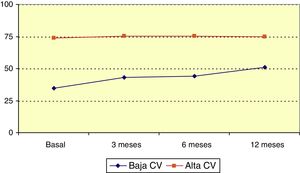
La puntuación media en la escala QOLIE-10 antes de iniciar LCM era 60,3 puntos (mediana 65). Esta puntuación ascendió a lo largo del periodo de observación (p=0,023; test de Friedman), y respecto a la situación basal esta variación fue estadísticamente significativa (p<0,001; test de Wilcoxon). El rango de la escala QOLIE-10 se recodificó formando 2 grupos: 0-50, «baja calidad de vida» y 51-100, «buena calidad de vida». El 34,5% de los pacientes presentaba «baja calidad de vida» antes de iniciar LCM, y en este grupo la puntuación de la escala QOLIE-10 aumentó significativamente a lo largo del seguimiento (p=0,021; test de Friedman) como se refleja en la figura 2.
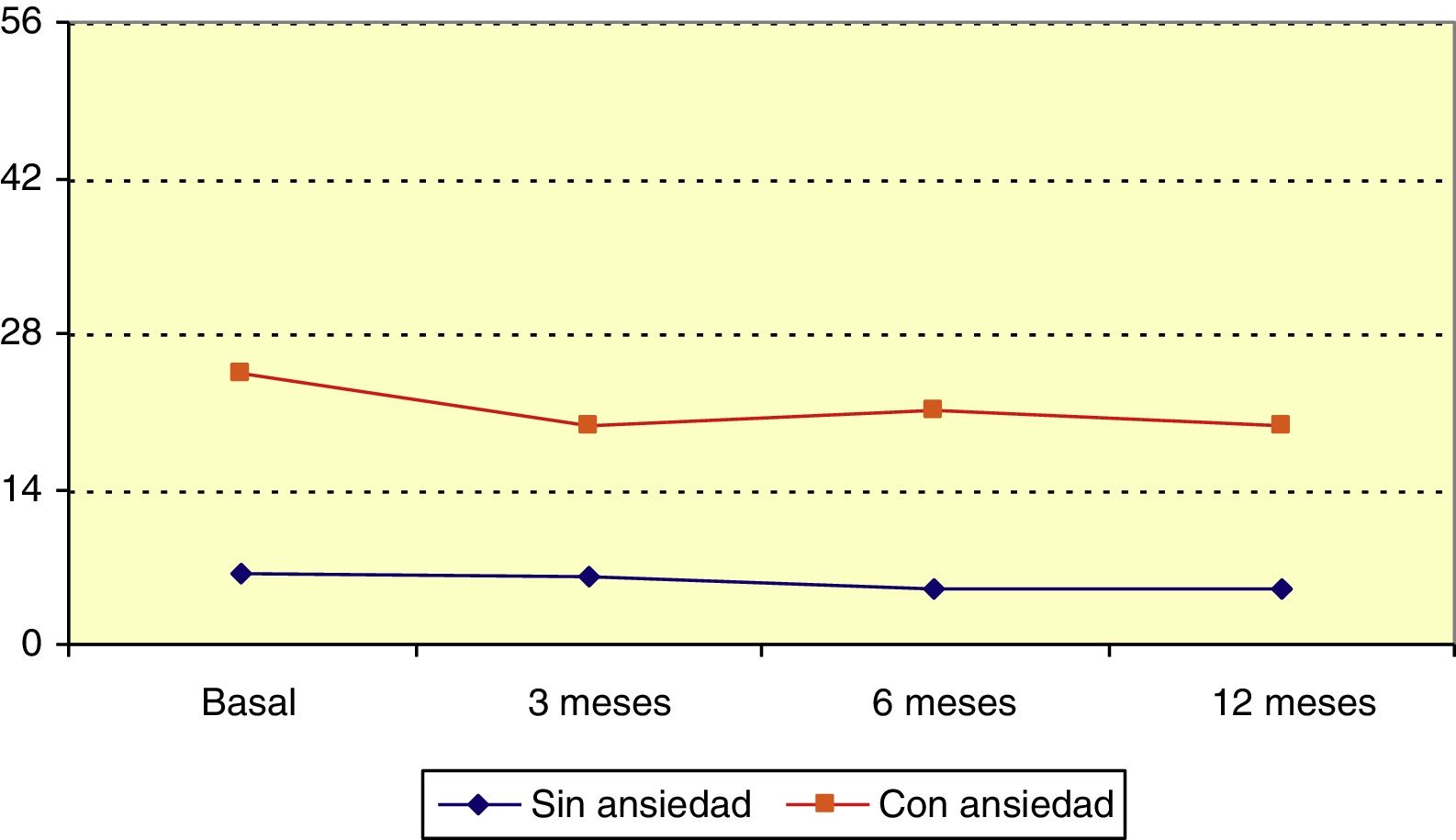
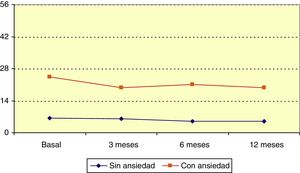
Hospital Anxiety and Depression Scale: ansiedadLa puntuación media en la escala HADS de ansiedad antes de iniciar LCM era 12,3 puntos (mediana 9). Esta puntuación descendió significativamente durante el periodo de observación (p=0,006; test de Friedman), y respecto a la situación basal esta variación fue estadísticamente significativa a los 3 (p=0,045; test de Wilcoxon), 6 (p=0,014; test de Wilcoxon) y 12 meses (p=0,020; test de Wilcoxon). Recodificamos la escala HADS de ansiedad formando los grupos: 0-7, normalidad; 8-10, probable ansiedad y 11-21, ansiedad. El 32,7% de los pacientes tenía ansiedad antes de iniciar el estudio. El grupo «con ansiedad» redujo significativamente la puntuación en esta escala a lo largo del periodo de observación (p=0,045; test de Friedman) como se observa en la figura 3.
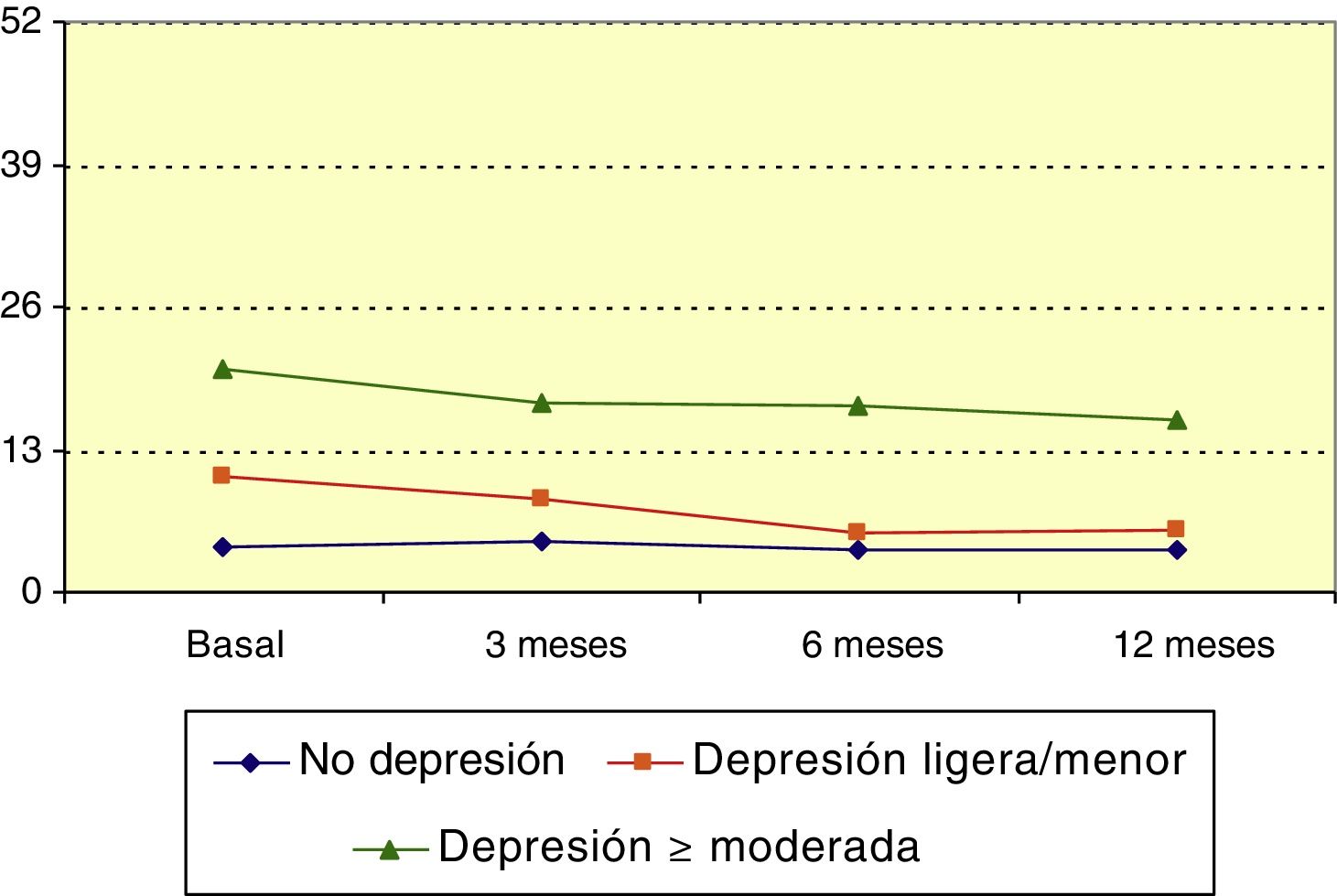
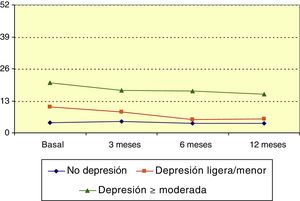
Hospital Anxiety and Depression Scale: depresiónLa puntuación media en la escala HADS de depresión antes de iniciar LCM era 9,1 puntos (mediana 7). Esta puntuación descendió significativamente a lo largo del periodo de observación (p<0,001; test de Friedman), y respecto a la situación basal esta variación fue estadísticamente significativa a los 3 (p=0,023; test de Wilcoxon), 6 (p<0,001; test de Wilcoxon) y 12 meses (p<0,001; test de Wilcoxon). Se recodificó la puntuación de la escala formando los grupos: 0-7 no depresión; 8-13 depresión ligera y ≥14 depresión moderada a muy severa. En el grupo de «depresión ligera» y en el de «depresión moderada a muy severa», la puntuación descendió de forma significativa (con valores de p<0.01 y p=0.031, respectivamente, según test de Friedman), como refleja la figura 4.
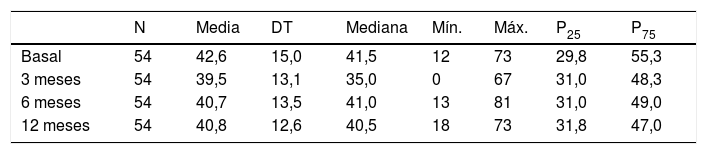
Barratt Impulsiveness Scale-11: impulsividadLa puntuación en la escala BIS-11 no varió significativamente durante el periodo de observación (p=0,303; test de Friedman) como se muestra en la tabla 2.
Puntuación de la escala de impulsividad (BIS-11) a lo largo del periodo de observación
| N | Media | DT | Mediana | Mín. | Máx. | P25 | P75 | |
|---|---|---|---|---|---|---|---|---|
| Basal | 54 | 42,6 | 15,0 | 41,5 | 12 | 73 | 29,8 | 55,3 |
| 3 meses | 54 | 39,5 | 13,1 | 35,0 | 0 | 67 | 31,0 | 48,3 |
| 6 meses | 54 | 40,7 | 13,5 | 41,0 | 13 | 81 | 31,0 | 49,0 |
| 12 meses | 54 | 40,8 | 12,6 | 40,5 | 18 | 73 | 31,8 | 47,0 |
DT: desviación estándar
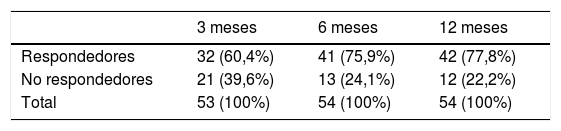
La eficacia se estudió mediante el porcentaje de pacientes «libres de crisis» y «respondedores» (mejoría ≥50% en el número de crisis). El porcentaje de pacientes «libres de crisis» se incrementó a lo largo del seguimiento, de tal manera que a los 3 meses el 32,1% de los pacientes no tenía crisis (IC 95%: 18,6-45,6%); a los 6 meses, el 48,1% no las presentaba (IC 95%: 33,9-62,4%) y a los 12 meses el 51,9% se encontraba sin crisis (IC 95%: 37,6-66,1%). En el grupo de pacientes «libres de crisis» mejoraron significativamente las puntuaciones en las escalas QOLIE-10 (p=0,016; test de Friedman), HADS de ansiedad y depresión (p<0,001; test de Friedman) y BIS-11 (p=0,002; test de Friedman).
En relación con los respondedores el 60,4% de los pacientes lo fueron a los 3 meses del inicio del tratamiento (IC 95%: 46,3-74,5%); a los 6, el 75,9% (IC 95%: 63,6-88,3%) y a los 12 meses el 77,8% de los pacientes (IC 95: 65,8-78,8%), como se puede ver en la tabla 3. En el grupo de «respondedores» mejoraron significativamente las escalas QOLIE-10 (p=0,004; test de Friedman), HADS de ansiedad (p=0,002; test de Friedman) y HADS de depresión (p<0,001; test de Friedman). La puntuación en la escala BIS-11 no varió significativamente (p=0,102; test de Friedman).
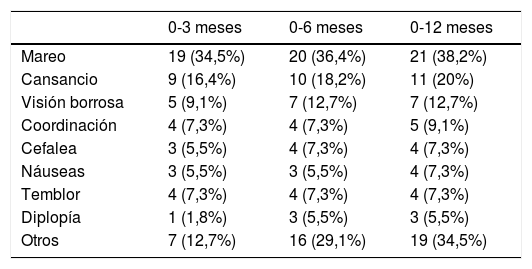
En la tabla 4 se recogen los EA más comunes, siendo el más frecuente mareo (38,2%), seguido de cansancio (20,0%) y visión borrosa (12,7%). La mayoría fueron leves y obligaron a retirar el fármaco en 10 casos (18,2%). No existieron variaciones significativas en las escalas evaluadas para los pacientes con EA.
Clasificación de efectos adversos durante el seguimiento
| 0-3 meses | 0-6 meses | 0-12 meses | |
|---|---|---|---|
| Mareo | 19 (34,5%) | 20 (36,4%) | 21 (38,2%) |
| Cansancio | 9 (16,4%) | 10 (18,2%) | 11 (20%) |
| Visión borrosa | 5 (9,1%) | 7 (12,7%) | 7 (12,7%) |
| Coordinación | 4 (7,3%) | 4 (7,3%) | 5 (9,1%) |
| Cefalea | 3 (5,5%) | 4 (7,3%) | 4 (7,3%) |
| Náuseas | 3 (5,5%) | 3 (5,5%) | 4 (7,3%) |
| Temblor | 4 (7,3%) | 4 (7,3%) | 4 (7,3%) |
| Diplopía | 1 (1,8%) | 3 (5,5%) | 3 (5,5%) |
| Otros | 7 (12,7%) | 16 (29,1%) | 19 (34,5%) |
En los últimos años ha aumentado el conocimiento acerca de los trastornos psicoafectivos asociados a la epilepsia, sin embargo es difícil demostrar la existencia de una relación causal entre el uso de un FAE y su repercusión en el estado de ánimo y la calidad de vida3,4,11. El gran problema a la hora de valorar el efecto de los FAE sobre la conducta es el hecho de que la mayoría de las investigaciones realizadas parten de poblaciones diversas, que utilizan politerapia, gran variabilidad de posologías, con duración del tratamiento variable y en ausencia de un seguimiento prolongado4.
El estudio LAM analiza de forma prospectiva el impacto sobre el estado de ánimo y la calidad de vida del uso de LCM en una muestra de 55 pacientes seguidos a largo plazo en condiciones de práctica clínica habitual. Para ello hemos utilizado escalas de uso cotidiano y validadas al castellano que nos permiten orientar de una manera objetiva la sintomatología del paciente. El cuestionario QOLIE-10 mide con fiabilidad la calidad de vida en relación con la salud en PDE7, la escala autoadministrable HADS posee una elevada validez y fiabilidad para detectar trastornos ansioso-depresivos8 y la escala BIS-11 permite determinar la presencia de un patrón de conducta impulsiva a largo plazo9. Nuestros pacientes presentaron una mejoría destacable en la mayoría de estas escalas durante el seguimiento, especialmente aquellos que partían de una posición de bienestar basal más desfavorable y una mayor alteración en su estado emocional, hecho que parece correlacionarse con el control de crisis. En este contexto debemos considerar el elevado porcentaje de pacientes en monoterapia con levetiracetam y valproato al inicio del estudio, ambos fármacos con un amplio espectro de acción, utilizados en epilepsias focales y generalizadas, eficaces en varios tipos de crisis y con efectos psicoafectivos conocidos4. Nuestros resultados sugieren que la terapia coadyuvante con LCM podría contrarrestar el perfil de efectos adversos de levetiracetam y potenciar a su vez las propiedades de valproato como estabilizador del ánimo. Tradicionalmente, el tratamiento con FAE se ha orientado a conseguir reducir las crisis, quedando los trastornos del estado de ánimo al margen de la consideración terapéutica. Sin embargo, esta tendencia está cambiando, se buscan fármacos eficaces que además tengan una influencia positiva, o al menos que no contribuyan a agravar los trastornos comórbidos conductuales asociados a la enfermedad4,11. La LCM como terapia añadida ha presentado un perfil favorable en distintos estudios, siendo sus EA en la esfera cognitiva inferiores a topiramato y similares a lamotrigina12, además se perfila como un fármaco seguro en PDE con trastornos del estado de ánimo13 e incluso podría tener una influencia positiva, mejorando la sintomatología depresiva por sus propiedades ansiolíticas14. Nuestro estudio estaría acorde con estas tendencias, ya que no existió deterioro de la situación anímica de los pacientes, por ejemplo un agravamiento de las situaciones previas de ansiedad o depresión o la aparición de reacciones paradójicas estimulantes como impulsividad, teniendo en cuenta, además, que el 34,5% de los pacientes padecía una enfermedad psiquiátrica antes de iniciar LCM.
Otro aspecto del estudio LAM es el elevado porcentaje de pacientes libre de crisis (51,9%), siendo el 77,8% respondedores, con una adhesión al tratamiento del 81,8%. Este elevado porcentaje de respondedores podría atribuirse a una población de PDE menos refractarios que en otros estudios. El 36,9% de nuestros pacientes había utilizado previamente uno o 2 FAE, y el número medio de crisis al mes, previo al inicio de LCM, fue 3,6±4,3 (mediana 2), muy similar al de los estudios GALACO15, REALLY16 y VITOBA17, pero por debajo de las 18,7 crisis del estudio RELACOVA18 o las 10,5 crisis del LACO-EXP19. No obstante, nuestra muestra incluyó pacientes con epilepsia muy refractaria (10,9% sin respuesta a 6 FAE), por lo que los resultados en términos de eficacia y ausencia de crisis son destacados. Además, LCM mostró un buen perfil de seguridad. Los EA en nuestro grupo fueron leves y similares a otros estudios publicados11,15–19. Entre las posibles limitaciones del estudio LAM se encuentra su diseño. Se trata de un estudio observacional prospectivo, donde los investigadores no son ciegos durante la evaluación y no existe un grupo control, circunstancia que podría introducir sesgos11,15.
En resumen, el estudio LAM documenta el efecto positivo de LCM sobre los trastornos comórbidos conductuales en epilepsia, mejorando la calidad de vida y la sintomatología ansioso-depresiva, en especial en aquellos pacientes que parten de una situación desfavorable y con un buen perfil de eficacia y tolerabilidad. En la práctica clínica cotidiana no se trata únicamente de que un FAE controle las crisis, sino que necesitamos de intervenciones terapéuticas que abarquen una visión más amplia y marquen una diferencia significativa, garantizando una adecuada mejora de la calidad de vida del paciente epiléptico.
Conflicto de interesesLos autores de este artículo declaran que no existe conflicto de intereses para la elaboración de este trabajo.
A Patricia Santagueda, Laura Betancourt y Vanessa Llorca por su ayuda técnica en la elaboración de este estudio.