La encefalopatía difusa es un motivo común de interconsulta hospitalaria a Neurología, siendo su etiología y severidad muy variables, por lo que exige una correcta aproximación diagnóstica junto un adecuado manejo para alcanzar su resolución1.
La encefalopatía hiperamoniémica es una causa de encefalopatía en el ámbito hospitalario, asociada a diversos escenarios clínicos, siendo uno de los más frecuentes la insuficiencia hepática secundaria a cirrosis. Las causas no hepáticas de la hiperamoniemia en adultos son medicamentos como el ácido valproico o fármacos quimioterápicos, infecciones por gérmenes productores de ureasa, cirugías recientes como uretero-sigmoidoscopia o cirugía bariátrica, shunt porto-cava, elevado aporte proteico vía parenteral o incluso errores congénitos del metabolismo de inicio en el adulto, como son el déficit de ornitin transcarbamilasa y carbamil fosfato sintetasa i2,3.
En pacientes con mieloma múltiple, son comunes la encefalopatía por uremia elevada, hipercalcemia e hiperviscosidad, siendo muy infrecuente la hiperamoniémica, que tiene una elevada mortalidad y requiere un alto índice de sospecha e instauración de tratamiento quimioterápico precoz4,5.
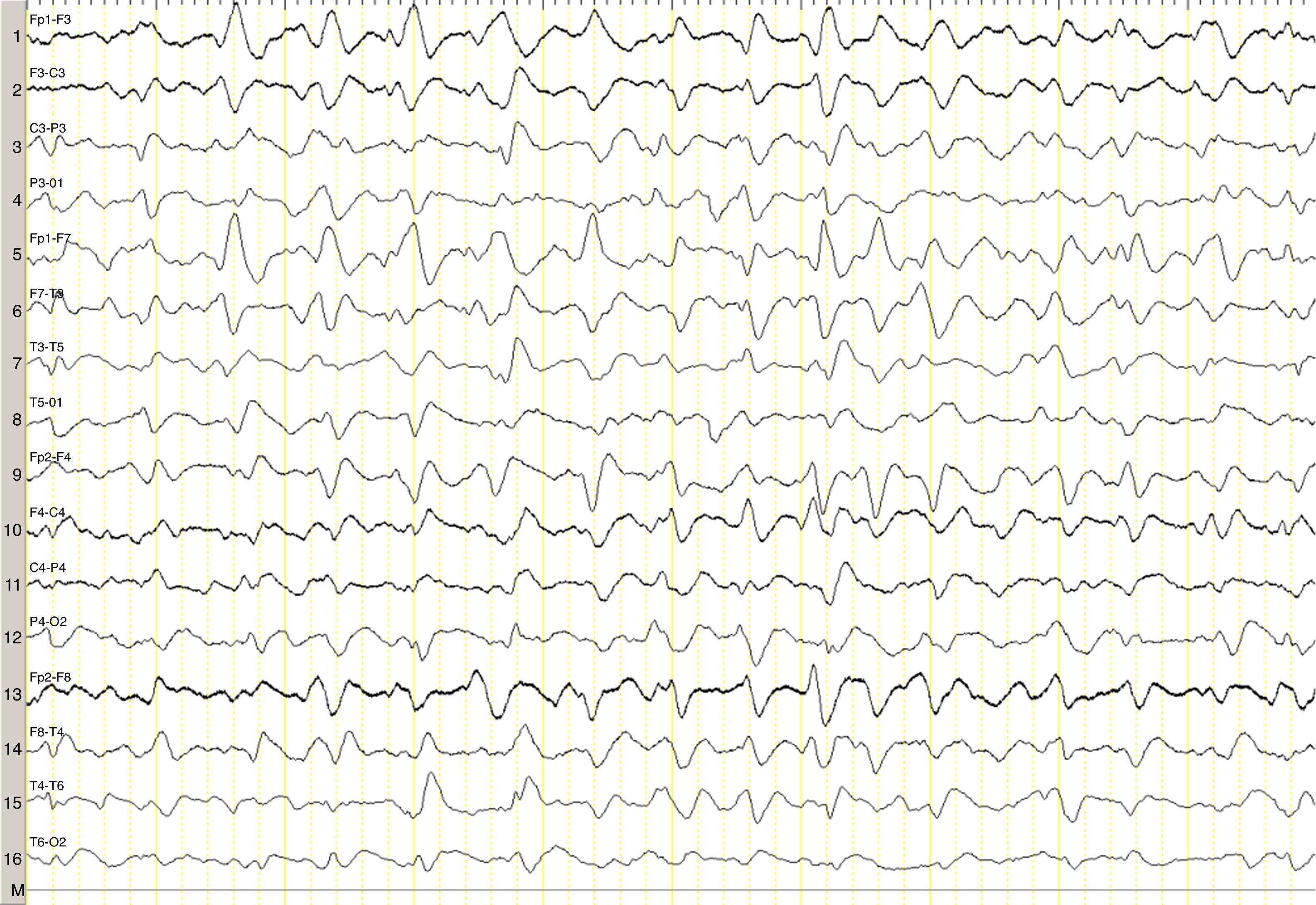
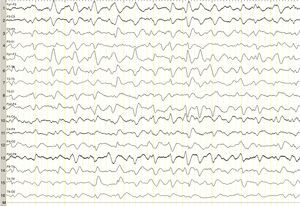
Describimos el caso de una mujer de 82 años con mieloma múltiple en estadio avanzado con hipergammaglobulinemia IgG lambda, de 2 años de evolución, que se encontraba en el quinto ciclo de tratamiento quimioterápico con lenalidomida y dexametasona, tras primera línea fallida de tratamiento con melfalán, prednisona y bortezomib. Comenzó con un cuadro clínico de un mes y medio de evolución consistente en irritabilidad, desorientación y disminución del apetito, así como somnolencia, motivo por el que fue ingresada en hematología. Fue valorada de urgencia por Neurología por estupor, sin clínica neurológica focal asociada, encontrándose afebril, sin otro hallazgo relevante a la exploración. El perfil hepático, la coagulación, la creatinina, la urea, el calcio y las proteínas totales resultaron normales. Presentaba una anemia normocítica normocrómica. Tomografía computarizada craneal, normal. El EEG urgente mostró un enlentecimiento generalizado y no reactivo de la actividad de fondo, con ondas agudas trifásicas de distribución generalizada, presentes durante todo el registro (fig. 1). Ante los hallazgos del EEG, se solicitó una determinación de amonio, constatándose niveles muy elevados (151μmol/l [valor de referencia 11-51μmol/l]). Se instauraron medidas antiencefalopatía, pero se desestimaron nuevas líneas de tratamiento quimioterápico por decisión de la familia de la paciente, falleciendo en el mes siguiente al diagnóstico.
El amonio, producto tóxico de degradación de las proteínas, se incorpora al ciclo de la urea en hígado, eliminándose por vía renal. Si incrementa, difunde pasivamente a través de la barrera hematoencefálica, ejerciendo un efecto neurotóxico. Se incorpora en los astrocitos formándose glutamina, produciendo edema celular, alterando la regulación del flujo sanguíneo córtico-subcortical y conduciendo al edema cerebral si la instauración es aguda6-8. Estos cambios biológicos se traducen, desde el punto de vista clínico, en situaciones de alteración del nivel atención y de conciencia de diversa severidad. En los registros electroencefalográficos es común encontrar enlentecimiento difuso de la actividad cerebral, que ocasionalmente se acompaña de ondas trifásicas. La génesis de las ondas trifásicas parece deberse a una actividad anormal en los circuitos tálamo-corticales9,10, aunque estas no son específicas, se observan en diferentes cuadros clínicos11. En nuestro caso, su presencia en el contexto de una encefalopatía difusa fue orientativa para completar el estudio metabólico con una determinación de amonio.
La fisiopatología de la hiperamoniemia en el mieloma múltiple es incierta. Se indica la posibilidad de una leucemización que predisponga a producir hiperamoniemia12, invasión del hígado por células plasmáticas causando un shunt porto-sistémico13, o bien que el metabolismo y la degradación de las grandes cantidades de inmunoglobulinas incrementen el amonio, superándose el aclaramiento hepático normal, sobre todo en estadios avanzados de la enfermedad14.
El subtipo más frecuente de inmunoglobulina producida por el mieloma descrito en estos pacientes parece corresponder a la IgG, seguida estrechamente de la IgA4. En nuestro caso, se trataba de un subtipo IgG y un estadio avanzado de la enfermedad con niveles de amonio muy elevados (151μmol/l), datos acordes con los observados en las series de casos descritas en la literatura4,5.
El diagnóstico precoz es fundamental, puesto que el pronóstico de estos pacientes es desfavorable, pero sin tratamiento dirigido es ominoso4.
En el mayor estudio disponible hasta la fecha sobre pacientes con encefalopatía aguda y ondas trifásicas, la etiología no influía en el pronóstico, pero sí la falta de reactividad en la actividad de fondo, reflejando esta un peor pronóstico11, como en el caso que describimos, aunque no se incluyó a pacientes con hiperamoniemia secundaria a un mieloma. Por ello se desconoce el papel que el EEG pueda tener en este tipo de pacientes, pero en nuestro caso contribuyó a un estudio metabólico dirigido.
Por tanto, ante pacientes con encefalopatía difusa y mieloma múltiple, junto con un EEG que muestre ondas trifásicas generalizadas, indicamos que se tenga en consideración la hiperamoniemia de origen no hepático como posible factor responsable, puesto que conlleva una actitud terapéutica y pronóstica diferente.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
No.