La Frontotemporal Dementia Rating Scale (FTD-FRS) es una escala diseñada para facilitar la estadificación clínica y la evaluación de la progresión de pacientes con demencia frontotemporal (DFT).
ObjetivoRealizar un estudio multicéntrico de adaptación y validación al castellano de la FTD-FRS.
MetodologíaLa adaptación se realizó mediante 2 procesos de traducción y retrotraducción inglés-español español-inglés y se verificó con los autores originales. El proceso de validación se llevó a cabo en una muestra consecutiva de pacientes diagnosticados de DFT. Se evaluó la consistencia interna, se determinó la unidimensionalidad con el método Rasch, se analizaron la validez de constructo y la validez discriminante, y se calculó el grado de acuerdo entre la Clinical Dementia Rating scale y la FTD-FRS para los casos con DFT.
ResultadosSe incluyeron 60 pacientes con DFT. La puntuación media de la FTD-FRS fue de 12,1 puntos (DE=6,5; rango=2-25) mostrando diferencias intergrupos (F=120,3; gl=3; p<0,001). El α de Cronbach=0,897, el análisis de componentes principales de los residuos produjo un aceptable autovalor para 5 contrastes (1,6-2,7) y una varianza respecto al origen del 36,1%. La FTD-FRS correlacionó con el Mini-mental test (r=0,572; p<0,001) y capacidad funcional (DAD; r=0,790; p<0,001). La FTD-FRS correlacionó significativamente con la Clinical Dementia Rating scale (r=−0,641; p<0,001) pero se observó variabilidad entre la distribución de la gravedad, siendo valorados como más leves según la Clinical Dementia Rating scale que con la FTD-FRS (kappa=0,055).
ConclusionesEl estudio de traducción y validación al español mostró resultados de validez y unidimensionalidad (gravedad) satisfactorios para el uso de la FTD-FRS en el estudio de la gravedad en pacientes con DFT.
The Frontotemporal Dementia Rating Scale (FTD-FRS) is a tool designed to aid with clinical staging and assessment of the progression of frontotemporal dementia (FTD-FRS).
ObjectivePresent a multicentre adaptation and validation study of a Spanish version of the FRS.
MethodologyThe adapted version was created using 2 translation-back translation processes (English to Spanish, Spanish to English) and verified by the scale's original authors. We validated the adapted version in a sample of consecutive patients diagnosed with FTD. The procedure included evaluating internal consistency, testing unidimensionality with the Rasch model, analysing construct validity and discriminant validity, and calculating the degree of agreement between the Clinical Dementia Rating scale (CDR) and FTD-FRS for FTD cases.
ResultsThe study included 60 patients with DFT. The mean score on the FRS was 12.1 points (SD=6.5; range, 2-25) with inter-group differences (F=120.3; df=3; P<.001). Cronbach's alpha was 0.897 and principal component analysis of residuals delivered an acceptable eigenvalue for 5 contrasts (1.6-2.7) and 36.1% raw variance. FRS was correlated with the Mini-mental State Examination (r=0.572; P<.001) and functional capacity (DAD; r=0.790; P<.001). FTD-FRS also showed a significant correlation with CDR (r=−0.641; P<.001), but we did observe variability in the severity levels; cases appeared to be less severe according to the CDR than when measured with the FTD-FRS (kappa=0.055).
ConclusionsThis process of validating the Spanish translation of the FTD-FRS yielded satisfactory results for validity and unidimensionality (severity) in the assessment of patients with FTD.
La demencia frontotemporal (DFT) constituye el 5% de los casos de demencia diagnosticados por autopsia en los estudios de series de casos y se ha estimado una incidencia de 9,4 casos por 100.000 personas/año menores de 65 años, siendo la segunda demencia neurodegenerativa en frecuencia en sujetos en esta franja de edad1–6. Neuropatológicamente, el cerebro de los pacientes con DFT presenta atrofia frontal y temporal y agregados anormales de proteína en las neuronas y/o en la glía, englobándose en el término degeneración lobular frontotemporal7, si bien los hallazgos histopatológicos, bioquímicos o genéticos son heterogéneos. Clínicamente se caracteriza por un cambio progresivo en la personalidad y la conducta, alteración temprana del lenguaje y de las funciones ejecutivas con una preservación relativa de la memoria episódica y de las funciones visuoespaciales en los estadios iniciales1,2,8. Las manifestaciones clínicas, conductuales y cognitivas, aparecen de forma insidiosa y son progresivas, si bien el trastorno que predomina inicialmente varía dependiendo de la subárea afectada9,10.
El deterioro funcional es un criterio para el diagnóstico de DFT clínicamente probable. Sin embargo, la precoz alteración de la conducta y función ejecutiva, y sobre todo, la no predominancia de la alteración de la memoria, dificultan el uso de escalas e instrumentos ampliamente extendidos, como la Clinical Dementia Rating scale (CDR) o la escala Geriatric Deterioration Scale, para la evaluación de la gravedad de la enfermedad. Estas escalas fueron desarrolladas para la valoración de la gravedad en la enfermedad de Alzheimer (EA), que es el subtipo de demencia más prevalente, y su aplicación en los casos de DFT presenta problemas de validez1,2,11–14.
Clínicamente, respecto a los casos diagnosticados de EA, el tiempo medio entre el inicio de los síntomas y el diagnóstico en los pacientes con DFT es superior, y presentan un mayor consumo de psicofármacos (antipsicóticos y ansiolíticos) y de fármacos antidemencia (para los cuales no hay indicación)15–17. Por ello, disponer de instrumentos válidos de medida del estadio clínico o gravedad es fundamental para evaluar de forma estandarizada la progresión de los pacientes con DFT con una finalidad clínica o de investigación18.
En este sentido, Mioshi et al. desarrollaron y validaron una escala específica para determinar el estadio clínico y gravedad de la DFT: la Frontotemporal Dementia Rating Scale (FTD-FRS)19. Esta escala clasifica a los pacientes en 6 grados de gravedad (desde muy leve hasta profundo) a través de la frecuencia de ocurrencia (nunca, algunas veces, todo el tiempo) de 30 signos y síntomas seleccionados por su validez, unidimensionalidad, y buena fiabilidad interna en pacientes con DFT. En el estudio original la FTD-FRS presentó valores de consistencia interna α de Cronbach=0,93 y un coeficiente de correlación intra-clase de 0,994. La FTD-FRS ha demostrado ser útil para determinar el estadio y evaluar la progresión longitudinal de pacientes con DFT. El objetivo del presente trabajo fue adaptar y validar la versión en castellano de la FTD-FRS.
MetodologíaDiseñoEstudio transversal, analítico, multicéntrico.
Población de estudioPacientes diagnosticados de DFT en dispositivos de atención especializada.
MuestraMuestra de conveniencia de pacientes con DFT reclutados en los 3 centros participantes en el estudio: el Hospital Clínic de Barcelona, el Hospital San Jorge de Huesca y el Hospital Santa Caterina en Girona. El estudio fue aprobado por los respectivos comités éticos de investigación clínica y se incluyeron aquellos participantes que cumplían criterios de DFT probable o posible1,3, con presencia de un familiar/cuidador capaz de responder sobre el estado del paciente y que firmaran el consentimiento informado (tanto por parte de pacientes como de sus tutores legales en caso necesario o cuidadores). De forma complementaria se reclutó un grupo control formado por pacientes con diagnóstico clínico de EA20.
ProcedimientoEste estudio se compuso de 2 etapas, una primera destinada al proceso de traducción y adaptación de la escala al castellano, y una segunda etapa de validación clínica del instrumento. El proceso de adaptación se realizó siguiendo los estándares de doble traducción y retrotraducción21.
El protocolo de validación incluía, además de la versión final consensuada de la FTD-FRS en castellano, datos sociodemográficos de los pacientes y de los cuidadores, y datos clínicos como el tiempo de evolución de los síntomas/diagnóstico, la función cognitiva, la capacidad funcional, la frecuencia y gravedad de los síntomas psicológicos y conductuales y la gravedad de la demencia.
Instrumentos- •
Gravedad de la demencia: Se utilizaron 2 escalas:
- ∘
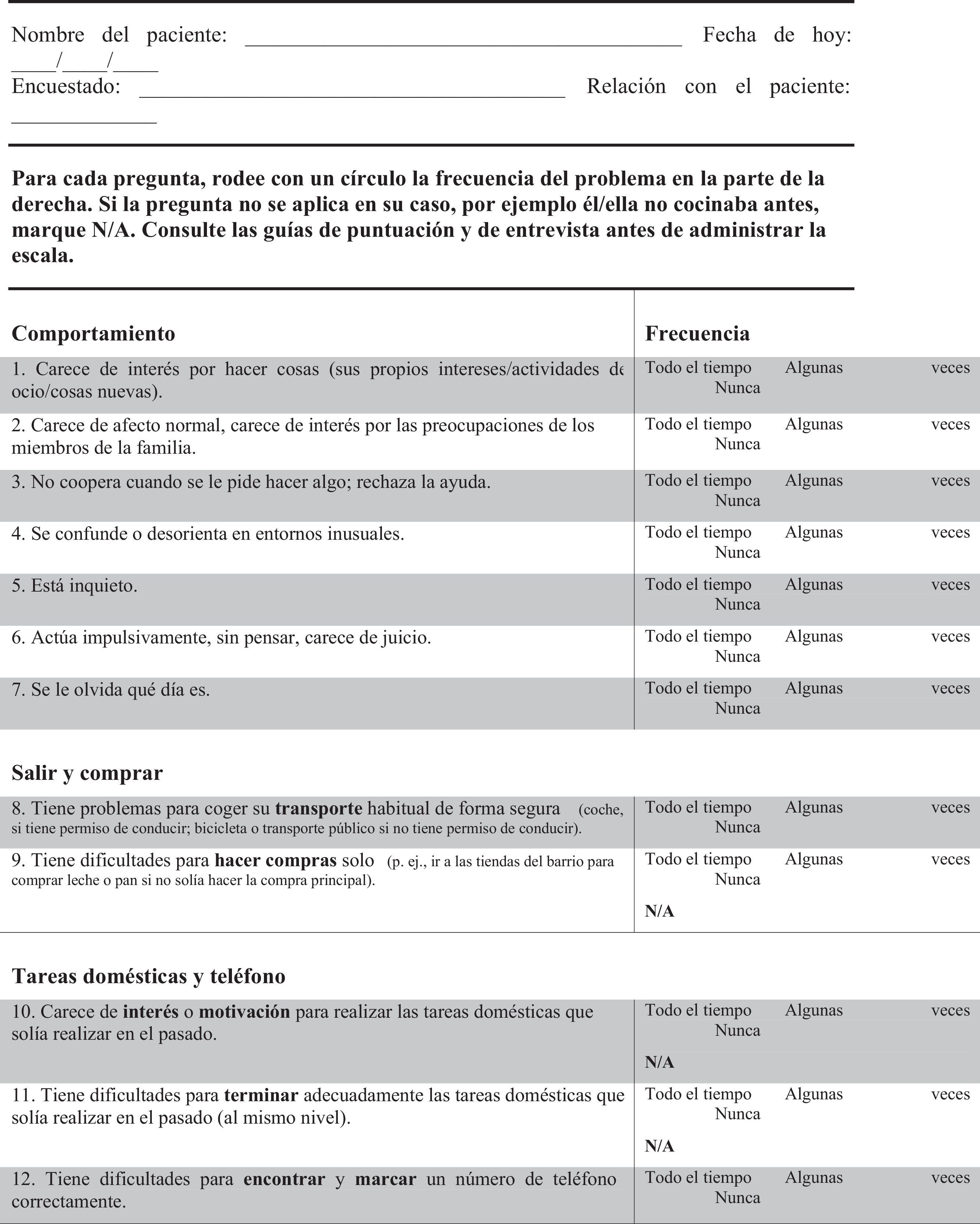
FTD-FRS19: Escala que se administra al cuidador, evalúa 30 ítems, cada uno valorado con 3 posibles respuestas de frecuencia (nunca, algunas veces o todo el tiempo) clasificados en 8 dimensiones (conducta, actividades fuera de casa, tareas domésticas, finanzas, medicación, ingesta, movilidad y autocuidado) y estratifica la gravedad de la demencia en 6 grados (muy leve, leve, moderada, grave, muy grave, profunda).
- ∘
CDR11: escala clínica para la gradación de la demencia en 5 estadios según el deterioro cognitivo y funcional siendo 0 ningún deterioro y 0,5 deterioro muy leve, 1 deterioro leve, 2 moderado y 3 grave a través de una entrevista semiestructurada al cuidador y complementada con una rápida valoración al paciente que valora memoria, orientación, razonamiento y solución de problemas, actividades fuera de casa, actividades domésticas y cuidado personal.
- ∘
- •
Datos administrativos y sociodemográficos: edad, sexo, lugar de residencia, edad del cuidador, sexo del cuidador, relación con el participante, fecha del diagnóstico de demencia y fecha de la visita.
- •
Función cognitiva: para valorar la función cognitiva del paciente se utilizaron la Addenbrooke's Cognitive Examination-Revised22, que incluye la valoración de 5 dominios (atención/orientación, memoria, fluencia verbal, lenguaje y praxis visoconstructiva) con puntuación máxima de 100 puntos y el Mini-Mental State Examination (MMSE)23
- •
Discapacidad funcional: Disability Assessment in Dementia (DAD), escala de evaluación del porcentaje de autonomía funcional preservado. Incluye 40 ítems sobre la realización de actividades básicas e instrumentales en los últimos 15 días24.
- •
Síntomas Psicológicos y Conductuales asociados a las demencias: se determinó la presencia mediante el Neuropsychiatric Inventory que valora la frecuencia y gravedad de diversos síntomas neuropsiquiátricos como delirios, alucinaciones, agitación, depresión, ansiedad, euforia, apatía, desinhibición, irritabilidad, conducta motora aberrante, alteración del sueño y alteración del apetito. La puntuación de cada subescala es de 0 a 12 y el total de la escala es de 0 a144 siendo mayor la puntuación a mayor presencia de los trastornos evaluados25.
El estudio descriptivo de los datos se realizó mediante frecuencias absolutas y relativas para las variables cualitativas, y medidas de tendencia central y dispersión para las cuantitativas. Se determinó la normalidad en la distribución de estas mediante el estadístico de Kolmogorov-Smirnov.
Para realizar el proceso de validación de la adaptación y validación se evaluó la consistencia interna mediante el cálculo del α de Cronbach y se determinó la composición de la escala siguiendo los parámetros de la escala original. Para ello se realizó un análisis de ajuste de información ponderada (infit) y ajuste sensible a los casos atípicos (outfit) para determinar que no hubiera ítems fuera de los parámetros (MNSQ=0,60 hasta 1,49 y Z=−2 a 2) y se replicó el análisis de componentes principales de los residuales con el método Rasch para determinar la unidimensionalidad de la versión en castellano de la FTD-FRS26,27. Para el análisis de validez de constructo concurrente se correlacionó la puntuación de la FTD-FRS con las puntuaciones de deterioro cognitivo, y funcional y para la determinación del constructo de la validez discriminante se calcularon ANOVA con la comparación post hoc de Bonferroni de las diferencias en la puntuación media de la FTD-FRS y las variables de capacidad cognitiva y funcional. Asimismo, se calculó el grado de acuerdo entre la CDR y la FTD-FRS mediante el índice kappa para los casos con DFT.
La elaboración del análisis estadístico se realizó mediante los programas SPSS v.19.0 para Windows (SPSS Inc., Chicago) y Winsteps 3.90.0 para Windows24.
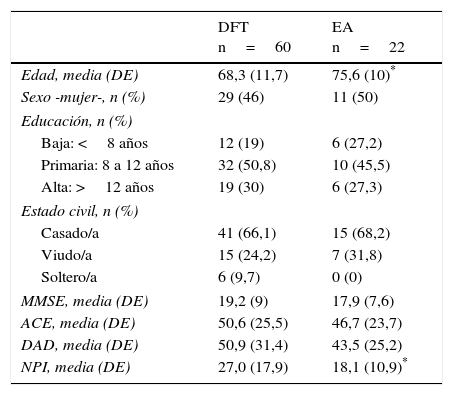
ResultadosCaracterísticas demográficas de los participantesLa muestra final del estudio estuvo compuesta por 60 casos con DFT con una media de edad de 68,1 años (DE=12,1; rango=45,0-95,7) y en un 54,2% fueron hombres. El tiempo medio de evolución de la enfermedad fue de 7,3 años (DE=5,6; rango=0,5–22,0 años). El 71,4% de los casos vivía en su propio domicilio, el 14,3% en el domicilio de un familiar y el 14,3% restante, institucionalizado. El 56% de los cuidadores eran la pareja de estos, el 32% la hija o el hijo y en un 12% otro familiar. De los 29 casos de EA fueron hombres el 44,8% y la media de edad fue de 75,7 años (DE=9; rango=56,1–90,4). El tiempo medio de evolución de la enfermedad fue de 5,2 años (DE=4,5; rango=0,5-15). En el momento del estudio, el 72% vivía en su domicilio, el 16% en el de un familiar y el 12% restante institucionalizados. Las hijas e hijos fueron las principales personas cuidadoras en el 52,6% de los casos, la pareja en el 36,8% y en el resto de los casos fueron otros familiares o cuidadores, Las características clínicas de los casos se describen en la tabla 1.
Descripción global de las características de la muestra y estratificación por diagnostico
| DFT n=60 | EA n=22 | |
|---|---|---|
| Edad, media (DE) | 68,3 (11,7) | 75,6 (10)* |
| Sexo -mujer-, n (%) | 29 (46) | 11 (50) |
| Educación, n (%) | ||
| Baja: <8 años | 12 (19) | 6 (27,2) |
| Primaria: 8 a 12 años | 32 (50,8) | 10 (45,5) |
| Alta: >12 años | 19 (30) | 6 (27,3) |
| Estado civil, n (%) | ||
| Casado/a | 41 (66,1) | 15 (68,2) |
| Viudo/a | 15 (24,2) | 7 (31,8) |
| Soltero/a | 6 (9,7) | 0 (0) |
| MMSE, media (DE) | 19,2 (9) | 17,9 (7,6) |
| ACE, media (DE) | 50,6 (25,5) | 46,7 (23,7) |
| DAD, media (DE) | 50,9 (31,4) | 43,5 (25,2) |
| NPI, media (DE) | 27,0 (17,9) | 18,1 (10,9)* |
ACE: Addenbrooke's Cognitive Examination; DAD: Disability Assessment in Dementia; DE: desviación estándar; DFT: demencia frontotemporal; EA: enfermedad de Alzheimer; MMSE: Mini-Mental State Examination; NPI: Neuropsychiatric Inventory.
Se realizaron 2 traducciones y adaptaciones independientes del inglés al castellano que fueron retraducidas nuevamente por personal externo especialista en traducción de información científica. Ambas versiones fueron revisadas y aceptadas por los autores de la escala original. Finalmente se consensuó una única escala en castellano para iniciar el proceso de validación (anexo 1).
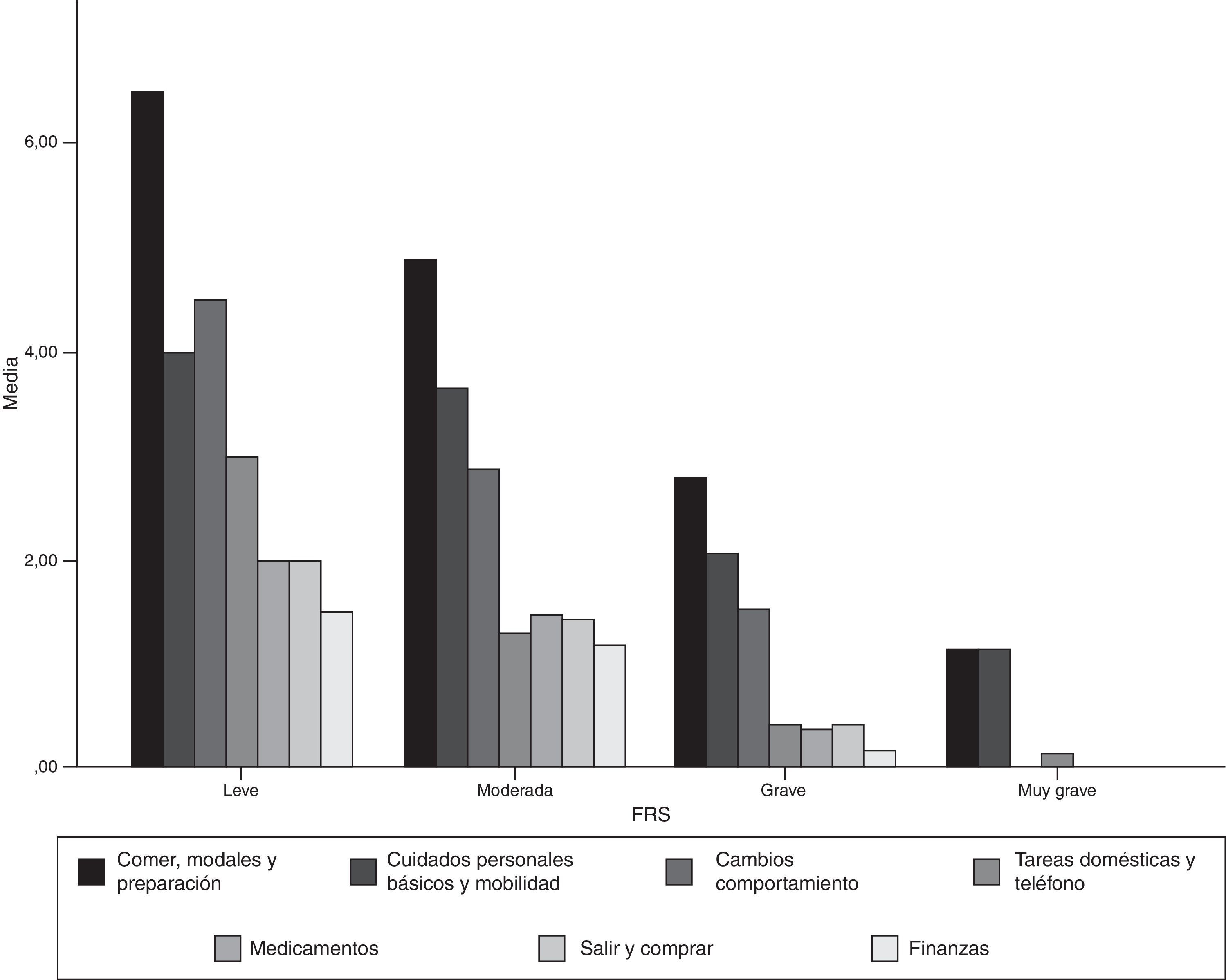
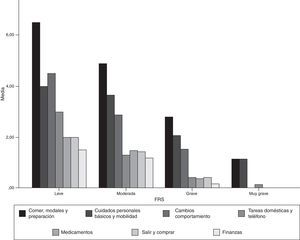
Aceptabilidad y consistencia interna de la versión castellana de la Frontotemporal Dementia Rating ScaleLa FTD-FRS se administró a todos los cuidadores de los pacientes que accedieron a participar en el estudio. No se objetivaron dificultades en la comprensión de las instrucciones ni en ninguno de los 30 ítems. En la tabla 2 se presenta el porcentaje de puntuación 1 (nunca) en cada uno de los ítems y en la figura 1 se representan los resultados por dominios de la FTD-FRS.
Porcentaje de respuesta negativa (nunca)
| Ítems | Nunca (%) |
|---|---|
| 1. Carece de interés por hacer cosas (sus propios intereses/actividades de ocio/cosas nuevas) | 15 |
| 2. Carece de afecto normal, carece de interés por las preocupaciones de los miembros de la familia | 28,3 |
| 3. No coopera cuando se le pide hacer algo; rechaza la ayuda | 31,7 |
| 4. Se confunde o desorienta en entornos inusuales | 41,7 |
| 5. Está inquieto | 26,7 |
| 6. Actúa impulsivamente, sin pensar, carece de juicio | 31,7 |
| 7. Se le olvida qué día es | 38,3 |
| 8. Tiene problemas para coger su transporte habitual de forma segura (coche, si tiene permiso de conducir; bicicleta o transporte público si no tiene permiso de conducir) | 46,7 |
| 9. Tiene dificultades para hacer compras solo (p. ej., ir a las tiendas del barrio para comprar leche o pan si no solía hacer la compra principal) | 32,1a |
| 10. Carece de interés o motivación para realizar las tareas domésticas que solía realizar en el pasado | 20,7b |
| 11. Tiene dificultades para terminar adecuadamente las tareas domésticas que solía realizar en el pasado (al mismo nivel) | 23,7b |
| 12. Tiene dificultades para encontrar y marcar un número de teléfono correctamente | 45,8c |
| 13. Carece de interés por sus asuntos personales como las finanzas | 22,2c |
| 14. Tiene problemas para organizar sus finanzas y pagar facturas (cheques, libreta del banco, facturas) | 11,3c |
| 15. Tiene dificultades para organizar su correspondencia sin ayuda (habilidades de escritura) | 23,2c |
| 16. Tiene dificultades en el uso adecuado de las monedas para pequeñas compras en las tiendas, gasolineras, etc. (dar y comprobar el cambio) | 45,8c |
| 17. Tiene problemas para tomar sus medicamentos a la hora correcta (olvida o se niega a tomarlos) | 34,8d |
| 18. Tiene dificultades para tomar sus medicamentos según las indicaciones (de acuerdo con la dosis correcta) | 42,4d |
| 19. Carece de interés o motivación previos para preparar una comida (o el desayuno, bocadillo) para sí mismo (valoración según lo hacía antes de la enfermedad; puntuar la misma tarea para las preguntas 19, 20 y 21) | 36,8 |
| 20. Tiene dificultades para organizar la preparación de las comidas (o un aperitivo si el paciente no era el cocinero principal) (elegir los ingredientes; utensilios de cocina; la secuencia de los pasos) | 37,5 |
| 21. Tiene problemas para preparar o cocinar una comida (o un aperitivo en su caso) por sí mismo (necesita supervisión/ayuda en la cocina) | 31,5 |
| 22. Carece de iniciativa para comer (si no se le ofrece comida, podría pasar el día sin comer nada) | 73,3 |
| 23. Tiene dificultades para elegir los cubiertos y aliños adecuados para comer | 75 |
| 24. Tiene problemas para comer a un ritmo normal y con los modales adecuados | 46,7 |
| 25. Quiere las mismas comidas repetidamente | 53,3 |
| 26. Prefiere comer dulces ahora más que antes | 40 |
| 27. Tiene problemas para elegir la ropa adecuada (con respecto a la ocasión, la climatología o la combinación de colores) | 55 |
| 28. Tiene incontinencia | 63,3 |
| 29. Se le puede dejar solo en casa un día entero (por motivos de seguridad) | 53,3 |
| 30. Está restringido a la cama | 95 |
La puntuación media de la FTD-FRS para los casos con DFT fue de 12,1 puntos (DE=6,5; rango=2-25) y presentó una distribución normal (Kolmogorv-Smirnov=0,183). A partir de los criterios originales, el 5% de los casos presentaba una gravedad leve con una puntuación media en la FTD-FRS de 25,2 puntos (DE=1,3; rango=24-26,7); el 41,7% moderada, con una puntuación media de 17,8 puntos (DE=2,8; rango=13-23); el 41,7% severa con una puntuación media de 8,5 puntos (DE=2,4; rango=4-11) y el 11,7% restante con una gravedad muy severa y con una puntuación media en la FTD-FRS de 2,4 puntos (DE=0,5; rango 2-3). No se registraron casos DFT de la categoría muy leve ni de la categoría gravedad profunda.
El análisis de la consistencia interna fue buena (α de Cronbach=0,897) y el análisis de Rasch se encontró entre los límites recomendados para el infit y el outfit (MNSQ=1; Z=0; p=0,21 y MNSQ=0,96; Z=-0,1; p=0,31 respectivamente). El análisis de componentes principales de los residuos produjo un aceptable autovalor para 5 contrastes (1,6-2,7) y una varianza respecto al origen del 36,1%.
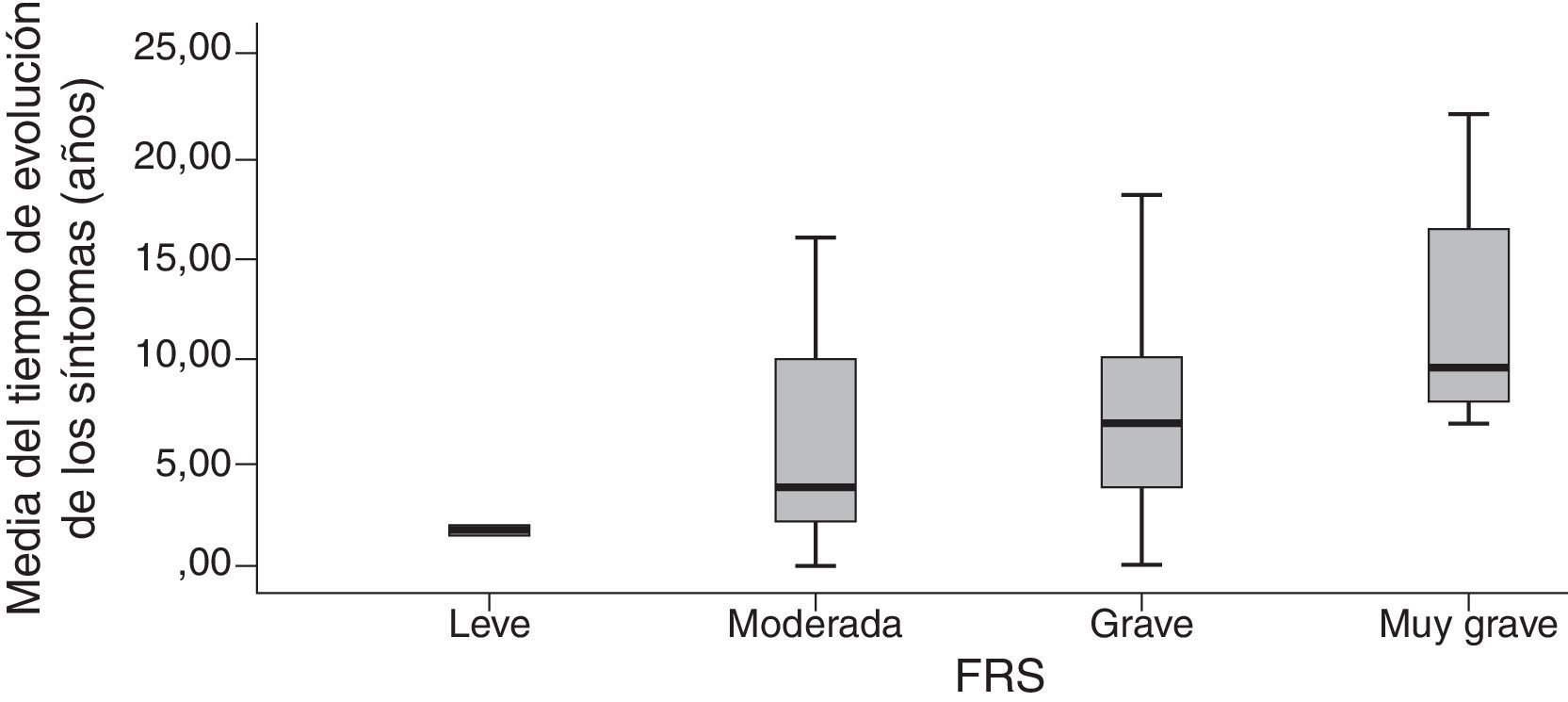
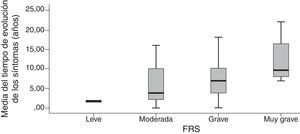
Criterios de validez de la Frontotemporal Dementia Rating ScaleLa FTD-FRS se correlacionó moderadamente con la puntuación del MMSE (r=0,572; p<0,001), y la puntuación de la Addembrooke's Cognitive Examination-Revised (ACE-R) (r=0,534; p<0,001). La correlación fue mayor con la DAD (r=0,790; p<0,001) y no se observó correlación con la puntuación del Neuropsychiatric Inventory (r=−0,241; p=0,101). La asociación con el tiempo de evolución aproximada de los síntomas presentó una correlación inversa estadísticamente significativa (a mayor tiempo peor capacidad) con la puntuación de la FTD-FRS (r=−0,554; p<0,001) y una distribución estadísticamente significativa entre la media de años y los diferentes estadios de la FTD-FRS (F=3,3; gl=3; p=0,017).
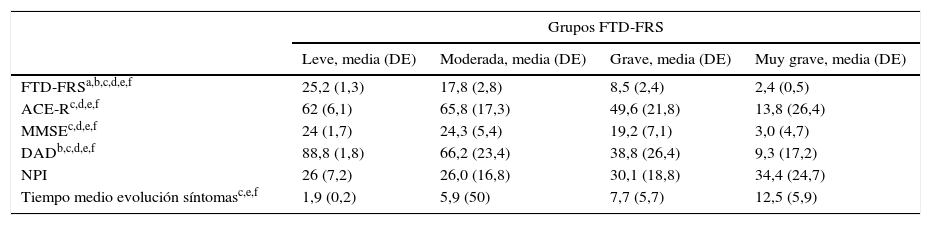
La agrupación categórica de la puntuación de la FTD-FRS mostró diferencias intergrupos con la puntuación continua (F=130,4; gl=3; p<0,001) y también intragrupos según las diferentes comparaciones de Bonferroni. Se observaron diferencias entre la puntuación de la función cognitiva tanto mediante la ACE-R (F=5,0; gl=3; p=0,001) como el MMSE (F=5,9; gl=3; p<0,001), y con la capacidad funcional con la DAD (F=19,9; gl=3; p<0,001); principalmente entre los casos leves con los casos más graves (tabla 3). Se observaron diferencias entre las categorías de la FTD-FRS y el tiempo de evolución de los síntomas, como se observa en la figura 2 (F=3,4; gl=3; p=0,026).
Descriptivo de las valoraciones clínicas en pacientes con DFT estratificado por grado de gravedad de la FTD-FRS
| Grupos FTD-FRS | ||||
|---|---|---|---|---|
| Leve, media (DE) | Moderada, media (DE) | Grave, media (DE) | Muy grave, media (DE) | |
| FTD-FRSa,b,c,d,e,f | 25,2 (1,3) | 17,8 (2,8) | 8,5 (2,4) | 2,4 (0,5) |
| ACE-Rc,d,e,f | 62 (6,1) | 65,8 (17,3) | 49,6 (21,8) | 13,8 (26,4) |
| MMSEc,d,e,f | 24 (1,7) | 24,3 (5,4) | 19,2 (7,1) | 3,0 (4,7) |
| DADb,c,d,e,f | 88,8 (1,8) | 66,2 (23,4) | 38,8 (26,4) | 9,3 (17,2) |
| NPI | 26 (7,2) | 26,0 (16,8) | 30,1 (18,8) | 34,4 (24,7) |
| Tiempo medio evolución síntomasc,e,f | 1,9 (0,2) | 5,9 (50) | 7,7 (5,7) | 12,5 (5,9) |
ACE-R: Addenbrooke's Cognitive Examination-Revised; DAD: Disability Assessment in Dementia; DFT: demencia frontotemporal; FRD-FRS: Frontotemporal Rating Scale; MMSE: Mini-Mental State Examination; NPI: Neuropsychiatric Inventory.
ANOVA Bonferroni p<0,05: a) Leve * Moderada; b) Leve * Grave; c) Leve * Muy grave; d) Moderada * Grave; e) Moderada * Muy grave; f) Grave * Muy grave.
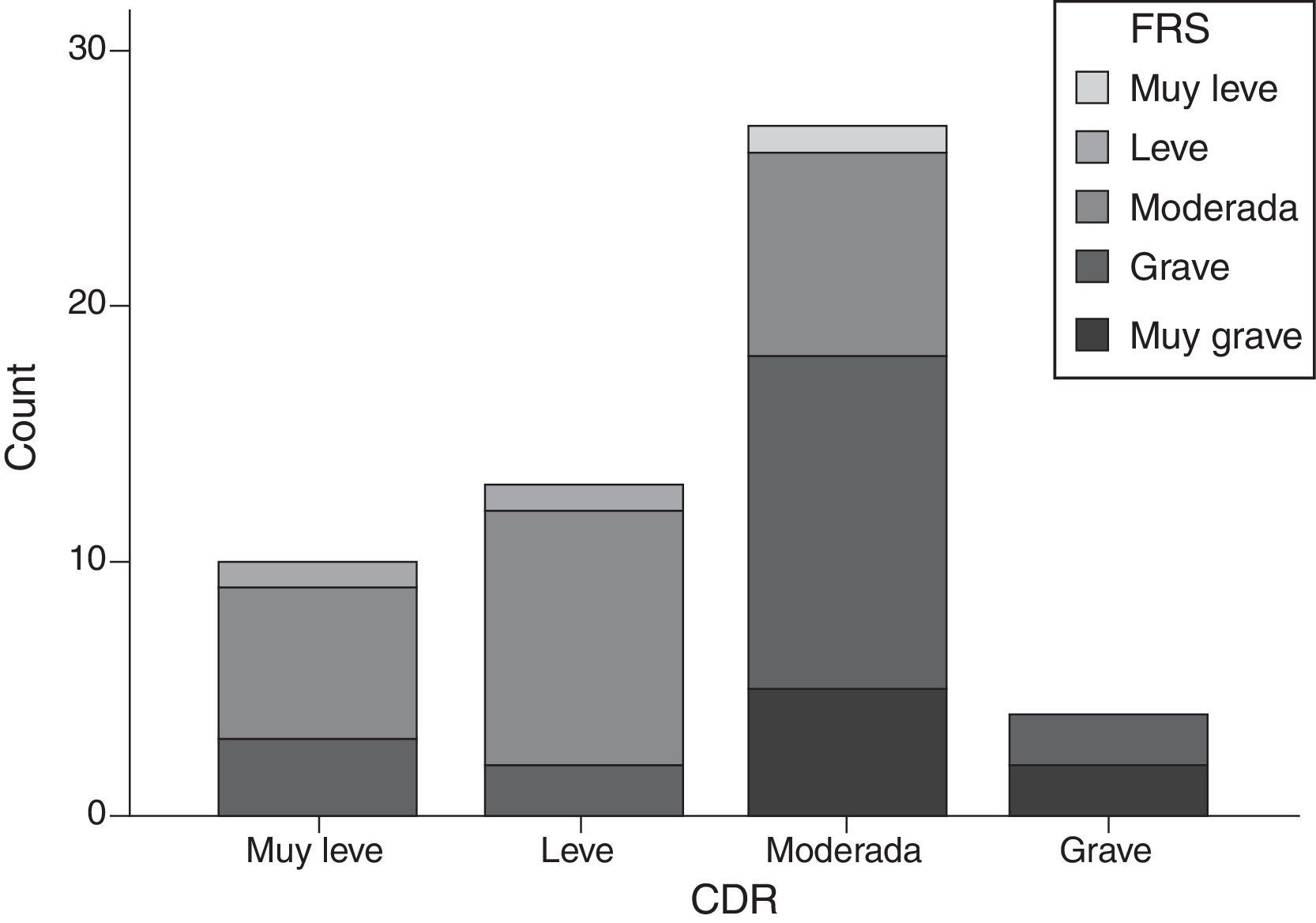
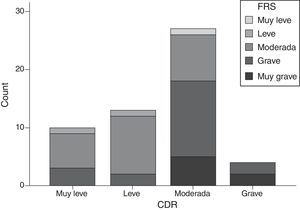
La puntuación de la FTD-FRS presentó una moderada correlación inversa con relación a la puntuación en la CDR (r=−0,641; p<0,001), aunque si estratificamos según los grupos establecidos por la FTD-FRS, los grupos de gravedad de la CDR presentan discrepancias (χ2=20,2; gl=9; p=0,017) y un mínimo grado de acuerdo (kappa=0,055). Los casos con DFT moderada y grave son los que mayor variabilidad presentan, llegando a ser valorados como casos leves según la CDR (fig. 3).
La puntuación media de la FTD-FRS según los casos con DFT y los casos con EA no presentó diferencias significativas (t=-0,769; gl=79; p=0,444) y tampoco en la distribución de la gravedad (χ2=0,985; gl=3; p=0,811). Si comparamos los resultados de correlación de la FTD-FRS en los casos con EA, observamos unas puntuaciones igualmente significativas aunque moderadamente menores en el MMSE (r=0,402; p=0,034) y el ACE (r=0,400; p=0,035), y no se observó correlación con el tiempo de evolución de los síntomas (r=−0,382; p=0,145). Por el contrario sí se observó una elevada correlación con la DAD (r=0,933; p<0,001). En el caso de los pacientes con EA y el CDR se observó una elevada correlación inversa en el MMSE (r=−0,560; p<0,001) y el ACE-R (r=−0,434; p=0,002), como también en el DAD (r=0,723; p<0,001). El análisis comparativo entre el tiempo de evolución de los síntomas y la gravedad según la FTD-FRS no mostró diferencias en los casos con EA (F=2,8; gl=2; p=0,102), a diferencia de lo observado con los casos con DFT, con lo que podemos ver el incremento del tiempo para el diagnóstico de DFT.
DiscusiónEl objetivo de este estudio fue adaptar y validar al castellano la FTD-FRS. Los resultados obtenidos muestran que la versión castellana es equivalente a la versión original inglesa, que es aplicable en nuestro medio y que permite una correcta discriminación de los estadios de gravedad de la DFT. Esta escala permite determinar casos leves, en fase inicial, y también diferenciar entre casos graves, muy graves y profundos. Ambos extremos de la escala aportan aspectos de gran relevancia clínica, tanto para favorecer un proceso diagnóstico precoz como para adecuar las pautas a los cuidadores y los tratamientos paliativos en las fases más avanzadas28,29.
La DFT presenta una mayor prevalencia en pacientes jóvenes (<65 años), pero paradójicamente muestra un retraso diagnóstico respecto a otras formas de demencia con gran itinerancia por distintos dispositivos asistenciales hasta el diagnóstico30. Una de las dificultades para realizar la evaluación inicial de estos pacientes es que la mayoría de los instrumentos desarrollados para el cribado rápido y/o la gradación de la gravedad de la demencia, como la CDR o la Geriatric Deterioration Scale de Reisberg, no contemplan las alteraciones características de esta enfermedad, como son los cambios en la conducta social o en los hábitos. Aun así, el seguimiento y la gradación de la gravedad de los casos con DFT son ampliamente evaluados con la CDR o la Geriatric Deterioration Scale y, aunque se han realizado adaptaciones, la valoración con instrumentos poco adecuados puede conllevar distintos inconvenientes tanto a pacientes como a cuidadores31,32.
En este sentido, la puntuación de la FTD-FRS presentó una buena correlación con la escala de discapacidad funcional a la vez que una moderada correlación inversa con relación a la puntuación en la CDR. También se objetivaron diferencias en la estratificación del estadio, de forma que la CDR habitualmente clasificaba a los pacientes en un grado de demencia inferior al de la FTD-FRS (fig. 3). La valoración de la gravedad debe determinarse en función de los aspectos de discapacidad funcional específicos para cada una de las enfermedades.
Aunque se han realizado avances en la caracterización de la DFT, el diagnóstico está estrechamente ligado a los síntomas clínicos y los estudios previos han demostrado una baja sensibilidad de los criterios de Neary et al., para los casos en estadio más leve33. En nuestro estudio, y ello supone una de las principales limitaciones, no se recogieron casos en fases extremas. La detección de la DFT en pacientes adultos-jóvenes con alteraciones de conducta o del estado de ánimo insidiosas no siempre es sencilla, como demuestra el mayor tiempo de evolución observado en los pacientes con DFT respecto los casos con EA17 y, en muchas ocasiones, previo paso por distintos dispositivos de atención primaria y/o psiquiatría30,34,35. La falta de casos en estadio profundo puede ser debido al carácter ambulatorio de la evaluación.
Este proceso de validación presentó algunas diferencias respecto al estudio original y deben tenerse en cuenta también como limitaciones del estudio. La validación original fue realizada en pacientes con afectación conductual, pacientes con afasia progresiva primaria subtipo no fluente y demencia semántica, mientras que en nuestro estudio se analizaron exclusivamente casos con la presentación conductual, más prevalente en el entorno clínico31. Futuros estudio permitirán ampliar el proceso de validación mediante el análisis de fiabilidad interexaminador y test-re-test. Cabe mencionar también que la traducción al castellano puede no ser directamente aplicable al conjunto de hispanohablantes. Por ello, de cara al futuro, creemos que sería interesante ampliar el proceso de validación de esta escala, y adaptarla a las características lingüísticas del resto de las comunidades hispanoparlantes.
Este estudio pone a disposición de los clínicos e investigadores un instrumento válido para la gradación y seguimiento de los pacientes con diagnóstico de DFT. La creación de una escala de gravedad adaptada a estos trastornos característicos de la DFT puede facilitar una identificación precoz de estos pacientes y reducir el tiempo desde el inicio de los síntomas hasta su detección, facilitar que los tratamientos farmacológicos sean los adecuados y no se den con retraso, así como que la información y asesoramiento a los cuidadores no esté desfasada. La FTD-FRS es un instrumento que puede mejorar la asistencia clínica a pacientes y familiares desde fases iniciales hasta estadios terminales de la misma.
FinanciaciónEste estudio fue parcialmente financiado por la Agrupació de Ciències Mèdiques de Girona (Accèssit a la Beca 2012) y la Fundació Marató de TV3 (20143810).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los miembros del ReDeGi Margarita Flaqué, Marta Hernández, Glòria Mas, Marta Linares e Isabel Casas por su colaboración en este estudio.