El infarto medular es una rara causa de paraplejía que constituye menos del 1% de todos los infartos isquémicos. Más infrecuente aún es su presentación como isquemia medular transitoria. Dada la baja incidencia de esta patología, se desconoce la frecuencia de las distintas etiologías. Presentamos el caso de un paciente con síntomas medulares intermitentes que derivó en un infarto medular secundario a aneurisma disecante de aorta.
Caso clínicoVarón de 64 años, sin alergias conocidas, fumador y consumidor de 60 g de alcohol al día. Diagnosticado de EPOC tipo enfisema, en tratamiento con tiotropio, budesonida y formoterol.
Seis meses antes del ingreso actual, consultó en otro centro hospitalario por presentar lumbalgia súbita, junto con pérdida de fuerza en miembros inferiores que le impedía la deambulación. Refería, además, parestesias en dichas extremidades. Negaba realización de sobreesfuerzo previo. El enfermo presentó recuperación espontánea de la fuerza y desaparición del resto de sintomatología horas después de su ingreso, por lo que fue dado de alta, sin llegar a encontrarse diagnóstico etiológico del cuadro durante su estudio.
En la actualidad, vuelve a consultar por lumbalgia repentina irradiada a región genital y miembros inferiores; de nuevo sin previo esfuerzo. Refiere parestesias bilaterales en ambas extremidades inferiores (de predominio distal) y pérdida de fuerza progresiva que le impide continuar la marcha.
A su llegada se encontraba alerta y correctamente orientado, manteniendo el estado general y eupneico en reposo. Afebril, con tensión arterial de 160/99 y saturación de oxígeno de 97% respirando aire ambiente. La auscultación cardiorrespiratoria y la exploración del abdomen fueron anodinas. En miembros inferiores destacaban lesiones bilaterales en región tibial anterior, en placas de coloración oscura, descamativas, de meses de evolución. No había dolor a la palpación de apófisis espinosas, aunque sí se objetivó a la presión de la musculatura paravertebral lumbar bilateral.
El lenguaje, los pares craneales, la fuerza y la sensibilidad en miembros superiores eran normales. Se determinó paraparesia 1/5, con reflejos patelares abolidos y aquíleos presentes aunque débiles. El reflejo cutáneo-plantar fue flexor en ambos miembros. Asimismo se detectó hipoestesia táctil y dolorosa desde nivel L1. La sensibilidad posicional y vibratoria estaba conservada. No se evidenciaron dismetrías ni signos meníngeos. Requirió sondaje urinario por dificultad para la micción.
En la analítica de Urgencias destacaba una hemoglobina de 19,3g/dl y volumen corpuscular medio de 106 fl. No había leucocitosis ni neutrofilia; estando la función renal y hepática dentro de los parámetros de normalidad. No se encontraron alteraciones en los niveles de sodio, potasio y calcio. La VSG era de 18mm/h y la PCR de 22mg/l.
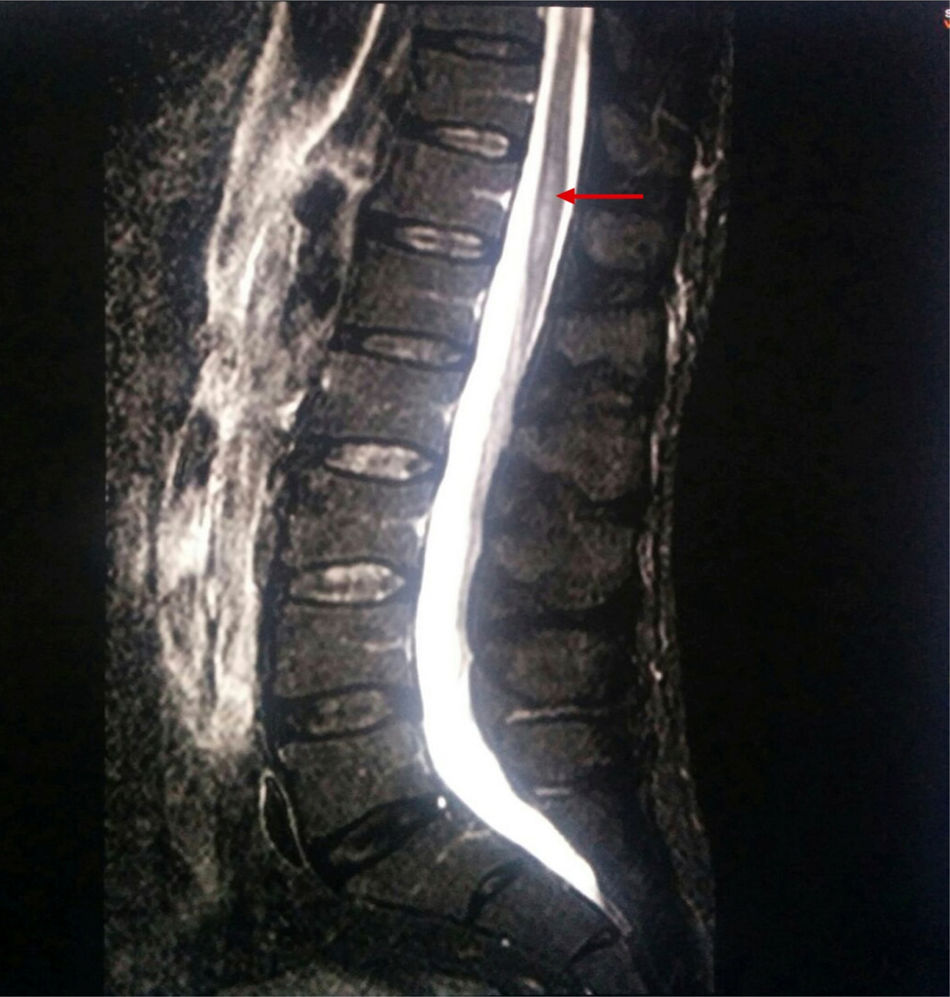
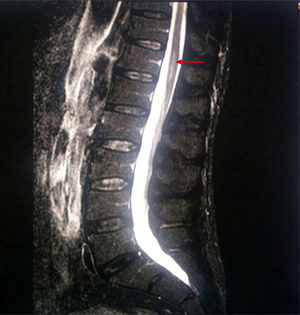
Se solicitó resonancia magnética de columna lumbar de forma urgente: en la porción proximal del cono medular (a nivel D12) se observaba un ensanchamiento y un aumento de intensidad de señal central en secuencias potenciadas en T2 y STIR, que planteaba diagnóstico diferencial con: proceso desmielinizante inflamatorio/infeccioso tipo mielitis transversa, isquemia medular y proceso metabólico-tóxico. No había signos de mielopatía compresiva.
El paciente fue ingresado con diagnóstico de mielopatía a nivel de cono medular. Se instauró tratamiento con 300mg diarios de ácido acetilsalicílico, profilaxis con heparina de bajo peso molecular y analgesia con fármacos de primer escalón. No se administraron corticoides al no detectarse signos de compresión medular en la resonancia magnética. A las 72 h, presentaba leve mejoría en cuanto a sensibilidad y movilizaba discretamente en horizontal ambos miembros inferiores.
En el estudio analítico de planta se objetivó GGT de 155 U/l, LDH de 567 U/l, ferritina 360ng/ml y LDL colesterol 119mg/dl. La enolasa neuroespecífica se encontraba en niveles de 46,3ng/ml (valores normales de 0-17ng/ml). Se determinó la presencia de anticuerpos antinuclerares positivos a título menor de 1/160, con patrón moteado fino. El resto de los parámetros analíticos solicitados: HDL colesterol, triglicéridos, bilirrubina directa e indirecta, GOT, GPT, FA, niveles séricos de hierro, transferrina, índice de saturación de la transferrina, proteínas totales, hormonas tiroideas, ácido fólico y vitamina B12 se mantenían dentro de la normalidad. Los anticuerpos anticitoplasma de neutrófilo, anticardiolipina y anticoagulante lúpico fueron negativos, así como el estudio serológico para Brucella, Borrelia, Treponema pallidum y VIH.
Se realizó nueva resonancia magnética abarcando columna dorsolumbar (fig. 1), encontrándose los siguientes hallazgos: a nivel D9-D10 y hasta el final del cono medular se apreciaba ensanchamiento del canal y cordón medular con hiperintensidad en secuencias T2 y STIR, y restricción de la difusión. Nuevamente no había signos de mielopatía compresiva. La exploración fue realizada sin contraste por intolerancia del paciente a esta prueba y su negativa para la administración de contraste por vía intravenosa.
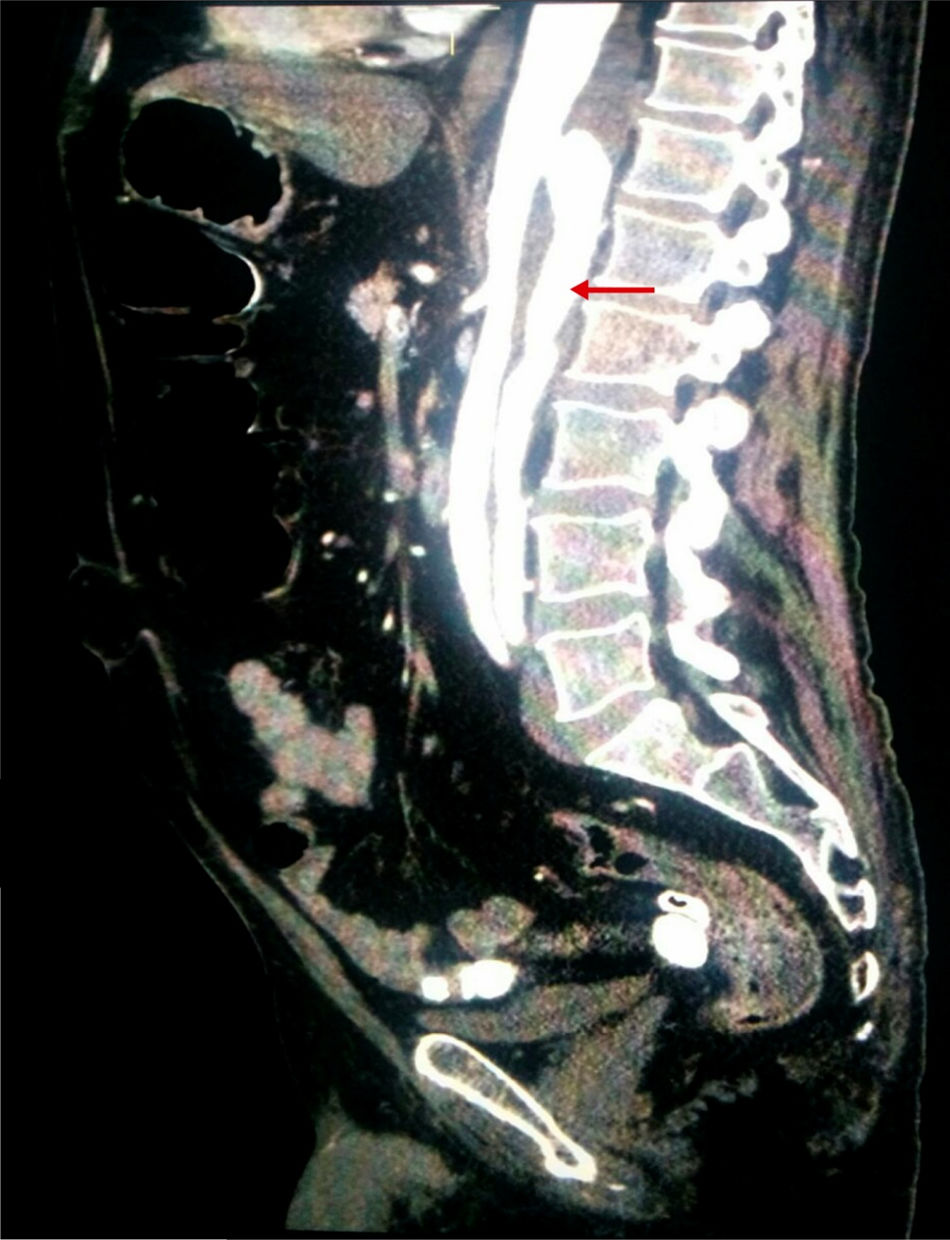
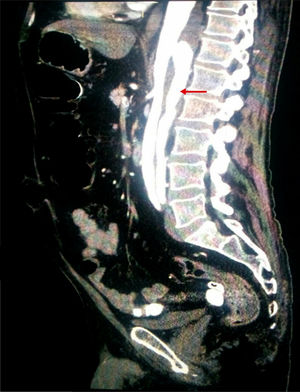
Dados los factores de riesgo vascular del paciente, se realizó una angio-TAC de abdomen (fig. 2) con objeto de descartar alteración vascular aguda. Esta exploración reveló la existencia de una disección de aorta torácica distal que se extendía hasta arteria renal izquierda e ilíaca externa izquierda, con luz falsa en la parte posterior.
Fue intervenido de forma urgente implantándose endoprótesis torácica. El postoperatorio fue favorable e inició tratamiento rehabilitador. El paciente fue trasladado al Hospital de Crónicos para continuar cuidados y seguir rehabilitación.
DiscusiónLa isquemia de la médula espinal es una enfermedad rara que representa menos del 1% de todos los infartos isquémicos1. Presenta una etiología variada2, que incluye disección de la arteria vertebral, patología aórtica, arteriosclerosis o embolismo, hipotensión, fármacos y síndromes autoinmunes3. También hay descritos casos en inmersiones, cirugías de columna y tratamientos de punción lumbar. La embolia fibrocartilaginosa, producida por el material del disco intervertebral, aparece en la literatura como mecanismo productor de infartos medulares en jóvenes4.
La frecuencia de las distintas etiologías es desconocida, ya que la baja incidencia de esta patología hace que los datos procedan de series personales y casos aislados5. Un alto porcentaje de pacientes con infarto medular queda sin diagnóstico etiológico.
Hay muy pocos casos descritos de sintomatología aguda y desaparición espontánea compatibles con isquemia medular transitoria (accidente isquémico transitorio medular). La bibliografía los menciona con el término «claudicación medular intermitente». En una publicación española6 se refleja el caso de un paciente que presentó 3 episodios transitorios previos al establecimiento de los síntomas. En otro trabajo, la revisión de varios casos post mortem reveló que el paciente que los refirió presentaba una extensa ateromatosis aórtica7.
La médula espinal se encuentra irrigada por 3 vasos principales que la recorren longitudinalmente: la arteria espinal anterior (ubicada en el surco anterior) y 2 arterias espinales posteriores que siguen la salida de las raíces posteriores. El aporte de la irrigación a dichas arterias en cada tramo medular se realiza por distintas ramas arteriales. A nivel cervical es suplida a través de las arterias vertebrales y cervicales profundas. A partir del tramo dorsal, son las distintas arterias radiculares (ramas a su vez de las arterias intercostales y lumbares de la aorta) las encargadas del aporte de irrigación. La arteria radicular magna de Adamkiewicz, originada en la mayoría de los casos a partir de las intercostales D9-D11, irriga el engrosamiento lumbar de la médula espinal. En el cono medular, existe una red arterial formada por la anastomosis de las arterias espinales anterior y posterior. También existen conexiones transversales entre los 3 troncos arteriales principales, lo cual hace que la patología medular isquémica sea mucho más infrecuente que la cerebral. Sin embargo, el territorio frontera localizado en la región dorsal alta puede presentar una vascularización deficiente y afectarse ante una situación de hipoperfusión global4.
En pacientes jóvenes, la disección de la arteria vertebral es un factor predominante de isquemia del cordón medular8. En pacientes de edad predomina la patología aórtica, estando ampliamente descrito como complicación de la cirugía de reparación de aorta9 y en empleo de stents10. Los casos relatados en relación con disección aórtica no suponen más del 3% de esta patología1,11,12.
La presentación clínica más frecuente es el síndrome correspondiente a la isquemia del territorio de la arteria espinal anterior, en el que los síntomas suelen ser agudos y pueden progresar durante 30-45 min, con dolor lumbar o en el cuello como primera manifestación usual5. Si la causa del infarto medular es patología aórtica, suele afectar a la irrigación de los 2 tercios anteriores de la médula espinal. Dicho compromiso vascular, descrito como «síndrome de la arteria de Adamkiewicz»13,4, se describe como un síndrome medular (completo o incompleto), con parálisis que en un principio es flácida e hiporrefléxica al nivel de la lesión. Posteriormente aparecen signos de afectación de primera motoneurona (espasticidad, hiperreflexia, clonus y signo de Babinski) al perderse el control inhibitorio que el haz corticoespinal ejerce sobre las motoneuronas del asta anterior por afectación de aquel. Se acompaña de déficit sensitivo por lesión de los haces espinotalámicos, encontrándose conservada la sensibilidad propioceptiva y vibratoria (ya que las columnas dorsales se mantienen intactas al estar irrigadas por las arterias espinales posteriores). No es infrecuente la incontinencia de esfínteres o trastornos intestinales como expresión de disfunción autonómica.
Los síndromes medulares posteriores son excepcionales y presentan dificultad para su reconocimiento clínico4.
La resonancia magnética de urgencia es el método diagnóstico de elección en pacientes con síntomas de afectación medular. Esta técnica de imagen detecta tanto patología extramedular (lesiones ocupantes de espacio, hematomas, colecciones infecciosas y hernias de disco) como lesiones intramedulares (tumores, alteraciones vasculares, hemorragias o mielitis) que deben ser tratadas de forma urgente.
En la mayoría de los casos el manejo está dirigido a identificar y tratar las causas subyacentes para prevenir el empeoramiento o la repetición del cuadro y acelerar la recuperación del paciente. Esto incluye la reparación quirúrgica de la patología vascular si se identifica. La terapia trombolítica, sobre la cual hay pocos casos publicados, es compleja por la incertidumbre del diagnóstico inicial y la posibilidad de disección aórtica, cuya presencia la contraindica. El empleo de antiagregantes se recomienda como prevención secundaria en pacientes con factores de riesgo cardiovascular o patología vascular14.
Una vez establecido el cuadro, es preciso el inicio de tratamiento rehabilitador. La recuperación motora completa ocurre en menos de un tercio de los pacientes y suele presentarse en las primeras 2-4 semanas. Se relaciona con la mejoría en las exploraciones neurológicas y fuerza conservada en los abductores y extensores de las rodillas. Déficits más extensos sin mejoría inicial suelen relacionarse con peor pronóstico15.
En conclusión, el infarto medular es una patología poco frecuente, aguda e invalidante, que supone un alto impacto sobre la calidad de vida de los pacientes. Hay muy pocos casos descritos de pacientes con pródromos, en los cuales el cuadro clínico no se establece plenamente y los síntomas remiten espontáneamente. Mantener un alto grado de sospecha, identificar las causas tratables y proporcionar el tratamiento adecuado debe ser nuestra pauta de actuación habitual.
FinanciaciónEste trabajo ha sido realizado sin financiación.
Conflicto de interesesLos autores declaramos no tener ningún conflicto de interés relacionado directa o indirectamente con los contenidos del manuscrito.
Los autores agradecemos al Servicio de Radiología del Complejo Hospitalario Ciudad de Jaén su colaboración en la realización de este trabajo; especialmente a la Dra. Ana María Carrillo Colmenero.