La granulomatosis de Wegener, la poliangeítis microscópica, la vasculitis limitada al riñón y el síndrome de Churg-Strauss son vasculitis ANCA positivas e incluidas dentro de las vasculitis de pequeño vaso. El tratamiento de estas entidades se ha estandarizado durante la última década, fundamentalmente como consecuencia de la aportación de los ensayos clínicos promovidos por el grupo EUVAS. De forma resumida, el tratamiento de las formas generalizadas incluye la fase de inducción de la remisión y posteriormente el mantenimiento de ésta. El tratamiento de inducción de la remisión es distinto en función de la gravedad de la enfermedad. Así, para las formas que comienzan con creatinina <500 mmol/l, el tratamiento de elección son los bolos de ciclofosfamida y la prednisona. En cambio, para las formas más severas o con hemorragia pulmonar, el tratamiento de elección incluye la ciclofosfamida oral y la prednisona junto con la plasmaféresis. En ambos casos se efectuarán los pertinentes ajustes de inmunodepresores en función de la edad y la función renal con el fin de minimizar los efectos secundarios. Una vez conseguida la remisión, el tratamiento de mantenimiento con el que hay más experiencia es la combinación de azatioprina y dosis bajas de corticoides. En el artículo se presentan alternativas a este esquema basadas en nuevos inmunodepresores, así como el tratamiento de las formas refractarias.
INTRODUCCIÓN
Las vasculitis asociadas a anticuerpos frente al citoplasma de los neutrófilos (ANCA) incluyen la poliangeítis microscópica, la granulomatosis de Wegener, la enfermedad de Churg-Strauss y las formas de vasculitis limitadas al riñón. En la clasificación de Chapel-Hill, estas enfermedades están incluidas como vasculitis de pequeño vaso, si bien en ocasiones pueden afectar a vasos de mediano calibre1. Su incidencia en la población es muy baja y se cifra en 2,4 casos por millón de habitantes en el caso de la enfermedad de Churg- Strauss, 3,6 casos por millón en la poliangeítis microscópica y 10 casos en la granulomatosis de Wegener2,3. Como es sabido, en España, como en todo el sur de Europa, la incidencia de la poliangeítis microscópica es superior a la de la granulomatosis de Wegener, por razones que aún se desconocen.
Desde el punto de vista clínico, todas estas entidades cursan en el riñón con una glomerulonefritis necrosante pauciinmune con proliferación extracapilar, siendo también frecuente la aparición de afectación pulmonar en forma de hemorragia pulmonar1. Como se trata de vasculitis sistémicas, se puede observar afectación en prácticamente todos los órganos, hecho que ocurre en distintos porcentajes en función del subtipo de vasculitis.
Como factor diferencial, el síndrome de Churg-Strauss es una forma de vasculitis caracterizada por una inflamación granulomatosa rica en eosinófilos del tracto respiratorio que cursa habitualmente con asma y eosinofilia periférica.
Desde el punto de vista diagnóstico, se considera fundamental la consecución de tejido que permita el diagnóstico histológico, así como la determinación de ANCA por inmunofluorescencia y ELISA. La sensibilidad y especificidad diagnóstica de estos anticuerpos para estas enfermedades es alta, relacionándose fundamentalmente los p-ANCA con especificidad MPO con la poliangeítis microscópica y los c-ANCA con especificidad PR3 con la granulomatosis de Wegener4,5.
Hasta el inicio del tratamiento con corticoides, la mortalidad de los pacientes con vasculitis sistémicas era aproximadamente del 80-90% al año de seguimiento. Desde la introducción de las nuevas formas de tratamiento que incluyen la ciclofosfamida y los corticoides, y que serán objeto de revisión detallada en este artículo, la mortalidad ha bajado de forma muy importante y se ha situado alrededor del 20-25% a 5 años de seguimiento, pero la morbilidad se ha convertido en un fenómeno muy frecuente (50%) y preocupante. Los dos principales determinantes de mal pronóstico son la edad avanzada y la función renal muy deteriorada en el momento del diagnóstico6. Antes de iniciar el bloque destinado al análisis del tratamiento de las vasculitis de pequeño vaso, es importante profundizar en distintos conceptos, como son los instrumentos clínicos de valoración de la actividad vasculítica y los marcadores serológicos de actividad, que ayudarán a discernir entre una vasculitis activa y una inactiva.
La categoría de enfermedad sistémica hace que la valoración de los síntomas y signos sea compleja, numerosa y subjetiva. Además, las personas con vasculitis tienen recaídas frecuentes y, en conjunto, se hace difícil considerar la clínica de las vasculitis de manera homogénea. En consecuencia, aparece la necesidad de establecer un método fiable y fácil de entender en lo que se refiere a la valoración clínica. Así nació el llamado BVAS (Birmingham Vasculitis Activity Score). Este método puntúa numéricamente los síntomas de 9 órganos o sistemas pudiendo obtener una puntuación máxima de 63 puntos. Se considera que un paciente está en remisión cuando la puntuación de sus síntomas en el BVAS no supera los 5 puntos. Dada la baja incidencia y prevalencia de la enfermedad, este índice es de vital importancia para valorar de forma uniforme a los pacientes y los resultados de los tratamientos entre distintos trabajos. Una alta puntuación inicial está asociada a un alto riesgo de mortalidad7.
En el laboratorio, se sabe que la PCR es un marcador ampliamente utilizado en la monitorización de la actividad clínica de los pacientes con granulomatosis de Wegener y poliangeítis microscópica8,9, y que se correlaciona razonablemente bien con el BVAS7. Los niveles de esta proteína son altos durante la fase de actividad y disminuyen hasta normalizarse en un período de entre 10- 20 días una vez iniciado el tratamiento inmunodepresor. También se ha demostrado que este marcador sube en las recaídas, si bien no las precede ni es útil para diferenciar entre actividad vasculítica e infección o inflamación por otra causa. A pesar de las dudas sobre la utilidad de su uso, los otros marcadores de actividad son los p-ANCA anti-MPO y los c-ANCA anti-PR3. Estos anticuerpos han demostrado que tienen una buena correlación con la actividad clínica, siendo positivos en el momento del diagnóstico y mayoritariamente negativos a los 3-6 meses de la remisión clínica. Cabe considerar que la elevación de ANCA o su mantenimiento a títulos altos es un signo de alarma que hay que tener muy en cuenta, valorado conjuntamente con la clínica y la PCR. En cambio, en los pacientes asintomáticos con PCR normal y ANCA negativos la recaída es excepcional10,11.
TRATAMIENTO DE LAS VASCULITIS ANCA POSITIVAS
El esquema de tratamiento de las vasculitis de pequeño vaso ANCA positivas hoy en día se subdivide en función del estadio de la enfermedad y de la gravedad de ésta. Así, de forma esquemática, cabe decir que, respecto al estadio, el tratamiento se divide en fase de inducción de la remisión y fase de mantenimiento de ésta. Respecto a la gravedad de la enfermedad, se divide en tratamiento de las formas localizadas y de las formas sistémicas. Entre estas últimas destacan las formas tempranas, las formas con afectación renal y creatinina <500 mmol/l, las formas con afectación renal muy severa (creatinina >500 mmol/l) o con hemorragia pulmonar importante y, finalmente, el tratamiento de las formas refractarias.
Generalidades
El primer aspecto importante que se debe considerar es que la gran mayoría de estudios sobre tratamiento de vasculitis ANCA positivas incluyen conjuntamente a pacientes con poliangeítis microscópicas, granulomatosis de Wegener y formas de vasculitis limitadas al riñón. Así, a pesar de que entre estas entidades existen factores clínicos diferenciales claros, como el hecho de que los pacientes con granulomatosis de Wegener o vasculitis asociadas a ANCA tienen claramente más recaídas que los afectados de poliangeítis (según la experiencia propia, el doble), el tratamiento definido para todas ellas es el mismo.
Clásicamente, el tratamiento estándar de este grupo de enfermedades ha incluido la ciclofosfamida y la prednisona después de demostrarse que los corticoides solos tenían unos índices de remisión más bajos que la combinación (55% frente al 90%) y unos porcentajes de recaídas y mortalidad francamente superiores. El principal problema de esta combinación de fármacos es la alta morbilidad que conlleva a nivel infeccioso, neoplásico, endocrino y ovárico12. Durante muchos años, la forma escogida para la administración de la ciclofosfamida ha sido la vía oral, que conseguía índices de remisión próximos al 90% a los pocos meses de iniciado el tratamiento. A partir de la segunda mitad de la década de 1990, y siguiendo la política usada en el lupus eritematoso sistémico (LES), se empezó a valorar la utilización de la ciclofosfamida en bolo con la intención de minimizar los efectos secundarios debidos a una reducción del 75% de la dosis del citado citostático. El año 2001, un primer metaanálisis demostró que esta modalidad de tratamiento tenía unos resultados parecidos en cuanto a mortalidad o evolución hacia la insuficiencia renal crónica (IRC), con menos incidencia de leucopenia (OR [odds ratio] 0,36) y menos episodios infecciosos relacionados (OR 0,45) que con la forma de administración oral14. Quedaban aún muchos interrogantes para averiguar respecto a la forma de utilización de la ciclofosfamida, dado que las pautas de tratamiento eran muy distintas en los diferentes trabajos analizados, no se disponía de datos claros respecto a índices de remisiones ni recaídas de ambas modalidades de tratamiento, y porque tampoco se conocía si esta forma de tratamiento era útil para el conjunto de vasculitis de pequeño vaso o sólo para algunas formas leves. A partir de estas fechas y en el seno del grupo europeo para el estudio de las vasculitis (EUVAS), se han desarrollado distintos ensayos clínicos a gran escala que han permitido disponer de evidencias sobre el tratamiento de estas entidades en sus diferentes grados de severidad.
Tratamiento de las formas de vasculitis de pequeño vaso localizadas
Definición
Se considera una forma de vasculitis localizada aquella en la que los síntomas están restringidos al tracto respiratorio superior y/o inferior sin síntomas sistémicos o constitucionales asociados.
Inducción de la remisión
En la década de 1980 se constató la utilidad del cotrimoxazol, solo o en combinación con ciclofosfamida, en una serie corta de pacientes con granulomatosis de Wegener, en la mayoría de ellos localizada15. Posteriormente, otros estudios han evidenciado una respuesta favorable y sostenida al cotrimoxazol en las formas de granulomatosis de Wegener localizada. En concreto, 11 de 20 pacientes tuvieron una buena respuesta con seis remisiones completas y cinco remisiones parciales16.
Mantenimiento de la remisión
Existe poca bibliografía disponible sobre este particular. Un único ensayo clínico aleatorizado publicado compara la utilización de cotrimoxazol frente a placebo en el mantenimiento de la remisión después de utilizar ciclofosfamida y prednisona en la inducción. Los resultados muestran una reducción del 40 al 18% en el grupo tratado con cotrimoxazol respecto al placebo, hecho no demostrado en pacientes con afectación renal o pulmonar importante. Hay que destacar el bajo número de casos del ensayo clínico, lo cual limita seriamente las conclusiones del estudio17.
Enfermedad sistémica precoz (Early Systemic Disease)
Definición
El grupo EUVAS definió como Early Systemic Disease a aquellos pacientes con granulomatosis de Wegener localizada, con síntomas constitucionales, o con una granulomatosis de Wegener multifocal o una poliangeítis microscópica sin afectación orgánica vital. Así, se admite una afectación renal con creatinina <1,7 mg/dl o afectación respiratoria siempre que la presión parcial de oxígeno (pO2) sea superior a 70 mmHg y la DLCO (capacidad de difusión del pulmón para el monóxido de carbono) sea superior al 70%.
Inducción de la remisión
La pauta de tratamiento básica consta en intentar utilizar pautas menos agresivas de inmunodepresión que las clásicas a base de ciclofosfamida en dosis altas y prednisona, muchas de ellas basadas en el uso de metotrexato. En los cuatro estudios prospectivos no controlados el porcentaje de remisión con este fármaco oscila entre el 35 y el 75% en función de la dosis de corticoides utilizada concomitantemente18- 20. Con estos antecedentes, el grupo EUVAS diseñó un ensayo clínico aleatorizado, llamado NORAM, en el que comparaba la seguridad y eficacia del tratamiento con metotrexato y prednisona con una pauta clásica de ciclofosfamida y prednisona en la inducción de la remisión (n = 100). Los resultados del estudio constataron unos índices de remisión a 6 meses del grupo a metotrexato comparables a la pauta clásica (89,8 frente al 93%), si bien la respuesta al fármaco prueba fue más lenta que con la ciclofosfamida en los pacientes con afectación pulmonar relevante21. Otras pautas probadas para este grupo de enfermos, como son el uso de anti-TNF añadidos al tratamiento con metotrexato y corticoides, no han aportado buenos resultados clínicos22.
Mantenimiento de la remisión
Los datos existentes en la literatura científica también apoyan el uso de metotrexato en el mantenimiento de la remisión de este grupo de enfermos a pesar de que las tasas de recaída son altas (70% a los 18 meses de seguimiento en el estudio NORAM21). La comparación entre la estrategia de mantenimiento basada en cotrimoxazol y metotrexato en dosis bajas (0,3 mg/kg semana) ha demostrado la superioridad de este último. Como consecuencia del alto índice de recaídas con la citada pauta, se considera fundamental combinar el tratamiento con una vigilancia clínica estricta del paciente para conseguir diagnosticar precozmente las recaídas en caso de que aparezcan23.
Tratamiento de las formas sistémicas
A raíz de los trabajos publicados por el grupo EUVAS, el tratamiento de las vasculitis de pequeño vaso ANCA positivas se ha dividido, según la gravedad de la afectación renal, entre aquellos pacientes que comienzan con unos valores de creatinina <500 mmol/l (ensayo CYCLOPS) y aquellos que lo hacen con creatinina >500 mmol/l (ensayo MEPEX). Para cada una de estas situaciones se diseñó hace años un ensayo clínico multicéntrico a nivel europeo cuyos resultados han permitido estandarizar el tratamiento de las vasculitis con afectación renal.
Inducción de la remisión con creatinina <500 mmol/l
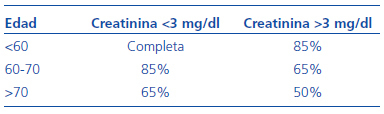
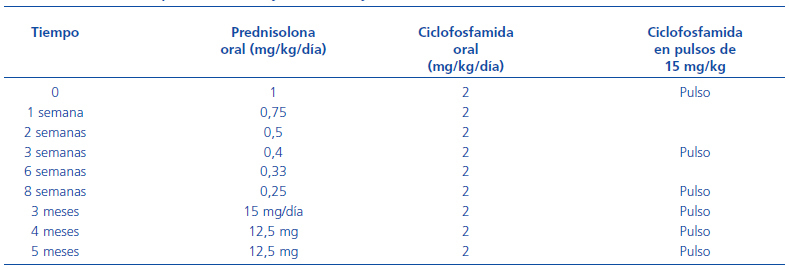
El ensayo CYCLOPS24 tenía como objetivo comparar la eficacia y la seguridad de una pauta de inducción de la remisión basada en ciclofosfamida oral y corticoides con otra pauta basada en los bolos de ciclofosfamida junto con la misma dosis de corticoides. Uno de los grandes logros de los ensayos del grupo EUVAS, independientemente de los resultados, ha sido definir una pauta uniforme de tratamiento en los distintos grupos. Así, en la actualidad existe un acuerdo generalizado sobre las pautas de corticoides que se deben utilizar y sobre las modificaciones de dosis de ciclofosfamida según edad y función renal, así como sobre los controles hematológicos que habrá que realizar (véanse las tablas 1 [dosis de ciclofosfamida y prednisona en el tratamiento de las vasculitis con creatinina <500 mmol/l] y 2 [reducción de dosis según función renal y edad para la ciclofosfamida]).
Los resultados del citado estudio (n = 149) pusieron de manifiesto que no existían diferencias entre el porcentaje, el tiempo de consecución de la remisión, ni la mortalidad entre ambos grupos pero, en cambio, el grupo tratado con ciclofosfamida en bolo permitía reducir de 16 a 8 g la dosis total de ciclofosfamida con una OR para leucopenia de 0,4. Previamente a la publicación de este trabajo, un metaanálisis ya parecía entrever los buenos resultados de la ciclofosfamida administrada en forma de pulsos, con la salvedad de un discreto incremento de las recaídas14.
Inducción de la remisión con creatinina >500 mmol/l
Los pacientes con afectación renal severa que cursan con insuficiencia rápidamente progresiva, especialmente aquellos en los que coexiste una hemorragia pulmonar severa con insuficiencia respiratoria, tienen mal pronóstico vital a corto plazo y un alto índice de secuelas (diálisis) o complicaciones. La pauta de tratamiento empleada es muy agresiva y combina la ciclofosfamida por vía oral con los bolos de metilprednisolona en dosis altas. Además, desde hace muchos años se sugiere que es beneficioso añadir a la citada terapia la plasmaféresis en casos con insuficiencia renal severa y hemorragia alveolar, con la intención de disminuir la cantidad de ANCA circulante y mejorar la supervivencia renal25,26. Para confirmar esta hipótesis, se decidió realizar el ensayo MEPEX (n = 151), que comparaba la eficacia y la seguridad en la inducción de la remisión de una pauta de ciclofosfamida oral y 3 bolos de 15 mg/kg de metilprednisolona con pauta descendente posterior de prednisona con una pauta de ciclofosfamida y prednisona estándar junto con 7 sesiones de plasmaféresis en 15 días. Los resultados demostraron que la pauta con plasmaféresis es igualmente segura y permite un mayor índice de recuperación de la función renal y disminución de las necesidades de tratamiento sustitutivo a un año de seguimiento. Cabe destacar que la mortalidad a un año del ensayo fue del 25%27.
Mantenimiento de la remisión
A diferencia de lo que ocurre con la inducción de la remisión, no existen trabajos que diferencien la aproximación terapéutica del mantenimiento de la remisión, en función del tratamiento de inducción utilizado o de la gravedad inicial de la enfermedad. Es sabido que el porcentaje de recaídas en estos enfermos es alto, especialmente en las vasculitis tipo granulomatosis de Wegener o poliangeítis con ANCA anti-PR3. También es conocido que las recaídas aumentan si el paso entre la fase de inducción de la remisión y de mantenimiento ocurre aun con ANCA positivos o bien cuando, pasados años de inactividad clínica, se retira toda la medicación inmunodepresora.
Las estrategias de mantenimiento de la remisión pasan indefectiblemente por intentar ahorrar inmunodepresión y reducir la dosis acumulada de ciclofosfamida y, en este sentido, el tratamiento con azatioprina está ampliamente validado28. Otros tratamientos como el micofenolato mofetil o la leflunomida pueden ser considerados como alternativas.
El estudio CYCAZAREM (n = 158) (Randomized Trial of Cyclophosphamide vs Azathioprine During Remission in ANCA-Positive Systemic Vasculitis)28 permitió comparar los resultados de ciclofosfamida con azatioprina para el mantenimiento de la remisión. El resultado fue que la azatioprina es tan eficaz como la ciclofosfamida en el mantenimiento de la remisión (porcentaje de recaídas del 13,7% en el grupo tratado con ciclofosfamida y del 15,5% en el grupo tratado con azatioprina), con menos efectos secundarios (84 episodios en el grupo tratado con ciclofosfamida y 61 en el grupo tratado con azatioprina). Recientemente ha aparecido un trabajo en el que se compara azatioprina (2 mg/kg) con metotrexato (25 mg/semana) como tratamiento de mantenimiento de la remisión, y en el que se comprueba que ambos grupos tienen un porcentaje similar de recaídas (20%) y de efectos secundarios29.
Con el esquema de tratamiento establecido por el grupo EUVAS en sus distintos protocolos, el pronóstico de las vasculitis ha mejorado notablemente. El estudio a largo plazo de los pacientes españoles que entraron en los citados estudios indica que la supervivencia a 9 años de seguimiento de esta cohorte ha sido alta (65%). La mortalidad es más importante durante los dos primeros años, y es mayor en los pacientes del grupo con valores de creatinina >500 mmol/l (55%) que en el grupo en el que estos valores son inferiores (30%). La morbilidad acumulada también ha sido muy importante, por lo que hará falta buscar nuevas estrategias de tratamiento que permitan reducir la mortalidad de los pacientes más graves, las recaídas y la toxicidad farmacológica.
Alternativas terapéuticas
Existen distintos fármacos que en un futuro pueden tener un papel dentro del esquema terapéutico de las vasculitis de pequeño vaso (micofenolato mofetil, leflunomida, deoxispergualina, rituximab o inmunoglobulinas).
Micofenolato mofetil
Uno de los fármacos de nueva generación con el que se está adquiriendo mayor experiencia es el micofenolato mofetil30-34, especialmente en la fase de mantenimiento de la remisión como sustituto de la azatioprina, con buenos resultados.
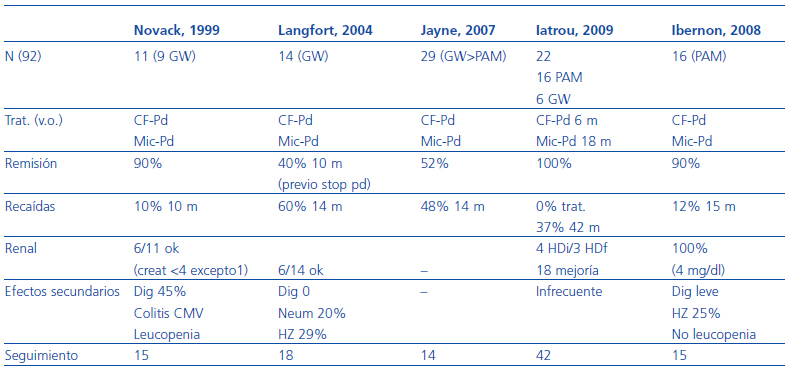
En la tabla 3 se resumen los resultados de los trabajos realizados con micofenolato en el mantenimiento de la remisión. Su utilización durante la fase de inducción es más reciente, hay menos experiencia y se suele circunscribir a pacientes con vasculitis sistémica con valores de creatinina al diagnóstico <500 mmol/l resistentes al tratamiento convencional, así como brotes de vasculitis en pacientes que ya han recibido dosis altas de CF acumuladas. Existen muy pocos datos sobre el tratamiento de inducción con micofenolato mofetil en primeros brotes. Recientemente se ha publicado la experiencia de Hu et al.30 quienes comparan la eficacia del tratamiento con micofenolato mofetil (n = 17) y ciclofosfamida en bolos (n = 18) en un grupo de pacientes con vasculitis mayoritariamente ANCA anti-MPO positivas con afectación renal (creatinina >1,8 mg/dl). Los resultados muestran unos índices de RC del 77% en el grupo tratado con micofenolato y del 44% en el grupo tratado con ciclofosfamida en bolo, así como una disminución muy importante del BVAS a partir de los 3 meses. En las tablas 3 y 4 se resumen los resultados clínicos disponibles con este fármaco en la inducción de la remisión.
En resumen, según nuestra opinión, las posibles indicaciones actuales de este fármaco son las siguientes:
1. Resistencia a los tratamientos convencionales.
2. Intolerancia a los tratamientos de primera elección.
3. Dosis acumulada importante previa de ciclofosfamida que limite su nuevo uso en el caso de recidivas.
4. Minimización de efectos secundarios de las pautas con ciclofosfamida, azatioprina y esteroides (esterilidad, toxicidad medular, infecciones a neoplasias).
Dado el posible potencial de este fármaco, actualmente están en marcha dos ensayos clínicos multicéntricos auspiciados por el grupo EUVAS; el primero compara la eficacia y la seguridad de micofenolato mofetil frente a azatioprina en el mantenimiento de la remisión, y el segundo compara ciclofosfamida y micofenolato en la inducción de la remisión en pacientes con vasculitis ANCA positivas sin hemorragia pulmonar ni insuficiencia renal avanzada.
Vasculitis refractarias
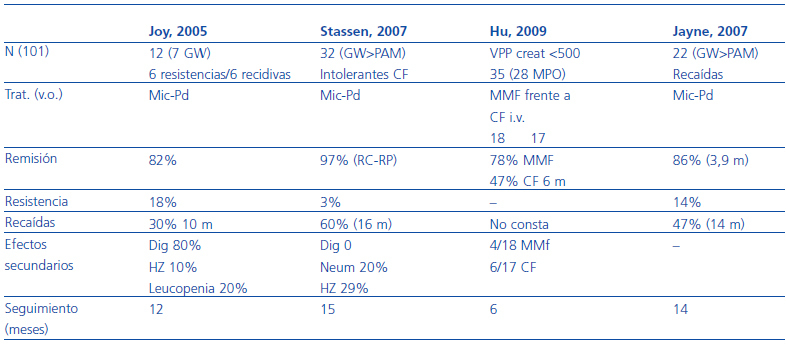
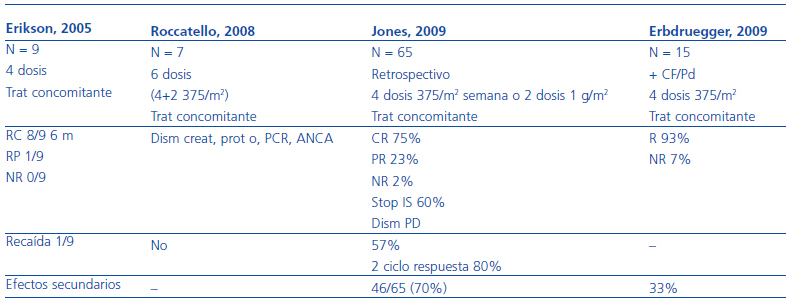
Aproximadamente, un 10% de los pacientes con vasculitis ANCA positivos son refractarios al tratamiento estándar. Existe muy poca experiencia en este campo, las definiciones de «forma refractaria» no son homogéneas, y no hay ensayos clínicos aleatorizados que permitan definir cuál es el tratamiento de elección. En este escenario, clásicamente se había utilizado ciclofosfamida en dosis altas (4 mg/kg) o la depleción de células T. Más recientemente, el arsenal terapéutico se ha abierto considerablemente, y se han probado fármacos como el micofenolato mofetil30-34, la deoxispergualina35, las inmunoglobulinas36, los anti-TNF y, especialmente el rituximab37-40. Respecto a la deoxispergualina35, un trabajo indica que se rescatan el 70% de formas refractarias, entre remisiones completas y parciales, y que las recaídas a los 18 meses de seguimiento son de, aproximadamente, el 20%. Finalmente, en los últimos años está aumentando la experiencia de añadir rituximab al tratamiento convencional con resultados prometedores. Los resultados obtenidos con este fármaco en formas refractarias se resumen en la tabla 5.
Síndrome de Churg-Strauss
La gran mayoría de estudios sobre el síndrome de Churg- Strauss los ha desarrollado en Francia el grupo de estudio de vasculitis de este país41-44, que ha propuesto una puntuación (score) para predecir el grupo de pacientes a los que es útil proporcionarles una pauta más agresiva de inmunodepresión por ser los de mal pronóstico. El score incluye los siguientes factores: a) presencia de insuficiencia renal; b) proteinuria >1 g/día; c) aparición de sangrado digestivo, perforación intestinal o pancreatitis; d) afectación del sistema nervioso central, y e) miocardiopatía. La presencia de más de un factor en un mismo paciente permite considerarlo como de mal pronóstico. En este grupo de pacientes la introducción temprana de ciclofosfamida añadida a los corticoides mejora la supervivencia, no siendo así con la plasmaféresis.
¿Cuándo debe curar el tratamiento de mantenimiento de la remisión? Desafortunadamente, no existen estudios sobre la duración óptima del tratamiento inmunodepresor en la fase de mantenimiento de la remisión, pero parece probado que un mínimo de 12-18 meses son imprescindibles. A partir de aquí, se cree adecuado plantearse parar la medicación inmunodepresora, especialmente en casos de poliangeítis microscópica o vasculitis ANCA anti-MPO (menos recaídas que en granulomatosis de Wegener o vasculitis ANCAPR3 positivas) que estén asintomáticos, con una cifra de BVAS normal y con reactantes de fase aguda y ANCA negativos. No se dispone de datos sobre la utilidad de prolongar la inmunodepresión en dosis bajas entre el segundo y el cuarto año de seguimiento pero está en marcha un ensayo clínico del grupo EUVAS para responder a esta pregunta. A pesar de todas estas precauciones, las recaídas de las vasculitis ANCA positivas sin medicación son frecuentes, hecho que obliga en muchos casos a seguir administrando dosis bajas de esteroides durante largos períodos o a intensificar los controles clínicos y analíticos en caso de suspensión completa.
CONCLUSIONES
Las vasculitis ANCA positivas son un grupo de vasculitis de pequeño vaso que incluyen la granulomatosis de Wegener, la poliangeítis microscópica, el síndrome de Churg-Strauss y las vasculitis limitadas al riñón. En los últimos años el pronóstico vital de estas entidades ha mejorado mucho, pero sigue existiendo una alta mortalidad entre las personas de edad avanzada y los pacientes que inician el cuadro con una insuficiencia renal avanzada. El esquema de tratamiento que ha permitido dar este salto adelante en la evolución de las vasculitis ANCA positivas se describe a continuación.
Para las formas localizadas, puede ser adecuado el tratamiento con cotrimoxazol asociado o no a prednisona y para las formas llamadas early systemic el tratamiento de elección se considera el metotrexato junto con los corticoides.
En las formas sistémicas con afectación renal y valores de creatinina <500 mmol/l, la mejor opción terapéutica son los bolos de ciclofosfamida y corticoides para la inducción de la remisión, y azatioprina y corticoides para el mantenimiento de ésta al menos hasta los 2 años del diagnóstico.
Para las formas más severas con insuficiencia renal y valores de creatinina >500 mmol/l, la plasmaféresis asociada a ciclofosfamida oral y corticoides se considera la pauta más adecuada, superando la plasmaféresis a los bolos de metilprednisolona en cuanto a supervivencia renal a un año de seguimiento. Para el mantenimiento de la remisión, la pauta más validada es la que incluye azatioprina y corticoides. Uno de los problemas más importantes por resolver es la alta tasa de efectos secundarios observados con estas pautas inmunodepresoras, así como el momento de parar la inmunodepresión.
Como alternativas a la pauta propuesta, especialmente en casos de efectos secundarios o intolerancia a la ciclofosfamida o azatioprina, se dispone de micofenolato mofetil. Están en marcha distintos ensayos clínicos que comparan la pauta clásica con este fármaco.
Finalmente, en aproximadamente un 10% de casos, el tratamiento anteriormente descrito no es efectivo y se precisa rescate. Existe poca evidencia sobre la mejor opción en estos casos, pero parece que rituximab puede ser una buena opción.
Recomendaciones para las formas localizadas
Para la inducción y el mantenimiento de la remisión de esta forma de vasculitis, poco frecuente en nuestro medio, la pauta sugerida es el uso de cotrimoxazol junto con prednisona. Esta pauta tiene buenas tasas de respuesta y pocos efectos secundarios.
Recomendaciones para las formas early systemic
Con las evidencias disponibles, para la inducción de la remisión el metotrexato y la prednisona se consideran la pauta de elección por encima del uso de ciclofosfamida con prednisona. Para mantenimiento se puede utilizar esta pauta, que se recomienda mantenerla al menos un año. Cabe destacar que el uso de metotrexato está asociado a una tasa de recaídas alta por lo que se recomienda una vigilancia clínica estricta para evidenciar precozmente las recaídas.
Recomendaciones para las formas sistémicas
Para la inducción de la remisión de las formas con valores de creatinina <500 mmol/l, el tratamiento validado son los pulsos de ciclofosfamida (0,6 a 0,7g/m2) cada 3 semanas durante 3 meses asociado a prednisona. Para las formas que comienzan con valores de creatinina >500 mmol/l se usará como inducción de la remisión ciclofosfamida 2 mg/kg, prednisona 1 mg/kg con pauta decreciente junto con 7 sesiones de plasmaféresis en 14 días. La ciclofosfamida se ajustará según la edad y la función renal. La dosis de prednisona se inicia a 1 mg/kg con descenso progresivo hasta 10 mg a los 6 meses. Para el mantenimiento de la remisión, la pauta más probada es el uso de azatioprina (1,5-2 mg/kg) y corticoides en dosis bajas. A partir de los 2 años de seguimiento, se puede plantear para la inmunodepresión dejar dosis bajas de prednisona, especialmente en pacientes con vasculitis ANCA anti-MPO que mantienen niveles de ANCA negativos y sin marcadores inflamatorios. En caso de intolerancia al citado tratamiento, se puede usar micofenolato mofetil.
Recomendaciones para las formas refractarias
Para las formas refractarias, que representan aproximadamente un 10%, no hay acuerdo en el mejor tratamiento que se debe utilizar, pero una opción interesante es añadir rituximab al tratamiento con ciclofosfamida y prednisona.
Tabla 1. Ajustes de ciclofosfamida según edad y función renal
Tabla 2. Dosis de ciclofosfamida-prednisona. Ensayos CYCLOPS y MEPEX
Tabla 3. Resultados de micofenolato mofetil para el mantenimiento de la remisión
Tabla 4. Resultados de micofenolato mofetil en inducción de la remisión
Tabla 5. Rituximab para el tratamiento de las formas refractarias