Evaluar la eficacia de los ultrasonidos focalizados guiados por resonancia magnética en el tratamiento del dolor producido por metástasis óseas.
Material y métodosSe realizó una revisión sistemática de la literatura en las bases de datos MEDLINE, SCOPUS, EBSCO y Cochrane Database utilizando los siguientes términos de búsqueda y sus asociaciones: «Focused ultrasound surgery», «High intensity focused ultrasound», «Magnetic resonance imaging», «Neoplasms», «Metastases» y «Pain», en el período desde 1960 hasta octubre de 2014. Se incluyeron aquellos trabajos publicados en cuyo abstract se indicara como objetivo la evaluación del control del dolor por metástasis óseas con ultrasonidos focalizados guiados por resonancia magnética. Se evaluó el grado de evidencia de los estudios seleccionados siguiendo el sistema GRADE.
ResultadosSe obtuvieron 6 artículos, de los cuales 5 publicaciones correspondieron a estudios prospectivos de cohortes y un estudio fue aleatorizado, simple ciego, controlado contra placebo, multicéntrico. En todos los trabajos se obtuvo una reducción del dolor (entre 64,2-100%) acompañada de una disminución del tratamiento analgésico. Método dispar en la evaluación analgésica. Efectos secundarios (dolor y quemaduras cutáneas, entre otros) bien tolerados y transitorios.
ConclusionesLa mayoría de los estudios analizados muestran un nivel de evidencia bajo para poder concluir el grado de eficacia de los ultrasonidos focalizados guiados por resonancia magnética como tratamiento analgésico del dolor secundario a metástasis óseas. Se necesitan más estudios que respalden su uso rutinario.
The aim of the study is to evaluate the effectiveness of magnetic resonance-guided high-intensity focused ultrasound in the treatment of pain produced by bone metastases.
Material and methodsA systematic literature review was performed in the MEDLINE, SCOPUS, EBSCO and Cochrane databases, using the following research terms and their associations: “Focused ultrasound surgery”, “High intensity focused ultrasound”, “Magnetic resonance imaging”, “Neoplasms”, “Metastases” and “Pain”, for the period between 1960 and October 2014. Those published works were included in which it indicated the evaluation of the control of pain due to bone metastasis with magnetic resonance-guided high-intensity focused ultrasound in the objective of its abstract. The level of evidence of the studies selected was evaluated following the GRADE system.
ResultsSix articles were obtained, of which 5 were prospective cohort studies and one was a randomised, single-blinded, placebo-controlled, multicentre study. A reduction in pain (between 64.2 and 100%) accompanied by a decrease in the use of analgesic treatment was obtained in all the studies. Methods differed in the analgesic evaluation. Side effects (including pain, skin burns, etc.) were well tolerated and transient.
ConclusionsThe majority of studies analysed show a low level of evidence to be able to conclude the level of efficiency of magnetic resonance-guided high-intensity focused ultrasound as an analgesic treatment of pain due to bone metastases. More studies are needed that support its routine use.
Las metástasis óseas son frecuentes en muchos tumores sólidos, siendo su incidencia mayor en los cánceres de mama (65-75%), próstata (65-75%) y pulmón (30-40%)1. La presencia de este tipo de lesiones se asocia a un deterioro en la calidad de vida y una limitación funcional de los pacientes producidos principalmente por dolor, astenia y somnolencia2. Se han descrito varios mecanismos por los cuales las lesiones tumorales desencadenan dolor óseo: reacción inflamatoria local como resultado del daño directo de los tejidos por el crecimiento tumoral, lesión de las terminaciones nerviosas por la infiltración y/o compresión por las células tumorales3 e hiperinervación inducida por el tumor4.
Los principales tratamientos utilizados para este síndrome doloroso se basan en las terapias sistémicas (analgésicos, radionúclidos, bifosfonatos), tratamientos locales (radioterapia, cirugía), técnicas de ablación con láser, radiofrecuencia, crioablación y otros procedimientos como la cementoplastia o técnicas anestésicas invasivas5–7. La radioterapia es el tratamiento estándar para las metástasis óseas. Sin embargo, se ha descrito que posteriormente a su aplicación un 30-40% de los pacientes no experimentan mejoría en el dolor y un 27% de los casos sufren recurrencia del mismo8, por lo que puede ser necesaria una reirradiación de las lesiones. Este hecho se asocia a una mayor toxicidad e incluso un 40% de los pacientes no se benefician con la reirradiación9,10.
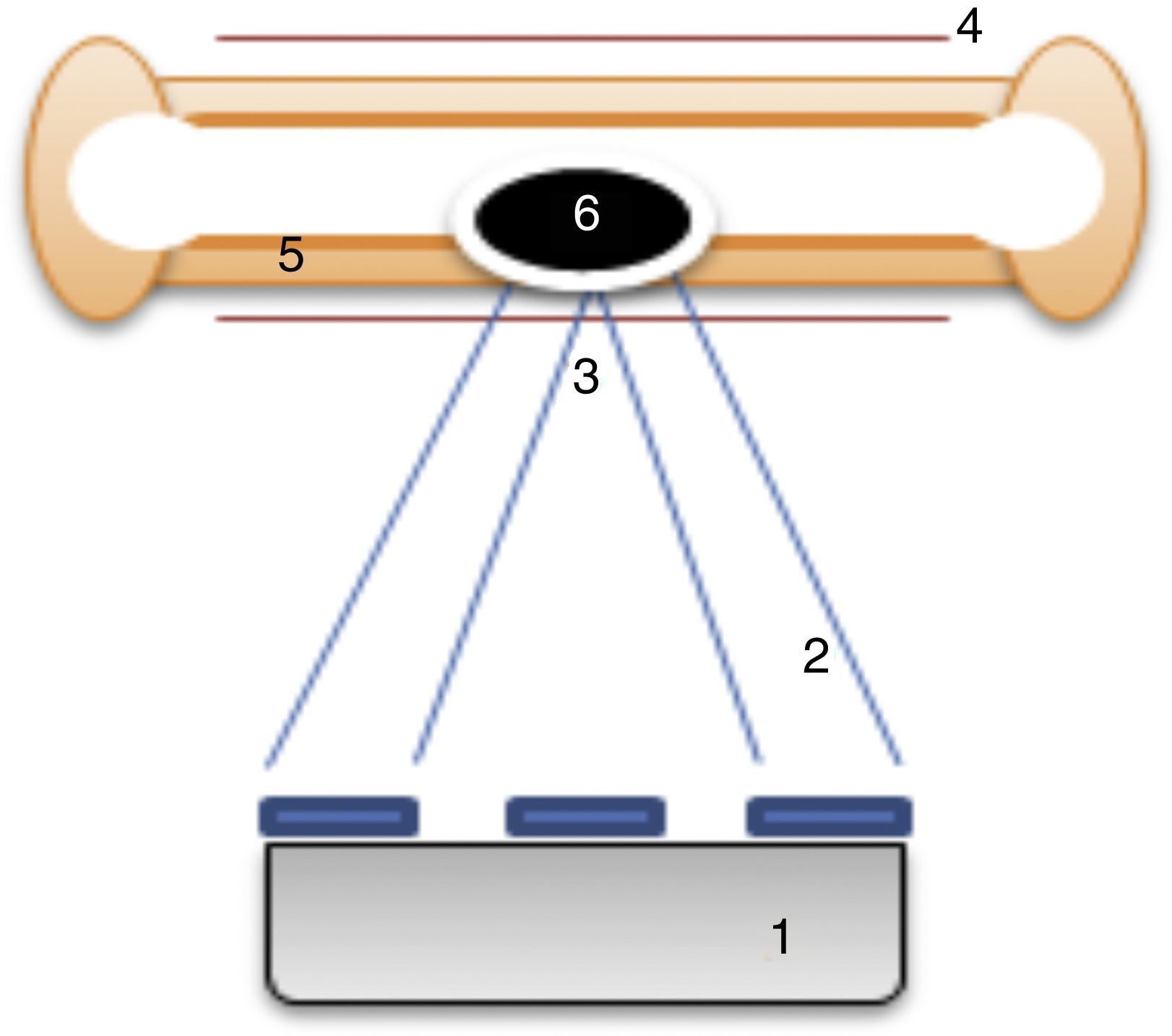
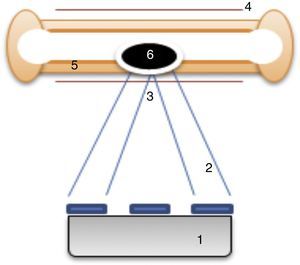
En los últimos años se han realizado investigaciones sobre el uso de ultrasonidos focalizados en el tratamiento de diversos tumores como el cáncer de próstata, el cáncer de mama, los fibromas uterinos o el osteoma osteoide, entre otros11,12. Esta técnica consiste en la aplicación de energía en forma de haces de ultrasonidos desde un transductor emisor integrado en una resonancia magnética. Guiados por esta prueba de imagen se emiten los haces de ultrasonidos desde el exterior del paciente y se concentran en un punto concreto (punto de sonificación). Los haces, al confluir, provocan un aumento de la temperatura local suficiente como para destruir el tejido tumoral13. La combinación del ultrasonido focalizado con las imágenes de resonancia magnética (MRgFUS) permite una planificación precisa del tratamiento, una monitorización en tiempo real del tejido en la zona específica de lesión, una termometría en tiempo real que permite un mapeo continuo de la temperatura utilizada, y una evaluación inmediata de la respuesta local11. Los pasos principales para la realización de un tratamiento con MRgFUS se describen en la tabla 1.
Secuencia de procedimientos para la realización de un tratamiento con ultrasonidos focalizados guiados por resonancia magnética
| 1. Sedación y analgesia (anestesia local/sedación consciente/anestesia general) |
| 2. Posicionamiento del paciente en la «mesa» del MRgFUS |
| 3. El sitio de la lesión debe dirigirse hacia el transductor de ultrasonido (sin interferencias) |
| 4. Verificación de la localización de la lesión mediante imagen de resonancia magnética |
| 5. El área de tratamiento es marcada en la estación de trabajo del MRgFUS |
| 6. Generación del plan de tratamiento optimizando el número de sonificaciones, la localización y el nivel de energía (evitando lesionar otros tejidos) |
| 7. Verificación del posicionamiento correcto utilizando una dosis subterapéutica |
| 8. Inicio del tratamiento con el equipo de MRgFUS alcanzando temperaturas ablativas de 65 a 85°C |
| 9. Termometría en tiempo real e imágenes anatómicas con resonancia magnética durante cada sonificación |
| 10. Al completar el tratamiento se obtienen imágenes contrastadas del área tratada |
Adaptada de Hurwitz et al.20.
Más recientemente se ha utilizado esta técnica para el tratamiento de metástasis óseas dolorosas, ya que la absorción del ultrasonido por la corteza del hueso es 50 veces superior a la de otros tejidos y solo una pequeña fracción de la energía penetra la corteza. Este hecho produce un rápido incremento de la temperatura y un daño crítico en el periostio, que es la zona más inervada del hueso maduro12 (fig. 1). También se describe que podría producirse ablación de la masa tumoral13. Los efectos secundarios, aunque poco frecuentes, son las quemaduras térmicas y el daño de estructuras cercanas sensibles al calor, como las estructuras nerviosas o la pared intestinal12,13. En general, se describe al MRgFUS como un tratamiento no invasivo, que no requiere de radiación ionizante, sin existencia de dosis límite y con posibilidad de repetición del tratamiento. Por otra parte, permite su administración de forma ambulatoria12.
El objetivo de este artículo es brindar al lector una revisión sistemática sobre la eficacia del MRgFUS como tratamiento analgésico en el dolor secundario a metástasis óseas.
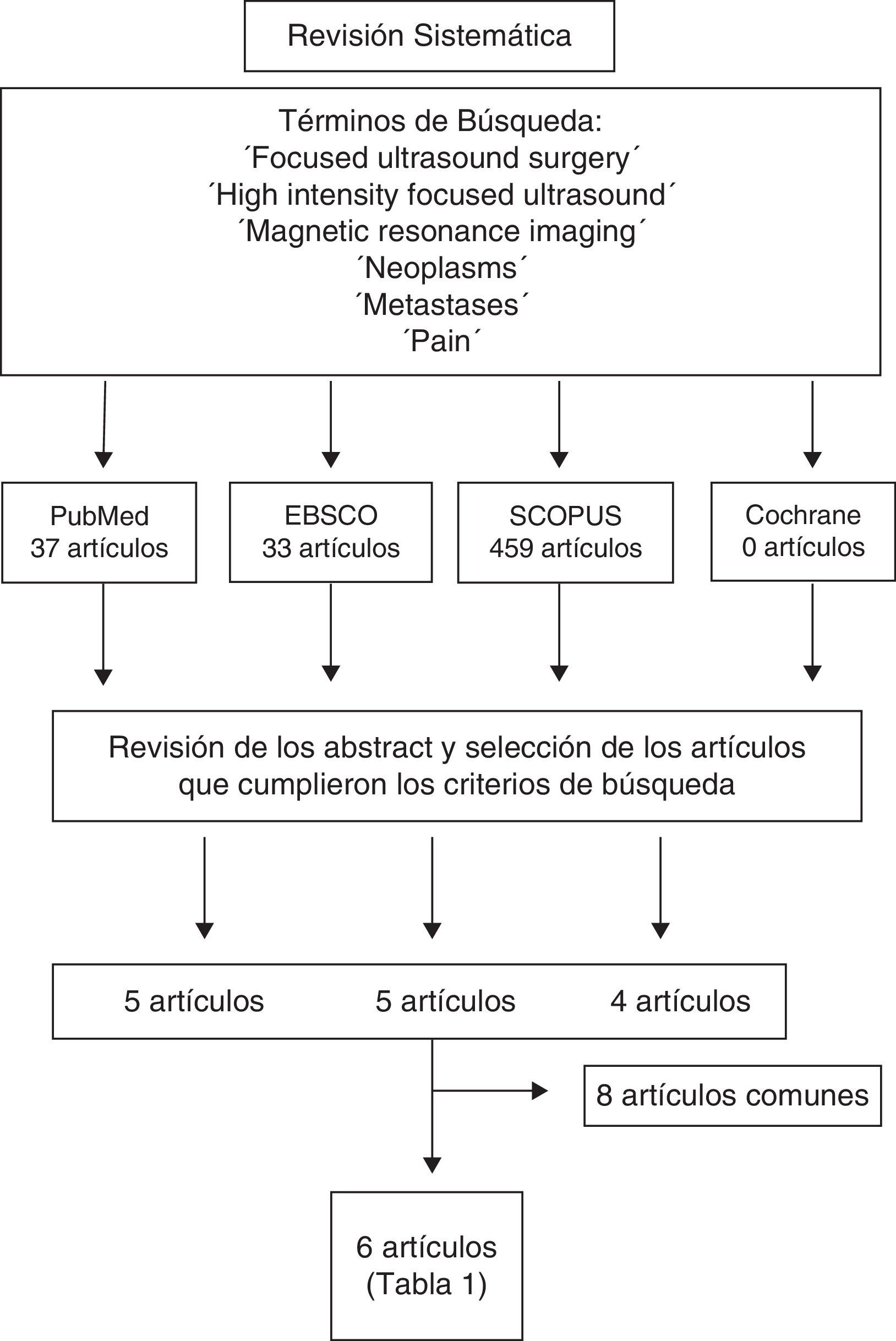
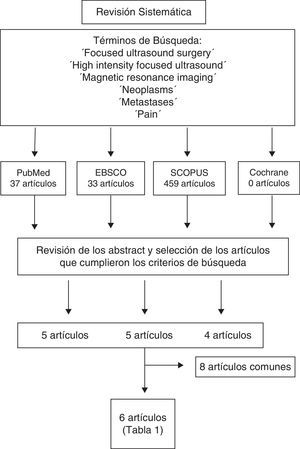
Material y métodosSe realizó una revisión sistemática de la literatura en las siguientes bases de datos: MEDLINE (1960-octubre 2014), EBSCO (1960-2014), SCOPUS (1960-2014) y Cochrane Database (1960-2014). Se utilizaron los siguientes términos de búsqueda y sus asociaciones: «Focused ultrasound surgery», «High intensity focused ultrasound», «Magnetic resonance imaging», «Neoplasms», «Metastases» y «Pain» (fig. 2).
Se analizaron los abstracts de estos artículos y se seleccionaron los documentos que cumplieran los siguientes criterios: estudios clínicos, uso de MRgFUS en el tratamiento del dolor por metástasis óseas, realizados en humanos, publicaciones en inglés, castellano, catalán y francés. Los artículos fueron revisados por 2 revisores de manera independiente (AVB y JGB). En caso de discrepancia se mantuvo reunión conjunta y se decidió la inclusión o no del artículo en cuestión.
Para evaluar el grado de evidencia de los estudios seleccionados se utilizó el sistema GRADE14.
ResultadosEn la búsqueda realizada se revisaron 37 artículos en MEDLINE, 459 en SCOPUS, 33 en EBSCO y 0 en Cochrane Database, de los cuales 6 cumplieron los criterios definidos. De los 6 artículos seleccionados, 5 corresponden a estudios prospectivos de cohortes15–19 y uno a un estudio aleatorizado, simple ciego, controlado contra placebo y multicéntrico20 (tabla 2). La información obtenida se resume en los siguientes apartados.
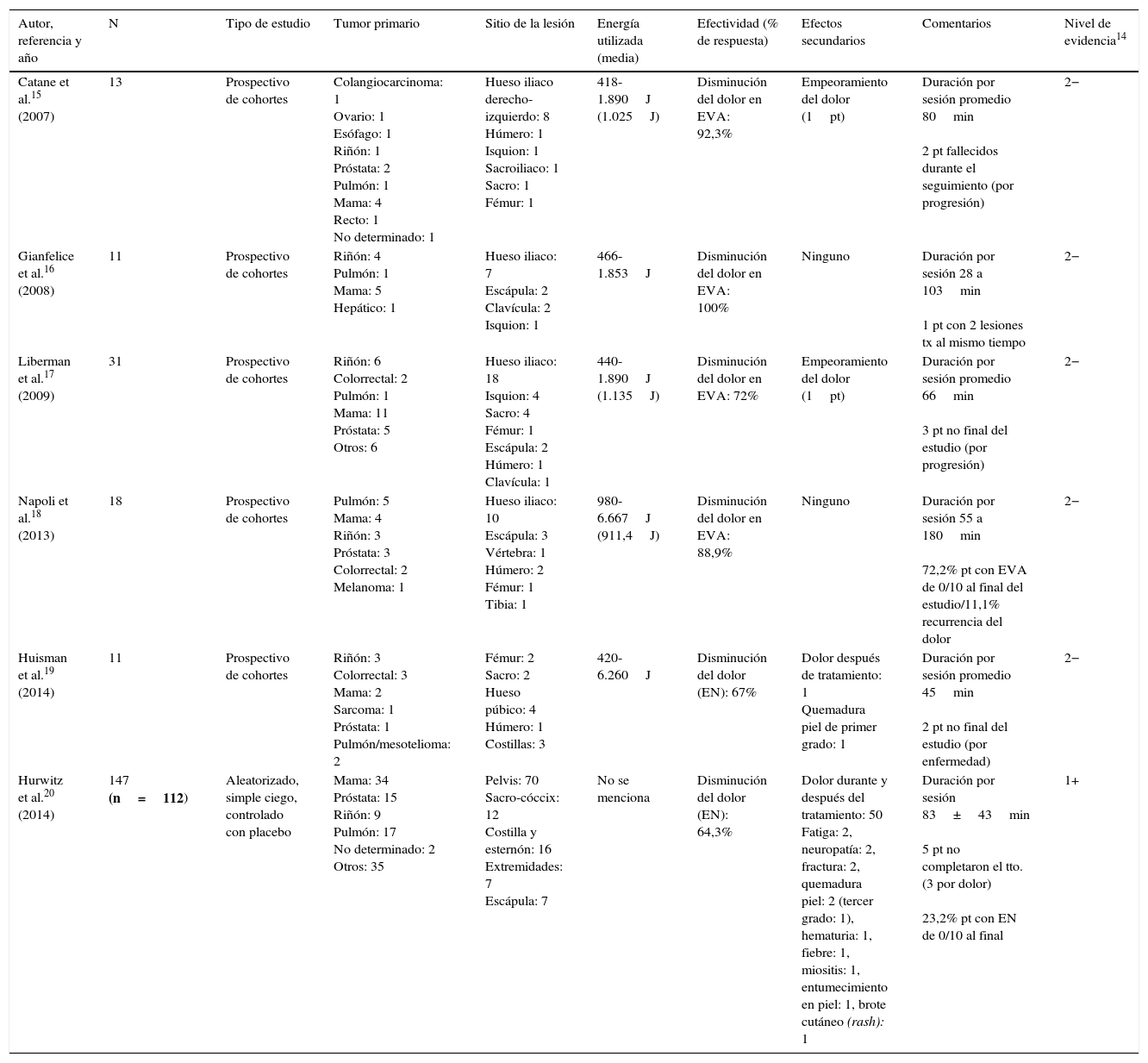
Datos principales de los estudios analizados
| Autor, referencia y año | N | Tipo de estudio | Tumor primario | Sitio de la lesión | Energía utilizada (media) | Efectividad (% de respuesta) | Efectos secundarios | Comentarios | Nivel de evidencia14 |
|---|---|---|---|---|---|---|---|---|---|
| Catane et al.15 (2007) | 13 | Prospectivo de cohortes | Colangiocarcinoma: 1 Ovario: 1 Esófago: 1 Riñón: 1 Próstata: 2 Pulmón: 1 Mama: 4 Recto: 1 No determinado: 1 | Hueso iliaco derecho-izquierdo: 8 Húmero: 1 Isquion: 1 Sacroiliaco: 1 Sacro: 1 Fémur: 1 | 418-1.890J (1.025J) | Disminución del dolor en EVA: 92,3% | Empeoramiento del dolor (1pt) | Duración por sesión promedio 80min 2 pt fallecidos durante el seguimiento (por progresión) | 2− |
| Gianfelice et al.16 (2008) | 11 | Prospectivo de cohortes | Riñón: 4 Pulmón: 1 Mama: 5 Hepático: 1 | Hueso iliaco: 7 Escápula: 2 Clavícula: 2 Isquion: 1 | 466-1.853J | Disminución del dolor en EVA: 100% | Ninguno | Duración por sesión 28 a 103min 1 pt con 2 lesiones tx al mismo tiempo | 2− |
| Liberman et al.17 (2009) | 31 | Prospectivo de cohortes | Riñón: 6 Colorrectal: 2 Pulmón: 1 Mama: 11 Próstata: 5 Otros: 6 | Hueso iliaco: 18 Isquion: 4 Sacro: 4 Fémur: 1 Escápula: 2 Húmero: 1 Clavícula: 1 | 440-1.890J (1.135J) | Disminución del dolor en EVA: 72% | Empeoramiento del dolor (1pt) | Duración por sesión promedio 66min 3 pt no final del estudio (por progresión) | 2− |
| Napoli et al.18 (2013) | 18 | Prospectivo de cohortes | Pulmón: 5 Mama: 4 Riñón: 3 Próstata: 3 Colorrectal: 2 Melanoma: 1 | Hueso iliaco: 10 Escápula: 3 Vértebra: 1 Húmero: 2 Fémur: 1 Tibia: 1 | 980-6.667J (911,4J) | Disminución del dolor en EVA: 88,9% | Ninguno | Duración por sesión 55 a 180min 72,2% pt con EVA de 0/10 al final del estudio/11,1% recurrencia del dolor | 2− |
| Huisman et al.19 (2014) | 11 | Prospectivo de cohortes | Riñón: 3 Colorrectal: 3 Mama: 2 Sarcoma: 1 Próstata: 1 Pulmón/mesotelioma: 2 | Fémur: 2 Sacro: 2 Hueso púbico: 4 Húmero: 1 Costillas: 3 | 420-6.260J | Disminución del dolor (EN): 67% | Dolor después de tratamiento: 1 Quemadura piel de primer grado: 1 | Duración por sesión promedio 45min 2 pt no final del estudio (por enfermedad) | 2− |
| Hurwitz et al.20 (2014) | 147 (n=112) | Aleatorizado, simple ciego, controlado con placebo | Mama: 34 Próstata: 15 Riñón: 9 Pulmón: 17 No determinado: 2 Otros: 35 | Pelvis: 70 Sacro-cóccix: 12 Costilla y esternón: 16 Extremidades: 7 Escápula: 7 | No se menciona | Disminución del dolor (EN): 64,3% | Dolor durante y después del tratamiento: 50 Fatiga: 2, neuropatía: 2, fractura: 2, quemadura piel: 2 (tercer grado: 1), hematuria: 1, fiebre: 1, miositis: 1, entumecimiento en piel: 1, brote cutáneo (rash): 1 | Duración por sesión 83±43min 5 pt no completaron el tto. (3 por dolor) 23,2% pt con EN de 0/10 al final | 1+ |
EN: escala numérica; EVA: escala visual analógica; pt: paciente; tto: tratamiento; tx: tratadas.
En los estudios analizados se incluyeron 231 pacientes, recibiendo tratamiento con MRgFUS un total de 196. Dichos pacientes tenían lesiones óseas metastásicas dolorosas que no habían tenido respuesta analgésica a otras opciones de tratamiento (incluyendo radioterapia antiálgica y tratamiento farmacológico), tenían contraindicación para reirradiación o los pacientes habían rechazado la radioterapia. El diagnóstico oncológico más frecuente fue el cáncer de mama, con 60 casos (30,6%), seguido por el cáncer de pulmón (27 pacientes; 13,7%) y el cáncer de próstata (26 pacientes; 13,2%). De 170 lesiones óseas tratadas, un 68,2% correspondían a lesiones osteolíticas. La localización principal de las lesiones (84%) fue en los huesos pélvicos.
Características del procedimientoPara la aplicación del procedimiento se realizó sedación consciente con midazolam (dosis de 2,5-10mg)15–17,19,20 o profunda con propofol intravenoso (dosis de inducción 0,5mg/kg; dosis de mantenimiento 5mg/kg/h)19 junto con analgesia con morfina intravenosa (dosis de 2-40mg)15,17 o fentanilo intravenoso (50-125mcg)16,19. Dos de los estudios no explican con precisión la técnica de sedación empleada18,20.
El tratamiento fue realizado con el equipo de ultrasonidos focalizados ExAblate® 2000-2100 (InSightec, Tirat Carmel, Israel)21 integrado con el equipo de resonancia magnética 1.5-T/3-T (General Electric, Milwaukee, EE. UU,)15–18,20, o con el MR-HIFU Sonalleve® (Philips Healthcare, Vantaa, Finlandia)22 integrado con el equipo de resonancia magnética Achieva 1.5-T (Philips Healthcare, Best, Países Bajos)19.
El 99% de los pacientes fueron tratados en una única sesión. En el estudio de Catane et al.15 dos pacientes fueron tratados en 2 ocasiones, uno por utilizar un insuficiente nivel de energía en el primer tratamiento, y otro por presentar 2 lesiones diferentes. El tiempo de duración de los procedimientos fue de 20 a 180min, y el número total de sonificaciones de 6 a 39 por sesión.
Seguimiento posterior al procedimientoLos esquemas de seguimiento tras el procedimiento de los diferentes estudios son muy variables entre sí. Se realizaron seguimientos de hasta un mes19, 3 meses17,18,20 o 6meses15,16, con evaluaciones intermedias también diferentes entre los distintos trabajos (24h, 3 días, una semana, 2 semanas, o bien mensual hasta la finalización del estudio).
Evaluación de la respuesta analgésicaPara evaluar la respuesta al tratamiento con MRgFUS la mayoría de los estudios17–20 utilizaron los criterios establecidos por la International Bone Metastases Consensus Working Party (tabla 3)23. Las escalas de medición del dolor utilizadas fueron la escala visual analógica15–18, la escala numérica 19,20 o el Brief Inventory Pain18,20. Dos estudios también evaluaron la calidad de vida de los pacientes tratados16,20.
Medición de la respuesta analgésica al tratamiento con ultrasonidos focalizados guiados por resonancia magnética
| Categorías de respuesta | |
|---|---|
| Respuesta completa | Puntuación de 0 en dolor (en el sitio tratado), sin incremento concomitante en el tratamiento analgésico |
| Respuesta parcial | Reducción del dolor en 2 o más puntos en el sitio tratado en una escala de 0-10, sin incremento en la analgesia o un 25% de reducción en el tratamiento analgésico sin incremento en el dolor |
| Progresión del dolor | Incremento del dolor en 2 o más puntos en el sitio tratado con una dosis analgésica estable o un incremento en un 25% o más en la dosis analgésica diaria con dolor estable o un punto sobre el basal |
| Respuesta indeterminada | Cualquier respuesta no incluida dentro de los criterios de respuesta completa, respuesta parcial o progresión de dolor |
Adaptada de Chow et al.25.
En todos los estudios se obtuvieron mejorías significativas tanto clínicas como estadísticas en el control del dolor. En los estudios prospectivos de cohortes15–19 la escala visual analógica media previa al tratamiento fue de entre 4,7 y 8 en comparación con la de 3 meses después, que fue de 0,5-4. Teniendo como referencia los criterios de la International Bone Metastases Consensus Working Party se obtuvieron respuestas totales en el 36-72,2% de los pacientes, respuestas parciales en el 16,7-92,3% y empeoramiento del dolor o recurrencia del mismo en el 4-11,1%. Así mismo, todos estos estudios destacan que la mejora del dolor comienza el tercer día tras el tratamiento y que se mantiene en el tiempo.
Hay que resaltar los datos aportados por Hurwitz et al.20 en su estudio aleatorizado 3:1, controlado con placebo, multicéntrico, de 147 pacientes, en el cual se trataron 112 con MRgFUS y 35 con placebo. Los resultados obtenidos muestran que el 64,3% de los pacientes de la rama del MRgFUS respondieron, frente al 20% en la rama de placebo a los 3 meses (p<0,0001). En el grupo de MRgFUS el 23,2% presentaron una respuesta completa. y en el grupo placebo, un 5,7%. Es importante reseñar que un 65,7% de los pacientes en el grupo placebo no completaron el seguimiento de 3 meses, un porcentaje mucho mayor a lo presentado en la otra rama. Los autores atribuyen estos resultados a la falta de respuesta con el tratamiento placebo. En relación con la intensidad del dolor se produjo una reducción significativa promedio de 3,6±3,1 de la escala numérica en el grupo de MRgFUS y de 0,7±2,4 en el grupo placebo (p<0,001) desde el dolor basal hasta los 3 meses.
Algunos estudios15,16,19,20 evaluaron el impacto de la MRgFUS sobre las necesidades de fármacos analgésicos postratamiento. La aplicación de la MRgFUS consiguió una reducción del tratamiento analgésico del 17 al 100% de los pacientes, mientras que permitió una suspensión completa en algunos estudios16,20 del 27 al 63% de los enfermos. Sin embargo, en los trabajos de Huisman et al.19 y Catane et al.15 tuvieron que incrementar la analgesia en el 9 y 22% de los casos, respectivamente.
Efecto sobre la calidad de vidaEn los estudios en los que se evaluó la calidad de vida16,20, el principal cambio presente en todos los cuestionarios de calidad de vida fue la disminución del dolor. En el estudio de Gianfelice et al.16 el 36,3% de los pacientes presentaron una mejoría en sus actividades de la vida diaria y un 9% mejoró su estado de ánimo16. Hurwitz et al.20 describen que los cambios en el BPI-QoL (cuestionario breve de dolor-calidad de vida) desde el basal hasta los 3 meses fue 2,4 puntos superior en el grupo de MRgFUS comparado con placebo (p<0,001). Esta diferencia se mantuvo desde el tercer día posterior al tratamiento en adelante.
Efectos secundarios del tratamientoEl dolor es el principal efecto adverso asociado al tratamiento con MRgFUS. El dolor puede presentarse durante o después del procedimiento15,17,19,20, con una incidencia de entre un 4 y un 32%17,20 de los casos. La intensidad del dolor fue leve en el 6,2% de los pacientes, moderada en el 10,7% y severa en el 15,2%20; solo en un caso el dolor impidió la realización del tratamiento15. Otros efectos adversos descritos fueron fatiga (1,8%), neuropatía (1,8%), fractura (1,8%) y quemaduras de la piel (1,8-9%)19,20. La mayoría de los efectos adversos fueron transitorios (60,3%) y se resolvieron el mismo día del tratamiento o dentro de la primera semana20.
DiscusiónLos estudios analizados son de una calidad media y con un número bajo de pacientes si excluimos el estudio de Hurwitz et al.20. Sin embargo, los resultados extraídos de dichos estudios, como son una alta tasa de respuesta en el control del dolor, una reducción significativa en el tratamiento analgésico previo, indicios de mejora en la calidad de vida y efectos secundarios poco frecuentes, en general leves y transitorios, hacen que se plantee como una técnica analgésica interesante en un futuro próximo.
La radioterapia antiálgica es el procedimiento de elección en el tratamiento de las metástasis óseas dolorosas no complicadas. A nivel global se consigue una mejoría del dolor, dependiendo de los estudios, en un 70-75%24 de los casos, con respuestas completas de en torno a un 25%. Sus efectos secundarios son poco frecuentes y corresponden principalmente a la aparición de náuseas, vómitos, diarreas y fenómeno de pain flare (aumento de dolor en la zona irradiada 24-48h tras la radioterapia debido a la estimulación de mediadores químicos de la inflamación)25.
En el momento de realizar la presente revisión no se ha obtenido ningún estudio que compare la MRgFUS con otros tratamientos. Sin embargo, especial interés cobra su comparación con la radioterapia antiálgica, dado que parece ser una técnica efectiva, con pocos efectos secundarios y que puede mejorar la calidad de vida de los pacientes20.
En los estudios mencionados uno de los criterios de selección de pacientes era que no se les pudiera administrar radioterapia antiálgica, bien porque ya se les había administrado, bien porque estuviese contraindicada. Este hecho hace que no se puedan comparar los resultados obtenidos en esta revisión con los publicados sobre radioterapia antiálgica y metástasis óseas, dado que las situaciones clínicas no son comparables entre sí.
Sin embargo, con los datos disponibles se podría plantear como una posible opción analgésica adecuada para un grupo bien seleccionado de pacientes (tabla 4) que no respondan a las terapias convencionales.
Criterios recomendados para la selección de pacientes candidatos a recibir un tratamiento con intención analgésica con ultrasonidos focalizados guiados por resonancia magnética
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| 1. Localización de las lesiones en: costillas, esternón, extremidades (excluye articulaciones), pelvis, elementos posteriores de vertebras dorsales, lumbares y sacras 2. Lesiones visibles en resonancia magnética 3. Lesiones en sitios accesibles por el haz de ultrasonido focalizado que no incluyan cicatrices extensas, vísceras huecas o tejido no óseo 4. La interfaz entre el hueso y la lesión debe estar a más de 10mm de la piel | 1. Contraindicaciones generales para la resonancia magnética (dispositivos metálicos, marcapasos) 2. Contraindicación para el uso de medios de contraste con gadolinio (intolerancia o insuficiencia renal crónica) 3. Lesiones localizadas en el cráneo, a menos de 1cm de paquetes nerviosos 4. Cicatrices extensas en la zona del tratamiento 5. Condiciones médicas agudas o crónicas que impidan la obtención de las imágenes, el uso de anestesia o la rutina del procedimiento 6. Necesidad de estabilización quirúrgica de las estructuras óseas afectadas (por el riesgo de fractura) 7. Cirugía previa para estabilización del sitio tumoral con equipo metálico |
Adaptada de Napoli et al.18.
La presente revisión muestra una serie de limitaciones, como son que la búsqueda se ha limitado a un pequeño grupo de bases de datos médicas y con selección de artículos en función de la presencia de resumen e idioma. Así mismo, con respecto a la estrategia de búsqueda utilizada, si bien se ha intentado inicialmente que fuera lo más sensible posible, existe la posibilidad de que algún trabajo haya quedado excluido de la revisión. Por otra parte, el escaso número de trabajos, así como su calidad, hacen que no se puedan extraer conclusiones definitorias respecto a la eficacia de la MRgFUS como procedimiento analgésico en metástasis óseas dolorosas.
Son necesarios más estudios que nos ayuden a dilucidar el papel real de la MRgFUS en el tratamiento del dolor oncológico óseo. Una de las líneas de investigación interesantes sería su comparación con la radioterapia antiálgica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.