El dolor irruptivo oncológico es un dolor transitorio, de corta duración (generalmente menos de 60min), que alcanza su máxima intensidad en 15min y aparece a pesar de un adecuado tratamiento del dolor basal con analgesia pautada a horas fijas. Estos episodios de dolor irruptivo oncológico se tratan con medicación “de rescate”. Debido a sus características clínicas y a la intensidad de los episodios, el fármaco ideal para su tratamiento sería un opioide de inicio rápido, corta duración del efecto y pocos efectos secundarios. Tradicionalmente, en esta situación se han utilizado los opioides de liberación rápida administrados por vía oral. Sin embargo, las nuevas formulaciones de fentanilo, que se absorben de forma rápida a través de las mucosas (oral e intranasal) parecen adaptarse mejor al patrón temporal de los episodios de dolor irruptivo oncológico. El éxito en el manejo de los episodios de dolor irruptivo dependerá de unas adecuadas identificación y evaluación.
Breakthrough cancer pain is a transient, short-lasting (usually less than 60minutes) exacerbation of pain that reaches maximum intensity within 15minutes and occurs despite adequate treatment of background pain with around-the-clock analgesia. These episodes of breakthrough pain are treated with “rescue” analgesia. Due to the clinical characteristics and intensity of these exacerbations, the ideal drug for the treatment of breakthrough pain would be a rapid-onset, short-acting opioid with few secondary effects. Traditionally, oral rapid-release opioids have been used in this situation. However, the new fentanyl formulations, which are rapidly absorbed through the mucous membranes (oral, intranasal), seem to be better adapted to the temporal pattern of episodes of breakthrough pain. The success of the management of these episodes depends on adequate identification and evaluation.
El dolor es uno de los síntomas más frecuentes y angustiantes en los pacientes oncológicos y afecta al 56-75% de los pacientes con enfermedad avanzada1,2. Dos de cada 3 pacientes con dolor crónico sufren con cierta frecuencia exacerbaciones puntuales de este debido a diferentes causas, en ocasiones previsibles y en otras inesperadas. Además del sufrimiento que conllevan, estos episodios constituyen un problema importante para el paciente, pues generan ansiedad y añaden incapacidad funcional, lo cual se traduce en una mayor dificultad para controlar el dolor basal, una menor calidad de vida y un incremento del gasto sanitario3.
En 1990 se acuñó en Estados Unidos el término “break-through pain” para definir las exacerbaciones transitorias de un dolor oncológico que está bien controlado con la utilización de opioides mayores. En el año 2002, la Sociedad Española de Oncología Médica, la Sociedad Española de Cuidados Paliativos y la Sociedad Española del Dolor establecieron un documento de consenso en el que asumieron el término “dolor irruptivo” para definir una exacerbación del dolor de forma súbita y transitoria, de gran intensidad (escala visual analógica [EVA] > 7) y de corta duración (usualmente inferior a 20-30min), que aparece sobre la base de un dolor persistente estable, cuando este se encuentra reducido a un nivel tolerable (EVA < 5) mediante el uso fundamental de opioides mayores3.
Fisiopatología y características del dolor irruptivo oncológicoLa fisiopatología del dolor irruptivo oncológico (DIO) comprende etiología mixta (nociceptivo + neuropático) en el 52% de los casos, seguido de dolor nociceptivo (28%) y neuropático (10%). Es un criterio de mal pronóstico en el control del dolor, que conlleva mayor riesgo de hospitalización y de consultas médicas y deteriora la calidad de vida y funcionalidad de los pacientes. El DIO se caracteriza por:
- •
Inicio rápido (escasosminutos).
- •
Intensidad moderada-severa (EVA ≥ 7).
- •
Duración limitada en el tiempo (media 60min).
- •
Frecuencia: de 1 a 4 episodios/día.
- •
Se asocia a importante repercusión en calidad de vida y funcionalidad.
- 1.
Incidental. Aparece relacionado con algún factor desencadenante. Se describen 3 clases:
- •
Volitivo: precipitado por un acto voluntario (p. ej., deambulación).
- •
No volitivo: precipitado por un acto involuntario (p. ej., toser).
- •
Procedimental: relacionado con un acto terapéutico (p. ej., cura de úlcera).
- •
- 2.
Espontáneo. Aparece sin relacionarse con ningún factor desencadenante.
El tratamiento del DIO debe tener un enfoque multimodal y contempla medidas farmacológicas y no farmacológicas. La tabla 1 recoge las recomendaciones clave para el manejo del dolor irruptivo publicadas por la Association for Palliative Medicine of Great Britain and Ireland4.
Resumen de las recomendaciones para el tratamiento del dolor irruptivo por cáncer4
| • En todo paciente con dolor debería evaluarse la presencia de dolor irruptivo |
| • En todos los pacientes con dolor irruptivo, este dolor se debería evaluar de forma específica |
| • El manejo del dolor irruptivo debería ser individualizado |
| • Se debería considerar tratar la causa que provoca el dolor |
| • Se debería considerar la evitación/tratamiento de los factores desencadenantes del dolor |
| • Se debería considerar la modificación de la analgesia basal (pautada a horas fijas) |
| • Los opioides son la “medicación de rescate” de elección en el manejo de los episodios de dolor irruptivo |
| • La dosis del opioide “de rescate” debe titularse de forma individual |
| • Las medidas no farmacológicas pueden ser útiles en el manejo de los episodios de dolor irruptivo |
| • Los analgésicos no opioides pueden ser útiles en el tratamiento de los episodios de dolor irruptivo |
| • Las técnicas intervencionistas pueden ser útiles en el tratamiento del dolor irruptivo |
| • En los pacientes con dolor irruptivo, este dolor debería ser revaluado de forma específica |
Los principios básicos para su manejo son5:
- •
Identificación y evaluación periódica del dolor.
- •
Cambios en el estilo de vida. Los episodios de dolor irruptivo pueden ser desencadenados por distintos eventos (p. ej., tos, estreñimiento, movimientos, etc.), algunos de los cuales se pueden evitar. Educar a los pacientes en estrategias de afrontamiento o evitación de los factores desencadenantes, usar antitusígenos, laxantes, etc. puede reducir la frecuencia o intensidad de estos episodios de dolor.
- •
Modificación del proceso causante del dolor (tratamientos antitumorales). Los tratamientos que intentan modificar el curso de la enfermedad tumoral, como la radioterapia o la quimioterapia, pueden mejorar tanto el dolor basal como el dolor irruptivo. La radioterapia es, además, un tratamiento analgésico especialmente eficaz en el tratamiento de las metástasis óseas o las radiculopatías compresivas.
- •
Manejo sintomático (farmacológico o no farmacológico).
Se han descrito distintos métodos no farmacológicos por los pacientes como útiles para aliviar el dolor. La aplicación de calor o frío local, las técnicas de relajación o los masajes, pueden ser estrategias válidas, aunque existe poca evidencia científica para apoyar el uso de estas intervenciones en el tratamiento de los episodios de dolor irruptivo5,6.
La vertebroplastia y la cifoplastia han demostrado su rápida capacidad para mejorar el dolor vertebral secundario a fractura y consiguen un alivio del dolor hasta en el 90% de los casos (p. ej., mieloma múltiple)3.
A pesar de usar tratamientos analgésicos adecuados, algunos pacientes no consiguen un control adecuado del dolor y pueden beneficiarse de técnicas analgésicas invasivas que modulan o bloquean el estímulo nociceptivo.
Medidas farmacológicasAnalgésicos no opioidesLa optimización de la analgesia basal, asociando fármacos adyuvantes, puede reducir la frecuencia e intensidad de los episodios de dolor irruptivo. Aunque no hay evidencia sobre la utilidad de los fármacos no opioides en este contexto, su asociación a opioides mejora el control del dolor en cualquier fase de la enfermedad.
Los antiinflamatorios no esteroideos (AINE) se han usado ampliamente en el manejo de las crisis de dolor mode-rado.
Estos fármacos adyuvantes (AINE, corticosteroides, antiepilépticos, antidepresivos, etc.) se usan de forma habitual en el manejo del dolor neuropático, que muchas veces se presenta asociado a crisis de dolor irruptivo. Los pacientes que presentan episodios de dolor irruptivo provocado por metástasis óseas, hipertensión intracraneal, obstrucción intestinal, etc., pueden beneficiarse del uso de fármacos no opioides6.
En el caso de metástasis óseas, el uso de bifosfonatos ha mostrado disminuir el dolor y la incidencia de complicaciones esqueléticas. Por otra parte, el uso de radioisótopos (samario, estroncio, radium-223, etc.) también se ha demostrado útil en el manejo del dolor óseo politópico (p. ej., cáncer de próstata)2.
Otros fármacos, como la lidocaína tópica, están apoyados por la evidencia científica y recomendados por las guías clínicas en el manejo de determinadas situaciones.
Analgésicos opioidesEl tratamiento requiere un adecuado control del dolor basal, con opioides de liberación prolongada pautados a horas fijas, y medicación “de rescate”, que se administrará cuando se produzcan las exacerbaciones de dolor. El tratamiento analgésico del DIO es específico y no sustituye al tratamiento del dolor basal.
En el caso del dolor espontáneo o del incidental no volitivo, la medicación de rescate debería administrarse en el momento de aparición del episodio de DIO. Por el contrario, en el caso de dolor incidental volitivo o procedimental, el tratamiento debería administrarse antes de la aparición del factor desencadenante.
Debido a la intensidad de los episodios de DIO, las guías recomiendan el uso de opioides potentes en esta situación. El opioide de rescate ideal para el tratamiento del DIO debería ser potente, tener un inicio de acción rápido, una duración de acción breve, pocos efectos secundarios y ser fácil de administrar.
Vías de administración de opioidesOralLa vía oral se usa de forma habitual para la administración de analgesia “de rescate” debido a su comodidad y precio. Tradicionalmente, los fármacos utilizados en el tratamiento del DIO han sido la morfina o la oxicodona de liberación inmediata por vía oral. Sin embargo, el perfil farmacocinético de estos fármacos no se adapta al patrón temporal de la crisis de DIO ya que, aunque en algunos pacientes estos episodios de dolor alcanzan su pico de intensidad en 15-45min, en la mayoría de los casos la intensidad máxima se alcanza en 5-15min y la duración del episodio es menor de 1 h. El inicio de la acción de la morfina o la oxicodona de liberación inmediata, administradas por vía oral, se establece a partir de los 30min y alcanza su concentración máxima en plasma entre 60-90min desde su administración7,8.
La metadona también se usa de forma ocasional como medicación de rescate, especialmente en pacientes que reciben metadona como tratamiento de base. Sin embargo, debe tenerse en cuenta que aunque el inicio de acción de la metadona es más rápido que el de la morfina y la oxicodona, su vida media es prolongada después de administraciones repetidas5.
Teniendo en cuenta las características clínicas de los episodios de DIO (rápido comienzo, corta duración), estos fármacos no van a permitir un óptimo control del dolor en la mayoría de los casos y su vida media supera la duración de la propia crisis de dolor (lo que aumenta el riesgo de efectos secundarios indeseables).
ParenteralDesde el punto de vista farmacológico, cualquier vía que evite el primer paso hepático e incremente la biodisponibilidad puede ser una buena opción terapéutica.
La administración parenteral de morfina u oxicodona podría ser una alternativa, ya que se adapta a la mayoría de los episodios de DIO (biodisponibilidad del 100% e inicio de acción prácticamente inmediato en el caso de la administración intravenosa), pero no siempre está disponible ni es la opción más deseada, especialmente en pacientes ambulatorios, y su vida media es prolongada (4 h). En caso de utilizar la vía parenteral, la dosis de rescate recomendada para tratar los episodios de DIO es 1/6 a 1/10 de la dosis total diaria de opioides.
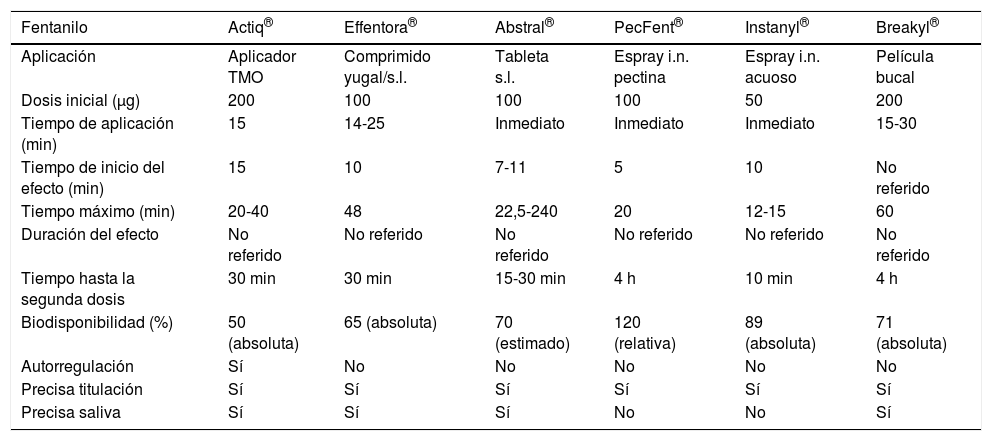
TransmucosaEl fentanilo es un agonista del receptor μ opioide, 100 veces más potente que la morfina, que posee una elevada liposolubilidad, lo que permite su rápida difusión a través de la barrera hematoencefálica y su absorción a través de piel y mucosas. Por estos motivos, es el principio activo que más se ajusta a las necesidades analgésicas del dolor irruptivo en el momento actual, con independencia del opioide utilizado para el control del dolor basal. En la última década se han aprobado distintas formulaciones de fentanilo para administración transmucosa (oral, bucal, sublingual o intranasal) para el tratamiento del DIO (tabla 2). Estas formulaciones parecen comparables en eficacia, por lo que la selección de una u otra presentación y vía de utilización (oral, sublingual o nasal) dependerá, especialmente, de la situación clínica y de las preferencias del paciente.
Formulaciones comercializadas de fentanilo transmucoso.
| Fentanilo | Actiq® | Effentora® | Abstral® | PecFent® | Instanyl® | Breakyl® |
|---|---|---|---|---|---|---|
| Aplicación | Aplicador TMO | Comprimido yugal/s.l. | Tableta s.l. | Espray i.n. pectina | Espray i.n. acuoso | Película bucal |
| Dosis inicial (μg) | 200 | 100 | 100 | 100 | 50 | 200 |
| Tiempo de aplicación (min) | 15 | 14-25 | Inmediato | Inmediato | Inmediato | 15-30 |
| Tiempo de inicio del efecto (min) | 15 | 10 | 7-11 | 5 | 10 | No referido |
| Tiempo máximo (min) | 20-40 | 48 | 22,5-240 | 20 | 12-15 | 60 |
| Duración del efecto | No referido | No referido | No referido | No referido | No referido | No referido |
| Tiempo hasta la segunda dosis | 30 min | 30 min | 15-30 min | 4 h | 10 min | 4 h |
| Biodisponibilidad (%) | 50 (absoluta) | 65 (absoluta) | 70 (estimado) | 120 (relativa) | 89 (absoluta) | 71 (absoluta) |
| Autorregulación | Sí | No | No | No | No | No |
| Precisa titulación | Sí | Sí | Sí | Sí | Sí | Sí |
| Precisa saliva | Sí | Sí | Sí | No | No | Sí |
i.n.: intranasal; s.l.: sublingual; TMO: transmucoso oral.
Un reciente metaanálisis, que incluyó 15 estudios y casi 1.700 pacientes con dolor irruptivo, mostró que el fentanilo como medicación de rescate puede usarse con seguridad con independencia del opioide de base. En los 2 estudios que compararon morfina oral frente a fentanilo, los resultados fueron inferiores con morfina. Cuando se comparó la administración de opioides por vía transmucosa frente a parenteral, esta última fue superior a los 15min de la administración del fármaco, pero no se observaron diferencias a los 30min. Los autores insisten en la necesidad de realizar ensayos clínicos comparativos entre los distintos opioides, ya que la mayoría de los publicados hasta la fecha son comparados con placebo9.
Los ensayos clínicos sugieren que la dosis del fentanilo transmucoso “de rescate” no puede calcularse a partir de la dosis de opioide basal, sino que debe titularse de forma individual en cada paciente. Se recomienda empezar con la menor dosis disponible del fármaco e ir escalando dosis según la necesidad del paciente, hasta encontrar la mínima dosis eficaz.
Recomendaciones de las guías clínicasLas recomendaciones de la European Association for Palliative Care10 afirman que las crisis de dolor irruptivo se pueden tratar adecuadamente con opioides de liberación inmediata administrados por vía oral, así como con fentanilo administrado por vía intranasal o bucal. Estas presentaciones de fentanilo son preferibles en algunos casos, debido a su mayor rapidez de acción y a la menor duración de sus efectos. Por otra parte, los opioides de liberación inmediata administrados por vía oral deberían utilizarse en los episodios predecibles de dolor, siempre que se administren 20-30min antes del factor desencadenante.
Las guías de la European Society of Medical Oncology11 consideran apropiado el uso de morfina oral de liberación inmediata para tratar los episodios predecibles de DIO (p. ej., dolor al movilizarse, tragar, etc.), siempre que se administre al menos 20min antes del factor desencadenante (nivel de evidencia IIA). La administración de opioides intravenosos o fentanilo transmucoso (bucal, sublingual o intranasal) tiene una actividad más rápida que la morfina oral en el tratamiento del DIO (nivel de evidencia IA).
ConclusionesEl DIO es un fenómeno heterogéneo que varía en etiología, frecuencia, duración, rapidez de aparición y previsibilidad, por lo que el tratamiento debe ser individualizado. El adecuado manejo de las crisis de DIO dependerá de una adecuada evaluación, de una revaluación periódica, de un óptimo control del dolor basal (con medidas farmacológicas y no farmacológicas) y de la administración de una medicación “de rescate” adecuada. El opioide “de rescate” óptimo debe adaptarse a las características clínicas del DIO, y su dosis debe determinarse mediante titulación individual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.