Detectar la astenia tumoral (AT) en Atención Primaria, posibilidades de evaluación y gradación de la misma con dos escalas propuestas, la clasificación ICD-10 (ICD-10) adaptada y el índice de Karnosfky (IK) graduado.
DiseñoEstudio observacional descriptivo realizado en la Zona básica de Salud de Utrera (Sevilla) que engloba siete centros. Se detectaron 67 pacientes con cáncer, de los cuales participaron 61. Criterios de inclusión: aceptación a participar en el estudio, mayor de edad y diagnóstico de cáncer. Criterios de exclusión: no aceptación a participar, evidencia clínica de astenia de origen no tumoral, deterioro cognitivo o trastorno psiquiátrico severo. Parámetros analizados: edad, sexo, tipo de tumor, tratamiento anti-tumoral en los últimos doce meses, enfermedad oncológica terminal, puntuación del IK y grados de la clasificación ICD-10 adaptada para AT. Análisis estadístico: descriptivo, y debido al pequeño tamaño muestral un análisis correlacional e inferencial, ambos no paramétricos.
ResultadosLa AT según la ICD-10 adaptada está presente en el 70,5% de los casos y un 78,7% según el IK. Al analizar la correlación parcial entre tumores más frecuentes, la ICD-10 adaptado y el IK graduado encontramos diferencias estadísticamente significativas en el cáncer de pulmón, mama, próstata y colo-rectal, en referencia a la presencia de AT. Entre los criterios establecidos de AT en la ICD-10 adaptado e IK graduado existe una relación lineal e inversa estadísticamente significativa (p=0,001).
ConclusionesLa ICD-10 adaptada permite reconocer y graduar la AT en pacientes oncológicos. El IK puede ser una herramienta complementaria.
Diagnosis of fatigue in cancer patients in primary health care centre, an opportunity for assessment and grading the fatigue with two scales, International Classification of Diseases (ICD-10) criteria and Karnosfky Index (KI).
DesignDescriptive observational study conducted in the Basic zone of Health of Utrera (Seville), includes seven care centres. We studied 67 patients suffering from cancer disease, only 61 were included. Inclusion criteria: agreement to participate in the study, adult and cancer diagnosis. Exclusion criteria: no agreement to participate, clinical evidence of non-tumour origin fatigue, cognitive impairment or severe psychiatric disorder. Personal interview recording: age, sex, type of tumour, antitumour specific treatment in the last twelve months, terminal oncological disease, KI and tumour asthenia valuation according to ICD-10 adapted, gradations being established between both scales. Statistical analysis: descriptive, and because of the small sample size, correlational and inferential analysis, both non-parametric.
ResultsFatigue, according to adapted ICD-10 criteria, is found in 70.5% of the cases. 78.7% presents a minor or equal KI. In analyzing the partial correlation between most common tumours, the adapted ICD-10 and graduated KI statistically significant differences in lung cancer, breast, prostate and colon and rectum, referring to the presence of fatigue in cancer patients. There is a negative relationship between these two tests (coefficient of correlation of -0.902) as for breast, lung and prostate statistically significant (p=0.001), proving a linear and inverse correlation between the established for adapted ICD-10 and graduated KI by the authors.
ConclusionsAdapted ICD-10 criteria can assessment and graduate fatigue in cancer patients. KI can be a complementary tool.
La astenia, del griego «stenos» es definida como «falta o decaimiento de fuerzas, caracterizado por apatía, fatiga física o ausencia de iniciativas»1–3, es un síntoma prevalente en la población general. Cada vez se reconoce más como un problema en pacientes con cáncer, incluso por encima del dolor. Su prevalencia en enfermos neoplásicos sin tratamiento específico es del 35%, alcanzando el 99% durante o después de tratamientos con quimioterapia y radioterapia2–10.
La astenia tumoral (AT) o síndrome asténico tumoral hace referencia a un «cansancio físico y/o mental en un paciente con cáncer, sin necesidad de esfuerzo previo, y que no se alivia con el reposo»2,3,6,11–13. Es un complejo síndrome multidimensional, que afecta a todas las esferas de la persona: física, cognitiva, psico-afectivo y social, menoscabando la calidad de vida considerablemente1,10,14,15. Parece tener relación con el tipo tumoral y, sobre todo, con el estado clínico. En su etiología encontramos diversas causas: sustancias producidas por el tumor, comorbilidades (anemia, malnutrición, endocrinopatías, infección), factores psicosociales, dolor, insomnio o, sobre todo, como efecto secundario de algunos tratamientos1,12,14.
Es un problema infravalorado (incluso por los especialistas en Cuidados Paliativos si lo comparamos con el dolor o la disnea), está infradiagnosticado e infratratado siendo compleja su expresión por el enfermo4,10. Por ello, se han diseñado escalas unidimensionales (Brief Fatigue Inventory, Fatigue Severity Scale,...) y multidimensionales (Fatigue Symptom Inventory, FACT, EFAT, MSI-20,...) para valorar la astenia en pacientes oncológicos1–4,9,10.
Las primeras miden la intensidad de la astenia. Son relativamente breves, fáciles de emplear y buenos métodos de screening o como medidas de resultados, pero no suelen emplearse3,4,6,8,11. Cuando se realizan adecuadamente pueden tener buenos niveles de consistencia interna y fiabilidad re-test4. Las multidimensionales son más largas, pero dan una evaluación detallada de los aspectos cuantitativos y cualitativos de la astenia. Permiten hacer comparaciones entre estudios o identificar mecanismos específicos subyacentes de la fatiga. La validez individual de las subescalas puede variar, siendo en algunas ocasiones su fiabilidad inaceptable4,7.
En un intento de unificar conceptos, la astenia fue definida en la clasificación internacional de enfermedades-10 (ICD-10), redactándose y aceptándose unos criterios diagnósticos (tabla 1)2,5–8,10,12.
Criterios diagnósticos de astenia tumoral de la clasificación internacional de enfermedades (ICD-10)
| Requisitos |
| 1. Los síntomas repercuten de manera clínica significativa y socialmente sobre el paciente. |
| 2. Evidencia por la anamnesis, exploración o pruebas complementarias de que los síntomas son consecuencia del cáncer o de su tratamiento. |
| 3. Los síntomas no se deben a comorbilidad psiquiátrica. |
| 4. Debe cumplir, al menos, un criterio mayor y cinco menores todos o casi todos los días durante al menos dos semanas en el último mes. |
| Criterio mayor |
| 1. Cansancio significativo, disminución de la energía o aumento de la necesidad de descansar, cualquier cambio reciente desproporcionado en el nivel de actividad. |
| Criterios menores |
| 1. Queja de debilidad pesada o pesadez de miembro. |
| 2. Malestar tras el esfuerzo que dura varias horas. |
| 3. Dificultad para completar las tareas diarias con normalidad. |
| 4. Percepción de la necesidad de luchar para superar la inactividad. |
| 5. Experiencia de sueño no reparador. |
| 6. Disminución de atención o concentración. |
| 7. Disminución de la motivación o interés por las actividades cotidianas. |
| 8. Insomnio o hipersomnia. |
| 9. Reactividad emocional marcada (tristeza, frustración o irritabilidad) a la sensación de fatiga. |
| 10. Percepción de problemas con memoria a corto plazo. |
Debido a las características de la práctica clínica en Atención Primaria (presión asistencial, escasa formación en Oncología y Cuidados Paliativos, etc.), hemos adaptado los criterios de la ICD-10 (Anexo) para que permitan identificar y cuantificar el grado de astenia en pacientes con cáncer, de forma sencilla y eficaz. Además empleamos el índice de Karnosfky (IK), escala funcional muy usada y conocida, graduándolo a partir de la escala ICD-10 para poder utilizarlo en la detección y gradación de AT.
ObjetivosDetectar la astenia tumoral en Atención Primaria, las posibilidades de evaluación y gradación de la misma con dos escalas propuestas, la clasificación ICD-10 adaptada para astenia tumoral y el índice de Karnosfky graduado.
Material y métodoEl estudio siguió un diseño observacional descriptivo. Fue evaluado satisfactoriamente por expertos en Bióetica e Investigación. Los sujetos del estudio fueron detectados en Atención Primaria a través de su historial clínico informatizado (DIRAYA) de las consultas y visitas domiciliarias de Medicina y Enfermería de los equipos básicos del Área Básica de Salud de Utrera (Sevilla), que incluye siete centros de salud. Los criterios de búsqueda fueron: pacientes mayores de 18 años, afectos en el momento del estudio de cáncer, independientemente del tipo de tumor, estadio y de la extensión de la enfermedad, así como de la presencia o no de situación de terminalidad. La selección de la muestra fue realizada de manera consecutiva entre los meses de enero y agosto de 2008.
Los criterios de inclusión fueron: aceptación a participar en el estudio mediante consentimiento informado específico, mayoría de edad y diagnóstico de cáncer. Los criterios de exclusión fueron: no aceptación a participar o retirada del estudio, evidencia clínica de astenia de origen no tumoral (descartada mediante anamnesis, exploración física y pruebas complementarias -analíticas e imagen-), deterioro cognitivo severo (Minimental test<14 puntos) o trastorno psiquiátrico severo (depresión mayor, somatización o delirios) según los criterios de la ICD-1016–21.
Las variables analizadas fueron: edad, sexo, tipo de tumor (pulmón, mama, digestivo, próstata, otros), tratamiento anti-tumoral en los últimos doce meses (quimioterapia, radioterapia, cirugía, hormonoterapia, inmunoterapia), enfermedad oncológica terminal, puntuación del IK (de 0 a 100) y grados de la ICD-10 para AT.
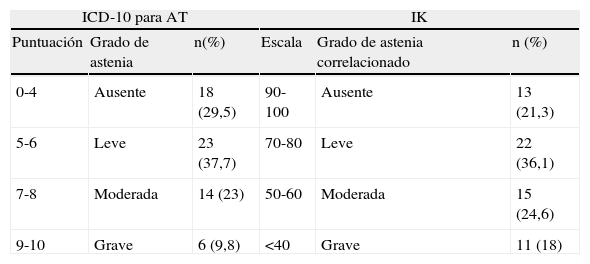
El valor del ICD-10 adaptado para AT se basó en sumar todas las respuestas afirmativas del paciente durante la entrevista a cada una de las preguntas de los criterios menores. Posteriormente se crearon 4 categorías (0-4 puntos: ausente; 5-6 puntos: leve; 7-8 puntos: moderada; 9-10 puntos: grave).
Para la clasificación de los pacientes en el IK se utilizó información sobre la capacidad para realizar actividad normal en el trabajo o domicilio, severidad de los síntomas y la necesidad de cuidados médicos y personales. Posteriormente se crearon intervalos de los niveles del IK en función de la puntuación obtenida (90-100: ausente, 70-80: leve, 50-60: moderado, ≤40: grave).
Definimos terminalidad con los siguientes criterios: a) presencia de enfermedad avanzada, progresiva e incurable sin posibilidades razonables de respuesta a tratamientos específicos; b) síntomas multifactoriales, concurrentes, cambiantes y de intensidad variable presentes en el paciente; c) gran impacto emocional o sufrimiento sobre el paciente, la familia y el personal sanitario; d) pronóstico de vida limitado, clásicamente definido por un intervalo de vida aproximado entre los 3 y 9 meses, y e) presencia implícita o explícita de la muerte11,22.
Se empleó el programa SPSS 14.0 para el análisis estadístico, realizándose un triple estudio: descriptivo, y dado el pequeño tamaño muestral, se realizó un análisis correlacional e inferencial, ambos no paramétricos.
El análisis correlacional se empleó para hallar la relación entre los grados o categorías de AT según la ICD-10 y la puntación del IK correspondiente para así poder establecer una graduación para AT en este último, aplicando el coeficiente de correlación de Spearman. Se realizaron correlaciones parciales de ambas escalas con los distintos tipos de tumores. El análisis inferencial valoró una serie de variables independientes (edad, tumores…) con el ICD-10 e IK (variables dependientes) utilizando la prueba H de KrusKal-Wallis. Sus resultados se analizaron con el test de comparaciones múltiples U de Mann-Whitney.
Se consideró estadísticamente significativo un riesgo alfa del 5% o valores de p≤0,05.
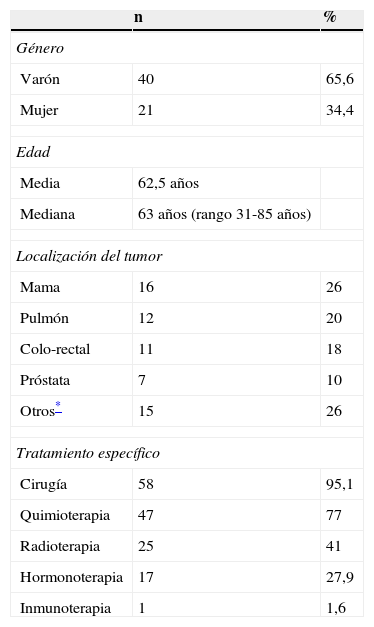
ResultadosSe detectaron 67 pacientes, de los cuales 6 no formaron parte del estudio: 2 por anemia en rango transfusional y 4 se negaron a participar en el mismo. Las características clínico-epidemiológicas de los pacientes incluidos en el estudio se presentan en la tabla 2.
Características clínico-demográficas de los pacientes incluidos en el estudio
| n | % | |
| Género | ||
| Varón | 40 | 65,6 |
| Mujer | 21 | 34,4 |
| Edad | ||
| Media | 62,5 años | |
| Mediana | 63 años (rango 31-85 años) | |
| Localización del tumor | ||
| Mama | 16 | 26 |
| Pulmón | 12 | 20 |
| Colo-rectal | 11 | 18 |
| Próstata | 7 | 10 |
| Otros* | 15 | 26 |
| Tratamiento específico | ||
| Cirugía | 58 | 95,1 |
| Quimioterapia | 47 | 77 |
| Radioterapia | 25 | 41 |
| Hormonoterapia | 17 | 27,9 |
| Inmunoterapia | 1 | 1,6 |
En las mujeres predominó el cáncer de mama (71,4%), mientras que el de pulmón fue más frecuente en hombres (30%). La combinación más frecuente de tratamientos fue: cirugía con quimioterapia y radioterapia (39,3%), seguida de cirugía más quimioterapia (32,8%). De los 61 pacientes incluidos en el estudio el 23% (n=14) se encontraban en una situación de terminalidad (dos pacientes fallecieron durante el transcurso del mismo).
Al realizar el estudio estadístico no encontramos diferencias significativas al correlacionar edad y grado de astenia para la ICD-10 (χ2=0,593; p=0,898) ni para el IK (χ2=1,780; p=0,619).
Se analizó la relación entre los tratamientos aplicados frente al grado de astenia valorado con la ICD-10 y el IK, no existiendo diferencias estadísticamente significativas (χ2 para ICD-10=8,217; p=0,084; χ2 para IK=6,634; p=0,157).
Al analizar los criterios mayores de astenia, el 96,7% de los pacientes (n=59) cumplían al menos uno de estos criterios, requisito imprescindible para valorar los criterios menores. La presencia de astenia se situó en el 70,5% de los casos según la ICD-10, siendo moderada o grave en el 32,8% del total de pacientes. Según la valoración adaptada del IK la presencia de astenia alcanzó el 78,7% (tabla 3).
Distribución de pacientes según criterios menores de la clasificación ICD-10 de Astenia Tumoral según los autores y valores correlacionales obtenidos del índice de Karnofsky
| ICD-10 para AT | IK | ||||
| Puntuación | Grado de astenia | n(%) | Escala | Grado de astenia correlacionado | n (%) |
| 0-4 | Ausente | 18 (29,5) | 90-100 | Ausente | 13 (21,3) |
| 5-6 | Leve | 23 (37,7) | 70-80 | Leve | 22 (36,1) |
| 7-8 | Moderada | 14 (23) | 50-60 | Moderada | 15 (24,6) |
| 9-10 | Grave | 6 (9,8) | <40 | Grave | 11 (18) |
ICD-10: ICD-10 adaptada por los autores para la AT; IK: índice de Karnofsky; n: número de pacientes.
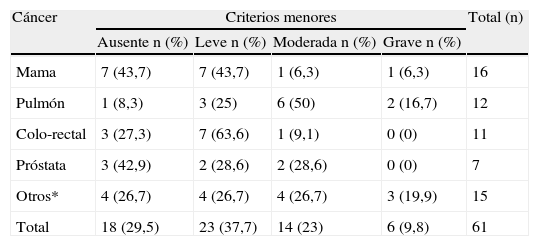
La mayor incidencia de astenia según el género fue el sexo masculino con 30 casos (75%), y según el tipo de tumor el pulmonar con 11 casos (91,7%) (tabla 4).
Tipo de tumor y su relación con el grado de astenia tumoral según la clasificación ICD-10 adaptada por los autores
| Cáncer | Criterios menores | Total (n) | |||
| Ausente n (%) | Leve n (%) | Moderada n (%) | Grave n (%) | ||
| Mama | 7 (43,7) | 7 (43,7) | 1 (6,3) | 1 (6,3) | 16 |
| Pulmón | 1 (8,3) | 3 (25) | 6 (50) | 2 (16,7) | 12 |
| Colo-rectal | 3 (27,3) | 7 (63,6) | 1 (9,1) | 0 (0) | 11 |
| Próstata | 3 (42,9) | 2 (28,6) | 2 (28,6) | 0 (0) | 7 |
| Otros* | 4 (26,7) | 4 (26,7) | 4 (26,7) | 3 (19,9) | 15 |
| Total | 18 (29,5) | 23 (37,7) | 14 (23) | 6 (9,8) | 61 |
n: número de pacientes; Otros*: reno-vesical, hematológico, hepatobiliar, sistema nervioso central, otorrinolaringológicos y tiroides.
La relación entre meses de diagnóstico con el grado de astenia medido con ambas escalas no fue estadísticamente significativa (ICD-10 χ2=3,467; p=0,177; IK χ2=4,799; p=0,091).
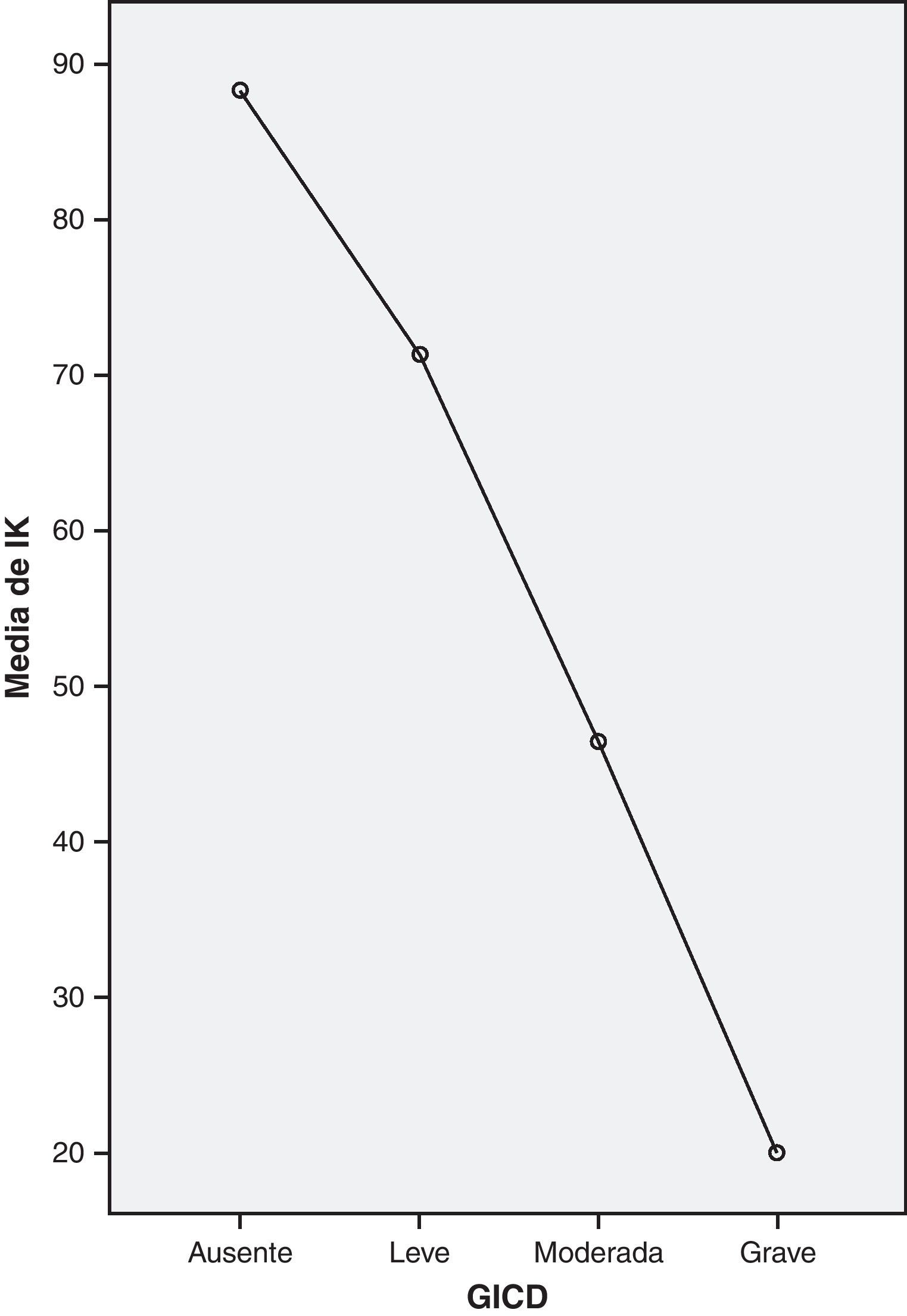
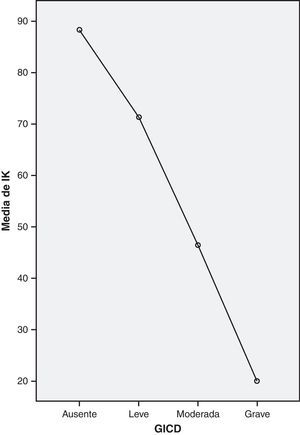
Se analizó la correlación global entre el ICD-10 adaptado y el IK graduado, siendo esta negativa o relación inversa, y su resultado estadísticamente significativo (χ2=44,75; p=0,001) (fig. 1), por lo que podemos considerar la validez del IK en nuestra población como método de diagnóstico y gradación de la astenia tumoral.
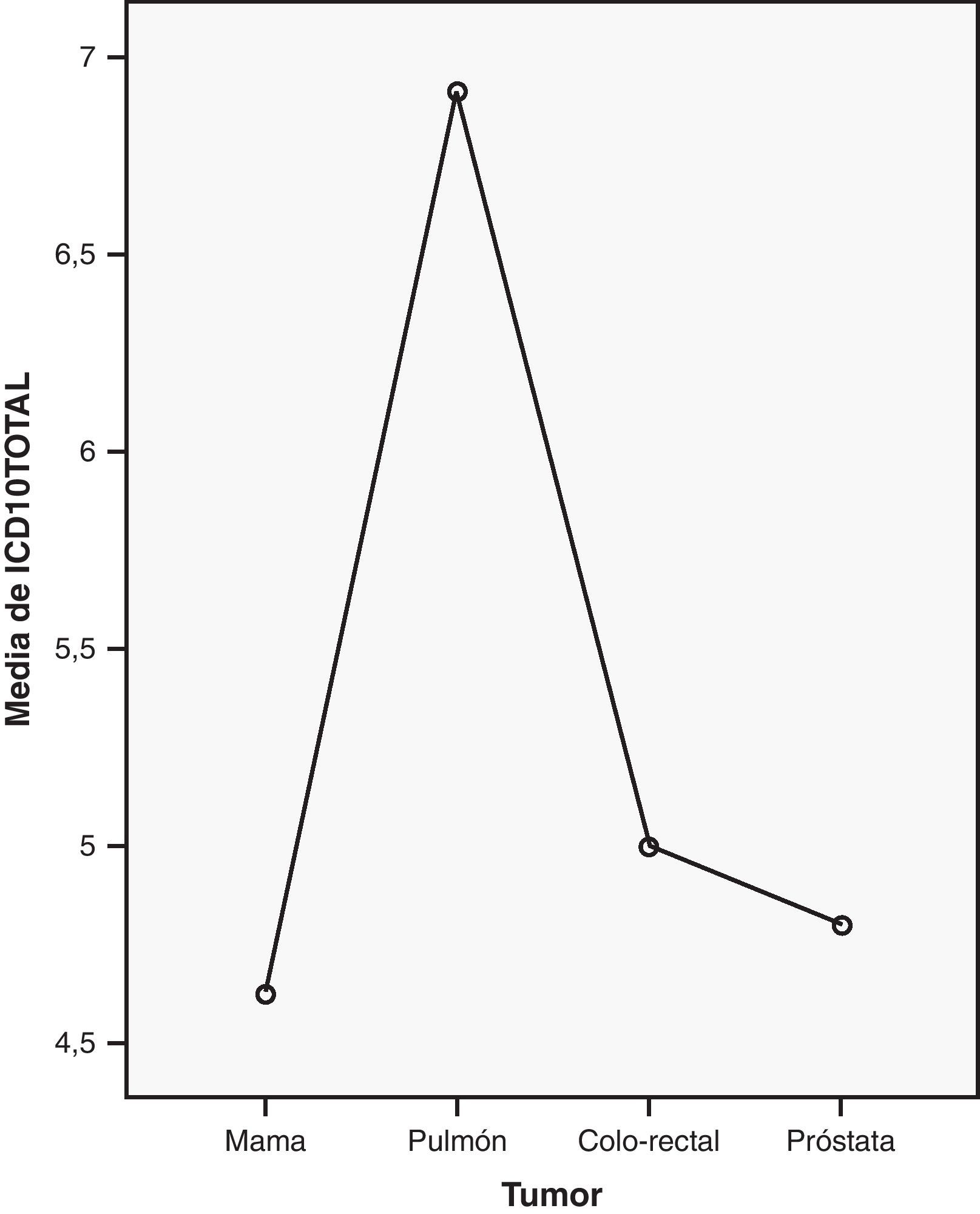
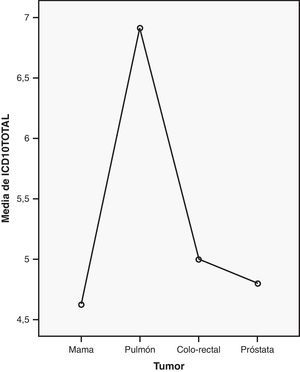
Al analizar la correlación parcial entre los tumores más frecuentes y el ICD-10 encontramos diferencias estadísticamente significativas (χ2=10,041; p=0,018). El test de comparaciones múltiples U de Mann-Whitney confirmó la existencia de diferencias entre el cáncer de pulmón y de mama (U de Mann-Whitney=33; p=0,003), pulmón y próstata (U de Mann-Whitney=7; p=0,014), pulmón y colo-rectal (U de Mann-Whitney=7; p=0,014), en referencia a la presencia de AT (fig. 2).
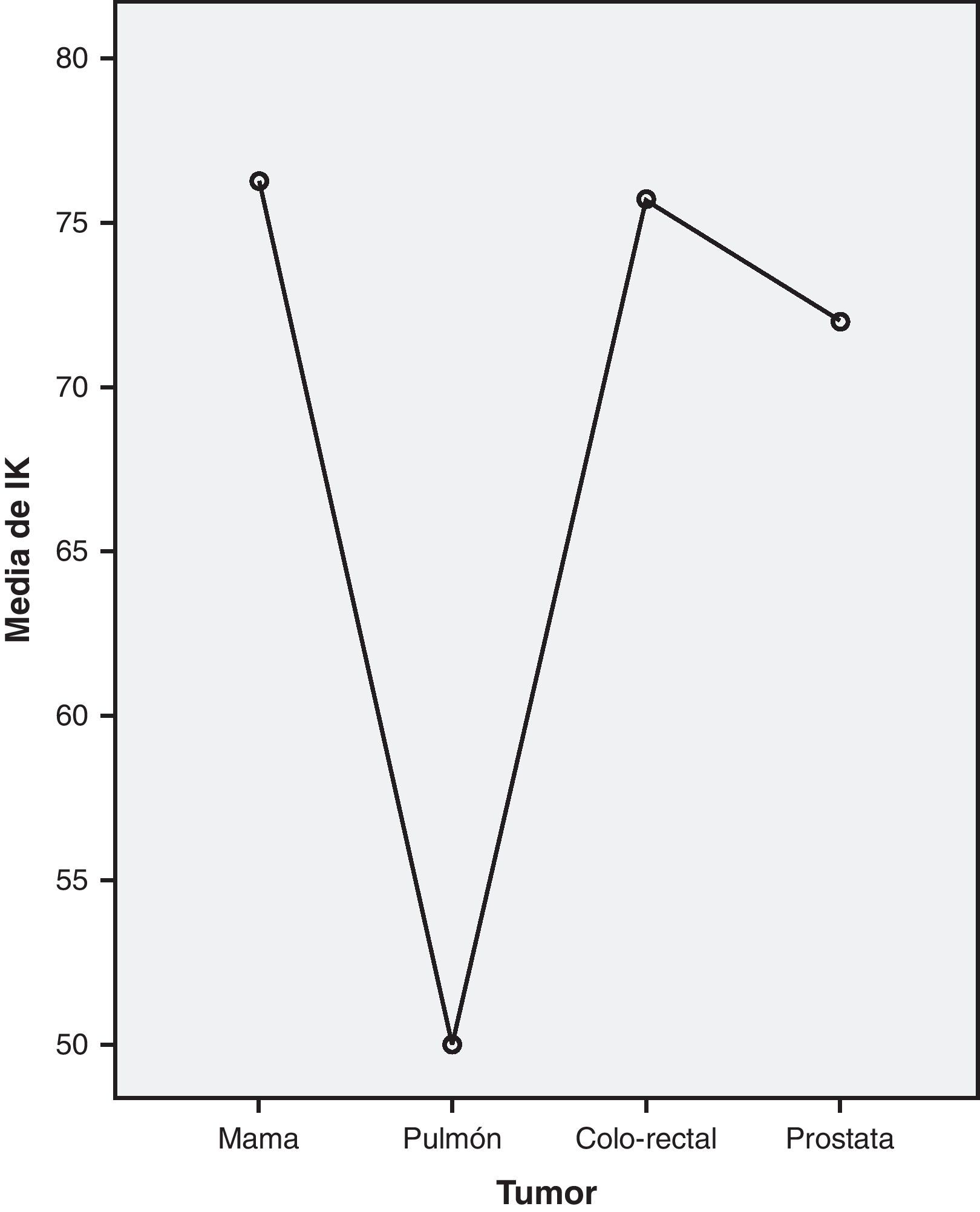
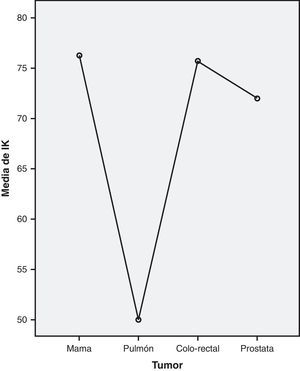
De igual forma, se compararon los tumores más frecuentes y el IK graduado, encontrando diferencias significativas de carácter inverso entre estas variables (χ2=10,684; p=0,014), que tras el análisis con el test de comparaciones múltiples U de Mann-Whitney, confirmó que el grupo diferente sigue siendo el cáncer de pulmón (U de Mann-Whitney=31,5; p=0,002), sobre todo frente al cáncer de mama, con falta de significación estadística con los tumores colo-rectal y prostático (fig. 3).
DiscusiónEl cáncer más frecuente de forma global fue el de mama (predominio en mujeres), seguido del pulmonar (predomino en varones), siguiendo los patrones generales encontrados en la literatura2,3,22–26.
Igualmente corroboramos que los cánceres de pulmón y mama son los que más astenia producen, tanto por los criterios de la ICD-10 adaptada como por el IK graduado, en consonancia con la bibliografía actual2,14.
No encontramos una relación directa entre astenia tumoral y los distintos tipos de tratamiento, probablemente debido al pequeño tamaño muestral, a diferencia de lo dispuesto en la bibliografía2,3,5,9. La AT, en nuestra serie, no depende ni de la edad ni del tiempo de diagnóstico de la enfermedad al igual que en la bibliografía1,5,14,26–28.
Tanto la clasificación ICD-10 adaptada como el IK graduado por los autores se presentan como un buen método, no solo para el diagnóstico, sino también para la gradación de la astenia en pacientes oncológicos.
Somos conscientes de las limitaciones de nuestro estudio: pequeño tamaño muestral; dificultades de la investigación en enfermos con cáncer; tiempo de latencia entre la administración de los tratamientos específicos y momento de valoración de la astenia como probable sesgo; ausencia de pacientes diagnosticados de cáncer sin tratamiento antitumoral específico en el periodo del estudio; falta de valoración de los distintos estadios de la enfermedad debido al escaso tamaño muestral. Igualmente, conocemos el reto que supone plantear la comparación de ambas escalas adaptadas a nuestro estudio al no existir trabajos previos en este sentido en la valoración de la AT.
Entendemos que, de cara al futuro, es necesario aumentar el tamaño muestral, así como hacerlo extensible a otras patologías causantes de astenia de origen no tumoral para dar mayor validez a las gradaciones establecidas tanto para el ICD-10 como para el IK adaptados. En este sentido se podrían plantear estudios similares multicéntricos.
ConclusiónEn el presente estudio hemos constatado la existencia de una correlación negativa o relación inversa entre los grados de astenia tumoral, según la adaptación de los autores de los criterios diagnósticos de la ICD-10 para astenia tumoral frente al índice de Karnofsky, siendo esta estadísticamente significativa. Al ser este último una herramienta fácil y especialmente asequible en cualquier medio sanitario, incluido Atención Primaria y Cuidados Paliativos, se convierte no solo en un indicador funcional sino que puede unidimensionalmente valorar y graduar la AT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Partes del presente artículo fueron presentados parcialmente en el VI Congreso de la Sociedad Andaluza de Cuidados Paliativos celebrado en Sevilla (marzo de 2009), donde recibió el premio a la mejor comunicación oral, y en el VIII Congreso Nacional de Cuidados Paliativos, SECPAL. La Coruña (mayo de 2010).
Francisco Javier Pérez de Santamaría; Juan Polo Padillo; Auxiliadora Fernández López; Rafael Cía Ramos; José Enrique Núñez Pérez; José María Cabral García; José Cabrera Troya; Roberto Moreno Borrego, Francisco Javier Aranda Lara.
Encuesta empleada para la valoración del ICD-10 en la consulta de Atención Primaria para valoración de la astenia tumoral.
| Encuesta realizada al paciente en la entrevista personal | SÍ | NO |
| Requisitos | ||
| 1. Los síntomas repercuten de manera clínica significativa y socialmente sobre el paciente. | ||
| 2. Evidencia por la anamnesis, exploración o pruebas complementarias de que los síntomas son consecuencia del cáncer o de su tratamiento. | ||
| 3. Los síntomas no se deben a comorbilidad psiquiátrica. | ||
| 4. Debe cumplir, al menos, un criterio mayor y cinco menores, todos o casi todos los días, durante al menos dos semanas en el último mes. | ||
| Criterios mayores ICD-10 | ||
| Cansancio significativo | □ | □ |
| Disminución de la energía | □ | □ |
| Aumento de la necesidad de descansar | □ | □ |
| Cualquier cambio reciente desproporcionado en el nivel de actividad | □ | □ |
| Criterios menores ICD-10 | ||
| a) ¿Le pesan más los brazos o las piernas últimamente? | □ | □ |
| b) ¿Le cuesta más recuperar el aliento después de un esfuerzo? | □ | □ |
| c) ¿Le cuesta hacer las actividades básicas de la vida diaria (baño, vestido, comer) solo? | □ | □ |
| d) ¿Necesita hacer un esfuerzo mayor para hacer cosas que hacia antes (pasear, leer, comprar)? | □ | □ |
| e) ¿Se despierta descansado por las mañanas? | □ | □ |
| f) ¿Le cuesta más concentrarse en la cosas (seguir una conversación, ver una película)? | □ | □ |
| g) ¿Tiene ganas de hacer las cosas por sí solo (comer, asearse, ver la tele, leer)? | □ | □ |
| h) ¿Se despierta por la noche con frecuencia o duerme más de la cuenta? | □ | □ |
| i) ¿Se siente más triste o irritable últimamente por su cansancio? | □ | □ |
| j) ¿Se le olvidan más las cosas (tomar la pastilla, qué cenó anoche) ? | □ | □ |
| Total respuestas | ||
La gradación de astenia se basó en la suma del total de respuestas afirmativas a los criterios menores, estableciéndose cuatro categorías de AT
≤4= ausencia; 5-6= leve; 7-8= moderada; 9-10= grave.