El término exantema fijo medicamentoso (EFM) fue introducido en 1894 por Brocq para describir una «erupción eritemato-pigmentada, fija, debida a la antipirina», y que tenía la particularidad de reaparecer en la misma localización cutánea unas horas después de readministrar por vía oral el fármaco desencadenante.
La lista de fármacos que producen EFM es cada vez más amplia y diversa, así como las formas clínicas, que varían desde la aparición de una mácula eritematosa única, a la aparición de múltiples lesiones ampollosas que pueden simular otros cuadros como un penfigoide ampolloso, un síndrome de Sweet o un eritema multiforme medicamentoso.
Epidemiología
EL EFM puede afectar a personas de cualquier edad, aunque la mayoría de los casos se producen entre adultos jóvenes. La proporción entre sexos varía según las series, y tiene una distribución mundial, sin diferencias raciales.
Es una de las cuatro manifestaciones cutáneas más frecuentes secundarias a fármacos, junto a la urticaria, el exantema medicamentoso y eritema exudativo multiforme.
Algunos autores han hallado cierta predisposición en personas con antecedentes familiares de diabetes mellitus, atopia y alergias medicamentosas.
Etiología
La lista de los fármacos implicados en la aparición del EFM varía tanto según cada autor que cada vez tiene menor relevancia, ya que la enorme diversidad observada entre los estudios realizados en diferentes regiones y décadas se debe a que la incidencia de casos de EFM inducidos por un fármaco determinado depende de la frecuencia con la que se emplee en una población o país concretos (tabla 1).
Algunos medicamentos se han asociado con mayor frecuencia a determinadas localizaciones (tabla 2) o formas clínicas, como las pirazolonas y barbitúricos, asociados a formas de EFM ampolloso generalizados.
Aunque generalmente una única sustancia es la responsable del EFM, hay casos de sensibilidad cruzada en los que la asociación de dos fármacos similares estructuralmente puede determinar la aparición de un nuevo episodio de EFM, como la ingestión de sulfonamidas en pacientes con episodios previos de EFM por dapsona.
También se han asociado casos de EFM a la exposición frente a metales pesados, como el arsénico, bismuto, antimoniales, sales de oro, magnesio, yodo o derivados mercuriales, y a gran diversidad de sustancias químicas y de origen vegetal como antralinas, alcaloides de la belladona, efedrina, ipecacuana, fenoftaleína, sulfato de estricnina, gomas, legumbres, colorantes como la tartracina, aromas, conservantes y suplementos alimenticios.
No debemos tampoco olvidar que aunque en la definición inicial del EFM se hablaba de la ingestión de una sustancia para su aparición, cada vez son más numerosos los casos publicados en la bibliografía médica de EFM provocados por la aplicación de sustancias tópicas, anestésicos locales o por simple fotoexposición.
Etiopatogenia
Al estudiar la piel a posteriori de sujetos que habían tenido un episodio de EFM, se observó la presencia de linfocitos intraepidérmicos, la mayoría del subtipo CD8, con potencial citotóxico, pero que mantenían un estado de anergia sin producir ninguna alteración de los queratinocitos, permaneciendo en la piel lesionada durante más de cuatro meses.
La ingestión del fármaco responsable del EFM provocaría la activación, mediante IgE y otros mecanismos no inmunológicos, como la simple presión física local, de los mastocitos presentes en los vasos vecinos, liberando una serie de citocinas como el TNF-α, que inducirían a estos queratinocitos a aumentar la expresión de la molécula de adhesión intercelular ICAM-1, implicada en la interacción entre queratinocitos y linfocitos, facilitando la activación de estos linfocitos CD8 con potencial autolítico.
Esto explicaría la especificidad de la localización del EFM, así como el denominado período refractario que acontece en algunos casos, ya que la activación de estos linfocitos les conduce a su apoptosis, siendo necesario cierto tiempo hasta que la recirculación intraepidérmica linfocitaria normal aporte nuevos linfocitos con capacidad citotóxica y afinidad epidérmica.
Se cree que existiría un desequilibrio cuantitativo entre la población linfocitaria intraepidérmica con funciones protectoras frente a tumores cutáneos, infecciones y enfermedades autoinmunes, que estarían ausentes o muy disminuidos. Este subgrupo de linfocitos citotóxicos podrían provenir de la piel fetal, habrían escapado al proceso de muerte programada de la población linfocitaria que es capaz de reconocer y dañar células propias, localizándose en las regiones de la piel donde se manifiesta el EFM.
Recientemente se ha tratado de demostrar la existencia de cierta susceptibilidad genética frente al EFM, observándose una asociación estadísticamente significativa entre el haplotipo HLA-B22 y una serie de casos de EFM inducidos por cotrimoxazol. También se han descrito casos de EFM por cotrimoxazol entre varios miembros de una familia.
Clínica
La forma de presentación más típica del EFM es en forma de mácula solitaria, redonda u oval, bien definida, de un tamaño variable entre los pocos mm y los 10-20 cm, edematosa, de color rojizo o violáceo, que aparece minutos o pocas horas después de la exposición, generalmente tras la ingestión oral, del fármaco o sustancia desencadenante. La rapidez de aparición de las lesiones parece ser independiente del tipo de medicamento.
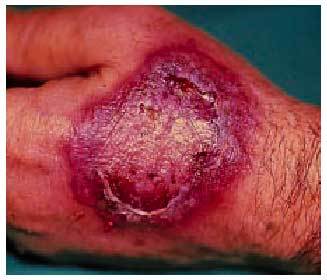
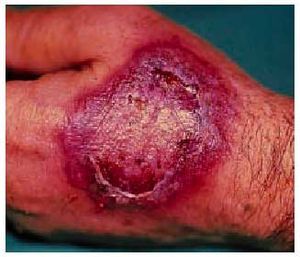
Poco después se forman placas edematosas que pueden desarrollar vesículas y ampollas centrales (fig. 1), de contenido serohemorrágico, que al romperse provocan erosiones especialmente dolorosas en la mucosa genital y oral. Posteriormente, una vez retirado el fármaco, las lesiones presentan costras y descamación superficial hasta desaparecer en un par de semanas, dejando una hiperpigmentacion residual marrón oscuro o violeta, debida a la incontinencia pigmentaria resultante de la degeneración vacuolar de la basal y la presencia de melanófagos en la dermis, y que es más intensa con cada recurrencia. Esta hiperpigmentación residual en la localización de las lesiones puede persistir durante meses o años, y no responde a despigmentantes como la hidroquinona.
Fig. 1. Placa eritematoedematosa con restos de lesión ampollosa central.
Aunque las lesiones suelen ser únicas, sobre todo al inicio, la persistencia del fármaco desencadenante puede aumentar el número y tamaño de las lesiones. En una serie de 450 casos recogida por A. Mahbood y T.S. Haroon entre 1992 y 1993, el 16,2% presentaron una única lesión, el 36,4% entre 2 y 5, el 30% entre 6 y 30 lesiones, el 13,5% entre 30 y 100 y casi el 4% más de 100 lesiones.
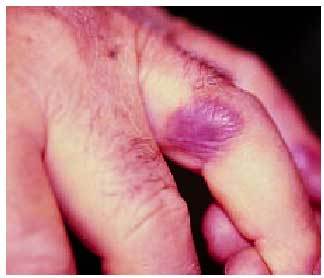
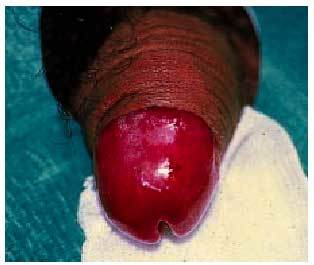
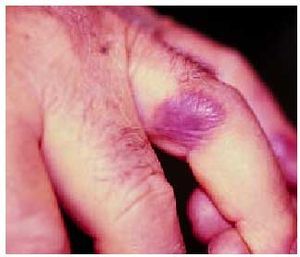
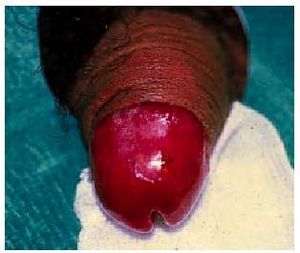
Tienen una distribución universal en piel y mucosas, generalmente aleatoria, algunas veces es simétrica (hasta en un 25%) e impredecible, aunque se creía que podía existir cierta predisposición en zonas localmente dañadas o traumatizadas por picaduras de insectos, herpes zoster o celulitis previas. Suelen ser más frecuentes en miembros que en tronco, y presentan cierta predilección por manos (fig. 2), pies, labios, glande (fig. 3) y área perianal. Pueden aparecer lesiones en nuevas regiones con la reexposición y respetarse las afectadas previamente.
Fig. 2. Localización típica del exantema fijo medicamentoso en un dedo de la mano.
Fig. 3. Exantema fijo medicamentoso en glande.
Las lesiones en mucosas desarrollan con mayor frecuencia formas ampollosas, y pueden presentarse con o sin afectación cutánea acompañante.
A veces se produce un período refractario, que varía de semanas a varios meses, en el que no reaparece la lesión a pesar de la nueva exposición al fármaco sensibilizado.
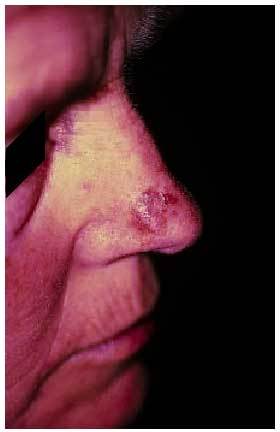
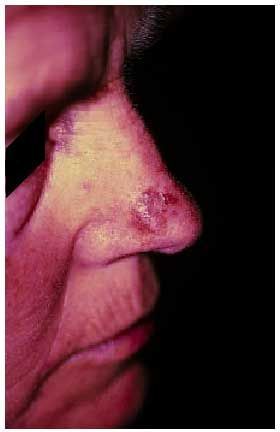
Algunos autores han tratado de relacionar ciertas localizaciones con un tipo concreto de medicamentos, aunque con muchas excepciones (tabla 2), ya que la localización atípica de las lesiones no descarta el cuadro (fig. 4).
Fig. 4. Localización atípica de exantema fijo medicamentoso en cara.
A nivel local, son lesiones habitualmente asintomáticas. A veces presentan prurito, escozor, sobre todo al inicio y de intensidad proporcional a la inflamación existente, o dolor si hay erosión.
Aunque leves, pueden aparecer síntomas de afectación sistémica, sobre todo al inicio del cuadro, en forma de fiebre, náuseas, diarrea, artralgias, uretritis, conjuntivitis, calambres abdominales y malestar general.
Se han descrito además numerosas formas clínicas atípicas de presentación clínica del EFM, entre las que simplemente enumeraremos las siguientes: EFM no pigmentado (placas eritematosas extensas, a menudo simétricas, asociadas a pseudoefedrina, tetrahidrozolina y piroxicam con mayor frecuencia, que se resuelven sin hiperpigmentación residual, por respetarse la epidermis, por lo que no se produce incontinencia pigmentaria); urticaria; dermatitis crónica; dermatitis periorbital; liquen plano; parapsoriasis; eritema exudativo multiforme; EFM lineal (por cefazolina IM); EFM lingual (en heroinomanos), e hipermelanosis difusa (en raza negra).
Las lesiones cutáneas desaparecen en días o semanas tras la suspensión del fármaco desencadenante.
Si se mantiene la ingestión del fármaco, como podrían ser los casos de pacientes en coma o ancianos sin la correcta supervisión, las lesiones persisten indefinidamente, haciéndose cada vez más grandes y apareciendo otras en nuevas localizaciones ante una nueva reexposición. Las lesiones pueden confluir de forma policíclica o en banda, simulando un patron zosteriforme.
Diagnóstico diferencial
Dada la gran diversidad de formas atípicas de EFM, se podría plantear su diagnóstico diferencial con numerosos cuadros dermatológicos. A continuación se recogen los cuadros que podrían originar mayor confusión en función de diferentes formas clínicas de EFM.
EFM oral: aftosis, herpes y EEM.
EFM genital solitario: herpes recurrente.
EFM múltiple: síndrome Stevens Johnson (SSJ), necrólisis epidérmica tóxica (NET).
Histología
Los hallazgos histopatológicos en el EFM son muy similares a los de otras entidades, como el eritema exudativo multiforme, por lo que tendrán un papel sugestivo para su diagnóstico, que deberá basarse en la clínica.
Se observan queratinocitos necróticos y disqueratosicos individualizados, con espongiosis y vacuolizacion de la capa basal de la epidermis. En la dermis aparece edema y un infiltrado linfohistocitario perivascular e intersticial, con algunos eosinófilos. Es muy característica la presencia de incontinencia pigmentaria, con macrófagos melanófagos cargados de melanina en la dermis papilar.
En las formas ampolloso-necróticas pueden existir vesículas y ampollas subepidérmicas con necrosis de la epidermis suprayacente.
Los estudios de inmunofluorescencia son inespecíficos, aunque puedan existir depósitos de IgG y C3 alrededor de los queratinocitos de la piel lesionada.
Pruebas complementarias y diagnóstico
El diagnóstico del EFM es esencialmente clínico, basado en la forma de las lesiones cutáneas, y el antecedente de ingestión de un fármaco en la mayoría de los casos, y su resolución al retirar dicho desecadenante. Para ello debemos realizar una anamnesis exhaustiva a los pacientes respecto a las medicinas que han tomado recientemente, lo que no es nada fácil debido a la tendencia a no considerar medicamentos sustancias como los laxantes, supositorios, jarabes, píldoras anticonceptivas, vitaminas o suplementos dietéticos, inyecciones o medicaciones que suelen tomar ocasionalmente y que inconscientemente creen que no pueden ser los responsables de su enfermedad cutánea. Otra dificultad añadida frecuentemente es que el paciente tome diversos fármacos, por lo que tendremos que valorar si debe suspender toda la medicación posible o sustituirla por otras, con la posible aparición de un nuevo episodio sin poder saber cuál de estos fármacos es el responsable.
En el pasado se intentó demostrar la presencia del agente causante mediante la captación local de isótopos radiactivos en las zonas lesionadas mediante yodo radiactivo, en casos debidos a yoduros, o sulfadimidina-S35 y a sulfadimidina, sin resultados.
Diversos estudios in vitro tampoco sirvieron para identificar el agente causal, como la inyección intradérmica de suero autólogo extraído del paciente durante la fase aguda del EFM en zonas previamente lesionadas que reproducía nuevas lesiones, pero no lo hacía tras la inoculación del fármaco.
Las pruebas complementarias que pueden ayudar al diagnóstico del EFM, especialmente en los casos de formas clínicas atípicas, son la realización de una biopsia cutánea y la exposición a la sustancia sospechosa, por tanto también de valor etiológico, mediante parches cutáneos. Sin embargo, dada la ausencia de una histopatología patognomónica y la baja sensibilidad de las pruebas de provocación cutáneas, debemos recordar que el diagnóstico del EFM debe basarse en la anamnesis del paciente y la exploración física, por lo que la realización de estas pruebas dependerá de la sospecha clínica.
La realización de pruebas de contacto (PAC) frente al posible fármaco desencadenante tienen un rendimiento bastante irregular. Pueden ser positivas hasta en un 30% de los casos si la prueba de provocación se realiza sobre la piel lesionada, ya que suelen ser negativas en la piel sana.
Si la PAC es negativa y el EFM leve, algunos autores proponen realizar una prueba de provocación oral mediante la ingestión del fármaco sospechoso para llegar a un diagnóstico etiológico. Esta prueba suele ser positiva en un alto porcentaje, y deberá realizarse administrando dosis subterapéuticas al principio, que progresivamente se irán aumentando, observando cuidadosamente cualquier signo físico, local o sistémico, de recidiva.
Entre los hallazgos analíticos, un hemograma realizado en la fase aguda el EFM puede mostrar una moderada leucocitosis, con ocasional eosinofilia e hipergammaglobulinemia (IgG e IgA). Estos valores hematológicos vuelven a ser normales unas tres semanas después de la resolución de las lesiones cutáneas.
Tratamiento
Lo más importante de la actitud a tomar frente a un paciente con cualquier erupción cutánea secundaria a un fármaco, en este caso ante la sospecha de un EFM, es tratar de identificar el fármaco responsable y suspender inmediatamente toda la medicación que sea posible.
Una vez retirado el probable agente causal, la naturaleza y gravedad de los signos y síntomas acompañantes serán los que determinen la necesidad de utilizar terapia adicional.
La mayoría de estas enfermedades se acompañan de prurito, por lo que la utilización de antihistamínicos, en el caso del EFM, será únicamente sintomática.
Localmente, las lesiones no erosionadas pueden mejorar con corticoides tópicos potentes o intralesionales.
Sin embargo, los corticoides orales se han usado en casos EFM ampollosos severos, pero no alteran la evolución del cuadro, por lo que su utilización es muy controvertida. En cuanto al balance entre los beneficios y perjuicios que supone para estos pacientes suspender la medicación desencadenante o sustituirla por otra diferente, son cada vez más interesantes los casos publicados de desensibilización tras reexposición progresiva al fármaco que originó el EFM, llegando a alcanzar dosis terapéuticas sin reaparición de un episodio de EFM.
Bibliografía
Baker H. Fixed eruption due to iodide and antipiride. Br J Dermatol 1962;74:310-6.
Breathnach SM. Drug reactions. En: Rook A, Wilkinson DS, Ebling FSG, editors. Textbook of Dermatology. 5.a ed. Oxford:Blackwell, 1992; p. 2973-4.
Del Río E, Guimaraens D, Aguilar A, Conde Salazar L, Sánchez Yus E. Fixed exanthema induced by ultraviolet radiation. Dermatology 1996;193:54-5.
Derbes VJ. The fixed eruption. JAMA 1964;190:765-6.
Domínguez Ortega J, Trindade C, Alonso Llamazares A, Castellano Bravo A, Cimarra Álvarez-Lovel M, Martínez-Cocera C. Hypersensitivity to allopurinol. Efficacy of a desensitizing protocol in 3 cases. An Med Interna 2001;18:27-8.
Fitzpatrick T B. Atlas y sinopsis de dermatología clínica. 5.a ed. Boston, Ma: Mc Graw-Hill, 2001; p. 560-2.
Korkij W, Soltani K. Fixed drug eruption: a brief review. Arch Dermatol 1984;120:520-4.
Krivda S J, Benson P M. Nonpigmented fixed drug eruption. J Am Acad Dermatol 1994;31:291-2.
Lisi P, Stingeni L. Fixed Drug Eruption. Clin Dermatol 1993;11:461-6.
Mahbood A, Haroon TS. Drugs causing fixed eruptions: a review of 450 cases. Int J Dermatol 1998;37:833-8.
Özkaya-Bayazit E, Akar U. Fixed drug eruption induced by trimethoprim-sulfamethoxazole: evidence for a link to HLA-A30 B13 Cw6 haplotype. J Am Acad Dermatol 2001;45:712-7.
Özkaya-Bayazit E, Bayazit H, Özarmagan G. Drug related clinical pattern in fixed drug eruption. Eur J Dermatol 2000;10:288-91.
Sehgal VN. Paracetamol-induced bilateral symmetric, multiple fixed drug eruption (MFDE) in a child. Pediatric Dermatology 1998; 16:165-6.
Shelley WB, Shelley ED. Nonpigmented fixed drug reaction pattern: examples caused by sensitivity to pseudoephredine hydrochloride and tetrahydrozoline. J Am Acad Dermatol 1987;17:403-7.
Shiohara T, Moriya N. Epidermal Tcells: their functional role and disease relevance for dermatologist. J Invest Dermatol 1997;109: 271-5.
Valsecchi R, Cainelli T. Nonpigmenting fixed drug reaction to piroxicam. J Am Acad Dermatol 1989;21:1300.
Welsh AL. The fixed eruption: a possible hazard of modern drug therapy. Springfield, IL: Charles C Thomas, 1961; p. 208.
Wyatt E, Greaves M, Sondergaard J. Fixed drug eruption (phenolphtlaein). Arch Dermatol 1972;106:671-3.