Las proteínas son compuestos orgánicos formados por cadenas de aminoácidos, unidos entre sí por enlaces peptídicos.
Debido a que su molécula posee grupos amino y carboxílicos, pueden actuar negativa o positivamente, en función del medio en que se hallen inmersas, es decir, pueden hacer función de ácido o base.
En un medio ácido, la proteína permanece con carga positiva y migra hacia el cátodo, en un campo eléctrico y en un medio alcalino, está cargada negativamente y migra hacia el ánodo.
Por tanto, la molécula de proteína tiene una carga positiva o negativa que depende de los siguientes factores: a) número de grupos ácidos y bases que tenga libres; b) estructura molecular terciaria y cuaternaria, y c) el pH y la fuerza iónica del medio en el que esté ubicada.
La velocidad de desplazamiento en un campo eléctrico depende de la carga de la proteína y de la fuerza del campo eléctrico. A este fenómeno se le denomina electroforesis.
Tiselius realizó las primeras investigaciones en Upsala en 1937. Para ello empleó la fase líquida libre, con separación en un tubo con forma de U, en un medio líquido que hacía de tampón. Acopló un par de electrodos y un sistema óptico con difracción de la luz, que le permitía observar la separación de cuatro bandas proteicas en el plasma, según el tono claro-oscuro de las mismas. A estas cuatro bandas proteicas las denominó: albúmina, alfa, beta y gamma.
Esta técnica cayó en desuso ya que era muy engorrosa y económicamente costosa para realizarla en el laboratorio de rutina. En 1950, se puso otra vez de actualidad la electroforesis al descubrirse distintos soportes para realizarla. El primero de ellos fue el papel, que permitía una rápida separación de las proteínas séricas que se visualizaban con sistemas de coloración. A continuación, mediante lecturas fotodensitométricas se pudo empezar a cuantificar estas bandas proteicas.
Se fueron perfeccionando los tipos de soporte, y en la actualidad los dos más usados para las determinaciones clínicas son el acetato de celulosa y la agarosa.
Existe también el gel de amida y el de poliacrilamida, que se utilizan sobre todo en investigación debido a su alta resolución.
Normalmente, con los tipos de soporte citados con anterioridad, podemos obtener una nítida separación de las siguientes fracciones de las proteínas del suero: albúmina, alfa-1 globulina, alfa-2 globulina, beta-1 globulina, beta-2 globulina y gammaglobulina.
Los tampones que se usan son básicos, con un pH alrededor de 8,6. Es un pH menos desnaturalizante que el ácido, y en él la mayor parte de las proteínas están cargadas negativamente y se desplazan hacia el ánodo más o menos rápidamente, en función de su carga, permitiendo una buena separación.
En la actualidad, existen aparatos semiautomáticos y automáticos que nos dan directamente la lectura y el diagrama de las distintas fracciones proteicas.
Descripción de las fracciones proteicas
Albúmina
Tiene un peso molecular (PM) de 65.000 daltons (Da).
Función. Las principales son: a) fijación y transporte de sustancias, y b) responsable del control del equilibrio de líquidos entre los compartimientos intra y extravascular.
Patología. Se encuentra aumentada en la deshidratación y disminuida en los siguientes procesos: hepatopatías, infección crónica, neoplasias, nefropatía, hemorragia, inanición y desnutrición.
Albúmina bigeminada o bisalbuminemia
Puede ser debida a tres etiologías:
1. Una mutación hereditaria. El desdoblamiento es una expresión permanente de una variación genética de la albúmina, sin ninguna consecuencia patológica conocida en la actualidad.
2. En el curso de un tratamiento con betalactamasas a grandes dosis en una insuficiencia renal, ya que el antibiótico se fija a la albúmina.
3. En presencia de una fístula pancreática por lisis intracavitaria de la albúmina debido a las enzimas pancreáticas. La puesta en evidencia de una bisalbuminemia en una ascitis o pancreatitis con ascitis debe hacer pensar en un seudoquiste de páncreas fistulizado. Ello constituye un argumento importante en favor de una decisión quirúrgica.
Alfa-1 globulina
Los principales componentes son:
Alfa-1 antitripsina. Su PM es de 45.000 Da.
Función: neutralización de enzimas proteolíticas tipo tripsina.
Patología: aumentada en reacciones inflamatorias y disminuida en el enfisema pulmonar.
Alfa-1 lipoproteínas. Su PM es de 200.000 Da.
Función: transporte de colesterol y vitaminas liposolubles.
Patología: aumentada en las hiperlipemias y disminuida en la enfermedad de Tangier.
Alfa-1 glucoproteínas. Su PM es de 44.000 Da.
Se halla en tejidos y secreciones mucosas.
Protrombina. Su PM es de 72.000 Da.
Función: participa en la coagulación sanguínea y disminuye en las hepatopatías.
Globulina fijadora de hormonas tiroideas. Su PM es de 36.500 Da.
Función: interviene en el transporte de hormonas tiroideas.
Aumenta en el embarazo, con el empleo de anticonceptivos y disminuye en las glomerulonefritis y el tratamiento con metiltestosterona.
Alfa-2 globulina
Sus componentes son:
Alfa-2 macroglobulina. Su PM es de 800.000 Da.
Función: inhibición de proteasas. Aumenta en las nefropatías, la diabetes, el síndrome de Down y el embarazo. Disminuye en la artritis reumatoide y en el mieloma.
Haptoglobina. Su PM varía de 85.000 a 100.000 Da.
Función: fija la hemoglobina y conserva el hierro. Aumenta en la inflamación aguda, las neoplasias, el infarto de miocardio y el linfoma de Hodgkin, y disminuye en las hepatopatías y en la anemia hemolítica.
Ceruloplasmina. Su PM es de 132.000 Da.
Función: fijación del cobre. Aumenta en el embarazo y con la ingesta de anticonceptivos y disminuye en la enfermedad de Wilson.
Alfa-2 lipoproteínas. Su función es de transporte de lípidos. Aumenta en las hiperlipemias y disminuye en las enfermedades hepáticas graves.
Eritropoyetina. Su PM es de 30.000 Da. Actúa como hormona esencial para la eritropoyesis.
Aumenta en las anemias y disminuye en las enfermedades renales crónicas y en las enfermedades autoinmunes.
Betaglobulina
Los componentes son:
Transferrina. Su PM es de 80.000 Da. Es una proteína de transporte que transfiere el hierro.
Aumenta en la anemia hipocroma y disminuye en hepatopatías, las enfermedades renales y las neoplasias.
Betalipoproteínas. Su PM es de 300.000 Da. Su función es el transporte de lípidos y hormonas.
Aumenta en las nefropatías e hiperlipemias y disminuye en la inanición.
C3 y C4. Su PM respectivo es de 185.000 y 400.000 Da. Actúan en las reacciones inflamatorias y disminuyen en las enfermedades inmunes.
Inactivadora de la esterasa C1. Su PM es de 104.000 Da. Inhibe la actividad de C1 y disminuye en el edema angioneurótico.
Hemopexina. Su PM es de 80.000 Da. Participa en el transporte del hemo. Aumenta en las inflamaciones agudas, neoplasias y disminuye en las hepatopatías y en la anemia hemolítica.
Gammaglobulina
Sus componentes son todas las inmunoglobulinas: IgG (PM 150.000 Da), IgA (PM 180.000 Da), IgM (PM 900.000 Da), IgD (PM 170.000 Da), e IgE (PM 190.000 Da). Participan en el sistema inmunitario del organismo. Aumentan en los siguientes procesos: hepatopatías, infecciones crónicas (banda heteroclonal); mieloma múltiple, enfermedad de Waldenström, lupus eritematoso sistémico, linfoma, leucemia, artritis reumatoide (banda monoclonal). Disminuyen en: edad avanzada, leucemia linfocítica crónica, hipo y agammaglobulinemia y enfermedad de cadenas ligeras.
Significado de las gammapatías monoclonales
Formas asintomáticas: pueden aparecer en las infecciones agudas y crónicas, y la artritis reumatoide.
Formas de asociación: leucemias, sarcomas de Kaposi, sida, neoplasias intestinales, de tracto biliar y mama, polineuropatías y lipodistrofias.
Formas transitorias: tratamientos farmacológicos como sulfamidas, inmunosupresores; infecciones virales y cardiocirugía valvular.
Formas de proliferación de clon neoplásico: mieloma, mieloma múltiple, plasmocitoma extramedular, leucemia plasmocelular, enfermedad de Waldenström y enfermedad de cadenas pesadas.
Formas asociadas a patología del componente monoclonal: enfermedad por crioglobulinas, amiloidosis, enfermedad de cadenas ligeras y polineuropatías.
Electroforesis en orina
Glomerular. Puede ser de dos tipos:
1. Proteinuria selectiva. Detección de una banda en la zona de la albúmina y a veces una fina banda de transferrina.
2. Proteinuria no selectiva. Patrón del uroproteinograma parecido al del suero. Se detecta en glomerulopatías primarias y secundarias.
Tubular. Se observan, sobre todo, las bandas globulínicas. Se encuentra en riñones poliquísticos, pielonefritis crónica, nefropatías tubulares congénitas y nefritis tubulares intersticiales.
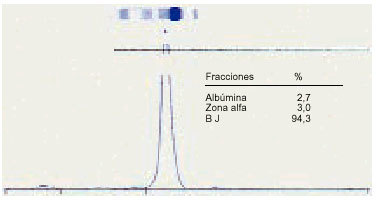
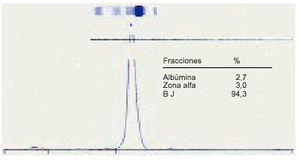
Proteinuria de Bence-Jones. Se presenta como una banda muy definida en la zona de la beta-gamma. La podemos encontrar en los siguientes procesos patológicos mieloma, enfermedad de Waldenström, crioglobulinemia, amiloidosis primaria, hiperparatiroidismo, síndrome de Fanconi del adulto y gammapatía monoclonal benigna.
No se detecta con la tira reactiva y, si sólo se realiza una electroforesis sérica, pueden pasar por alto mielomas kappa y de cadena ligera lambda.
Siempre hay que realizar un uroproteinograma con orina previamente concentrada.
Electroforesis en jugo gástrico
En un 80% de casos de enfermedad de Menetrier hay una notable pérdida de proteínas plasmáticas a través de la mucosa gástrica. Esto es debido a la existencia de una hipertrofia importante de la mucosa que da lugar a pliegues de mucosa gigantes.
En esta afección podemos encontrarnos con que el pH gástrico haya perdido parte de su acidez por el tamponamiento proteico; por tanto, al efectuar una electroforesis con el jugo gástrico previamente concentrado, se detecta una banda muy visible en la zona de emigración de la albúmina.
Electroforesis en líquido cefalorraquídeo (LCR)
En el LCR los componentes proteicos definidos en la electroforesis son análogos a los del suero. No obstante, en la electroforesis de LCR aparece muy frecuentemente una banda anterior a la albúmina, denominada prealbúmina, banda que en la electroforesis sérica aparece raramente. La gammaglobulina está elevada en infecciones tipo meningitis o encefalitis.
En bloqueos medulares hay un aumento de albúmina.
Es fundamental concentrar el LCR antes de efectuar una electroforesis del mismo.
Datos valorables
Después de haber realizado en el servicio un promedio de 14.000 proteinogramas durante los últimos 7 años, usando como soporte gel de agarosa, podemos esta-
blecer los siguientes datos valorables en la patología clínica:
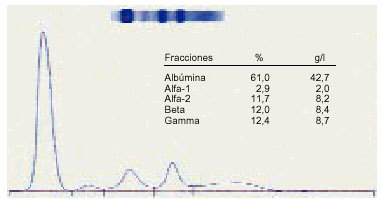
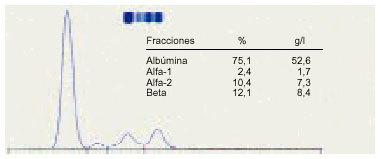
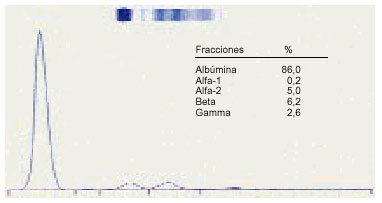
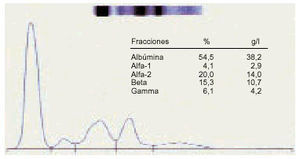
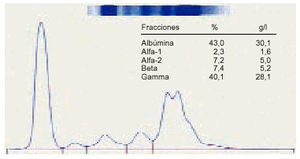
1. Podemos considerar un proteinograma normal en suero, con los siguientes valores en las distintas fracciones proteicas (fig. 1).
Fig. 1. Proteinograma normal.
Albúmina: 53-69%; 35-46 g/l.
Alfa-1 globulina: 2-4%; 1-3 g/l.
Alfa-2 globulina: 6-11%; 4-7,5 g/l.
Betaglobulina: 8-13%; 5-9 g/l.
Gammaglobulina: 12-19%; 8-12 g/l.
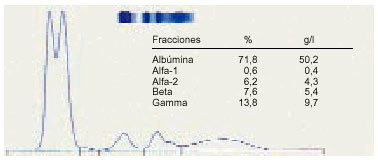
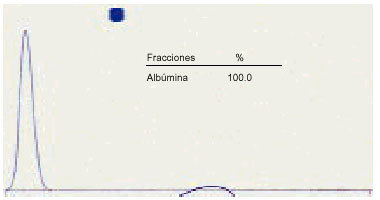
2. La bisalbuminemia es permanente o transitoria, dependiendo de una mutación genética o tratamiento con betalactamasas, ascitis o pancreatitis con ascitis (fig. 2). Alguna vez se ha encontrado acompañada de una gammapatía monoclonal.
Fig. 2. Bisalbuminemia.
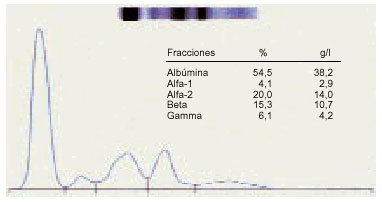
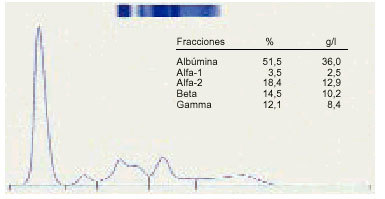
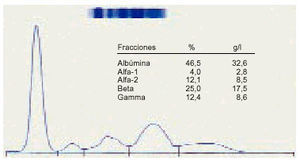
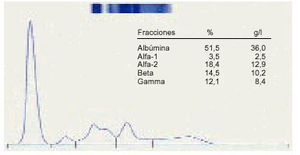
3. La alfa-2 hiper globulinemia hace sospechar una infección aguda o una neoplasia (fig. 3).
Fig. 3. Elevación de la alfa-2 globulina.
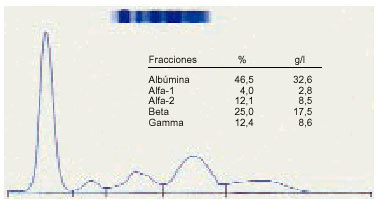
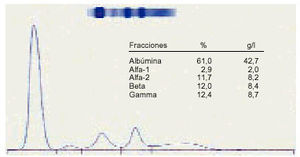
4. La hiperbetaglobulinemia nos indica una discrasia lipídica o un trastorno debido a la transferrina (fig. 4).
Fig. 4. Elevación de la betaglobulina.
5. Debemos pensar en una neoplasia cuando el valor de las alfa-2 globulinas sumado al de las betaglobulinas es superior al doble del de la gammaglobulina.
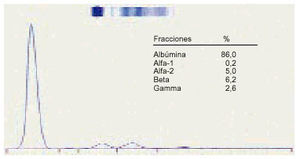
6. Las hipo y agammaglobulinemias pueden ser debidas a cualquier etiología que cause fallos inmunitarios. Nosotros hemos observado una agammaglobulinemia por un timoma (fig. 5).
Fig. 5. Agammaglobulinemia.
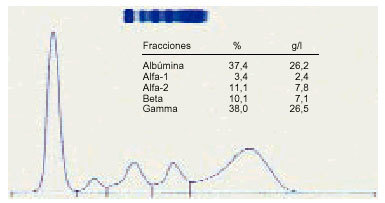
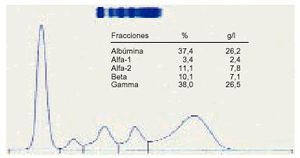
7. Una hipergammapatía heteroclonal nos hace sospechar, en primer lugar, una cirrosis hepática o un VIH en fase reactiva y, en segundo lugar, una infección crónica, aunque en este último caso el incremento suele ser más moderado (fig. 6).
Fig. 6. Elevación policlonal de la gammaglobulina.
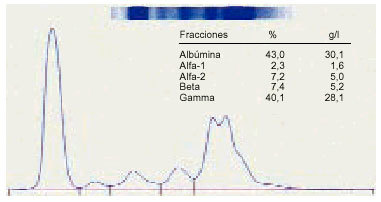
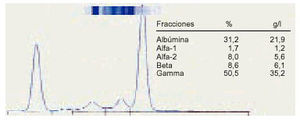
8. El número de gammapatías monoclonales encontradas en nuestro servicio en estos últimos años es del 6,7%. Es decir, de cada 100 proteinogramas había 6 o 7 que tenían una banda monoclonal. Ésta, la mayor parte de veces, se localiza en la zona de emigración de la gammaglobulina, ya sea al principio, en medio o al final, pero excepcionalmente se puede encontrar en la zona de la beta o de la alfa-2 globulina. Incluso hemos detectado gammapatías monoclonales con 2 o 3 bandas (figs. 7-9).
Fig. 7. Gammapatía monoclonal.
Fig. 8. Gammapatía monoclonal con dos bandas.
Fig. 9. Banda monoclonal en alfa-2.
9. El 35-40% de estas gammapatías monoclonales descubiertas fueron hallazgos del laboratorio. El primer dato encontrado de que el enfermo podía tener una patología debida a esta alteración se debió al proteinograma.
10. Casi siempre una gammapatía monoclonal patológica va acompañada de una hiperproteinemia total (90-110 g/l). No obstante, hay un pequeño porcentaje que cursa con normoproteinemia.
11. Puede existir una gammapatía monoclonal con una gammaglobulina cuantitativa normal.
12. Ante toda gammapatía monoclonal hay que continuar efectuando exploraciones analíticas y clínicas para determinar su transitoriedad, benignidad o malignidad.
13. Por todo lo citado anteriormente, se puede asegurar que el proteinograma es una muy buena técnica de ayuda diagnóstica de varios procesos patológicos y como paso previo para descartar la cuantificación de proteínas específicas, que sólo se deben determinar cuando en el proteinograma se encuentre alguna alteración relacionada con bandas monoclonales. Esto evita duplicidades técnicas y el aumento del coste económico.
14. El uroproteinograma proporciona una información fidedigna sobre si se trata de una proteinuria de filtración selectiva o no selectiva, o bien de una proteinuria de Bence-Jones (figs. 10-12).
Fig. 10. Proteinuria de filtración selectiva.
Fig. 11. Proteinuria de filtración no selectiva.
Fig. 12. Proteinuria de Bence-Jones.
15. En la enfermedad de Menetrier, el proteinograma en jugo gástrico detecta una banda en la zona de la al búmina debido a la gran pérdida de la misma por la mucosa gástrica (fig. 13).
Fig. 13. Proteinograma en jugo gástrico. Enfermedad de Menetrier.
16. En LCR se pueden hallar las siguientes alteraciones:
Hiperalbuminorraquia en un bloqueo medular.
Gammaglobulina oligoclonal elevada en la esclerosis múltiple.
Gammaglobulina elevada en infecciones como meningitis o encefalitis.
Agradecimientos
Agradecemos la colaboración recibida del Laboratorio Atom S.A. y Sebia Hispania S.A., que nos ha permitido realizar este trabajo.
Bibliografía general
Gras J. Proteínas plasmáticas. Barcelona: Jims, 1961.
Le Carrer D. Electrophorese et immunofixation des proteines seriques. París: Ed. Sebia, 1995.
Marco M. Curso de avances en electroforesis. Atom S.A., 1995.
McManamon T, Lott JA. Cancer. Electroforesis de proteínas séricas, cap. 101.
Sanford T. Diagnóstico clínico por el Laboratorio. Madrid: Marín, 1996.
Tiselius A. A new apparatus for electrophoresis: analysis of colloidal mixtures. Trans Faraday Soc 1937; 33: 524-529.
Wallach J. Interpretación clínica de las pruebas de Laboratorio. Barcelona: Masson, 1998.
Yamada T et al. Handbook of gastroenterology. Filadelfia: Lippincott Raven Publishers, 1998.