INTRODUCCIÓN
El 30-40% de los pacientes con cáncer sometidos a tratamiento activo refieren dolor. En enfermedad oncológica avanzada este porcentaje llega a ser del 70 al 90%1.
Los opioides representan la mejor arma terapéutica para el control del dolor en el paciente oncológico. Más de la mitad de los pacientes con dolor oncológico precisarán, a lo largo de su seguimiento, tratamiento con opioides del 3.er escalón de la Organización Mundial de la Salud (OMS) para ser controlados2. Sin embargo, diversos estudios demuestran que estos pacientes no reciben el tratamiento analgésico adecuado. El consumo de morfina en España, un indicador sugerido por la OMS para valorar el control del dolor oncológico en un determinado país, permanece por debajo de los países de nuestro entorno a pesar de los progresos realizados en los últimos años3.
Es importante conocer las características, las acciones y los efectos secundarios de los principales opioides para controlar el dolor en los pacientes oncológicos.
OPIOIDES
Los opiáceos son fármacos naturales o semisintéticos derivados del jugo extraído del opio. Los opioides son un grupo de sustancias que alivian el dolor fijándose a receptores opioides específicos del sistema nervioso central (SNC), periférico y entérico. Aunque existen numerosos receptores opioides, sólo se han identificado varios tipos: mu, delta, kappa, sigma, épsilon, y de algunos de ellos se diferencian subtipos. Lo más probable es que cada individuo tenga diferentes cantidades y subtipos de receptores.
El tipo de interacción con estos receptores (excitación o inhibición) determina las distintas acciones de los fármacos opioides y sus efectos adversos. Pero además, las sustancias opioides pueden interaccionar sobre otros sistemas de neurotransmisores y otros receptores. Esto explica que un paciente pueda responder tras un cambio de opioides y que al desarrollar reacciones adversas intolerables, pueda ser sustituido un opioide por otro.
La intensidad farmacológica de los opioides está determinada por su capacidad de llegada a los distintos receptores y existe una serie de factores que influyen sobre su acción: la mayor liposolubilidad, la alcalosis del medio y la menor unión a proteínas plasmáticas dan mayor acceso al receptor.
CLASIFICACIÓN
Los opioides, según interaccionan con el receptor opioide, se clasifican en: agonistas puros, agonistas parciales, agonistas/antagonistas mixto y antagonistas.
1. Agonistas puros: son fármacos que interaccionan fundamentalmente con el receptor mu. En consecuencia, cuando se administran producen analgesia, euforia, depresión respiratoria, miosis, náuseas, vómitos, estreñimiento, aumento de la presión en las vías biliares, dependencia física, sedación, alteraciones endocrinas (liberación de prolactina, GH, inhibición de ACTH, LH/FSH). Se caracterizan por su gran afinidad por el receptor opioide y su actividad intrínseca.
a) Opioides mayores: se caracterizan por no tener techo analgésico, es decir, el grado de analgesia crece casi ilimitadamente con la dosis y podría alcanzar un techo antiálgico muy alto de no ser por sus efectos adversos. Son la morfina, el fetanilo, la oxicodona y la metadona.
b) Opioides menores: se caracterizan por poseer techo analgésico. Son la codeína, la dihidrocodeína y el tramadol.
2. Los agonistas parciales, tales como la buprenorfina. Se caracterizan por su aumentada afinidad por el receptor opioide, pero con actividad intrínseca parcial. Si los administramos con morfina estos fármacos pueden desplazar a la morfina. Tienen techo analgésico.
3. Agonistas/antagonistas: se caracterizan por activar al receptor opioide kappa y por comportarse como agonistas/antagonistas débiles del receptor mu. Su representante es la pentazocina. Tienen techo analgésico bajo y producen disforia y psicomimesis, que limitan mucho su utilización.
4. Antagonistas puros: presentan alta afinidad por los receptores opioides y no tienen actividad intrínseca. Compiten con los agonistas por el receptor, desplazando a éstos, y sirven para evitar sus efectos secundarios. Son la naloxona y la naltrexona.
OPIOIDES MENORES (tabla 1)
Constituyen el segundo nivel de la escala de la OMS, eficaces en dolor moderado. Son la codeína, la dihidrocodeína y el tramadol. Se caracterizan por tener techo analgésico: a partir de determinada dosis no existe mayor analgesia y sí efectos secundarios. Aunque es un agonista parcial, la buprenorfina también posee techo analgésico, por este motivo se incluye dentro de este grupo.
Codeína
El hígado la transforma en morfina, pero posee acción analgésica por sí misma. Se convierte en morfina por el citocromo CYP2D6. Existe un escaso número de personas que carecen de este citocromo, por lo que la codeína puede resultar ineficaz.
Es antitusígena y antidiarreica con dosis de 10 mg cada 8 horas. La dosis analgésica mínima es de 30 mg cada 6 horas. La dosis máxima es de 350 mg al día. Sus efectos secundarios son mareo, náuseas, vómitos, estreñimiento y sedación, que se relaciona con la dosis.
Tramadol
Es un agonista opiáceo puro débil de receptores mu que modifica la actividad serotoninérgica y noradrenérgica de las vías nerviosas descendentes moduladoras del dolor, por lo que es efectivo en dolor neuropático. Su potencia es 5-10 veces menor que la de la morfina y ligeramente superior a la de la codeína.
La dosis inicial debe ser de 50 mg cada 6-8 horas y la dosis máxima de 400 mg (equivalente a 8 comprimidos de 50 mg). Se realizarán incrementos del 50% de la dosis en 48 horas si no se controla el dolor.
Los efectos secundarios son similares a los otros opioides, aunque de menor intensidad, siendo muy bajo el riesgo de depresión respiratoria. Es más eficaz y produce menos estreñimiento y menos depresión respiratoria que otros opioides menores, pero produce más vómitos en personas mayores4.
En insuficiencia renal se deben disminuir dosis o evitarlo, ya que puede interaccionar con inhibidores selectivos de la recaptación de serotonina por su metabolismo hepático.
Se puede usar vía oral, rectal, subcutánea o intravenosa, con una relación entre dosis de 1:1, es decir, la dosis subcutánea no precisa ajuste de dosis respecto a la vía oral.
La sustitución por opiáceo mayor se realizará con dosis equianalgésicas.
Buprenorfina
Es un opioide agonista parcial. No precisa receta de estupefacientes, ya que tiene techo analgésico (al contrario que el resto de los opioides mayores).
Se aplica sobre piel intacta por encima de la cintura a primera hora del día y se cambia a los 3 días. El calor excesivo aumenta su absorción. Tras su aplicación, se necesitan de 12 a 24 horas para tener niveles mínimos eficaces en la circulación, por lo que durante las primeras 24 horas de su aplicación se debe prescribir medicación de rescate. Tras retirar el parche, la concentración sanguínea del fármaco disminuye en 30 horas, por lo que no se recomienda administrar otro opioide en las 24 horas posteriores a su retirada.
Siempre se debe prescribir medicación de rescate para tratar los episodios de dolor irruptivo con buprenorfina sublingual a dosis de 0,2 mg. Si se necesitan más de 0,6 mg al día, hay que aumentar la dosis del parche a la siguiente concentración o poner 2 parches de la misma concentración. Nunca se deben colocar más de 2 parches sea cual sea la concentración.
Al suspender el parche de buprenorfina, existe escasa información sobre la dosis de inicio de otros opioides. La experiencia es limitada en tratamientos de más de 2 meses de duración. No existen estudios comparativos entre la buprenorfina transdérmica y otros opioides de segundo y tercer escalón. Existe poca evidencia que nos permita afirmar que la buprenorfina transdérmica sea una alternativa frente a lo ya existente5.
OPIOIDES MAYORES
La morfina, la oxicodona, el fentanilo y la metadona son igual de eficaces para el control del dolor6. La selección de uno u otro depende de la vía de administración, el coste del fármaco y los efectos secundarios.
La morfina es el opioide mayor de elección en el dolor moderado e intenso en pacientes oncológicos, aunque no existen estudios concluyentes7.
Todos los fármacos de este grupo no tienen techo analgésico, por lo que si no se consigue control del dolor se debe aumentar la dosis. La dosis apropiada es la cantidad de opioide que controla el dolor con mínimos efectos secundarios. Si se presenta tolerancia analgésica, se puede superar aumentando la dosis o cambiando el fármaco por otro opioide. La rotación o el cambio de opiáceos es una alternativa terapéutica para mejorar la relación entre la eficacia analgésica y la aparición de efectos secundarios de tratamiento opiáceo.
Morfina
Se trata de un opioide natural extraído de la planta Papaver somniferum. Es el prototipo de analgésico opioide por su buena eficacia analgésica, unida a su gran hidrosolubilidad, que le permite ser usada por vía parenteral, y su buena biodisponibilidd (15-60%), por la que puede ser administrada por vía oral. Se metaboliza en el hígado y se elimina el 10% por vía renal.
Se metaboliza por glucoronoconjugación 3 o 6 dando lugar a dos metabolitos:
1. Morfina 6 glucorónico (M6G): es un metabolito con gran afinidad por el receptor mu y con gran potencia analgésica. Se ha relacionado con sus efectos secundarios clásicos. Su excreción renal depende del aclaramiento de creatinina, por lo que en caso de insuficiencia renal sus concentraciones aumentan y pueden aumentar la toxicidad.
2. Morfina 3 glucorónico (M3G): es un metabolito sin efecto analgésico pero que se ha relacionado con el cuadro de neurotoxicidad por morfina.
La morfina está disponible en forma oral, rectal, subcutánea, intravenosa y espinal. La vía oral es la más recomendable para su administración. La vía alternativa en caso de pérdida de vía oral es la subcutánea, que resulta tan eficaz como la intravenosa para el control del dolor. No existe indicación para la administración intramuscular8.
El efecto comienza a los 10-15 minutos de la administración intravenosa, a los 15 minutos de la dosis subcutánea, a los de 20-30 minutos en presentaciones orales de liberación rápida y a las 4 horas en las presentaciones de liberación sostenida.
La duración del efecto es de 4 horas para formulaciones parenterales y orales de liberación rápida y de 8-12 horas para las formulaciones de liberación sostenida. Además, existe una nueva presentación oral de liberación sostenida de 24 horas de duración.
Para calcular la dosis inicial que necesita un paciente se administra 0,05 mg/kg cada 4 horas si no ha existido tratamiento previo con opiáceos y si son ancianos, o 0,1 mg/kg cada 4 horas si ha existido tratamiento previo. Se permitirán rescates en caso de dolor irruptivo, incluso de un comprimido cada hora. Se calcula así la dosis diaria total (DDT). Si el paciente necesita tres o más rescates al día se aumenta un 50% la DDT. Cuando se controla el dolor se pasa la DDT a dosis de morfina de liberación controlada cada 12 o 24 horas.
La dosis de rescate, cuando el dolor está controlado, es del 10-15% o 1/6 parte de la DDT9. Es importante destacar que aunque el paciente tenga un buen control del dolor, siempre tiene que tener acceso a una dosis de rescate para controlar el dolor irruptivo.
Formas de presentación
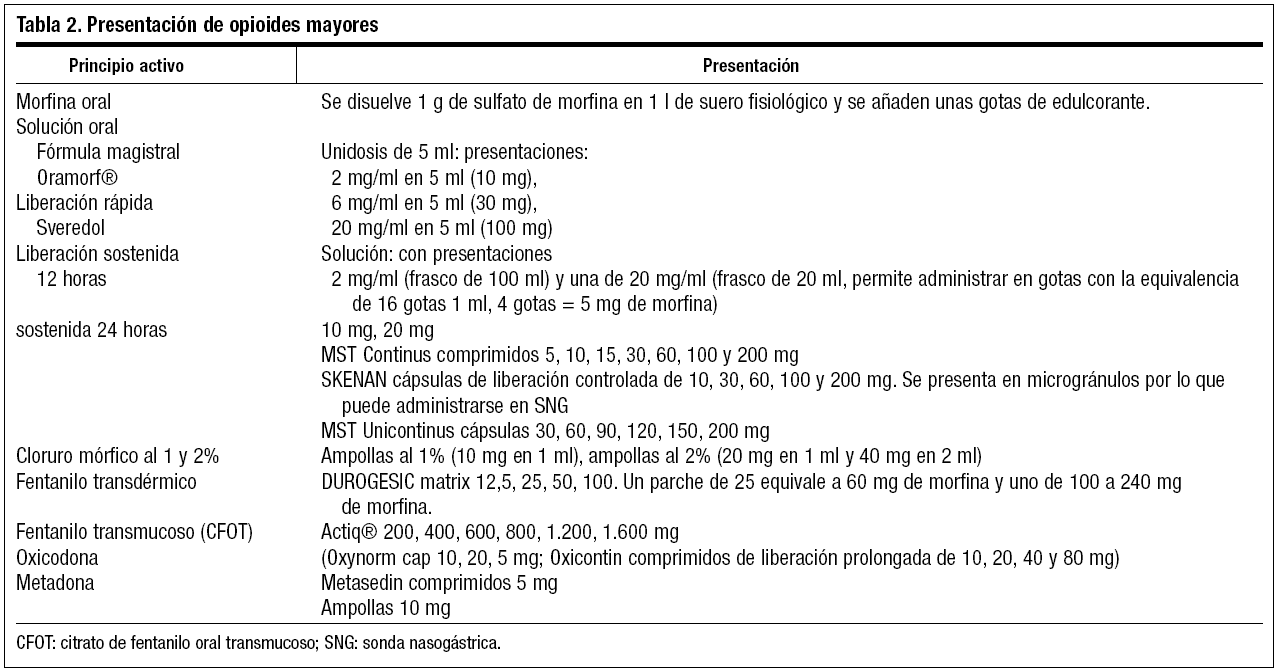
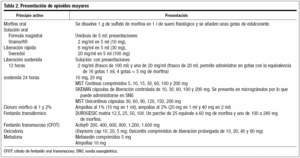
Las principales formas de presentación de la morfina son (tabla 2):
1. Solución acuosa de morfina:
a) Fórmula magistral que puede ser preparada por el farmacéutico: se disuelve 1 g de sulfato de morfina en 1 l de suero fisiológico y se añaden unas gotas de edulcorante. De esta forma, cada ml de esta solución contiene 1 mg de morfina y se comienza por 10 mg cada 4 horas.
b) Se ha comercializado la solución oral de morfina (Oramorf®), que permite ajustar mejor las dosis para el dolor irruptivo, sobre todo si estamos en rangos extremos: dosis muy bajas o muy elevadas, y permite prescindir de fórmulas magistrales.
2. Sulfato de morfina de liberación intermedia: sveredol 10 mg y 20 mg, comprimidos recubiertos. Los comprimidos se pueden machacar o fraccionar.
La dosis de sveredol total es de la mitad de mg de la dosis total de cloruro mórfico. Se usa al inicio del tratamiento para calcular la dosis que necesita el paciente. También puede usarse para conseguir la supresión de un episodio aislado de dolor agudo en un paciente en tratamiento con morfina de liberación controlada (dosis de rescate). El principal inconveniente del uso de la morfina de liberación rápida es el tiempo transcurrido desde la ingesta hasta el inicio de la acción (20-30 minutos), con un pico máximo de actuación a los 40-60 minutos. Por lo tanto, cuando se alcanzan valores máximos en el plasma, el dolor ya ha desaparecido en un porcentaje alto de los pacientes.
3. Sulfato de morfina de liberación controlada (MST, SKENAN®). Su efecto analgésico comienza a las 4 horas, es máximo a las 6 horas y dura 12 horas. No se puede machacar ni fraccionar porque pierde su condición de liberación retardada. En los últimos años ha aparecido la morfina de liberación cada 24 horas (UNICONTINUS®), y no existen diferencias en cuanto a la duración de su efecto y su potencia analgésica relativa con respecto a la morfina de liberación cada 12 horas.
4. Cloruro mórfico al 1 y al 2%. Se puede administrar vía subcutánea o intravenosa. La dosis administrada por vía oral es la mitad de la que se debe administrar por vía subcutánea, la tercera parte de la administrada por vía intravenosa y una décima parte de la administrada por vía espinal. Para la administración subcutánea se calcula la mitad de la DDT vía oral y se reparte cada 4 horas. Para su administración intravenosa se calcula un tercio de la DDT. Se pautan rescates de 1/6 parte de la DDT calculada.
Efectos adversos
Los efectos secundarios10 (tabla 3) de los opioides son poco frecuentes. La toxicidad de los opioides está relacionada con el fenómeno de tolerancia y con la acumulación de sus metabolitos tóxicos. Se denomina tolerancia a la disminución de la respuesta a un fármaco debido a su uso continuado. La toxicidad de los opioides se produce por la acumulación de sus metabolitos sin poder analgésico pero con un importante efecto neurotóxico. Se ha relacionado al metabolito M3G con la neurotoxicidad inducida por opioides (NIO). También se puede producir toxicidad por la propia acción neurotóxica de los opioides a dosis altas.
Los efectos secundarios se dividen en efectos dependientes de la dosis de morfina e independientes de ésta (tabla 3).
1. Depresión respiratoria. Es el efecto secundario más grave que se corrige con la administración de naloxona. Sin embargo, este efecto secundario es muy poco frecuente.
2. Náuseas y vómitos. Aproximadamente entre uno y dos tercios de los pacientes que toman opioides padecen náuseas y vómitos11. Ésta es una complicación común de la exposición temprana a opioides y normalmente desaparece durante la primera semana de tratamiento. Existen dos mecanismos principales que provocan este efecto secundario de los opioides. El mecanismo predominante parece ser la estimulación de la zona impulsora de quimiorreceptores del SNC, donde la dopamina es el neurotransmisor principal. Por ello, la cobertura antiemética adecuada con haloperidol 15-20 gotas en dosis nocturna durante los primeros días de toma de opioides suele ser eficaz en la eliminación de este efecto secundario. Otro mecanismo es la reducción de la motilidad gastrointestinal, que incluye la evacuación gástrica retardada, por lo que, si persisten los vómitos, podemos asociar metoclopramida o domperidona.
3. Somnolencia. Aparece tolerancia en 2-3 días. Si aparece, se debe disminuir la dosis en un 10-20%, pero si al disminuir la dosis aumenta el dolor, se debe rotar el opiáceo o asociar metilfenidato-rubifén de 5 a 10 mg en desayuno y comida.
4. Estreñimiento. Es una causa frecuente de náusea crónica y se observa entre el 40 y el 70% de los pacientes que toman opioides. Es posible la aparición de casos de estreñimiento grave provocado por opioides. En casos extremos se puede presentar como un íleo y una pseudoclusión intestinal grave. El estreñimiento nunca presenta tolerancia, por lo que siempre se debe prescribir un laxante solo o asociado (tipo osmótico, parafina, estimulante del peristaltismo). No se debe prescribir fibra. Si a los 2-3 días no se produce deposición, se utilizarán microenemas o enemas. Por colostomía se pueden poner enemas, nunca supositorios.
5. Boca seca. Se debe proceder a la hidratación de la mucosa bucal.
6. Sudoración. Se debe disminuir la dosis diaria total del opioide. Si no cede o persiste el dolor al disminuir la dosis se asociará dexamentasona 2-4 mg/día o tioridazina 10 gotas por la noche.
7. NIO: es un síndrome que da lugar a alteración cognitiva, confusión, delirio y alucinaciones, mioclonias, convulsiones e hiperalgesia secundaria al efecto neurotóxico de los opioides sobre el sistema nervioso12 (tabla 4). Los mecanismos implicados en la NIO no resultan claros, pero los metabolitos de los opioides están implicados en ellos. El más estudiado ha sido el M3G. El empleo precoz de analgésicos opioides y su uso a dosis crecientes a lo largo de la enfermedad ha hecho aumentar la frecuencia de NIO en los últimos años.
Son factores de riesgo para desarrollar NIO la edad avanzada, las dosis elevadas de opioides, los tratamientos prolongados, la alteración cognitiva o el delirium previo, la deshidratación, la insuficiencia renal, el dolor neuropático incidental, las interacciones medicamentosas (psicofármacos, antiinflamatorios no esteroideos), el estrés psicológico importante, la somatización y el abuso de sustancias.
No existe ninguna prueba diagnóstica, por lo que se recomienda monitorizar estos síntomas de manera sistemática en todos los pacientes en tratamiento con opioides. Si no monitorizamos sistemáticamente estos síntomas y pensamos en la posible NIO, al atender un paciente con alodinia o con hiperalgesia subiremos la DDT del opioide, con lo que agravaremos la NIO.
El tratamiento de la NIO siempre será hidratar por vía oral o vía parenteral si ésta no está disponible. Si el dolor está controlado se disminuirá la dosis del opioide un 20-50% de la DDT y si persiste el dolor se asociará un adyuvante o se rotará el opioide.
Fentanilo
Se trata de un opiáceo agonista de los receptores mu con una potencia analgésica 80 veces mayor que la morfina. Las características lipofílicas del fentanilo hacen que se acumule en tejido graso y de allí se libere de forma continua desde el parche al tejido subcutáneo, y de ahí al torrente sanguíneo. Por otro lado, al atravesar muy bien las membranas permite su administración transoral y transdérmica.
Su baja afinidad por el receptor hace que su efecto dure poco tiempo.
Fentanilo transdérmico
Sólo está indicado si el dolor es muy estable, la intensidad apenas cambia a lo largo del día, ni entre el reposo y la actividad, y si hay riesgo de incumplimiento terapéutico. Está contraindicado en pacientes con dolor progresivo o inestable13.
Se aplica sobre piel intacta por encima de la cintura a primera hora del día y se cambia a los 3 días. Los niveles plasmáticos se consiguen a las 2-3 horas y sus efectos analgésicos se inician a las 8 horas. Se forma un depósito intradérmico de manera que después de retirar el parche los niveles plasmáticos tardan unas 16 horas en descender al 50 por ciento. Por lo tanto, al iniciar el tratamiento se debe pautar morfina de liberación normal las primeras 8 horas desde que se pone el parche y tener en cuenta la existencia de analgesia las 12-16 horas siguientes tras la retirada del mismo.
Siempre se deben prescribir dosis de rescate para tratar los episodios de dolor irruptivo con morfina de liberación normal o con citrato de fentanilo oral transmucoso (CFOT). Errores muy frecuentes son no dejar dosis de rescate, dejarla con un fármaco que no sea un opioide potente o dejar una dosis insuficiente para aliviar el dolor irruptivo.
Entre los efectos adversos del fentanilo transdérmico en estos pacientes, con frecuencia aparece fiebre tumoral que hace aumentar la absorción del fentanilo, apareciendo cuadros de NIO. Si aparece fiebre hay que bajarla rápidamente y/o retirar el parche, ya que se aumenta la absorción del fentanilo por vaso de dilatación periférica. Siempre se deben evitar fuentes de calor sobre el parche ya que la sudoración excesiva produce una pobre adhesión de éste. Existe evidencia de que el fentanilo transdérmico produce menor estreñimiento que la morfina14. En ocasiones, un cambio de morfina oral a fentanilo puede mejorar una situación de estreñimiento pertinaz que no responde a laxantes.
Es una buena alternativa en caso de insuficiencia renal.
Citrato de fentanilo oral transmucoso
El CFOT es efectivo para el dolor irruptivo en pacientes estabilizados con morfina oral o con un opioide alternativo del tercer escalón15,16.
El paciente debe estar con una DDT basal de morfina mínina de 60 mg o con fentanilo 50 mg/h durante al menos 1 semana. Produce un rápido alivio de la analgesia a los 5-15 minutos, con una corta duración de acción de 2 horas debido a la baja afinidad por el receptor opioide del fentanilo.
Tras su administración, un 25% se absorbe rápidamente a través de la mucosa oral y el 75% restante es deglutido y de éste otro 25% se absorbe en el tracto digestivo; por tanto, la biodisponibilidad es del 50%. Una absorción a través de la mucosa oral evita el primer paso hepático y consigue un rápido inicio de la analgesia en 5-15 minutos; tiene una duración del efecto analgésico de 2 horas.
La dosis de inicio y la forma de administración se pueden ver en la tabla 5.
Sus efectos secundarios son similares a los de otros opioides. Produce somnolencia en el 28% de los casos, vértigo en el 14%, náuseas en el 10% y cefalea en el 5%.
A pesar de su elevada eficacia, presenta los inconvenientes de la necesidad de titulación y de una correcta aplicación, con las dificultades que eso implica en los pacientes oncológicos en situación terminal.
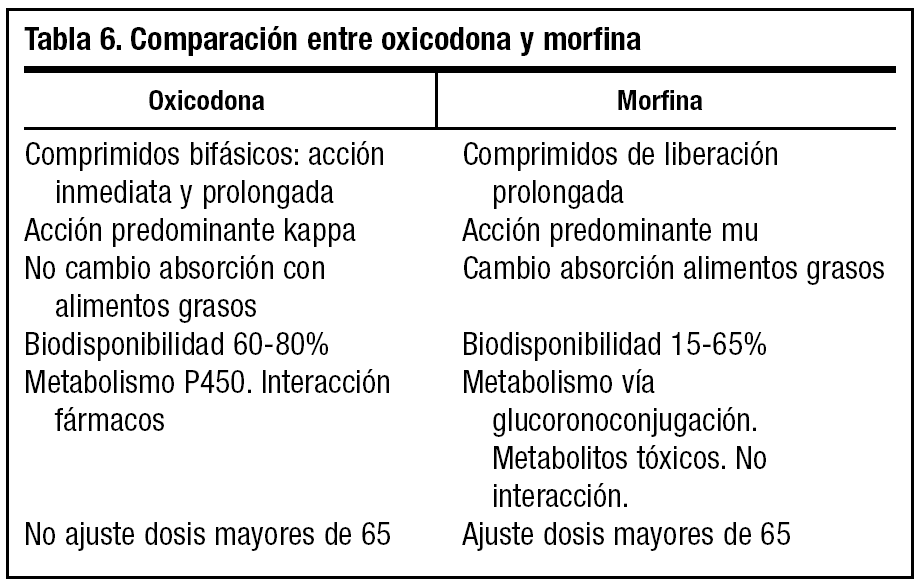
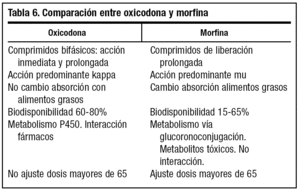
Oxicodona (tabla 6)
Es un opioide semisintético derivado de la tebacaína clasificado como agonista puro con afinidad para los receptores mu y kappa.
No existe ninguna ventaja clínica de la oxicodona sobre otros opioides potentes que justifique su mayor coste, por lo que no debe de ser utilizado como tratamiento de primera línea. Puede utilizarse como fármaco para tratamiento del dolor intenso no controlado con morfina o en caso de intolerancia a ésta17.
La oxicodona es más lipofílica que la morfina y por vía oral tiene un menor metabolismo hepático, por lo que su biodisponibilidad es mayor (60-87%). La biodisponibilidad no se ve afectada con la ingesta de alimentos o con la edad (ancianos) y por tanto sus concentraciones plasmáticas presentan menor variedad que las de la morfina. Se metaboliza en el hígado por el sistema enzimático del citocromo P450 2D6, por lo que este sistema puede interaccionar con inhibidores (sertralina, fluoxetina, ciclosporina y rifampicina). Hay que disminuir la dosis en insuficiencia hepática.
Su eliminación se realiza por vía renal. La eliminación del fármaco se reduce muy poco en personas mayores, por lo que no es necesario reducir la dosis. Por esta razón se puede utilizar en insuficiencia renal moderada.
Se comercializa en comprimidos de liberación combinada: la fórmula galénica permite en un mismo comprimido una liberación rápida (que da lugar a un inicio del efecto a los 15-45 minutos) y una segunda liberación lenta y sostenida que hace que el efecto se mantenga al menos 12 horas (dosis cada 12 horas).
Permite una titulación más rápida de la dosis, en 24 horas, para el control del dolor.
Presenta menor incidencia de alucinaciones, náuseas y prurito que la morfina18.
La dosis de inicio es:
1. En pacientes con dolor severo no controlado con opioides débiles (400 mg de tramadol) la dosis inicial es de 20 mg cada 12 horas.
2. En paciente virgen de opioides o en anciano debilitado, la dosis de inicio es de 10 mg/12 horas.
3. En pacientes con insuficiencia renal y/o hepática evolucionada se ajusta la dosis de la mitad o a un tercio. En caso de tratamiento con morfina habrá que dividir por dos la dosis diaria.
Diez miligramos de oxicodona de liberación retardada cada 12 horas equivalen a 20 mg de morfina de liberación sostenida. La dosis se aumenta cada 24-48 horas en un 30-40% para el control del dolor.
Los efectos adversos son los típicos de los opioides: somnolencia en el 37% de los casos, náuseas en el 32%, vómitos en el 8%, mareo en el 12%, cefalea en el 7%, prurito en el 5% y ortostatismo en el 5%19.
Metadona
Es un opioide clasificado como agonista puro de los receptores mu. Además de interactuar con este receptor, posee una afinidad por el receptor opioide delta que inhibe la recaptación de noradrenalina y serotonina. Además, es capaz de unirse a receptores de N-metil-D aspartano del transmisor excitador del glutamato. Este hecho puede explicar que la metadona sea eficaz en dolores que no respondan a otros opioides y en los casos en que exista tolerancia a la morfina.
Se usa como alternativa a dolores intensos que no han respondido a otros opiáceos o en situaciones de toxicidad por opiáceos20.
Se absorbe por vía oral con una biodisponibilidad del 85%. La semivida de eliminación es de 15 a 20 horas, pero con una administración continuada la semivida varía mucho de un individuo a otro, entre 13 y 100 horas. Su concentración en sangre aumenta lentamente, por lo que pueden aparecer efectos adversos con retraso y, si se administran nuevas dosis a intervalos fijos y cortos, pueden originar una alta acumulación de metadona. Se metaboliza en el hígado sin originar metabolitos activos. Se elimina por vía renal. Tiene un uso complejo por prolongada vida media y por su cinética imprevisible con una variabilidad interindividual (hasta en un mismo individuo existe variabilidad si se administra de forma prolongada).
Se recomienda al iniciar el tratamiento con metadona que sea la evolución de cada paciente la que marque la dosis y el ritmo de administración.
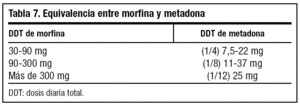
La dosis equianalgésica de morfina y metadona aparece en la tabla 7. La dosis de metadona oral es la mitad de la dosis subcutánea. En caso de sobredosificación habrá que disminuir un tercio la dosis y repartirla cada 12 horas.
¿CUANDO UTILIZAR OPIOIDES EN EL TRATAMIENTO DEL DOLOR ONCOLOGICO?21
En 1982, la OMS propuso un programa mundial con el objetivo de mejorar el tratamiento del dolor oncológico. Un grupo multidisciplinar de expertos internacionales presentó una guía clínica preliminar en 1984 y la versión final fue publicada en 198621. La escalera analgésica de la OMS permite elegir el fármaco más adecuado para el tratamiento del dolor oncológico, ver la respuesta al tratamiento y homogeneizar los criterios de tratamiento cuando el paciente es atendido por los distintos profesionales sanitarios en Atención Primaria, Atención Especializada o Urgencias, permitiendo así la utilización de opioides con criterios más objetivos.
Esta escalera define una secuencia de tratamiento en relación con la intensidad del dolor y la eficacia de los analgésicos. Progresa desde los analgésicos no opioides hasta los opioides débiles y luego hasta los opioides potentes. La terapia paliativa oncológica y los fármacos coadyuvantes, así como otros tratamientos sintomáticos, podían ser integrados en cualquiera de los escalones. La utilización de un nuevo escalón terapéutico obedece a la ineficacia de los fármacos del escalón previo para el control completo del dolor.
La situación actual del tratamiento del dolor, los avances en el conocimiento de su fisiopatología, su evaluación continuada y la aparición de nuevos fármacos y nueva tecnología hacen que el seguimiento de la escalera analgésica de la OMS se convierta en una barrera y en un retraso para el adecuado tratamiento de muchos cuadros dolorosos, ya que obliga al paciente a recorrer unos escalones farmacológicos hasta llegar a encontrar el fármaco más adecuado para su dolor.
Para paliar las controversias respecto a la aplicación de la escalera analgésica de la OMS, en el año 2002 la Sociedad Española del Dolor propuso sustituir el concepto escalera por el de "ascensor analgésico": se utilizará el fármaco necesario según la intensidad del dolor, sin necesidad de escalonar el tratamiento. Es decir, ante un dolor severo, el tratamiento se realizará directamente con fármacos opioides mayores, sin necesidad de pasar por los escalones inferiores22.
En la minoría de pacientes que obtienen una analgesia inadecuada o sufren efectos secundarios intolerables pese al uso óptimo de opioides sistémicos, se pasa al cuarto escalón de la escalera analgésica de la OMS: se llama así a la administración de fármacos de tercer escalón por otras vías. Si la supervivencia esperada es mayor de tres meses, se recomienda la administración espinal de analgésicos, si es menor de tres meses se administra la morfina vía subcutánea23.
ROTACIÓN DE OPIOIDES
En pacientes en tratamiento con opioides potentes en los que se ha realizado una correcta valoración del dolor y un adecuado ajuste farmacológico, si no se consigue un adecuado control del dolor o sufren efectos intolerables antes de conseguir un alivio adecuado del dolor, se recomienda sustituir el opioide de tercer escalón por otro alternativo o utilizar otra vía de administración, como la subcutánea. Es una alternativa para mejorar la relación entre eficacia analgésica y la aparición de efectos secundarios24.
En la rotación de opioides se debería utilizar una dosis equianalgésica. Sin embargo, debido a un fenómeno de tolerancia cruzada incompleta, la dosis del nuevo opioide deber reducirse entre un 25 y un 50% como fórmula para garantizar la inocuidad. La selección de un opioide alternativo es empírica. Existen pocas pruebas clínicas que indiquen que un opioide tenga superioridad terapéutica sobre otro. Por ejemplo, si un paciente requiere cambiar de morfina a otro opioide, éste puede cambiarse por hidromorfona, oxicodona, fentanilo o metadona25.
La pautas para realizar una rotación de opioide serían las que figuran en la tabla 8.
Correspondencia: S. Duce Tello.
C/ Toledo, 126, 2.o H. 28005 Madrid.
Correo electrónico: susanaduce@hotmail.com
Recibido el 15-02-07; aceptado para su publicación el 18-09-07.