En el paciente con diabetes tipo 2, el control estricto de la glucemia previene o retrasa la aparición de complicaciones microvasculares. Por el contrario, sigue siendo debatido el efecto sobre las complicaciones macrovasculares y cuál es el papel del control glucémico precoz sobre la enfermedad cardiovascular subsiguiente. Aunque grandes ensayos clínicos aleatorizados no han mostrado un efecto claramente benefcioso del control intensivo a corto plazo, estudios posteriores de seguimiento de los participantes en estos ensayos sugieren un efecto cardiovascular favorable a largo plazo.
Desde hace unos años, a raíz de las dudas sobre el aumento del riesgo de infarto de miocardio provocado por la rosiglitazona, las agencias reguladoras solicitan que, previa aprobación de una nueva molécula para el tratamiento de la hiperglucemia, el patrocinador demuestre que es segura desde el punto de vista cardiovascular.
Los ensayos de seguridad cardiovascular publicados hasta el momento han evidenciado que los nuevos fármacos no incrementan el riesgo e, incluso, que algunas moléculas pueden proporcionar cierta protección cardiovascular.
Ante estos hallazgos, ¿qué es prioritario al elegir el tratamiento hipoglucemiante: el control metabólico o la reducción del riesgo cardiovascular?
La palabra individualización ofrece la respuesta. No se puede situar el foco terapéutico únicamente en la seguridad cardiovascular dejando al margen las complicaciones micro-vasculares, causa de elevada morbimortalidad.
Las personas con diabetes poco evolucionada y larga expectativa de vida se benefciarán de un control metabólico estricto. Los pacientes con diabetes y enfermedad cardiovascular establecida o elevado riesgo serán candidatos a un tratamiento que incluya fármacos que han demostrado un benefcio en este perfl de pacientes.
In patients with type 2 diabetes, tight glycemic control prevents or delays the develop-ment of microvascular complications. In contrast, there is continued debate on the effect of macrovascular complications and the role of early glycaemic control on the ensuing cardiovascular disease. Although large randomised clinical trials have not shown a clearly beneficial effect of intensive control in the short term, subsequent follow-up studies of participants in these trials suggest a favourable cardiovascular effect in the long term. Due to doubts about the increased risk of myocardial infarction with rosiglitazone, for the last few years regulatory agencies have required sponsors to demonstrate the cardiovascular safety of new drugs before they can be approved for the treatment of hyperglycae-mia.
The cardiovascular safety trials published to date have shown that the new drugs do not increase cardiovascular risk and that some molecules may even provide some cardiovascular protection.
These findings raise the following question: what is the priority when selecting lipid-low-ering drugs – metabolic control or reduced cardiovascular risk?
The answer lies in the word individualisation. Treatment cannot focus solely on cardiovascular safety, without considering microvascular complications, which cause high morbidity and mortality.
Patients with recent onset diabetes and long life expectancy will benefit from tight meta-bolic control. Patients with diabetes and established cardiovascular disease or at high risk are candidates for treatment that includes drugs with a demonstrated benefit in this pa-tient group.
La diabetes mellitus tipo 2 (DM2) es una enfermedad multi-factorial y compleja que afecta a diversos órganos. En su patogenia están implicadas diferentes vías1,2 que, en su mayoría, contribuyen a la disfunción de la célula b-pancreática sin que exista ningún fármaco antidiabético que actúe sobre todas ellas ni modifique la historia natural de la enfermedad.
La importancia de esta patología radica, por una parte, en el alto riesgo cardiovascular (RCV) que confiere y, por otra, en las complicaciones microangiopáticas, que ocasionan una elevada morbimortalidad y afectan muy negativamente a la calidad de vida del paciente3,4.
El control glucémico intensivo ha demostrado reducir las complicaciones microvasculares5,7, mientras que el efecto que ejerce sobre la reducción del RCV es moderado y no parece disminuir la mortalidad8-11.
En los últimos años se han publicado varios estudios12-14 que han evidenciado cómo algunos fármacos para el tratamiento de la DM2 producen efectos cardiovasculares favorables más allá de la acción hipoglucemiante. Ante estos resultados cabe preguntarse si al seleccionar el fármaco más apropiado para tratar la hiperglucemia es más prioritario el control metabólico o la reducción del riesgo vascular. Incluso algunos autores han polemizado sobre los pros y contras de que estos nuevos fármacos, que actúan sobre varios mecanismos fisiopatológicos de la enfermedad y presentan un perfil cardiovascular más favorable que la metformina, puedan desplazar a esta de la primera línea de tratamiento15,16.
Control metabólico y prevención de complicacionesLos pacientes con DM2 tienen un riesgo incrementado de experimentar enfermedad cardiovascular (ECV), tanto por la hiperglucemia como por otros factores de riesgo asociados, siendo la causa principal de mortalidad en esta pobla-ción17.
Recientemente se han publicado los resultados de 3 ensayos clínicos (EMPA-REG OUTCOME12, CANVAS13 y LEADER14) diseñados para valorar la seguridad cardiovascular de empa-gliflozina, canagliflozina y liraglutida, respectivamente, que han puesto de manifiesto una reducción significativa de la variable combinada muerte cardiovascular, infarto de miocardio no fatal o ictus no fatal en los pacientes tratados con estas moléculas; en el caso de empagliflozina y liraglu-tida también se redujo la mortalidad cardiovascular.
La diferencia en las cifras de glucemia entre los grupos de cada ensayo fue mínima, no pudiendo atribuirse los resultados al efecto hipoglucemiante. Además, los beneficios cardiovasculares del buen control glucémico, aunque modestos, no se manifiestan hasta pasados varios años, como se verá más adelante.
Por otra parte, la diabetes ocasiona múltiples complicaciones específicas que condicionan la calidad de vida: reti-nopatía, enfermedad renal, neuropatía autonómica, úlceras y amputaciones relacionadas con la neuropatía periférica.
La retinopatía diabética es la primera causa de ceguera en el mundo occidental; además la diabetes también se asocia con el desarrollo de edema macular, neuropatía óptica, glaucoma y cataratas18.
La enfermedad renal diabética, considerada un factor de riesgo para ECV, aún hoy es la principal causa de enfermedad renal terminal3, mientras que la neuropatía diabética es el factor etiopatogénico más importante del pie diabético que, a su vez, constituye la causa más frecuente de amputación no traumática de extremidades inferiores4.
Todas estas complicaciones, que incluso pueden manifestarse antes que la diabetes19, están directamente relacionadas con la magnitud y duración de la hiperglucemia: existe una correlación continua entre control glucémico y complicaciones microangiopáticas sin que se haya encontrado un umbral de hemoglobina glucosilada (HbA1c) por encima del cual no se produzcan beneficios al reducir su valor20-23. Diversas revisiones sistemáticas que han comparado el control glucé-mico intensivo frente al convencional, han demostrado una reducción estadísticamente significativa del riesgo de complicaciones microvasculares con el control más estricto5-7.
Por otra parte, la diabetes acentúa la gravedad de todas las fases de aterosclerosis24, lo que confiere a quien la padece un elevado riesgo de ECV y mortalidad, así como una reducción de varios años en la expectativa de vida, dependiendo del momento del diagnóstico17.
Tanto las fluctuaciones de glucemia como la hipergluce-mia mantenida originan una glucación de las proteínas mito-condriales, desencadenando una respuesta inflamatoria que aumenta la sobrecarga del retículo sarcoplasmático y la producción de anión superóxido. Estas alteraciones son mecanismos conocidos en la patogenia de la disfunción endote-lial, paso inicial del proceso de aterogénesis que conducirá a una ECV en fases más avanzadas de la vida25.
Si se retrasa la exposición a la hiperglucemia de forma temprana se pueden retrasar las complicaciones vasculares de la diabetes, pero llega un momento, tras años de exposición a valores elevados de glucemia, que el control metabó-lico per se ya no impide que las proteínas mitocondriales glucosadas sigan produciendo superóxido26. Por lo tanto, el beneficio del control glucémico intensivo solo ocurriría si se inicia precozmente.
Contrariamente a lo que ocurre en las complicaciones mi-croangiopáticas, los resultados de los ensayos clínicos que han abordado la eficacia del control intensivo para reducir complicaciones cardiovasculares son contradictorios. Mientras que en sujetos con diabetes de pocos años de evolución, el control más estricto ha logrado un beneficio cardiovascular a largo plazo, cuando la diabetes es de larga evolución o el daño cardiovascular está establecido, no se ha podido demostrar un efecto beneficioso de la terapia intensiva.
En el estudio UKPDS21 se evidenció una reducción del riesgo de infarto de miocardio en pacientes con DM2 de reciente diagnóstico, aunque la diferencia no fue estadísticamente significativa. Posteriormente, tras 10 años más de seguimiento, los individuos originalmente aleatorizados al tratamiento intensivo presentaron una incidencia significativamente inferior de infarto de miocardio (reducción del riesgo relativo [RRR]: 15%; p = 0,0014) y de mortalidad por todas las causas (RRR: 13%; p = 0,007)20.
Años más tarde, a lo largo de la década de 2000, se plantearon 3 estudios de intervención (ACCORD, ADVANCE y VADT)27-29, con el fin de determinar si el control glucémico intensivo reducía las complicaciones cardiovasculares en personas con DM2.
En el estudio ACCORD27, la estrategia fue muy agresiva, con un objetivo para el grupo de control intensivo de una HbA1c < 6% (42 mmol/mol). No hubo diferencias en los desenlaces primarios (infarto de miocardio, ictus o mortalidad por ECV), pero la mortalidad por todas las causas fue mayor en el brazo de terapia intensiva, por lo que se tuvo que suspender prematuramente el estudio. Aún están por explicar las causas del exceso de mortalidad, que inicialmente se han atribuido al mayor número de hipoglucemias en el grupo de control intensivo.
En el estudio ADVANCE28, el control glucémico intensivo, HbA1c < 6,5 (48 mmol/ml), no confirió mayor protección frente a complicaciones macrovasculares que la terapia estándar. La tasa de hipoglucemias también fue más elevada en el grupo de control intensivo.
Tampoco en el estudio VADT29 hubo beneficio cardiovascular significativo con el control intensivo frente al control estándar: ni reducción de la tasa de episodios cardiovasculares mayores ni la mortalidad cardiovascular. Pero tras un seguimiento posterior de 10 años, se observó que en los individuos inicialmente aleatorizados al grupo de control estricto se redujo de forma significativa el riesgo de sufrir un episodio cardiovascular mayor, concretamente en un 17%. También disminuyó la mortalidad un 12% con la terapia intensiva, pero, en este caso, sin significación estadística30.
Aunque en ninguno de estos estudios se demostró mejoría de las complicaciones macrovasculares, un metaanálisis de los 3 ensayos31 revela que, por cada punto porcentual de reducción en la HbA1c, disminuye un 15% el riesgo relativo de infarto de miocardio no letal, sin beneficio alguno sobre ictus ni sobre mortalidad total. La ausencia de efecto del control glucémico sobre la mortalidad es achacable, en buena parte, a los resultados negativos del estudio ACCORD.
La comparación de estos trabajos con el UKPDS se ve obstaculizada por la inclusión de poblaciones con características diferentes, los pacientes incluidos tenían ECV establecida o un RCV muy alto y, además, la diabetes era más evolucionada (8-11 años) que en el UKPDS. De hecho, los análisis de subgrupos de estos ensayos apuntan a que es posible que los sujetos con menor duración de la diabetes o sin ECV se hayan beneficiado significativamente del control glucémico más intensivo32.
Otro estudio destacado en relación con el control meta-bólico y el riesgo de ECV fue el PROactive33, en el que se evaluó el efecto de la pioglitazona sobre episodios cardiovasculares y mortalidad en pacientes con DM2 y alto RCV, y se evidenció una reducción significativa de episodios con una diferencia de HbA1c de aproximadamente 0,5% entre ambos grupos. Sin embargo, la pioglitazona mejoró otros factores de riesgo además de la glucemia; un análisis a pos-teriori sugiere que el cHDL (colesterol unido a lipoproteínas de alta densidad) podría haber sido un mediador de los efectos cardiovasculares más potente que la HbA1c34.
Riesgo cardiovascular: intervención multifactorialEs conocido que el RCV en las personas con diabetes se ve agravado por la alta prevalencia de otros factores de RCV (FRCV)35. El grupo de trabajo para el estudio UKPDS investigó el impacto de los diferentes factores sobre el riesgo coronario (UKPDS 23)36 y objetivó que el cLDL (colesterol unido a lipoproteínas de baja densidad) era el predictor más decisivo, ya que un incremento de 39 mg/dl aumentaba un 57% el riesgo coronario, el consumo de tabaco un 41%, una elevación de 10 mmHg en la presión arterial sistólica lo incrementa un 15% y el aumento de un punto porcentual en la HbA1c un 11%.
En consonancia con estos hallazgos, la evidencia científica apoya el abordaje intensivo y simultáneo de todos los FRCV para disminuir las complicaciones microangiopáticas y macroangiopáticas. En el STENO-237, en pacientes con DM2 y microalbuminuria sometidos a un tratamiento estricto para todos los FRCV, se consiguió reducir el riesgo absoluto de episodios cardiovasculares en un 20%, aunque no se pudo determinar la contribución relativa de cada factor. Tras aplicar el modelo de cálculo de riesgo del estudio UKPDS, se objetivó que el efecto hipolipemiante era responsable de más del 70% de la reducción del riesgo de episodios cardiovasculares observada38.
El esquema del tratamiento multifactorial del STENO-2 se reprodujo en una población más numerosa, donde también se puso de manifiesto que el control intensivo de glucemia, presión arterial y lípidos redujo el riesgo de ECV39.
Seguridad cardiovascular y fármacos hipoglucemiantesEn la última década, a raíz de la publicación de un polémico metaanálisis que indicaba que el tratamiento con rosiglita-zona aumentaba el riesgo de infarto de miocardio40, uno de los aspectos que mayor relevancia ha tomado es conocer si el tratamiento antidiabético afecta a la tasa de episodios cardiovasculares.
Por esta razón, desde entonces, diversas agencias reguladoras, entre ellas la Food and Drug Administration (FDA), exigen que el patrocinador demuestre que cualquier nueva molécula para el tratamiento de la diabetes no incrementa de forma inaceptable el RCV, y establecen una serie de requisitos necesarios antes de la comercialización41 (tabla 1).
Requisitos de la Food and Drug Administration (FDA) para aprobar un fármaco antihiperglucemiante41
|
ECV: enfermedad cardiovascular; IAM: infarto agudo de miocardio; IC: intervalo de confanza; RCV: riesgo cardiovascular; RR: riesgo relativo.
A partir de ese momento se publicaron varios estudios de seguridad cardiovascular de diferentes clases de antidiabé-ticos12-14,33,42-45: inhibidores de la dipeptidil peptidasa 4 (iDPP4), agonistas del receptor del péptido similar al gluca-gón tipo 1 (arGLP1) e inhibidores del cotransportador sodio-glucosa tipo 2 (ISGLT2). El estudio PROactive33, en el que se valoró el efecto de la pioglitazona, aunque fue publicado con anterioridad a la nueva normativa, cumplía todos los requisitos que posteriormente exigió la FDA.
Estos ensayos están diseñados para tratar de evidenciar que no hay diferencias en el número de episodios cardiovasculares entre las personas tratadas con el nuevo fármaco y con placebo, ambos añadidos a la medicación de base del paciente, y siendo uno de los criterios de inclusión la presencia de ECV establecida o un elevado RCV. Para evitar resultados equívocos, todos ellos han de fijar como objetivo glucémico el aceptado por la comunidad científica.
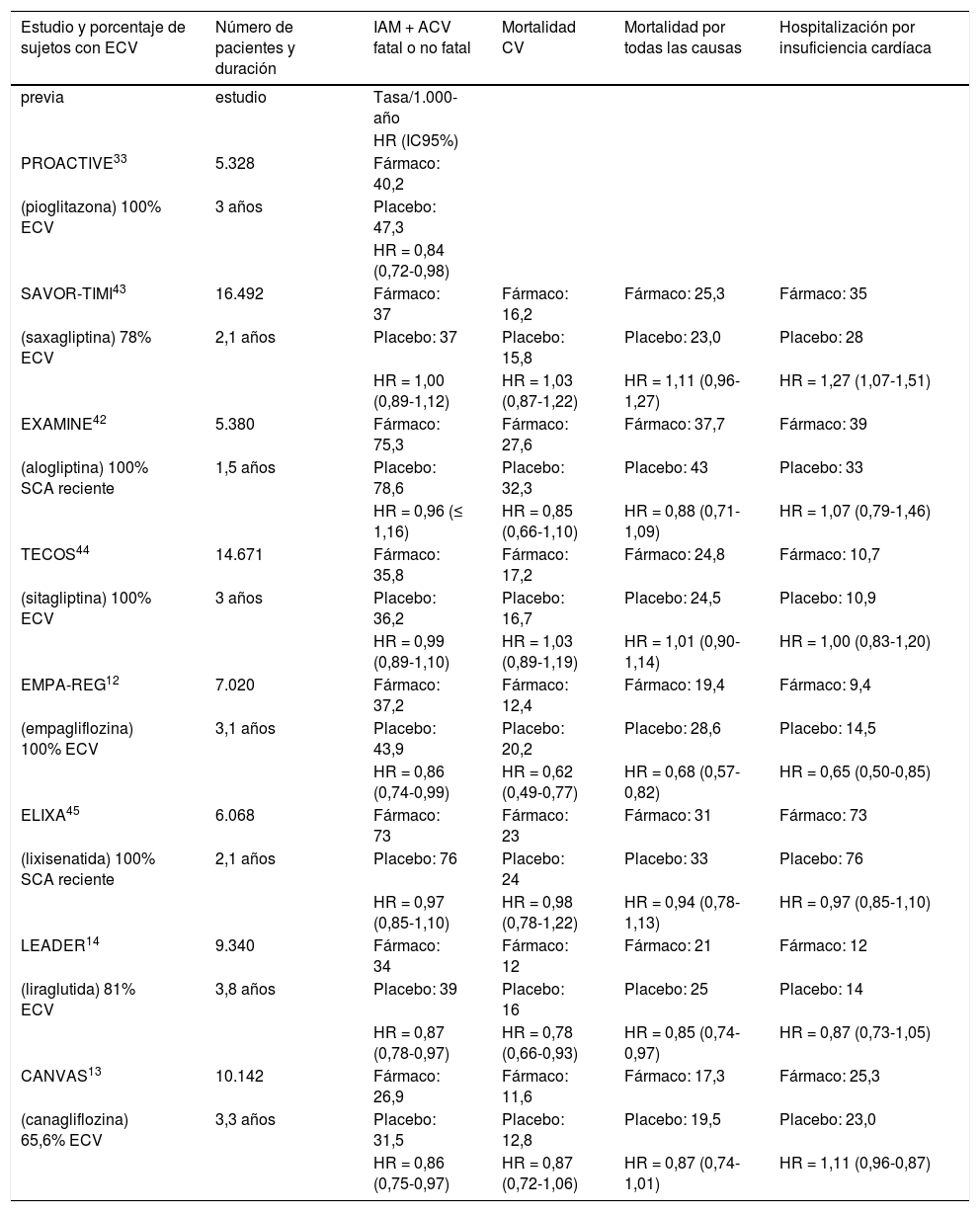
En los estudios finalizados hasta el momento, el tratamiento con los respectivos antidiabéticos no incrementó la muerte cardiovascular en comparación con placebo (tabla 2). Para saxagliptina43, sitagliptina44, lixisenatida45 y aloglip-tina42, los resultados no difirieron entre los grupos y se confirmó la no inferioridad del grupo tratado frente a placebo en las variables de seguridad cardiovascular y en las condiciones particulares de cada ensayo.
Resultados de ensayos clínicos de seguridad cardiovascular de fármacos hipoglucemiantes no insulínicos
| Estudio y porcentaje de sujetos con ECV | Número de pacientes y duración | IAM + ACV fatal o no fatal | Mortalidad CV | Mortalidad por todas las causas | Hospitalización por insuficiencia cardíaca |
|---|---|---|---|---|---|
| previa | estudio | Tasa/1.000-año | |||
| HR (IC95%) | |||||
| PROACTIVE33 | 5.328 | Fármaco: 40,2 | |||
| (pioglitazona) 100% ECV | 3 años | Placebo: 47,3 | |||
| HR = 0,84 (0,72-0,98) | |||||
| SAVOR-TIMI43 | 16.492 | Fármaco: 37 | Fármaco: 16,2 | Fármaco: 25,3 | Fármaco: 35 |
| (saxagliptina) 78% ECV | 2,1 años | Placebo: 37 | Placebo: 15,8 | Placebo: 23,0 | Placebo: 28 |
| HR = 1,00 (0,89-1,12) | HR = 1,03 (0,87-1,22) | HR = 1,11 (0,96-1,27) | HR = 1,27 (1,07-1,51) | ||
| EXAMINE42 | 5.380 | Fármaco: 75,3 | Fármaco: 27,6 | Fármaco: 37,7 | Fármaco: 39 |
| (alogliptina) 100% SCA reciente | 1,5 años | Placebo: 78,6 | Placebo: 32,3 | Placebo: 43 | Placebo: 33 |
| HR = 0,96 (≤ 1,16) | HR = 0,85 (0,66-1,10) | HR = 0,88 (0,71-1,09) | HR = 1,07 (0,79-1,46) | ||
| TECOS44 | 14.671 | Fármaco: 35,8 | Fármaco: 17,2 | Fármaco: 24,8 | Fármaco: 10,7 |
| (sitagliptina) 100% ECV | 3 años | Placebo: 36,2 | Placebo: 16,7 | Placebo: 24,5 | Placebo: 10,9 |
| HR = 0,99 (0,89-1,10) | HR = 1,03 (0,89-1,19) | HR = 1,01 (0,90-1,14) | HR = 1,00 (0,83-1,20) | ||
| EMPA-REG12 | 7.020 | Fármaco: 37,2 | Fármaco: 12,4 | Fármaco: 19,4 | Fármaco: 9,4 |
| (empagliflozina) 100% ECV | 3,1 años | Placebo: 43,9 | Placebo: 20,2 | Placebo: 28,6 | Placebo: 14,5 |
| HR = 0,86 (0,74-0,99) | HR = 0,62 (0,49-0,77) | HR = 0,68 (0,57-0,82) | HR = 0,65 (0,50-0,85) | ||
| ELIXA45 | 6.068 | Fármaco: 73 | Fármaco: 23 | Fármaco: 31 | Fármaco: 73 |
| (lixisenatida) 100% SCA reciente | 2,1 años | Placebo: 76 | Placebo: 24 | Placebo: 33 | Placebo: 76 |
| HR = 0,97 (0,85-1,10) | HR = 0,98 (0,78-1,22) | HR = 0,94 (0,78-1,13) | HR = 0,97 (0,85-1,10) | ||
| LEADER14 | 9.340 | Fármaco: 34 | Fármaco: 12 | Fármaco: 21 | Fármaco: 12 |
| (liraglutida) 81% ECV | 3,8 años | Placebo: 39 | Placebo: 16 | Placebo: 25 | Placebo: 14 |
| HR = 0,87 (0,78-0,97) | HR = 0,78 (0,66-0,93) | HR = 0,85 (0,74-0,97) | HR = 0,87 (0,73-1,05) | ||
| CANVAS13 | 10.142 | Fármaco: 26,9 | Fármaco: 11,6 | Fármaco: 17,3 | Fármaco: 25,3 |
| (canagliflozina) 65,6% ECV | 3,3 años | Placebo: 31,5 | Placebo: 12,8 | Placebo: 19,5 | Placebo: 23,0 |
| HR = 0,86 (0,75-0,97) | HR = 0,87 (0,72-1,06) | HR = 0,87 (0,74-1,01) | HR = 1,11 (0,96-0,87) |
ACV: accidente cerebrovascular; CV: cardiovascular; ECV: enfermedad cardiovascular; IAM: infarto agudo de miocardio; SCA: síndrome coronario agudo; HR: hazard ratio; IC: intervalo de confanza.
Para empagliflozina12 y liraglutida14 se demostró la no inferioridad y también la superioridad respecto a placebo, mostrando una reducción de la mortalidad cardiovascular. Los pacientes tratados con canagliflozina13 tuvieron menor riesgo de sufrir un episodio cardiovascular que los tratados con placebo, pero no hubo reducción en la mortalidad.
La hospitalización por insuficiencia cardíaca fue una variable secundaria estudiada. La sitagliptina44, la lixisenati-da45 y la liraglutida14 no mostraron diferencias frente a placebo a este respecto, ni aumentan ni disminuyen la hospitalización por esta causa. Sin embargo, en el estudio SAVOR-TIMI43, la saxagliptina aumentó la tasa de ingresos por insuficiencia cardíaca (hazard ratio [HR]: 1,27), lo mismo que la alogliptina en el estudio EXAMINE42 (HR: 1,07), mientras que en el EMPA-REG12 y en el CANVAS13, la hospitalización por insuficiencia cardíaca es menor en el grupo que recibe tratamiento con empagliflozina y canagliflozina frente al grupo control (tabla 2).
La comparación entre los distintos estudios de seguridad cardiovascular está limitada por la disparidad en la duración, las diferencias en el diseño (rango de edad) y por las características basales de los pacientes (con distinto grado de gravedad de la ECV previa).
En resumen, los resultados publicados indican que los nuevos fármacos son seguros desde el punto de vista cardiovascular; en unos casos, no aumentan el riesgo, y en otros existen efectos cardiovasculares favorables más allá de la acción hipoglucemiante.
¿Qué es prioritario, el control metabólico o la reducción del riesgo vascular?Ante la hipótesis de que los diferentes antihiperglucemian-tes puedan tener efectos variados sobre el perfil de RCV, independientemente de la magnitud del control glucémico, volvemos a la cuestión inicial: ¿qué es prioritario, el control metabólico o la reducción del riesgo vascular?
Una vez más, la palabra individualización ofrece la respuesta.
Las complicaciones crónicas se desarrollan durante un período prolongado. Por tanto, las personas con diabetes de menos de 10 años de evolución, una larga esperanza de vida y sin complicaciones van a beneficiarse de un control meta-bólico estricto. No existe duda del beneficio que representa en este caso mantener una cifra de glucemia lo más próxima posible a la normalidad, siempre que se pueda conseguir sin hipoglucemias y, actualmente, se dispone de un amplio arsenal terapéutico que permite alcanzar un control metabó-lico óptimo sin riesgo de hipoglucemias y sin otros efectos secundarios graves.
En los sujetos con DM2 y ECV establecida, la terapia anti-hiperglucemiante debe incorporar fármacos que hayan demostrado reducir episodios cardiovasculares mayores y mortalidad por este motivo, siempre después de la metfor-mina y las modificaciones del estilo de vida, y tras valorar las circunstancias específicas del medicamento y del pa-ciente46.
Extender los hallazgos de los estudios de seguridad cardiovascular al paciente de prevención primaria es prematuro, al no existir evidencia de los efectos cardiovasculares beneficiosos en estas personas. En el estudio LEADER, el análisis de subgrupos sugiere que los beneficios cardiovasculares se manifestarían únicamente en los sujetos con ECV establecida al inicio del estudio.
Las personas con diabetes de larga evolución, edad avanzada, frágiles o con complicaciones graves, ni se van a beneficiar de un control intensivo, ni parece razonable que sean sometidas a terapias con efectos secundarios que repercutan negativamente en su calidad de vida, y es preferible evitar hipoglucemias, hipotensión e interacciones farmacológicas en pacientes presumiblemente polimedicados46.
En cualquier caso, el carácter evolutivo de la diabetes hace necesario, en casi todos los casos, una terapia combinada para mantener un buen control glucémico a largo plazo. La elección no solo del fármaco, sino también de la estrategia terapéutica más adecuada, es un proceso dinámico que cambia a medida que lo hacen las características del paciente o se van revaluando los objetivos del tratamiento.
ConclusionesEn el momento de seleccionar el fármaco para el tratamiento de la hiperglucemia se debe particularizar, teniendo en cuenta que no se puede situar el foco únicamente en la seguridad cardiovascular dejando al margen las complicaciones microvasculares, que también acarrean morbilidad significativa y mortalidad prematura, sin menoscabo de utilizar, en sujetos con ECV o RCV elevado, fármacos que han demostrado un beneficio cardiovascular en este perfil de pacientes.
No se debe olvidar que la estrategia más eficaz es la intervención terapéutica multifactorial e integral, con objetivos de control para cada factor de riesgo modificable.
Conflicto de interesesM. Alonso Fernández ha asistido a cursos y congresos, y/o ha colaborado impartiendo formación para Almirall, Astra, Boehringer Ingelheim, Esteve, Janssen, Lilly, Menarini y Mundifarma.