El cáncer de mama es una enfermedad prevalente con implicaciones en todas las esferas de la vida de las pacientes, por lo que el médico de familia debe conocer en profundidad esta dolencia, para optimizar la atención con los mejores recursos disponibles.
Los 5 artículos que se presentan a continuación ofrecen un resumen elaborado a partir de una revisión detallada de la literatura sobre el cáncer de mama publicada en los últimos 10 años. El primero de ellos trata sobre la epidemiología, los factores de riesgo y los factores protectores de esta enfermedad.
Esta revisión pretende ofrecer una visión global, actualizada y práctica sobre esta enfermedad que permita resolver los interrogantes que se presentan en la consulta de Atención Primaria, facilitar respuestas a las mujeres que lo soliciten y, en definitiva, permanecer al lado de las pacientes a lo largo de su enfermedad con la tranquilidad del conocimiento.
Breast cancer is a prevalent disease affecting all areas of the patients’ lives. Therefore, family physicians should have a thorough knowledge of this disease in order to optimize the health care services for these patients, and making the best use of available resources.
A series of 5 articles on breast cancer is presented below. It is based on a review of the scientific literature over the last 10 years. The first article reviews the epidemiology, risk factors, and protective factors in this disease
This summary report aims to provide a current and practical review on breast cancer, providing answers to family doctors and helping them to support the patients for their benefit throughout their illness.
Desde las consultas del médico de Atención Primaria existe la percepción de que el cáncer de mama está aumentando y que se diagnostica a edades más jóvenes. ¿Es esto una realidad o una falsa sensación?
Las mujeres afectadas por esta enfermedad se convierten, a veces de la noche a la mañana, en pacientes habituales de la consulta por diferentes motivos: informar al médico de familia de las novedades que se van produciendo, petición de recetas, consultas sobre efectos secundarios de los diferentes fármacos o quimioterapia, recogida de partes de incapacidad temporal, cuestiones sobre prótesis o elementos estéticos adaptados a su nueva situación, afectación anímica, relación de pareja y familiar, situación laboral, etc. ¿Estamos adecuadamente formados los médicos de Atención Primaria en esta enfermedad como para poder prestar una atención eficiente?
El papel del médico de familia es crucial en el manejo de la mayoría de las enfermedades. El consejo profesional en Atención Primaria favorece la participación en programas de cribado poblacionales1. Según datos de una encuesta del Servicio de Salud de la Comunidad de Madrid, las mujeres con cáncer de mama y sus familiares desearían contar, para la toma de decisiones respecto a su enfermedad, con profesionales de confianza y con la participación más activa del médico de familia2.
Gran parte de los artículos consultados indican que la combinación de los programas de detección precoz y los avances en el tratamiento de esta enfermedad han conseguido un aumento sustancial de la supervivencia en las últimas décadas (supervivencia general a 5 años del diagnóstico del 88%, y del 77% a 10 años), aunque el papel del cribado poblacional sigue generando polémica3,4. Además, existen mujeres que, por sus características (especialmente antecedentes familiares), pertenecen a grupos de riesgo elevado para padecer cáncer de mama, y en ellas debería realizarse un abordaje diferente, siendo el primer nivel asistencial el más adecuado para la captación activa de estas mujeres por su mayor accesibilidad a la población.
En los últimos años se han desarrollado diversas herramientas informáticas que podrían servir de ayuda para la toma de decisiones a profesionales y pacientes en diferentes aspectos de la enfermedad. En nuestro país se investiga sobre la validación de estos instrumentos adaptados al entorno local2,5,6.
Muchas veces el médico del primer nivel asistencial se siente desbordado por falta de conocimientos y recursos ante una enfermedad prevalente, grave y especialmente compleja, tanto por los cambios continuos que afectan al pronóstico y el tratamiento como por la necesidad de proporcionar asesoramiento adecuado en aspectos psicosociales.
Este artículo pretende ofrecer una visión global, actualizada y práctica sobre el cáncer de mama que permita resolver los interrogantes que se presentan en la consulta de Atención Primaria. Dadas la complejidad y la amplitud del tema tratado, se ha dividido en varios apartados que abordarán diferentes aspectos de la enfermedad, con una visión siempre adaptada al primer nivel asistencial.
El primer apartado recoge las evidencias sobre epidemiología, factores de riesgo, factores protectores y aspectos genéticos del cáncer de mama. Una segunda parte tratará sobre el cribado poblacional, la conducta a seguir al respecto en situaciones de riesgo aumentado y el consejo genético en este tumor. El tercer artículo recordará el contexto clínico, el estudio de extensión, la afectación ganglionar, la clasificación, la estadificación y los factores pronósticos de la enfermedad. En un cuarto apartado se revisarán el tratamiento, el papel del médico de Atención Primaria al respecto y el manejo de algunas de las principales complicaciones, como el linfedema o los efectos adversos de la quimioterapia y la radioterapia. Por último, se abordarán los aspectos sociales, psicológicos, laborales y familiares relacionados con la enfermedad, así como algunas situaciones especiales de cáncer de mama, entre ellas, el cáncer de mama en el varón, en el embarazo y en edades extremas de la vida.
Para la elaboración de estos artículos se ha revisado la literatura científica de los últimos 10 años, consultando las bases de datos: PubMed, IME, Cochrane, MEDES, IBECS y las plataformas: BMJ, Science Direct, OVID, así como la información ofrecida por las principales sociedades científicas e institutos nacionales e internacionales de estadística sobre el cáncer, usando como descriptores las palabras clave y eligiendo fundamentalmente artículos de revisión, guías clínicas y bases de datos sobre incidencia, prevalencia y mortalidad.
Epidemiología del cáncer de mamaA nivel mundial, el cáncer de mama es el más común en mujeres y representa el 23% de los nuevos diagnósticos de cáncer. Su tasa duplica la del cáncer colorrectal y triplica la del cáncer de pulmón. El cáncer de mama fue el responsable, en el año 2008, del 14% de todas las muertes por cáncer7. También es la localización más frecuente de tumores en mujeres españolas y europeas8.
La incidencia de cáncer de mama varía considerablemente en todo el mundo, siendo mayor en los países desarrollados. Las tasas anuales de incidencia estandarizada por edad por cada 100.000 mujeres según datos de GLOBOCAN 20029 variaban entre 18 en el este de Asia y 99 en América del Norte, pasando por 46 en América del Sur, 62 en el sur de Europa y 84 en Europa occidental. Datos de 2006 para países europeos superaban los 120 casos por 100.000 mujeres-año en Bélgica, Irlanda, Holanda, Francia, Suecia, Dinamarca, Reino Unido y Alemania, situándose entre 100 y 120 en Finlandia, Hungría, Luxemburgo, Italia y Portugal. Nuestro país, junto con Malta, Chipre, Eslovenia, República Checa, Austria y Grecia, mostraba cifras intermedias de incidencia (entre 80 y 100 casos por 100.000 mujeres-año), pero superiores a las de Rumania, Bulgaria, Polonia y otros países del este de Europa10. En Estados Unidos la incidencia en 2009 fue de 127 casos por 100.000 mujeres11.
Las diferencias observadas entre los diferentes países evidencian que los estilos de vida y los factores ambientales podrían tener un papel relevante en la aparición y evolución de esta enfermedad. De hecho, algunos estudios indican que en sujetos pertenecientes a poblaciones de baja prevalencia que emigraron a países de alta prevalencia, se incrementó el riesgo de padecer este tumor en una sola generación, siendo un 60% superior al de sus poblaciones de origen12.
En Estados Unidos, la incidencia se incrementó entre los años 70 y 90, sin embargo, en los últimos 10 años ha disminuido, al igual que en Australia, Francia y Reino Unido. Una de las razones estimadas para este descenso ha sido la disminución de los tratamientos hormonales sustitutivos indiscriminados, administrados durante periodos prolongados en la menopausia13,14. Desde 1990 se observa también una reducción de la mortalidad en este país (2,2% cada año) en relación con la mejora de los tratamientos y el diagnóstico precoz10.
Se estima que una de cada 8 mujeres estadounidenses padecerá cáncer de mama, y una de cada 28 tendrá riesgo de morir por esta enfermedad11.
En España, a nivel poblacional, en el año 2004, y sin contar con el cáncer de piel no melanoma, el cáncer más frecuente fue el colorrectal, con 25.600 casos de cáncer al año. Lo seguía en frecuencia el cáncer de pulmón, con 18.800 cánceres/año, y el tercero en incidencia era el cáncer de mama, con 15.979 casos nuevos por año.
Según datos de GLOBOCAN 2002 (http://www.dep-iarc.fr) y las cifras extrapoladas por el INE para 2015, en las mujeres españolas el tumor con mayor incidencia será el cáncer de mama, con 21.262 casos estimados. Esta misma fuente indicaba que en España, los 2 tumores que mantenían más casos prevalentes eran el de mama y el colorrectal. Asimismo, se ha observado una incidencia creciente de este tumor en nuestro país hasta hace una década. A partir del año 2000, la incidencia de cáncer de mama en España parece haberse estabilizado, e incluso descendido ligeramente en algunos grupos de edad, aunque se mantiene al alza en mujeres menores de 45 años15.
El estudio EUROCARE 4 (http://www.eurocare.it/), que muestra datos de supervivencia en países de Europa en personas con cáncer a los 5 años, diagnosticadas entre 1995-1999 y seguidas hasta el final de 2003, indicaba que, respecto al cáncer de mama, la supervivencia para dicho periodo fue del 79,4% en Europa y del 80,3% en España, con un incremento del 6% de supervivencia en la década 1990-2000.
Datos del año 2007, aportados por el Centro Nacional de Epidemiología, perteneciente al Instituto Carlos III, indicaban que el tumor que causaba mayor mortalidad en la mujer era el de mama seguido por el colorrectal, en gran parte debido a que son tumores prevalentes.
Según el Instituto Nacional de Estadística (www.ine.es), en 2010 las enfermedades tumorales fueron en España la segunda causa de muerte después de las del sistema circulatorio. Los tumores que más muertes generaron fueron los de pulmón, seguidos de los de colon. En el caso de los hombres, el de pulmón era el que más muertes causaba, mientras que en mujeres, el de mama era el principal. A pesar de ello, la tasa de mortalidad española por cáncer en 2010 fue una de las más bajas de la Unión Europea, en especial la del cáncer de mama, con una de las cifras más bajas de todos los Estados miembros.
Los factores que más parecen influir en la mortalidad por cáncer de mama entre distintos países son: la propia incidencia del tumor y la eficiencia de los sistemas sanitarios de cada estado, que incluyen programas de cribado poblacionales y tratamientos más adecuados para esta enfermedad. Los factores genéticos y otros aspectos relacionados con el tipo de tumor pueden variar en las distintas etnias y/o estar influidos por condicionantes ambientales.
Factores de riesgo y factores protectores en el cáncer de mamaTodas las mujeres deberían considerarse «de riesgo» para padecer cáncer de mama, ya que el sexo es el factor de riesgo principal y solo el 1% de los tumores de mama aparecen en varones.
EdadEl cáncer de mama está fuertemente relacionado con la edad, y solo el 5% de estos tumores ocurren en mujeres menores de 40 años. Sin embargo, estudios recientes tanto nacionales como internacionales alertan sobre el descenso de la edad en el diagnóstico de cáncer de mama, la mayor dificultad diagnóstica a estas edades por la menor sensibilidad de la mamografía en mamas jóvenes, más densas, y la mayor proporción de cáncer avanzado a estas edades16,17.
La frecuencia acumulada de cáncer de mama entre las mujeres europeas y norteamericanas es del 2,7% a los 55 años, del 5% a los 65 y del 7,7% a los 75.
Como curiosidad, en países como México existen casos de cáncer de mama documentados desde la segunda década de la vida y la incidencia máxima se da entre los 40 y los 54 años (una década antes que en las mujeres norteamericanas y europeas), con un descenso paulatino a partir de la quinta década.
Factores racialesLas mujeres afroamericanas de EE. UU. son más propensas a morir de cáncer de mama a pesar de que las mujeres blancas tienen más probabilidades de ser diagnosticadas de esta enfermedad. Incluso después del diagnóstico, las mujeres negras son menos propensas a recibir tratamiento en comparación con las mujeres blancas. La causa podría ser la falta de acceso a la detección, la menor disponibilidad de técnicas más avanzadas médicas y quirúrgicas, o alguna característica biológica de la enfermedad en esta población, aunque lo más probable es que las diferencias en la mortalidad se deban a motivos socioeconómicos.
Entre los años 2004 y 2008, la incidencia de cáncer de mama en EE. UU. fue mayor en mujeres blancas no hispánicas (125 casos por 100.000 mujeres) que en mujeres de origen asiático (85 casos por 100.000 mujeres), y la incidencia se mantuvo estable durante dicho periodo para estos subgrupos étnicos18. El peso de un posible factor racial en estos casos es controvertido, y tal vez se deba a factores ambientales.
La mutación del gen BRCA2, que incrementa el riesgo de padecer este tumor, se observa más frecuentemente en la población judía de origen Askenazi.
Antecedentes familiares o personales de cáncerExiste un riesgo aumentado de cáncer de mama en mujeres con antecedentes familiares de este tumor, especialmente si se desarrolló en la premenopausia, si fue bilateral o sucedió en familiares de primer grado de parentesco, con un incremento mayor del riesgo a mayor número de familiares afectados19.
A este respecto hay que dejar bien claras las diferencias entre cáncer familiar y cáncer hereditario. En el primer caso, existen varios miembros de la misma familia afectados por la enfermedad, sin que exista transmisión autosómica dominante. Ya en el año 1995, Hoskins et al. establecieron una primera clasificación del cáncer de mama familiar20.
El cáncer de mama hereditario se produce como resultado de una transmisión autosómica dominante, afectando a múltiples generaciones.
La mutación del gen BRCA1, localizado en el brazo largo del cromosoma 17, y la del gen BRCA2, situado en el brazo largo del cromosoma 13, incrementan considerablemente el riesgo de padecer esta enfermedad.
Otros genes cuyas mutaciones han sido relacionadas con tumores mamarios y que se observan en algunos síndromes hereditarios son el P53 (síndrome de Li-Fraumeni), el gen PTEN (síndrome de Cowden), el gen STK11 (síndrome de Peutz-Jeghers) y el ATM21.
Los antecedentes personales de cáncer de ovario o endometrio elevan el riesgo de padecer cáncer de mama, y las mujeres que han padecido cáncer de mama tienen un riesgo aumentado de padecer cáncer en la mama contralateral.
De todos los cánceres de mama, un 75% son esporádicos, un 20-25% se consideran de agregación familiar no asociado a mutaciones (posible polimorfismo de bajo riesgo, predisposición genética más débil, resultado de la interacción de múltiples genes de baja penetrancia [CHEK2, ATM, BRIP1, PALB2], junto con el efecto de factores ambientales) y solo un 5-10% de los casos se encuentran asociados a alteraciones genéticas (mutaciones de los genes BRCA1 y BRCA2, genes de alta penetrancia que se transmiten mediante un patrón de herencia autosómica dominante).
Hallazgos histológicosLa hiperplasia mamaria incrementa el riesgo de padecer este tumor, sobre todo si es atípica (incremento de hasta 4 veces la enfermedad). Dicha hiperplasia está presente en un 10% de las mujeres con mastopatía fibroquística, papilomas o adenosis esclerosante. El carcinoma lobulillar in situ también aumenta el riesgo de esta enfermedad19.
El haber padecido un cáncer de mama contralateral aumenta el riesgo de cáncer de la otra mama un 1% anual, y si el tumor fue del tipo lobulillar infiltrante, el riesgo se incrementa hasta un 1,5% anual.
Densidad radiológica de las mamasEn las mujeres con mamas radiodensas se observa un aumento del riesgo respecto a aquellas con mamas radiolúcidas, a lo que se suma la mayor dificultad diagnóstica en estas pacientes22–25.
Factores ambientales, dietéticos y antropométricosDiferentes factores podrían ser la causa de que el cáncer de mama sea más prevalente entre poblaciones urbanas y altamente industrializadas respecto a las rurales.
Estudios observacionales parecen indicar que el consumo de alcohol a partir de 10g al día podrían incrementan el riesgo de cáncer de mama, ascendiendo un 7% el riesgo relativo por cada 10g de ingesta al día, independientemente del tipo de alcohol consumido26.
Ningún otro factor dietético ha podido ser demostrado en el momento actual. La posible asociación entre las grasas saturadas de la dieta y el cáncer de mama permanece controvertida.
En relación con la antropometría, se observa una incidencia mayor de cáncer de mama en mujeres más altas y con un índice de masa corporal superior a 30Kg/m2; esta última asociación solo se ha establecido para mujeres posmenopáusicas, tal vez por los mayores niveles circulantes de estrógenos procedentes del tejido adiposo27. Otros estudios, sin embargo, indican que el sobrepeso y la obesidad podrían actuar como factores protectores en esta enfermedad.
La realización de ejercicio físico regular podría ser un factor protector. Existen estudios que indican que el ejercicio físico regular en pacientes diagnosticadas de cáncer de mama actúa como factor protector frente a las recidivas28.
Radiaciones ionizantesLa mama es un órgano muy sensible a la radiación. Las fuentes de radiación más frecuentes son la radioterapia y las diferentes pruebas radiológicas de rastreo que precisan ciertas enfermedades. Se ha apreciado un aumento del riesgo en mujeres sometidas a dosis altas de radiación, por encima de 100rad.
Se estima que el 1% de los tumores de mama pueden ser atribuidos a la radiación. Estos tumores son más frecuentes si la exposición tuvo lugar a edades más jóvenes. Actualmente, las técnicas mamográficas utilizadas en los programas de cribado y diagnóstico producen bajas dosis de radiación.
La exposición a campos electromagnéticos podría tener un papel en esta enfermedad, aunque no hay pruebas actuales que lo ratifiquen.
Factores geográficosEl cáncer de mama es más frecuente en Norteamérica y Europa occidental, y más bajo en Asia, África y América Latina, es decir, más alta en países desarrollados, a excepción de Japón, país donde la incidencia es baja, pese a que en los últimos años también se está incrementando.
Factores hormonales y reproductivosHaber tenido la menarquia antes de los 12 años, la menopausia después de los 55, el primer embarazo más allá de los 30 años y ser nulípara incrementan el riesgo de padecer esta enfermedad. Por el contrario, la lactancia y la multiparidad son factores protectores19,29,30.
Respecto a la paridad, parece que el riesgo de presentar tumores de mama se incrementa en el periodo inmediatamente posterior al nacimiento, aunque a largo plazo el efecto es protector. Cada embarazo a término disminuye un 25% el riesgo, y las mujeres que han tenido 5 partos a término presentan la mitad del riesgo de cáncer de mama que las mujeres nulíparas. El riesgo de padecer cáncer de mama también va ligado a la edad del primer embarazo a término. Para mujeres con gestación a término antes de los 18 años el riesgo es solo de un tercio, en comparación con las mujeres que tuvieron su primer embarazo después de los 30 años de edad.
Con respecto a la lactancia materna, parece actuar como factor protector de esta enfermedad, sobre todo en lactancias prolongadas19,30. Algunos estudios muestran que las mujeres que han amamantado a sus hijos 25 meses o más, en total, tienen un 33% menos de riesgo de desarrollar esta enfermedad.
El papel de los anticonceptivos hormonales como factor de riesgo de cáncer de mama permanece controvertido31–33. Un metaanálisis reciente que evalúa el peso de los diferentes factores de riesgo en mujeres de 40 a 49 años evidencia un posible incremento del riesgo de 1-1,5%19. Parece que el riesgo podría ser mayor si se administran en etapas finales de la vida reproductiva, cuando la mujer es más susceptible al desarrollo de esta enfermedad.
Con respecto a la terapia hormonal sustitutiva, que fue utilizada y recomendada ampliamente hace 2 décadas, se han restringido sus indicaciones en la actualidad, por incrementar el riesgo de tumores mamarios34,35 (el riesgo relativo es de 1,35 tras 5 o más años de uso). Este efecto se diluye con el tiempo y tras 5 años de su retirada no se observa un riesgo mayor. Diferentes estudios posteriores intentan racionalizar el uso de esta terapia36–38.
Los niveles más elevados de estradiol en la posmenopausia incrementan el riesgo, que también parece aumentar con niveles elevados de prolactina y factor 1 de crecimiento tipo insulínico.
La utilización de dietilestilbestrol durante el embarazo entre los años 40 y 60 incrementó un 30% el riesgo de desarrollar cáncer de mama en las mujeres tratadas.
Respecto a las técnicas de reproducción asistida, uso de sustancias inductoras de la ovulación como clomifeno o gonadotrofinas, no existen suficientes estudios de calidad que permitan establecer conclusiones.
Líneas de investigación en epidemiología del cáncer de mamaActualmente se está llevando a cabo un estudio a largo plazo (al menos 10 años), financiado por el National Institute of Environmental Health Sciences, que intenta dilucidar mejor los factores que contribuyen a la aparición de cáncer de mama39. Este estudio, llamado «Sister Study», cuenta con 50.000 mujeres que tienen hermanas con este tumor (www.sisterstudy.org). De él se pretende obtener información genética, de estilos de vida y factores ambientales que pudieran estar implicados. Una rama de este estudio ha sido diseñada para averiguar las posibles causas de cáncer de mama en edades tempranas de la vida.
En España, el Grupo Español de Investigación en Cáncer de Mama –GEICAM–40, cuya actividad más importante es la realización de ensayos clínicos nacionales e internacionales sobre cáncer de mama, sigue desde 1990 la evolución de mujeres con esta enfermedad de 32 hospitales españoles, aportando datos muy valiosos en diferentes aspectos de la enfermedad, incluyendo los epidemiológicos. La última actualización del grupo está pendiente de publicación en los próximos meses.
Genética del cáncer de mamaEste apartado trata de recordar conceptos de genética que ayuden al lector a comprender determinados aspectos sobre la patogenia de esta enfermedad y algunos de los tratamientos para la misma.
Los protooncogenes son genes incluidos en el genoma humano que regulan el crecimiento y la diferenciación celular. Sus proteínas se expresan en diferentes momentos del ciclo y son imprescindibles para su regulación. Determinados cambios en los protooncogenes los convierten en oncogenes, contribuyendo a la malignización de la estirpe celular. Estos oncogenes originarán proteínas cuya expresión y/o función se verá alterada, manteniéndose activas sin degradarse y favoreciendo el crecimiento de la estirpe celular anómala. En el ser humano se han identificado más de 60 oncogenes.
Los oncogenes solo precisan estar mutados en un alelo para que se produzca la sobreexpresión de una proteína dada y esta ejerza su acción promotora (oncogenes dominantes).
Existe otro tipo de genes, los genes supresores, que cuando están activos ejercen un efecto antiproliferativo en la célula. Se trata de genes normales, que actúan deteniendo la división celular. La mutación de estos genes implica que pierdan esta función y se pueda desarrollar un tumor. En ellos es necesaria la mutación de los 2 alelos para que pierdan su función protectora (si uno de los alelos permaneciera inalterado se podría producir la proteína supresora normal).
Este es el motivo por el que a los primeros se les conoce como oncogenes dominantes, y a los últimos, como oncogenes recesivos.
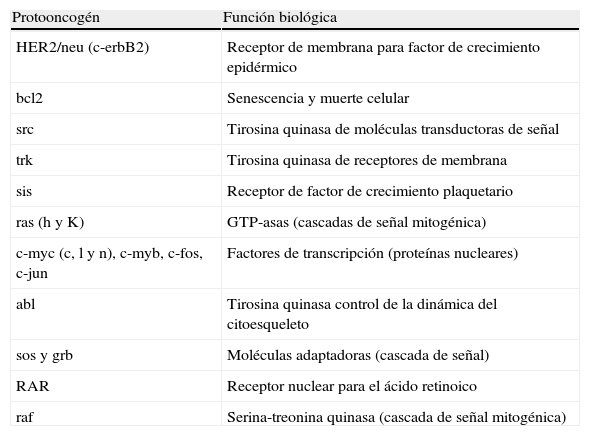
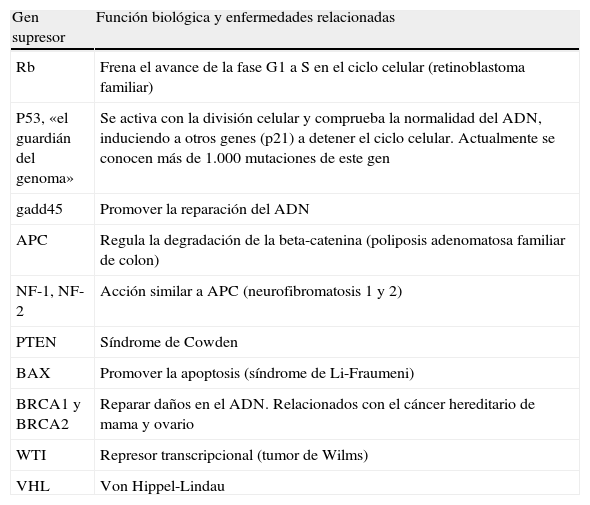
En la tabla 1 se resumen los protooncogenes más importantes y la función que realizan, y en la tabla 2, los genes supresores y algunas de sus características.
Protooncogenes y función biológica que realizan
| Protooncogén | Función biológica |
| HER2/neu (c-erbB2) | Receptor de membrana para factor de crecimiento epidérmico |
| bcl2 | Senescencia y muerte celular |
| src | Tirosina quinasa de moléculas transductoras de señal |
| trk | Tirosina quinasa de receptores de membrana |
| sis | Receptor de factor de crecimiento plaquetario |
| ras (h y K) | GTP-asas (cascadas de señal mitogénica) |
| c-myc (c, l y n), c-myb, c-fos, c-jun | Factores de transcripción (proteínas nucleares) |
| abl | Tirosina quinasa control de la dinámica del citoesqueleto |
| sos y grb | Moléculas adaptadoras (cascada de señal) |
| RAR | Receptor nuclear para el ácido retinoico |
| raf | Serina-treonina quinasa (cascada de señal mitogénica) |
Fuente: modificada de http://www.cancerquest.org/index.cfm?lang=spanish&page=780 [consultado 12 Ago 2013].
Genes supresores más significativos, función biológica que realizan y enfermedades derivadas de su alteración
| Gen supresor | Función biológica y enfermedades relacionadas |
| Rb | Frena el avance de la fase G1 a S en el ciclo celular (retinoblastoma familiar) |
| P53, «el guardián del genoma» | Se activa con la división celular y comprueba la normalidad del ADN, induciendo a otros genes (p21) a detener el ciclo celular. Actualmente se conocen más de 1.000 mutaciones de este gen |
| gadd45 | Promover la reparación del ADN |
| APC | Regula la degradación de la beta-catenina (poliposis adenomatosa familiar de colon) |
| NF-1, NF-2 | Acción similar a APC (neurofibromatosis 1 y 2) |
| PTEN | Síndrome de Cowden |
| BAX | Promover la apoptosis (síndrome de Li-Fraumeni) |
| BRCA1 y BRCA2 | Reparar daños en el ADN. Relacionados con el cáncer hereditario de mama y ovario |
| WTI | Represor transcripcional (tumor de Wilms) |
| VHL | Von Hippel-Lindau |
Fuente: modificada de http://www.cancerquest.org/index.cfm?page=52⟨=spanish [consultado 12 Ago 2013].
El HER2/neu es un protooncogén localizado en el brazo largo del cromosoma 17. Es clave para el crecimiento y la división normal de las células, por lo que su expresión anormal está vinculada a procesos cancerosos. Se ha convertido en un importante marcador y diana de tratamientos oncológicos, especialmente del cáncer de mama.
Codifica para producir una glucoproteína que actúa como receptor para el factor de crecimiento de tipo endodérmico humano. El receptor está compuesto por 3 dominios: uno intracitoplasmático con actividad tirosina quinasa (lugar de actuación de terapias dirigidas, como lapatinib), otro dominio transmembrana, y otro extracelular (lugar de terapias dirigidas como trastuzumab y pertuzumab). Los dominios extracelulares de otros miembros de la familia, como HER1, HER3 y HER4, son también receptores de superficie celular para factores de crecimiento.
La concentración sérica de HER2/neu puede ser un indicador de la amplificación génica y de la activación del receptor.
Se sabe que cada célula tiene 2 copias del gen HER2, pero por razones aún desconocidas, algunas células cancerosas poseen múltiples copias de dicho gen (amplificación genética), lo que se traduce en una sobreexpresión de la proteína HER2/neu.
Desde 1980 se ha descrito que el oncogén HER2/neu y su receptor intervienen en el desarrollo del cáncer de mama y de sus metástasis, estimándose que un 20-30% de los cánceres de mama sobreexpresan esta proteína. Las pacientes con cáncer de mama que presentan amplificación de HER2/neu muestran generalmente una forma más agresiva de cáncer, además de una mayor resistencia a tratamientos convencionales.
En cuanto al papel de los oncogenes en el desarrollo del cáncer, pueden contribuir al mismo de 2 maneras: por un lado, activando los procesos de proliferación celular, y por otro, bloqueando los procesos de senescencia y muerte celular o apoptosis. Estos últimos pueden ser desencadenados por estímulos químicos (diversos fármacos quimioterápicos, entre otros), físicos (radiaciones ionizantes, radiaciones ultravioleta) y biológicos (receptores en la superficie celular, como los factores de necrosis tumoral).
Estudios recientes en cáncer de mama proporcionan pruebas de que el riesgo de cáncer asociado a ciertas alteraciones genéticas comunes puede ser modulado por determinados factores ambientales41.
Los daños provocados por la radiación o el estrés oxidativo en el ADN son detectados en los puntos de control del ciclo celular, que se detiene, y si la reparación no es eficaz, la célula se dirige a la apoptosis. El equilibrio entre factores proapoptóticos y antiapoptóticos es necesario para prevenir activadores erróneos de muerte o proliferación celulares.
Algunos de los genes codificantes para las proteínas que intervienen en la inducción de apoptosis son protooncogenes. Entre ellos, encontramos una de las subunidades del receptor para el factor de necrosis tumoral β, una de las subunidades del receptor para IL-1 y los productos de la familia de genes bcl.
Los avances en el conocimiento genético de tumores mamarios han permitido elaborar nuevas clasificaciones con implicaciones pronósticas y terapéuticas. Asimismo, existen diferentes sistemas que analizan los genes de estos tumores mediante micromatrices y sirven de ayuda para la toma de decisiones en esta enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo está dedicado a todas las mujeres y sus familiares que luchan cada día contra el cáncer de mama, lo harán en un futuro o lo hicieron en el pasado. En especial a vosotras, Coti y Pilar. También a los profesionales y asociaciones que contribuyen con su trabajo y dedicación a la mejora de la salud y calidad de vida de estas pacientes.