El traumatismo craneoencefálico severo (TCES) es una entidad grave. La monitorización de la presión intracraneal (PIC) permite dirigir el tratamiento, el cual es de limitado acceso en países en vías de desarrollo.
ObjetivoDescribir la experiencia clínica de pacientes pediátricos con TCES.
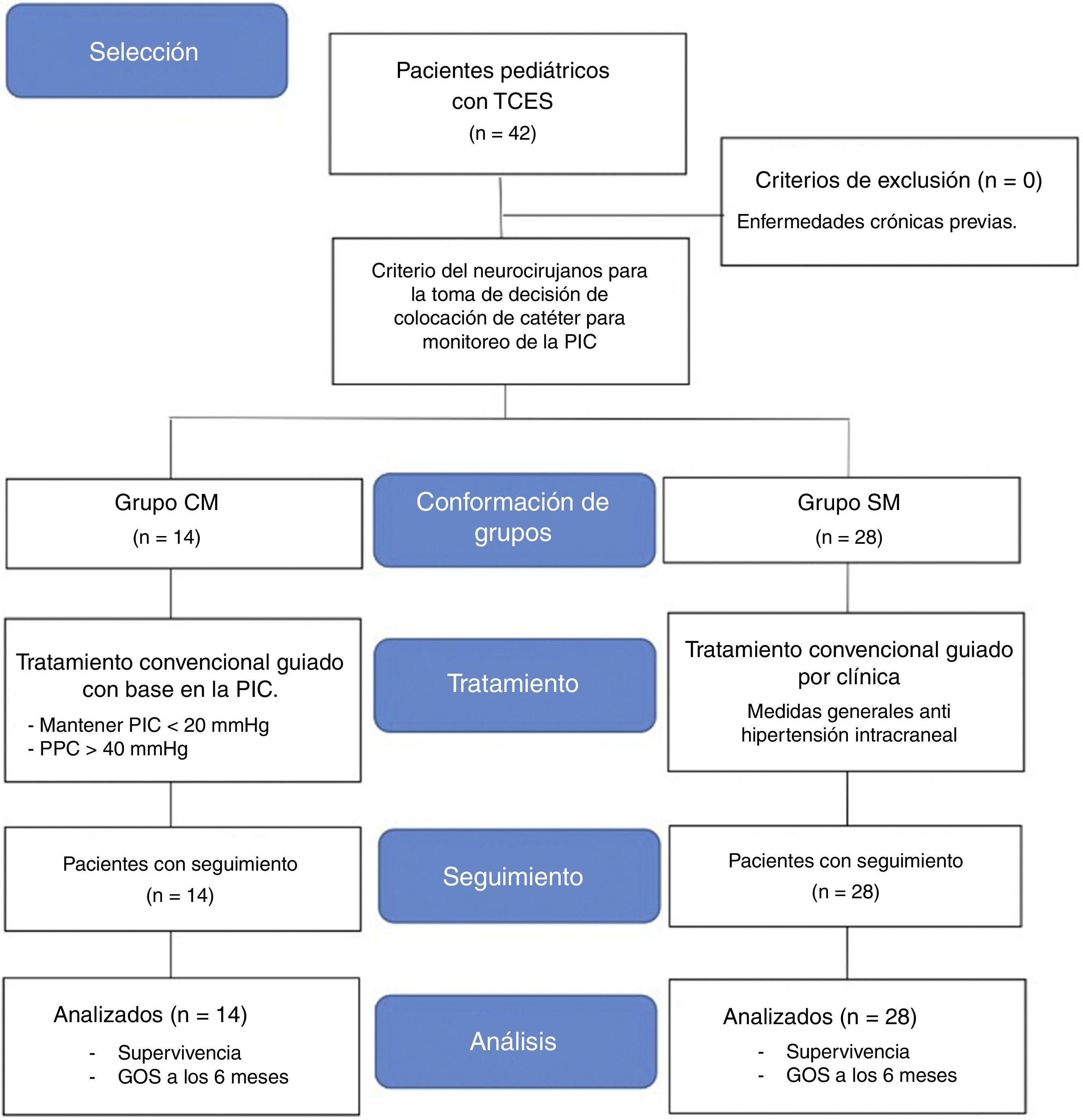
Pacientes y métodoSe incluyeron pacientes con TCES, edad entre 1 y 17 años, previo consentimiento informado de los padres y/o tutores. Se excluyeron pacientes con enfermedades crónicas o retraso psicomotor. Los pacientes ingresaron desde el Servicio de Urgencia, donde se les realizó scanner cerebral (TAC), clasificándose las lesiones por Escala de Marshall. Los pacientes fueron divididos en 2 grupos según criterio neuroquirúrgico: con monitorización (CM) y sin monitorización (SM) de presión intracraneana. La monitorización de la PIC se realizó a través de un catéter intraparenquimatoso 3PN Spiegelberg conectado a un monitor Spiegelberg HDM 26. Los pacientes fueron tratados de acuerdo a las guías pediátricas para TCES. Se consideró la supervivencia como los días transcurridos entre el ingreso hospitalario y el fallecimiento, o su evaluación por Escala de Glasgow para un seguimiento de 6 meses.
ResultadosCuarenta y dos pacientes (CM = 14 y SM= 28). Aquellos con monitorización tenían menor puntuación de la escala de coma de Glasgow y clasificación de Marshall con peor pronóstico. En ellos la supervivencia fue menor y el resultado moderado a bueno. No se registraron complicaciones con el uso del catéter de PIC.
ConclusiónPacientes con monitorización tuvieron mayor gravedad al ingreso y una mayor mortalidad; sin embargo, el resultado funcional de los sobrevivientes fue de moderado a bueno. Se requiere de la realización de ensayos clínicos aleatorizados para definir el impacto de la monitorización de la PIC en la supervivencia y calidad de vida en estos pacientes.
Severe traumatic brain injury (TBI) is a serious condition. Intracranial pressure (ICP) monitoring can be used to direct treatment, which is of limited access in developing countries.
ObjectiveTo describe the clinical experience of pediatric patients with severe TBI.
Patients and MethodA clinical experience in patients with severe TBI was conducted. Age was 1–17 years, exclusion criteria were chronic illness and psicomotor retardation. Informed consent was obtained in each case. Two groups were formed based on the criterion of neurosurgeons: with and without intracraneal pressure (ICP) monitoring. PIC monitoring was performed through a 3PN Spiegelberg catheter and a Spiegelberg HDM 26 monitor. Patients were treated according international pediatric guides. The characteristics of both groups are described at 6 months of follow-up.
ResultsForty-two patients (CM=14 and SM=28). Those in the CM Group had lower Glasgow coma scale score and Marshall classification with poorer prognosis. Among them survival rate was lower, although the outcome was from moderate to good. No complications were reported with the use of the ICP catheter.
ConclusionPatients with ICP monitoring had greater severity at admission and an increased mortality; however, the outcome for the survivors was from moderate to good. It is necessary to conduct randomized clinical trials to define the impact of ICP monitoring on survival and quality of life in severe TBI patients.
La monitorización de la presión intracraneal (PIC) en niños con traumatismo craneoencefálico severo (TCES) es una recomendación que se realiza como guía del tratamiento. Las guías del manejo del traumatismo cerebral en niños no han documentado suficiente evidencia para usar la monitorización de la PIC como un estándar, pero sí como una recomendación de buena práctica clínica1–3. El indicador de la severidad del TCE es la Escala de Coma de Glasgow, donde el TCES corresponde a valores iguales o menores a 84.
La tomografía axial computarizada (TAC) es la principal herramienta diagnóstica usada para la evaluación de un TCE, permitiendo identificar daño estructural. La clasificación de Marshall para hallazgos por TAC se ha utilizado como predictor de resultados clínicos, siendo las clasificaciones iv y vi las más relacionadas con mal pronóstico5,6.
En México, la monitorización de la PIC no se encuentra dentro de las recomendaciones de la guía de atención para niños con TCE7; sin embargo, ésta plantea entre sus objetivos principales preservar la oxigenación y ventilación, prevenir la broncoaspiración, mantener la presión arterial media (PAM) y evitar elevaciones de la PIC. De este modo, en función de criterios clínicos e imagenológicos se decide la colocación de catéteres de la monitorización de la PIC8. En las unidades de terapia intensiva pediátricas (UTIP) de la región sureste de México no se había utilizado la monitorización de la PIC, con mortalidad histórica de 41% (IC 95%: 35-47%) en TCES. La PIC representa un punto de partida para tomar decisiones terapéuticas, permitiendo guiar el tratamiento para mejorar la presión de perfusión cerebral (PPC=PAM-PIC), detección temprana de hipertensión intracraneal y/o herniación cerebral9–11.
El objetivo de este estudio es describir la experiencia clínica de pacientes pediátricos con TCES, en quienes se utilizó o no monitorización de la PIC.
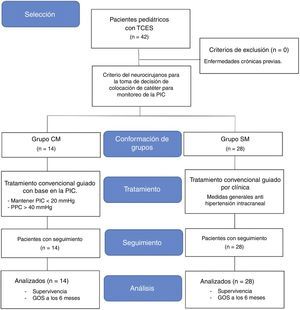
Pacientes y métodoExperiencia clínica en 42 pacientes pediátricos con TCES que ingresaron de manera consecutiva en las UTIP de la Unidad Médica de Alta Especialidad del IMSS y del Hospital General Agustín O’Horán del Servicio de Salud de Yucatán, durante el periodo comprendido entre septiembre de 2010 a febrero de 2014. Ambos hospitales son públicos, tienen departamentos de urgencias pediátricas, imagenología y neurocirugía, disponible las 24h del día, y son los únicos hospitales con UTIP de la región. Los catéteres intraparenquimatosos se proporcionaron sin costo alguno.
El estudio fue aprobado por los comités de ética de las instituciones participantes. Se incluyeron en el estudio a todos aquellos pacientes con TCES, entre 1 y 17 años de edad, previo consentimiento informado de los padres y/o tutores. No se incluyeron pacientes con enfermedad crónica o con retraso psicomotor.
Los pacientes ingresaron en el estudio desde el Servicio de Urgencias, donde se les realizó TAC, clasificándose las lesiones con la escala de Marshall. Seguidamente recibieron valoración por el neurocirujano, quien a criterio clínico y de imagen tomaba la decisión de monitorización de la PIC determinándose 2 grupos: con monitorización (CM) y sin monitorización (SM). El uso de la monitorización de la PIC comprendió la colocación de un catéter intraparenquimatoso 3PN Spiegelberg conectado a un monitor de PIC Spiegelberg HDM 26. Dicho monitor cumple con la norma de la asociación para el avance del instrumental médico estándar que establece que un aparato de monitorización de la PIC debe de tener las siguientes especificaciones: 1) rango de presión entre 1-100mmHg; 2) precisión±2mmHg en rango de 0-20mmHg; y 3) máximo error del 10% con un rango de 20-100mmHg12,13. Se prefirió el empleo de catéteres intraparenquimatosos por su fácil instalación y menor número de complicaciones14–16. El procedimiento consistió básicamente en una incisión lineal de aproximadamente 2cm en la región frontal derecha o izquierda, contralateral al sitio de la lesión, a 2-3cm de la línea media, por delante de la sutura coronal. Se colocó un separador autoestático, y se realizó un orificio de trépano de 0,5cm de diámetro, posteriormente una incisión sobre la duramadre, y se colocó una sonda acanalada curva como guía para insertar el catéter progresando 2cm aproximadamente para quedar intraparenquimatoso. Se exteriorizó por contrabertura y se conectó directamente al monitor de PIC.
Los pacientes fueron tratados de acuerdo a las guías de manejo de los pacientes pediátricos con TCES1,2. En el grupo CM los objetivos fueron mantener una PIC≤20mmHg y una PPC≥40mmHg1,2, mientras que los pacientes del grupo SM fueron tratados con las mismas medidas ante la sospecha de hipertensión intracraneal. Se utilizó el electroencefalograma para verificar muerte cerebral. Para fines de este estudio se consideró la supervivencia como los días transcurridos entre el ingreso hospitalario y el fallecimiento o su seguimiento por 6 meses.
A los 6 meses del accidente se valoró el grado de recuperación. Para medir secuelas se utilizó la Escala de respuesta de Glasgow (GOS, por sus siglas en inglés) que tiene como propósito valorar el estado funcional o incapacidad después de un TCE17,18. Estos fueron clasificados en las siguientes categorías: estado vegetativo, incapacidad severa, incapacidad moderada y buena recuperación19.
El análisis de este estudio se realizó por medio de estadística descriptiva. El programa informático utilizado fue el SPSS v. 21.0 software. Los resultados se expresaron como media±DS o mediana (rango intercuartílico) según la distribución de los datos.
ResultadosSe incluyeron 42 pacientes pediátricos con TCES. La edad fue de 7,5 años (3-13). El 59,5% fue del sexo masculino. El principal mecanismo de lesión fueron los accidentes automovilísticos (57,1%), seguido de caídas (28,6%) y de impacto por proyectil (14,3%). Con respecto al lugar donde ocurrió el accidente el 62% fue en la vía pública, seguido del 33,3% en el hogar (fig. 1).
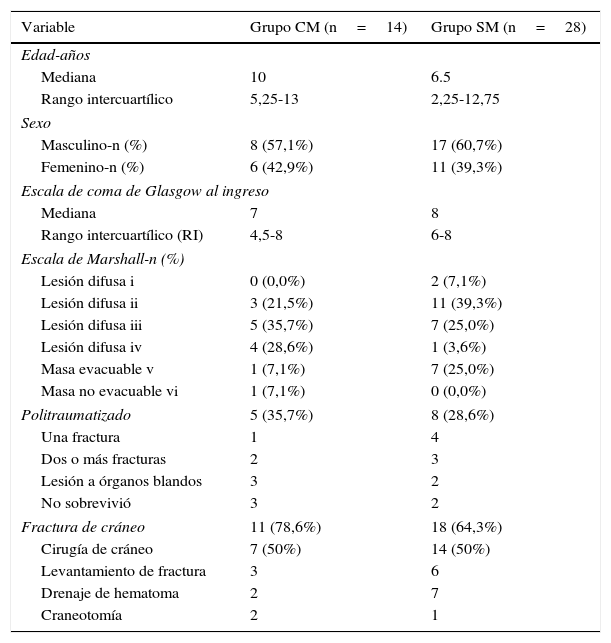
En la tabla 1 se describen las características de los grupos. La mediana de Escala de coma de Glasgow al ingreso en el grupo CM fue de 7 y del grupo SM de 8. En la clasificación de Marshall el 71,4% (9/14) de los pacientes del grupo CM tuvo las lesiones más graves (lesión difusa iii, iv y masa no evacuable vi), mientras que en el grupo SM el 28,6% (8/28) de los pacientes presentaron este tipo de lesiones. El 31% (13 pacientes del total) fueron politraumatizados, siendo la fractura de fémur la más frecuente, seguida de la de radio y la de húmero. El 69% (29/42) del total de pacientes presentaron fractura de cráneo.
Características de los grupos con (CM) y sin (SM) monitorización de la Presion Intracraneana (PIC)
| Variable | Grupo CM (n=14) | Grupo SM (n=28) |
|---|---|---|
| Edad-años | ||
| Mediana | 10 | 6.5 |
| Rango intercuartílico | 5,25-13 | 2,25-12,75 |
| Sexo | ||
| Masculino-n (%) | 8 (57,1%) | 17 (60,7%) |
| Femenino-n (%) | 6 (42,9%) | 11 (39,3%) |
| Escala de coma de Glasgow al ingreso | ||
| Mediana | 7 | 8 |
| Rango intercuartílico (RI) | 4,5-8 | 6-8 |
| Escala de Marshall-n (%) | ||
| Lesión difusa i | 0 (0,0%) | 2 (7,1%) |
| Lesión difusa ii | 3 (21,5%) | 11 (39,3%) |
| Lesión difusa iii | 5 (35,7%) | 7 (25,0%) |
| Lesión difusa iv | 4 (28,6%) | 1 (3,6%) |
| Masa evacuable v | 1 (7,1%) | 7 (25,0%) |
| Masa no evacuable vi | 1 (7,1%) | 0 (0,0%) |
| Politraumatizado | 5 (35,7%) | 8 (28,6%) |
| Una fractura | 1 | 4 |
| Dos o más fracturas | 2 | 3 |
| Lesión a órganos blandos | 3 | 2 |
| No sobrevivió | 3 | 2 |
| Fractura de cráneo | 11 (78,6%) | 18 (64,3%) |
| Cirugía de cráneo | 7 (50%) | 14 (50%) |
| Levantamiento de fractura | 3 | 6 |
| Drenaje de hematoma | 2 | 7 |
| Craneotomía | 2 | 1 |
El tratamiento consistió en mantener la cabeza a 30° de la horizontal, la sedoanalgesia usada fue fentanilo con midazolam, y eventualmente se utilizó vecuronio. Se usó hiperventilación moderada para mantener PaCO2 entre 30 y 35mmHg. La osmoterapia más utilizada fue solución salina hipertónica al 3% (en el 95% de los pacientes) y manitol al 20% (en el 5% de los pacientes). Se utilizó lidocaína en el 87% de los pacientes. Nueve pacientes requirieron el segundo nivel de terapia, donde se utilizó tiopental en 7 de ellos y descompresión quirúrgica en 2.
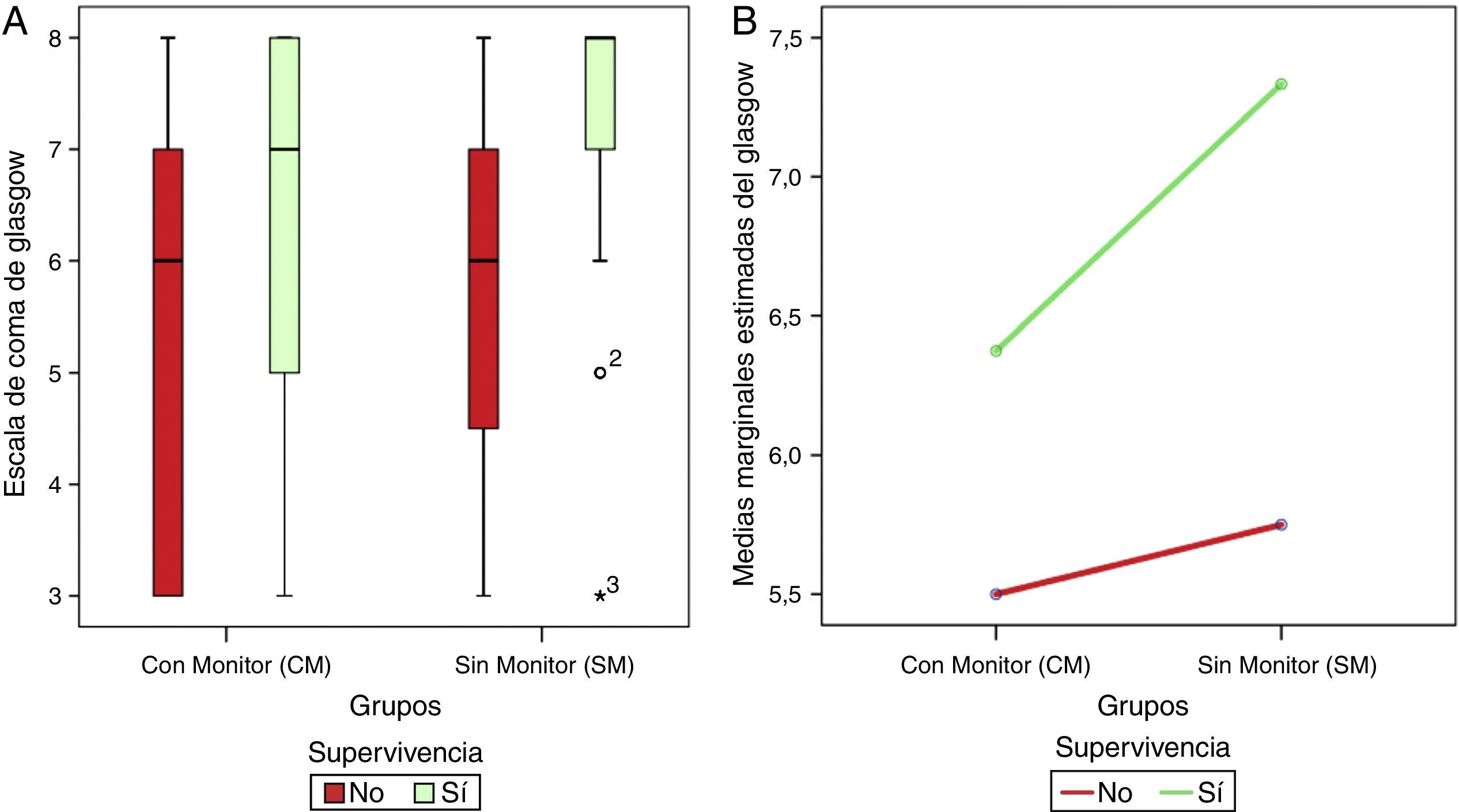
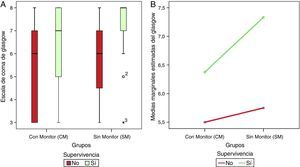
En la figura 2 se ilustra la distribución de la escala de Glasgow por grupo al ingreso hospitalario y la supervivencia. Se observó que el 75% de los pacientes fallecidos en el grupo CM tuvieron una puntuación entre 3 y 7, y el 75% de los sobrevivientes en este grupo tuvieron una puntuación entre 5 y 8; mientras en el grupo SM el 50% de los fallecidos tuvo una puntuación entre 4,5 y 7, pero el 75% de los sobrevivientes tuvo una puntuación entre 7 y 8. Los pacientes con monitorización de PIC tuvieron menor puntuación de Glasgow.
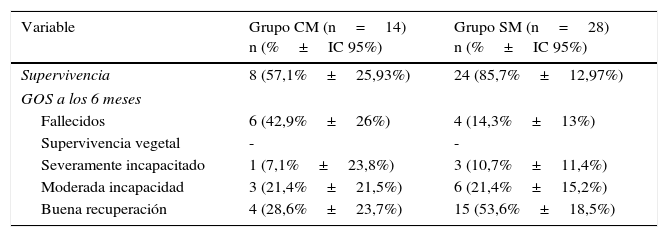
La supervivencia total fue de 76,2% (63,3-89,1%). En la tabla 2 se describe la supervivencia y secuelas en ambos grupos. Cabe señalar que todas las muertes ocurridas fueron atribuidas al TCES.
Supervivencia y Escala de respuesta de Glasgow (GOS) a los 6 meses
| Variable | Grupo CM (n=14) n (%±IC 95%) | Grupo SM (n=28) n (%±IC 95%) |
|---|---|---|
| Supervivencia | 8 (57,1%±25,93%) | 24 (85,7%±12,97%) |
| GOS a los 6 meses | ||
| Fallecidos | 6 (42,9%±26%) | 4 (14,3%±13%) |
| Supervivencia vegetal | - | - |
| Severamente incapacitado | 1 (7,1%±23,8%) | 3 (10,7%±11,4%) |
| Moderada incapacidad | 3 (21,4%±21,5%) | 6 (21,4%±15,2%) |
| Buena recuperación | 4 (28,6%±23,7%) | 15 (53,6%±18,5%) |
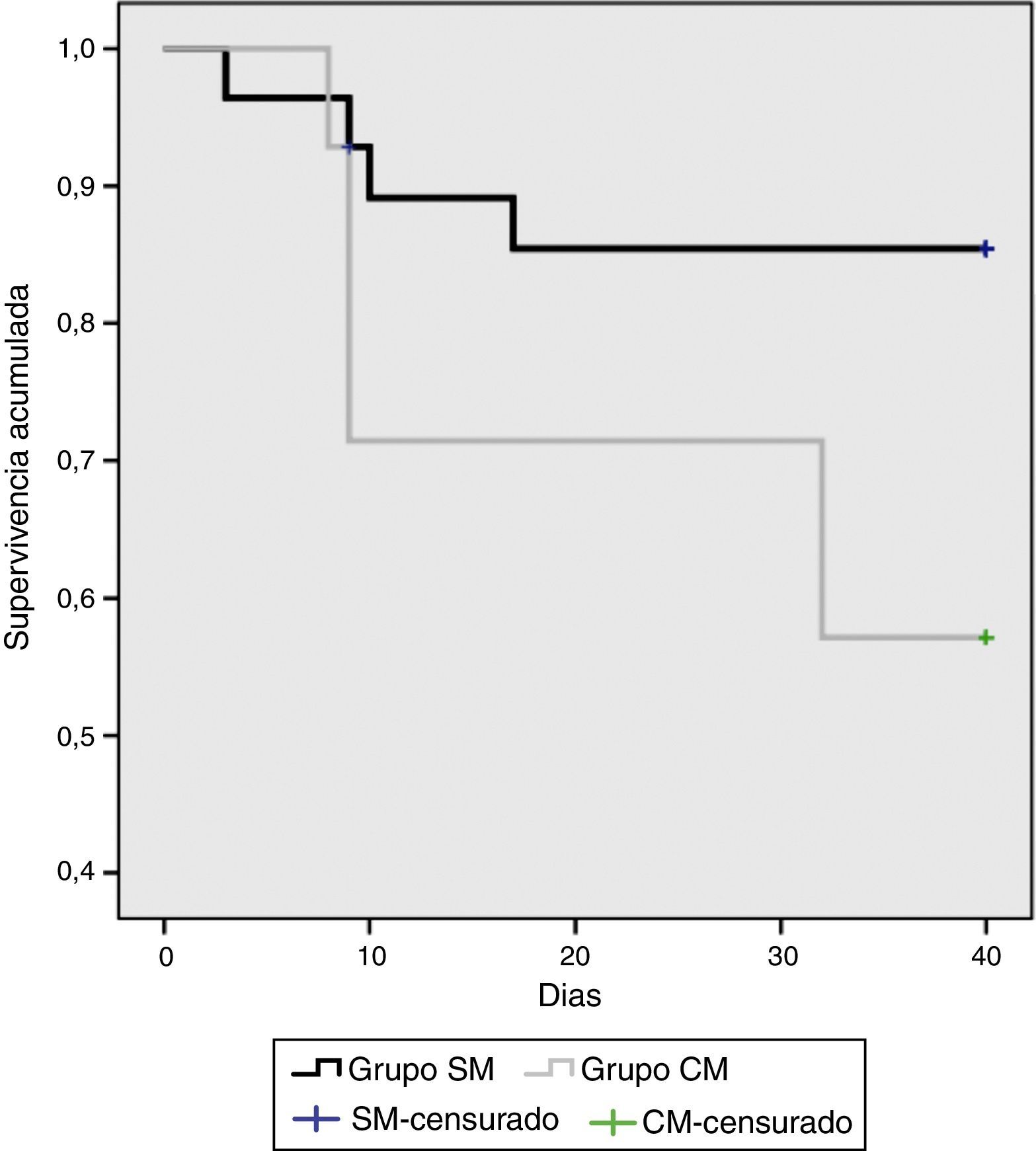
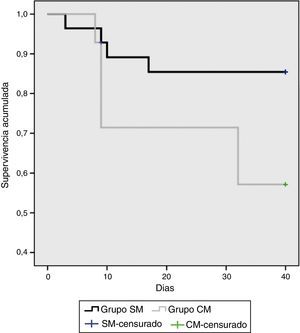
En la figura 3 se ilustran las curvas de supervivencia para ambos grupos, posterior a los 40 días no hubo ningún deceso, la supervivencia del grupo CM fue de 57,1% y del grupo SM de 85,7%.
En todos los casos se logró el registro de la PIC sin fallos técnicos ni complicaciones. La mediana del tiempo transcurrido entre el accidente y la colocación del catéter intraparenquimatoso fue de 23,5h (12,75-34,25). La permanencia de la monitorización de la PIC fue de 6 días (5-7).
La estancia hospitalaria fue de 20 días (9,0-33,3) para el grupo CM y de 13,5 (9,0-22,3) para el grupo SM. La estancia en la UTIP fue de 10 días (8,8-15,8) para el grupo CM y de 6,5 días (4,8-9,3) para el grupo SM.
Todos los pacientes estuvieron bajo ventilación mecánica 9 días (8,0-15,5) en el grupo CM y de 4 días (RI: 4-8,3) en el grupo SM.
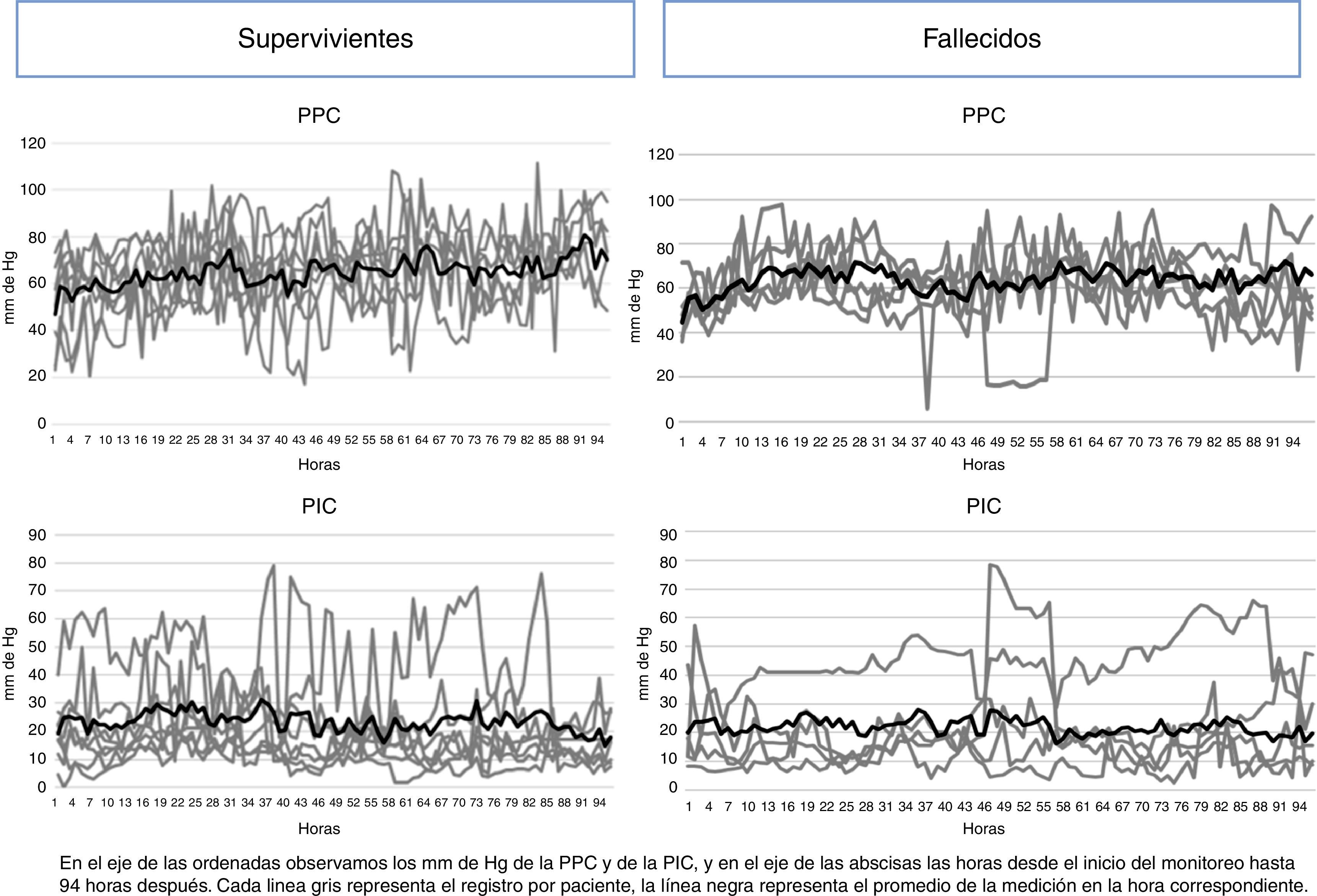
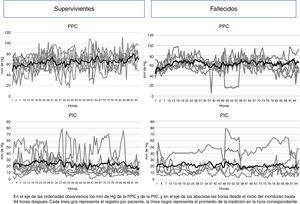
La figura 4 representa gráficamente el comportamiento de la PIC y de la PPC horaria, de sobrevivientes y fallecidos del grupo CM. En los pacientes fallecidos se mantiene una PIC elevada por arriba de los 20mmHg, a pesar del tratamiento empleado, mientras que los supervivientes tienen picos de PIC elevada que disminuyen con intervenciones terapéuticas.
DiscusiónEl TCES es unas las principales causas de mortalidad en la población pediátrica20,21. La preponderancia en el sexo masculino22,23 y la ocurrencia del accidente en la vía pública24,25 fue similar a lo reportado, para los pacientes pediátricos que sufren TCES.
La monitorización de la PIC es recomendada en el tratamiento de los pacientes con TCES1,2, aunque no se ha demostrado el beneficio de su uso debido a la dificultad de llevar a cabo ensayos clínicos aleatorizados y al gran tamaño de muestra que se requeriría3,26–29.
Para este estudio se usó la monitorización de la PIC por medio del catéter intraparequimoso debido a la facilidad en su colocación, aun en ventrículos colapsados por el edema cerebral, su calibración automática y la baja tasa de infección, comparada con el intraventricular, a pesar de no ser factible el drenaje del líquido cefalorraquídeo por este para la terapia de la hipertensión intracraneal30.
En este estudio en un tercio de los pacientes fue monitorizada la PIC, decidiéndose la colocación del catéter a niños más graves según la escala de Glasgow y clasificación de la lesión por criterios de Marshall, esperándose mayor morbimortalidad y peor pronóstico funcional en el grupo CM. Esta fracción fue menor comparada con otro estudio donde se monitorizó la PIC hasta en un 60%22, y la tendencia dadas las recomendaciones internacionales es aumentar su uso. Sin embargo, en los países en vías de desarrollo los catéteres no siempre se encuentran disponibles. Es importante destacar que la mortalidad de nuestros pacientes con TCES fue mayor que lo reportado en otros estudios pediátricos22,31, aunque la mayoría de los sobrevivientes tuvieron una buena recuperación, lo que puede deberse a múltiples factores, siendo uno de estos un tratamiento oportuno y adecuado.
La Escala de coma de Glasgow es uno de los principales factores pronósticos: concordante con estudios previos, a mayor severidad menor puntuación, peor evolución y mayor mortalidad5,32–35. En este estudio hubo mayor número de pacientes en la clasificación de Marshall iii, iv y vi (las más graves) en el grupo CM (71,4%), pero a pesar de ello tuvieron buena recuperación, lo que sugeriría indirectamente algún beneficio del empleo de la monitorización de la PIC36–39.
El tiempo empleado desde el accidente hasta la colocación del catéter de PIC fue mayor de lo recomendado (antes de las 24h) en muchos casos40. Esto fue debido al tiempo de traslado, valoración neuroquirúrgica y a la disponibilidad de recursos en el momento del ingreso.
Nuestra principal limitación fue que los comités de ética involucrados no autorizaron la aleatorización de los pacientes en el entendido de que aquellos con Glasgow menor o igual a 8 tuvieran la oportunidad de ser monitorizados, asumiendo ventaja para los mismos. Los pacientes que no fueron monitorizados fue porque los padres y/o tutores no aceptaron su uso, o porque así lo decidieron los neurocirujanos tratantes.
ConclusionesDescribimos nuestra experiencia clínica en niños con TCES tratados con y sin monitorización de PIC. Aquellos con monitorización tenían mayor gravedad al ingreso y presentaron una mayor mortalidad; sin embargo, el resultado funcional de los sobrevivientes medido con la GOS fue de moderado a bueno. Se requiere de la realización de ensayos clínicos aleatorizados para definir el impacto de la monitorización de la PIC en la supervivencia y calidad de vida en estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos catéteres de la PIC fueron financiados por el Programa de Mejoramiento del Profesorado (PROMEP) UADY-EXB-140.
AutoríaLos autores somos responsables de la investigación y hemos participado en su concepto, diseño, análisis e interpretación de los datos, escritura y corrección del manuscrito y aprobamos el texto final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los profesionales de Salud del Hospital Agustín O’Horán y de la Unidad Médica de Alta Especialidad por el apoyo; al igual que a los pacientes y sus familias, que ante la situación colaboraron en el estudio en aras de beneficiar a otros niños en condiciones similares.