Tanto la tomografía computarizada (TC) como la resonancia magnética (RM) dependen de alteraciones anatómicas para detectar la enfermedad. Sin embargo, la tomografía por emisión de positrones (PET) identifica los tejidos neoplásicos gracias a procesos moleculares y bioquímicos que se desarrollan en el interior de los tejidos tumorales. La PET utiliza radioisótopos de elementos naturales, como el 15oxígeno, 11carbono, 13nitrógeno y 18flúor. Estos radioisótopos poseen una función biológica que permite la síntesis de numerosos radiofármacos emisores de positrones, los cuales pueden ofrecer imágenes e información cuantitativa sobre el flujo sanguíneo, el estado de los receptores y el metabolismo celular. El radiofármaco más utilizado es la 18F-fluoro-2-desoxi-D-glucosa (18F-FDG). El elevado consumo de FDG, debido a un aumento de la glucólisis, es la característica más distintiva de las células malignas, que poseen así una alta captación de este radiofármaco. La FDG se incorpora a través de la membrana celular por difusión pasiva (facilitada por proteínas transportadoras) y rápidamente se transforma en 18F-FDG-6-fosfato por acción de las enzimas hexocinasa y glucocinasa. Pese a que esta reacción es reversible por efecto de la glucosa-6-fosfatasa, la hipoxia tumoral estimula el paso de FDG a través de la membrana, así como su fosforilación, quedando atrapada bajo la forma de 18F-FDG-6-fosfato en el interior de la célula1,2.
La principal ventaja de la FDG sobre los otros radioisótopos emisores de positrones es su mayor período de semidesintegración: 110 min, frente a 20 min del 11C, 10 min del 13N y 2 min del 15O. Dada su elevada vida media, la FDG es el radiofármaco más utilizado en las unidades de medicina nuclear. Requiere únicamente una cámara de positrones para su detección y no es imprescindible la existencia de un ciclotrón (acelerador productor de radioisótopos emisores de positrones) en el interior de la instalación radiactiva1,2.
Indicaciones de la PET-FDG aprobadas en España
No conviene confundir las indicaciones de la PET-FDG con utilidad claramente demostrada y las financiadas por los sistemas sanitarios (más estrictas, menos numerosas y sujetas a controles económicos rigurosos, dependientes de cada sistema de salud).
A continuación exponemos las indicaciones reseñadas en el Informe de Evaluación de Tecnologías Sanitarias del Instituto de Salud Carlos III, publicado en noviembre del 20013.
Entre «las indicaciones claramente demostradas» figuran las siguientes: a) nódulo pulmonar solitario; b) estadificación preterapéutica de carcinoma pulmonar no microcítico; c) diagnóstico diferencial recidiva/radionecrosis en tumores cerebrales; d) carcinomas diferenciados de tiroides; e) estadificación preterapéutica del cáncer de esófago; f) sospecha de recurrencia de carcinoma colorrectal; g) estadificación preterapéutica del melanoma; h) sospecha de recurrencia de melanoma; i) estadificación y reestadificación del linfoma; j) estadificación preterapéutica en tumores de cabeza y cuello, y k) sospecha de recurrencia en tumores de cabeza y cuello.
Entre «otras indicaciones razonablemente demostradas» destacan: a) diagnóstico de benignidad/malignidad en lesión conocida y de difícil acceso para biopsia; b) valoración pronóstica y del grado de malignidad, y c) detección y estadificación de tumor de origen desconocido.
Indicaciones aprobadas por los sistemas sanitarios
Las indicaciones aprobadas por los sistemas privados y públicos varían en función de los países. En EE.UU., las aseguradoras privadas tienen aprobadas las indicaciones de la PET en numerosos procesos, que en algunos casos superan a las del Medicare (sistema público estadounidense)4. En dicho país el cáncer de mama (estadificación, detección de recurrencia y monitorización de la respuesta durante el tratamiento) está incluido como indicación de la PET-FDG desde finales de 2002.
En España, 2 meses después de la realización de la mencionada revisión sistemática en noviembre de 20013, la Agencia de Evaluación de Tecnologías Sanitarias (AETS)5 publicó el «Protocolo de uso tutelado para la recogida de información sobre la utilización de la 18FDG-PET», vigente desde el 1 de abril de 2002. En este documento se establecen 8 indicaciones de la PET-FDG claramente demostradas en oncología (tabla 1) y 2 con posible fundamento que se autorizan en determinados casos (detección de tumor de origen desconocido y valoración de epilepsias resistentes a los fármacos).
Aplicaciones clínicas de la PET-FDG
Cribado de tumores
No podemos decir que la PET-FDG pueda ser una herramienta habitual en el cribado del cáncer en pacientes asintomáticos, debido, por una parte, a su considerable coste (todavía muy por encima del resto de las pruebas de imagen convencionales) y, por otra, a una elevada tasa de falsos negativos (31/67; 46%), identificada en el estudio de Yasuda et al6, en el que casi la mitad de las neoplasias urológicas (14/31; 45%) se pasaron por alto. Sin embargo, en este trabajo se detectan 36 de 67 cánceres y se juzga muy positivo que la PET sea capaz de identificar los estadios más tempranos o potencialmente curables.
Sin embargo, investigaciones posteriores que valoran la utilidad de la PET-FDG en el cribado del cáncer de colon7 y del cáncer de pulmón8 son más positivas, considerándose en este último trabajo una estrategia coste-efectiva. Si nos referimos a la detección de metástasis cerebrales, la RM muestra una mayor exactitud diagnóstica que la PET, que a la vez presenta una mayor dificultad a la hora de detectar lesiones subcentimétricas9.
Diagnóstico diferencial de benignidad o malignidad en lesión conocida
Se ha comprobado que la PET-FDG posee una elevada sensibilidad (92%) y un elevado valor predictivo negativo (90%) para la determinación de benignidad o malignidad del nódulo pulmonar solitario10-15. No obstante, las últimas investigaciones realizadas al respecto, con estudios de coste-efectividad, orientarían a efectuar la PET-FDG ante las siguientes situaciones: a) discordancia entre los resultados de la probabilidad pretest de malignidad y los hallazgos de la TC, y b) pacientes con probabilidad pretest intermedia y con alto riesgo de complicaciones quirúrgicas (fig. 1). En las demás circunstancias, las estrategias actuales basadas en la TC proporcionan un resultado similar en cuanto a años de vida ajustados por calidad y con un coste menor16.
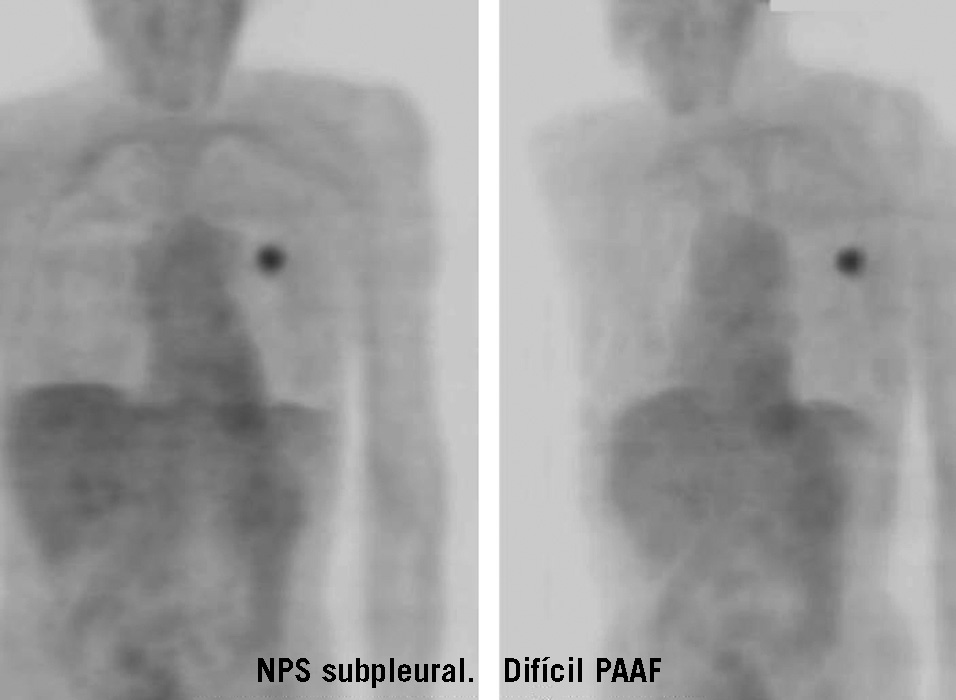
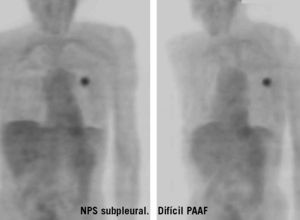
Fig. 1. Paciente con nódulo pulmonar solitario (NPS) subpleural izquierdo inaccesible mediante punción-aspiración con aguja fina (PAAF). La PET-FDG (tomografía por emisión de positrones mediante 18F-fluoro-2-desoxi-D-glucosa) objetiva hipermetabolismo en el lóbulo superior izquierdo focal, con valor de captación estandarizado máximo de 7, indicativo de alta probabilidad de malignidad.
Parece constatarse la menor utilidad de la PET-FDG en el diagnóstico de enfermos con nódulo pulmonar solitario y riesgo bajo o alto de padecer cáncer, al igual que en lesiones subcentimétricas, infecciones y tumores broncoalveolares y carcinoides17.
El valor de la PET-FDG para diferenciar lesiones pancreáticas benignas de las malignas se ha estudiado ampliamente, con porcentajes de sensibilidad entre el 71 y el 100% (media del 92%) y de especificidad entre el 64 y el 100% (media del 82%)18. Al parecer, las dificultades mayores de la PET en estos procesos son: a) la hiperglucemia; b) pacientes con enfermedad activa pancreática (pancreatitis aguda o pancreatitis crónica activa)18, y c) la dificultad en la detección de tumores pancreáticos T119. Por ello, las recomendaciones actuales son: efectuar PET-FDG en lesiones hipoecogénicas en la ecografía o hipodensas en la TC con incremento de las concentraciones de CA-19.9 de origen dudoso20, o en pacientes con tumores pancreáticos de naturaleza indeterminada sin hiperglucemia y sin evidencia serológica de enfermedad activa inflamatoria (proteína C reactiva)21.
Por último, la PET-FDG muestra unos resultados óptimos en la caracterización de lesiones hepáticas indeterminadas por ecografía, TC o RM. Existen resultados fiables que avalan su utilización en el diagnóstico diferencial entre benignidad y malignidad de las lesiones hepáticas, con un valor de captación estandarizado (standardized uptake value, SUV) mayor de 3,5 para las lesiones malignas (adenocarcinomas, sarcomas y colangiocarcinomas) y menor de 3,5 para las de origen benigno, con escasos falsos positivos en abscesos hepáticos y falsos negativos en algunos hepatocarcinomas22-24.
El SUV es un índice semicuantitativo que relaciona la concentración del radiotrazador en la lesión a estudio con la actividad inyectada y el peso corporal. Se utiliza de forma habitual sobre todo en las enfermedades oncológicas como valor adicional de la interpretación cualitatitiva o visual. El valor de corte más utilizado para discriminar las lesiones extracerebrales benignas de las malignas se sitúa entre 2,5 y 3, salvo en el esqueleto, en el cual el valor umbral es de 2,01,2.
Detección del tumor primario
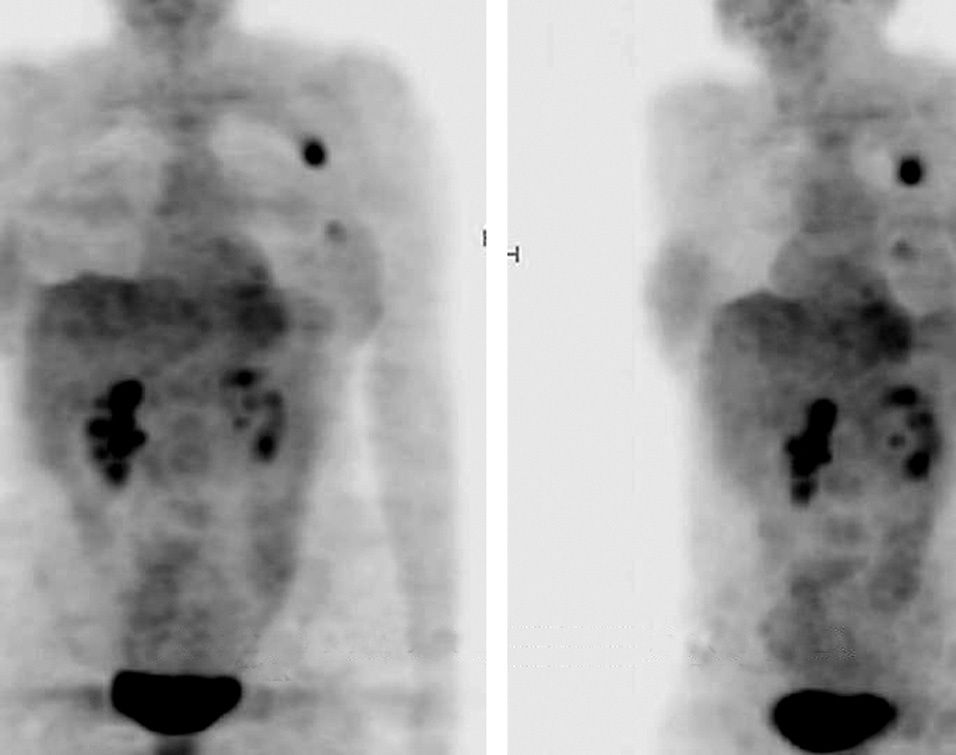
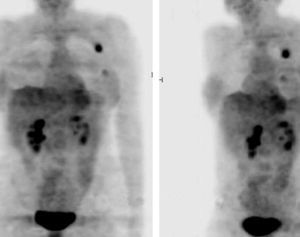
Es frecuente encontrar metástasis linfáticas o hematógenas de un tumor primario desconocido. Esto acontece en un 3% de todas las neoplasias y figura entre los 10 cánceres más frecuentes en el ser humano25. El pronóstico y el tratamiento están muy relacionados con la presencia de enfermedad localizada o avanzada. El manejo de pacientes con neoplasias de origen desconocido incluye frecuentemente un gran número de exploraciones radiográficas y de procedimientos invasivos y costosos, que en la mayoría de los casos (70-80%) no van a permitir la filiación del tumor primario. Los porcentajes de detección del tumor primario mediante PET-FDG varían entre un 24%26 y un 45%27, con sensibilidad elevada y especificidad intermedia28 (fig. 2).
Fig. 2. PET-FDG (tomografía por emisión de positrones mediante 18F-fluoro-2-desoxi-D-glucosa) para valoración de metástasis (MTX) axilar izquierda de origen desconocido. Las imágenes volumétricas permiten apreciar, además de la lesión axilar conocida, una acumulación del radiotrazador en la región mamaria homolateral que se confirmó como tumor primario.
Aunque en el grupo de enfermos con metástasis cervicales parece existir un beneficio claro en cuanto a la aplicación de la PET-FDG como técnica diagnóstica, el Grupo de Oncología de la Federación Mundial de Medicina Nuclear y Biología resume que la PET-FDG constituye una técnica complementaria, con una relación coste-beneficio óptima en pacientes con metástasis de origen desconocido secundarias a carcinoma pulmonar no microcítico, recaídas del cáncer colorrectal, melanoma y tumores avanzados de cabeza y cuello29.
Estadificación
En el año 1999, Dwamena et al30 confirmaron en su metaanálisis la superioridad de la PET-FDG con respecto a la TC en la estadificación mediastínica del carcinoma de pulmón no microcítico, con una sensibilidad y especificidad del 79 y el 91% para la PET-FDG y del 60 y el 77% para la TC, respectivamente. La PET permite la detección de metástasis a distancia no conocidas hasta en un 15% de los casos31, lo que posibilita una estadificación más correcta que con las pruebas morfológicas convencionales.
Comparada con la mediastinoscopia, la PET-FDG estadifica correctamente (N0-N1 frente a N2) a 50 de 61 pacientes (82%), con incremento de la estadificación en un 13% y disminución de ésta en un 5%32. Verhagen et al31 estiman unos valores predictivos negativo y positivo en la estadificación mediastínica para la PET-FDG del 71 y el 83%, y para la mediastinoscopia del 92 y el 100%, respectivamente. Sin embargo, en los tumores de localización central o en los pacientes N1 con captación patológica en la PET se obtiene un valor predictivo negativo del 17%, y del 96% en los casos de PET negativa, tanto para la localización N1 como para los tumores primarios no centrales. Por tanto, estos autores recomiendan que, ante un paciente con PET-FDG negativa en mediastino, la mediastinoscopia sólo puede evitarse cuando exista un tumor primario no central y sin nódulos N1 positivos en la PET-FDG.
Por último, en los estadios I y II, los beneficios de la PET-FDG parecen centrarse en una mejora de la estadificación y en un tratamiento más específico, pero sin reducir de forma significativa el número de toracotomías33.
En el cáncer de pulmón microcítico, aunque con menor evidencia científica, parece ser que la PET-FDG es a menudo discordante con los hallazgos de la TC, tanto en la estadificación como en la reestadificación; se detecta hasta un 33% de incremento en el estadio, con la subsiguiente modificación terapéutica (sin aplicación de radioterapia torácica), e influye en la reestadificación en un 52% de los pacien tes34.
También se ha objetivado la utilidad de la PET-FDG en la estadificación de linfomas. Se utiliza de forma habitual en pacientes con enfermedad de Hodgkin y linfoma no hodgkiniano de grados intermedio y alto. En una revisión sistemática publicada en el año 2003 que incluía 359 casos35, la PET habría cambiado el estadio en un 8-50% de los pacientes con linfoma (valor medio del 24%) y modificado el abordaje terapéutico en un 0-25% de los casos (media del 13%). En un 89,6% de los casos los enfermos pasaban a estadios superiores, mientras que tan sólo en un 10,4% pasaban a estadios inferiores, con resultados similares a los señalados por Hoskin36 en una revisión sobre PET y linfomas (n = 458).
En la estadificación del melanoma, la PET-FDG está autorizada en España en tumores con índice de Breslow superior a 4 mm (nivel Clark de 5, pT4), mientras que en EE.UU. se permite practicar PET ya con tumores con Breslow mayor de 1,5 mm (nivel Clark de 4, pT3). Recientemente, además de valorar la superioridad de la PET-FDG sobre los métodos de imagen convencionales, investigadores como Gulec et al37 han analizado los cambios producidos en el manejo terapéutico de los pacientes al incorporar la PET-FDG en la estadificación del tumor. Definen estas modificaciones como cambios intermodalidad (entre diferentes modalidades de tratamiento; p. ej., de cirugía a inmunoterapia o a quimioterapia) y cambios intramodalidad (dentro de la misma modalidad, es decir, equivalente a una modificación en la dosis o forma de aplicación de una opción terapéutica). Estos autores estudian a 49 pacientes con melanoma metastásico conocido o sospechado, en los que se realizó TC de tórax, abdomen y pelvis, así como RM cerebral. Tras indicar un tratamiento inicial, se efectuó la PET-FDG y se estableció definitivamente un plan terapéutico post-PET. La PET-FDG identificó más localizaciones metastásicas que la TC y la RM en 27 de 49 pacientes (55%), con cambio del plan terapéutico en 24 enfermos (49%). Un 75% de las modificaciones terapéuticas fueron quirúrgicas, mientras que en un 25% de los casos se administró quimioterapia, radioterapia o protocolos experimentales de inmunoterapia.
En la estadificación de los carcinomas de cabeza y cuello la PET-FDG está plenamente indicada, con mejores resultados si se dispone además de PET/TC (nueva tecnología que une metabolismo con morfología), que mejora la localización de las lesiones38. Además de estadificar correctamente la enfermedad, permite detectar la presencia de otros tumores sincrónicos asociados. Según Schwartz et al39, habría que efectuar PET-FDG de cuerpo entero (ligeramente por debajo de la región inguinal) para la detección de hasta un 21% de lesiones metastásicas infradiafragmáticas.
No ocurre lo mismo en la estadificación del cáncer de esófago, en el que inicialmente se preveían unos resultados alentadores. En la actualidad, según los artículos recientes, la PET-FDG detecta mejor el tumor primario y las metástasis sistémicas que los métodos convencionales de imagen, pero parece tener dificultad en la detección de las metástasis linfáticas (peritumorales o a distancia)40.
Por último, hay que señalar resultados recientemente publicados que van a favor de la utilización de la PET-FDG en la estadificación de los cánceres rectales avanzados, previamente a la aplicación del tratamiento adyuvante preoperatorio. En un 17% de los casos se anuló la cirugía y en un 4% se cambió el campo de aplicación de la radioterapia. En conjunto, el estadio tumoral se modificó en un 39% de los pacientes41.
Reestadificación (estadificación en la recaída)
La reintervención quirúrgica puede curar potencialmente a una fracción de pacientes con cáncer. Entre los mejores ejemplos cabe señalar la recurrencia en el cáncer de colon y en el melanoma. Se ha preconizado el uso de la PET-FDG en enfermos con incremento sucesivo del antígeno carcinoembrionario y con negatividad de pruebas complementarias de imagen, debido a la positividad del estudio PET-FDG sobre todo en neoplasias de crecimiento rápido y en tumores pobremente diferenciados42. También está muy estudiada la superioridad de la PET-FDG sobre la TC en la reestadificación preoperatoria de metástasis hepáticas de cáncer colorrectal, con sensibilidad y especificidad de la PET del 100 y el 91% y de la TC del 47 y el 91%, respectivamente, con cambio en el manejo terapéutico en un 42,8% de los pacientes43. En esta última indicación, Schussler-Fiorenza et al44 recomiendan aplicar la escala del riesgo clínico en pacientes con recaída hepática por carcinoma colorrectal. Cada factor preoperatorio (intervalo libre de enfermedad menor de un año, tamaño tumoral superior a 5 cm, existencia de más de un tumor; antígeno carcinoembrionario mayor de 200 y tumoración primaria con ganglios positivos) puntuaría 1 punto. Tan sólo los pacientes con sospecha de recaída aislada hepática por neoplasia colorrectal y 0 puntos quedarían exentos de efectuar PET-FDG antes de la cirugía.
El papel de la PET-FDG en la recurrencia secundaria a melanoma se ha definido de forma extensa en la bibliografía. En los 2 últimos años el interés se focaliza sobre todo en la posibilidad de obtener resultados falsos negativos y posi tivos, así como en su impacto terapéutico. Stas et al45 evalúan la sensibilidad y la especificidad de la PET-FDG por lesión detectada, en comparación con los métodos convencionales de imagen, y el valor adicional de la PET en el manejo terapéutico de los diferentes tipos de recurrencia por melanoma. Analizan restrospectivamente 100 exploraciones de PET-FDG en 84 pacientes con melanoma y recidiva regional o a distancia. En cuanto a las lesiones identificadas, la PET-FDG y los métodos de imagen convencional mostraron una sensibilidad del 85 y el 81%, una especificidad del 90 y el 87% y una exactitud diagnóstica del 88 y el 84%, respectivamente. Los resultados falsos negativos de la PET se encontraron en metástasis pequeñas localizadas en la piel y en metástasis cerebrales. Los resultados falsos positivos de la PET se describen en tumores benignos y malignos no relacionados, y en captaciones periféricas óseas y de tejidos blandos. La PET-FDG permitió incrementar la estadificación de los pacientes en 10 casos, la disminuyó en 24 y detectó más lesiones que los métodos morfológicos dentro del mismo estadio de enfermedad en 15 casos. Mediante la PET se modificó el manejo terapéutico en un 26% de los casos. Estos investigadores concluyen señalando que la PET-FDG posee un valor adicional en la reestadificación de la recurrencia por melanoma si se acompaña de un cuidadoso seguimiento clínico y de una valoración específica de las lesiones cerebrales (por RM). Señalan también que, ante resultados discordantes de la PET y la TC, se impone una vigilancia estrecha para descartar un resultado falso positivo de la PET o bien un verdadero positivo de esta técnica.
En el cáncer de cabeza y cuello la PET-FDG obtiene unos resultados óptimos en la estadificación de la recidiva, tanto en la detección de la recurrencia local como en la demostración de metástasis linfáticas locales y de metástasis sistémicas, con una exactitud diagnóstica del 89, el 96 y el 98%, respectivamente46.
Después de la tiroidectomía, la PET-FDG ha demostrado ser útil en pacientes con evidencia clínica o serológica de recurrencia por carcinoma diferenciado de tiroides y rastreo con 131I negativo, en quienes objetivó hasta en un 90% de los casos enfermedad metastásica. En enfermos afectados de cáncer medular de tiroides con incremento de calcitonina posterior a la cirugía y con pruebas morfológicas negativas o indeterminadas, la PET-FDG tiene una sensibilidad del 70-75% en la localización de la enfermedad metastásica38.
En el cáncer de mama, la PET-FDG parece adquirir un papel importante en la detección de la recurrencia local47 y a distancia48. Van Oost et al47 observan hasta un 16% de pacientes con metástasis a distancia en la recurrencia locorregional del cáncer de mama; en esta situación podría estar indicado practicar una PET-FDG de cuerpo entero. Además, cada vez existen más estudios que orientan a efectuar una PET-FDG ante la sospecha de recurrencia tumoral basada en la clínica, exploración física, marcadores tumorales o bien ante hallazgos indeterminados de las pruebas complementarias de imagen47,48. Grahek et al48 estudian a 134 pacientes con sospecha de recurrencia secundaria a cáncer de mama basada en la clínica, técnicas morfológicas o marcadores tumorales. La sensibilidad y la especificidad de la PET-FDG en comparación con las pruebas complementarias de imagen fueron del 84 y el 78% frente al 63 y el 61%, respectivamente, con mejores resultados en las pacientes con enfermedad oculta (el 90 y el 73%). Mediante el estudio con PET se modificó el manejo terapéutico en un 44% de las enfermas, en la mayoría de los casos con cambios intermodalidad. Este trabajo muestra la utilidad de la PET para confirmar y evaluar la extensión de recurrencia en el cáncer de mama, así como para detectar la enfermedad oculta (pacientes con incremento sérico del marcador tumoral y con pruebas de imagen negativas).
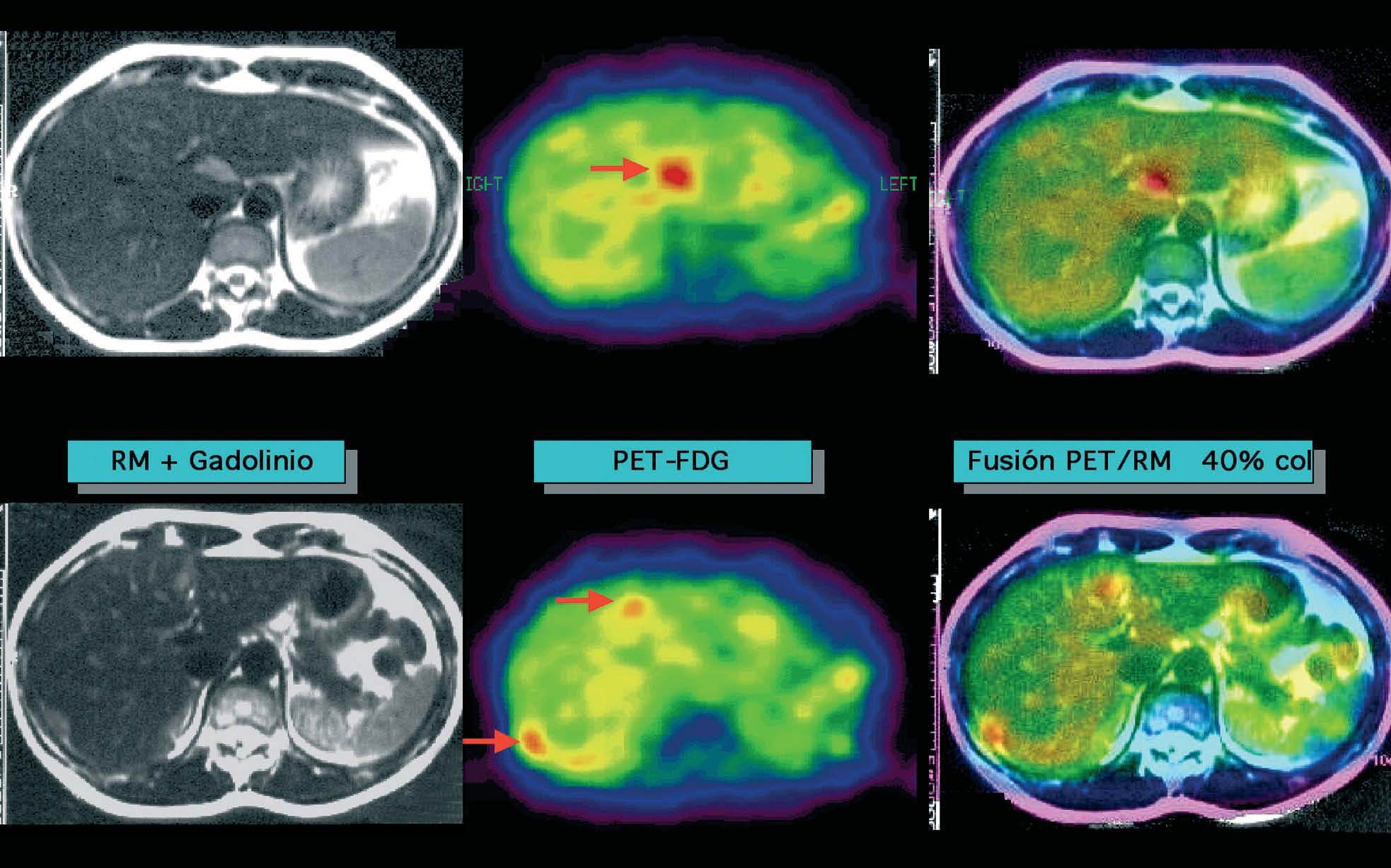
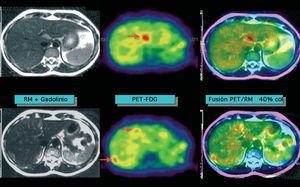
Al igual que en el cáncer de mama47-49, los estudios actuales efectuados con PET-FDG en el cáncer de ovario son bastante prometedores, con muy buenos resultados en la detección de recurrencia basada en la elevación de marcadores tumorales o bien en pruebas de imagen negativas o indeterminadas, y una mayor dificultad en el diagnóstico de la enfermedad residual subcentimétrica50 (fig. 3).
Fig. 3. Paciente con cáncer de ovario e incremento sucesivo del marcador tumoral CA-125, con tomografía computarizada y resonancia magnética (RM) posterior negativas. La RM hepática no objetiva alteraciones; en la PET-FDG (tomografía por emisión de positrones mediante 18F-fluoro-2-desoxi-D-glucosa) (flechas) se observan varias acumulaciones en el hígado y/o peritoneo perihepático claramente indicativas de recurrencia, que se visualizan fácilmente en las imágenes de fusión.
Detección de la enfermedad residual
Tanto en pacientes con enfermedad de Hodgkin como en linfomas no hodgkinianos, la PET-FDG puede ofrecer al clínico la respuesta metabólica del tumor al tratamiento, lo que permitiría definir si las masas residuales identificadas en la TC o en la RM se corresponden con tejido tumoral viable o bien son lesiones inactivas o fibróticas. El esquema general de valoración consiste en que a los pacientes que alcancen una respuesta radiológica completa se les administrarían 2 ciclos de quimioterapia convencional, mientras que aquellos que no obtuvieran una respuesta radiológica completa después de la quimioterapia convencional serían subsidiarios de efectuar un tratamiento de consolidación, mediante radioterapia o, para las formas de mayor agresividad, mediante dosis altas de quimioterapia. Este enfoque es erróneo porque la presencia de tejido tumoral viable no depende del tamaño del tumor, de forma que adenopatías de tamaño centimétrico pueden ser malignas y otras lesiones, en ocasiones de tamaño considerable, pueden ser masas residuales fibrosadas o inactivas. El enfoque más aceptado consiste en la realización de la PET-FDG al finalizar el tratamiento; de esta forma, además de una correcta definición del metabolismo de la lesión (con las consiguientes implicaciones terapéuticas), se obtiene una información pronóstica de gran valor íntimamente relacionada con la mejor o peor evolución del paciente. En la actualidad, la tendencia es a utilizar la PET-FDG mucho más temprana, incluso tras el primer ciclo de quimioterapia, con ventajas al parecer significativas con respecto a la detección más tardía.
Los pacientes afectados de enfermedad de Hodgkin o linfomas no hodgkinianos con PET-FDG positiva postrasplante después de dosis altas de quimioterapia y de trasplante de células progenitoras tienen un peor pronóstico que los enfermos con PET negativa; la PET-FDG podría utilizarse como método para identificar los casos con riesgo alto de recaída.
La mayoría de los trabajos de reestadificación con PET-FDG en linfomas malignos se han realizado al finalizar el tratamiento (fig. 4). Estos estudios señalan que: a) los pacientes con PET positiva tienen un mayor riesgo de recaída y demandan tratamientos adicionales o modificación del inicial, así como un seguimiento clínico más estrecho, y b) la PET-FDG es más exacta que la TC a la hora de definir la remisión de la enfermedad y de predecir la supervivencia (libre de enfermedad, libre de recaída o de progresión o la supervivencia global de los pacientes). Así pues, un resultado positivo de la PET tras el tratamiento indica al clínico la persistencia de actividad tumoral y, por tanto, la mayor necesidad de tratamientos alternativos. Por el contrario, un resultado negativo orientaría a obviar otras maniobras terapéuticas pese a la existencia de masa residual no activa en los métodos convencionales de imagen35,51-53.
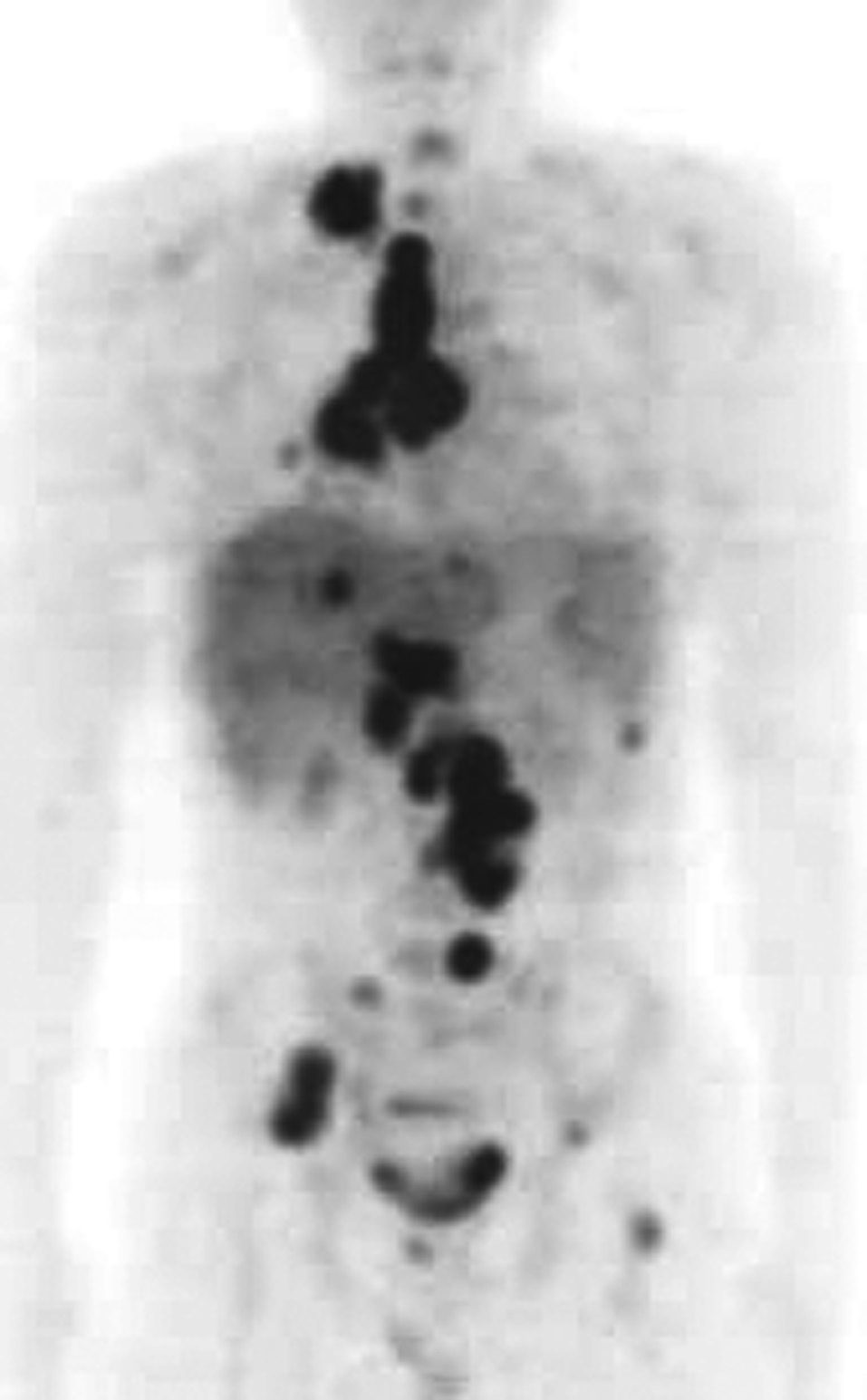
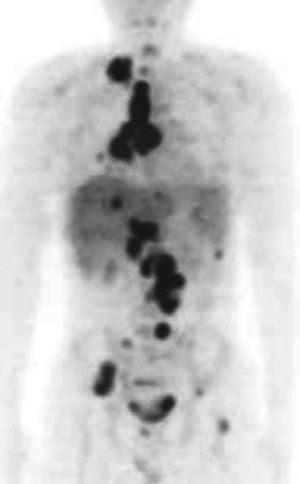
Fig. 4. Paciente de 26 años, con linfoma no hodgkiniano B, rico en células T (estadio III E + S), y dudosa afectación pulmonar inicial subcentimétrica en la tomografía computarizada (TC). Recibe poliquimioterapia y se constata un 50% de reducción con respecto a la masa inicial en la TC, sin lesiones adicionales. En la PET-FDG se aprecian grandes masas residuales intensamente hipermetabólicas en cadenas supraclavicular, paratraqueal e hiliar derecha, paraórticas bilaterales, hilio hepático e ilíaca derecha, así como acumulaciones extranodales (esqueleto, hígado y pulmones) y en el bazo indicativas de alto grado de malignidad.
Otra indicación bastante clara de la PET-FDG es la detección de tumor viable en pacientes con seminoma tratados con quimioterapia. Aunque el manejo óptimo de las masas residuales en enfermos con seminoma de tipo bulky es controvertido, la resección quirúrgica se realiza ahora en la mayoría de los centros si las masas residuales poseen un tamaño mayor de 3 cm (un 30-40% de riesgo de tumor residual). No obstante, las resecciones son técnicamente difíciles porque se asocian a una reacción desmoplásica y a una fibrosis considerable. Ya en el año 2001, De Santis et al54 publicaron muy buenos resultados en la valoración de la enfermedad residual mediante PET-FDG. La PET-FDG clasificó correctamente las 14 lesiones residuales mayores de 3 cm y 22 (96%) de las 23 lesiones menores o iguales a 3 cm, con un valor predictivo positivo del 100% (8/8) y negativo del 97% (28/29), superiores ambos a los datos obtenidos midiendo el tamaño residual de las masas ( < 3 cm o > 3 cm). Recientemente, estos investigadores han publicado un estudio multicéntrico de la PET-FDG como predictor de la presencia de tumor viable en el seminoma tratado con quimioterapia. En 51 pacientes (56 exámenes de PET-FDG), la especificidad, sensibilidad, valor predictivo positivo y valor predictivo negativo fueron del 100, el 80, el 100 y el 96%, frente al 74, el 70, el 37 y el 92%, respectivamente, para la TC. En sus conclusiones afirman que la PET-FDG es el mejor predictor de tumor viable residual en pacientes con seminoma tras la administración de quimioterapia55.
En pacientes con tumores de células germinales no seminomas disminuye de forma notoria la sensibilidad y el valor predictivo negativo de la PET-FDG en la valoración de la enfermedad residual, por lo que su aplicación en este tipo de tumores es más discutible56.
En la monitorización de la respuesta al tratamiento de tumores cerebrales, los métodos morfológicos convencionales muestran dificultades a la hora de valorar la enfermedad residual o la recidiva posquirúrgica. La PET-FDG cerebral presenta buenos resultados, pero la captación fisiológica cerebral de este radiotrazador hace que, siempre que sea asequible (centros diagnósticos con ciclotrón adyacente a la cámara PET dedicada), resulte más recomendable utilizar PET mediante 11C-metionina57.
Nueva tecnología: sistemas PET/TC
Encontrar la localización anatómica exacta de las hipercaptaciones identificadas en un estudio PET resulta en ocasiones complicado. Combinando el sistema PET con la TC se obtiene el registro metabólico y anatómico de las lesiones tumorales, todo ello en una misma exploración, con idéntica posición del paciente, y minimizando incluso los tiempos de adquisición.
La experiencia inicial de estos equipos ha demostrado un incremento del grado de exactitud en la interpretación del estudio combinado de PET/TC, comparado con lecturas separadas de ambas exploraciones, sobre todo para poder distinguir algunas lesiones de la captación fisiológica normal del radiotrazador y para precisar su localización.
Recientemente algunos estudios han señalado que el resultado de las exploraciones con PET/TC es superior a los de las cámaras PET convencionales y a los de la TC, sobre todo en la valoración T y N de los cánceres de pulmón no microcíticos y en los carcinomas de cabeza y cuello, con resultados prometedores en linfomas, melanomas, neoplasias gastrointestinales y en la planificación del tratamiento radioterápico de los cánceres de pulmón no microcíticos58-61.
Conclusiones
La utilización de la PET-FDG en la detección y en la valoración de las enfermedades neoplásicas supone la adición de una información molecular y bioquímica del tumor a la proporcionada habitualmente al especialista clínico por las técnicas de imagen morfológicas convencionales (TC y RM). Esta técnica metabólica posee una relación coste-eficacia demostrada en la estadificación, reestadificación y detección de la enfermedad residual en la mayoría de neoplasias captadoras de FDG (tumores de grados intermedio o elevado de malignidad), con peores resultados en los cánceres de bajo grado de malignidad o de lento crecimiento tumoral.
Las indicaciones más aceptadas de la PET-FDG en oncología incluyen: a) el diagnóstico diferencial de benignidad o malignidad de lesión conocida (nódulo pulmonar solitario y lesiones pancreáticas y hepáticas de origen incierto); b) la detección del tumor primario en neoplasias de origen desconocido; c) la estadificación del tumor (carcinoma de pulmón no microcítico, melanoma, cánceres de cabeza y cuello y neoplasias rectales avanzadas); d) la reestadificación (recurrencia de carcinomas colorrectales, melanoma, cáncer de cabeza y cuello, tumores primarios cerebrales, neoplasias tiroideas, cáncer de mama y de ovario), y e) el estudio de la enfermedad residual (en linfomas, enfermedad de Hodgkin, linfomas no hodgkinianos y seminomas).
La incorporación de una TC en los tomógrafos PET representa una mejoría importante en la información anatómica, al localizar con mayor exactitud las captaciones o acumulaciones patológicas del radiotrazador. Una alternativa totalmente válida, si no se dispone de esta nueva tecnología, es la obtención de imágenes de fusión PET-TC de tomógrafos diferentes.
En un futuro próximo, los nuevos equipos PET-TC podrían ser una de las principales herramientas para los especialistas clínicos, tanto en el diagnóstico como en el seguimiento y en la valoración terapéutica de la mayoría de las enfermedades neoplásicas.