El mieloma múltiple (MM) es una neoplasia hematológica resultante de la proliferación de células plasmáticas (CP) tumorales, que afecta anualmente a unos 2.250 pacientes en España1. El número de pacientes afectados puede ser mayor, especialmente en aquellas zonas con pirámide poblacional de edad elevada, ya que su frecuencia aumenta con la edad (mediana de 69 años)2. Es algo más frecuente en varones y en sujetos de raza negra y es la segunda neoplasia hematológica más frecuente (el 10% de todas ellas). Aunque es una enfermedad incurable, los últimos datos indican una notable mejoría en la supervivencia gracias a la introducción de nuevos tratamientos, como altas dosis de quimioterapia y nuevos fármacos.
La forma sintomática del MM se define por la presencia de una o varias alteraciones clínicas de las incluidas en la tétrada de hipercalcemia, alteraciones renales, anemia y lesiones óseas3. Dos de ellas, hipercalcemia y lesiones óseas, se relacionan directamente con la presencia de enfermedad ósea, que se produce en un 90% de los pacientes, como resultado de múltiples factores4,5. La destrucción ósea provoca complicaciones tales como dolor óseo, fracturas patológicas, requerimientos quirúrgicos o radioterapéuticos, compresión medular e hipercalcemia maligna5,6. Todo ello afecta negativamente tanto a la mortalidad como a la calidad de vida7, y es causante de importantes incrementos en el coste del tratamiento de estos pacientes8. Por esto, los bisfosfonatos (BF) se han convertido en parte del tratamiento estándar para reducir la morbilidad esquelética que causa el MM.
1Relevancia de la enfermedad ósea en el mieloma múltipleLa lesión ósea tiene un gran impacto en la morbimortalidad del mieloma. Así, el 80% de los pacientes con MM tiene lesiones óseas radiológicamente visibles. Más aún, según revisiones recientes, hasta el 90% de los pacientes presenta destrucción ósea9, cifra que llegaría al 100% si se emplearan técnicas de resonancia magnética (RM) o evaluación microscópica10. La presencia de estas lesiones provoca dolor y otras complicaciones relacionadas con el esqueleto (CRE), tanto al diagnóstico como durante la evolución. Hay poca información referente a la frecuencia de CRE al diagnóstico. En la experiencia del Grupo Español de Mieloma del Programa para el Estudio de la Terapéutica en Hemopatía Maligna (GEM/PETHEMA), estas complicaciones están presentes al diagnóstico en el 43% de los pacientes: fracturas vertebrales (21%), necesidad de radioterapia ósea (14%), fracturas patológicas no vertebrales (10%), hipercalcemia (8%), compresión espinal (8%) y necesidad de cirugía ósea (5%)11. La frecuencia acumulada de CRE asciende hasta el 60–70% durante la evolución de la enfermedad en pacientes sin tratamiento con BF12,13, y hasta el 30% si se administran pamidronato (PAM) o ácido zoledrónico (ZOL)14,15. Esta reducción podría ser incluso mayor, como así sucede en la experiencia del GEM, donde la frecuencia acumulada fue de un 10% en pacientes que recibieron trasplante autólogo de progenitores hematopoyéticos11.
Las complicaciones derivadas de la lesión ósea condicionan una peor evolución. Así, las fracturas patológicas implican aumento significativo del riesgo de muerte. Saad et al observaron que la mortalidad de los pacientes con alguna fractura patológica aumentaba con un riesgo relativo de 1,4416. En el trabajo de Sonmez et al, la mediana de supervivencia de los pacientes con fracturas fue de 18 meses frente a 57 en el grupo sin fracturas17.
La enfermedad ósea también afecta al coste y utilización de recursos. Según datos estadounidenses, las CRE suponen un aumento del coste de 9.480 dólares en cáncer de pulmón; de 13.940 dólares en cáncer de mama, y de 10.247 dólares en MM. Un estudio holandés estimó que el coste de las CRE supone un 17% del coste total del tratamiento del MM (~7.000euros)18. Por otro lado, el número de ingresos en pacientes con dolor supera al de los pacientes sin dolor (el 28 frente al 13%; p<0,05)19 y la aparición de una CRE supone hospitalizar al paciente en el 62% de los casos20. Además, la enfermedad ósea también tiene gran repercusión en la calidad de vida. No hay estudios extensos al respecto, pero sí se sabe que la ausencia de dolor óseo mejora notablemente la puntuación de los cuestionarios de calidad de vida como los Functional Assessment of Cancer Therapy (FACT) G y P19.
2DefinicionesDe todo lo anterior se deduce que la enfermedad ósea es un factor de gran relevancia en el MM, que puede condicionar tanto la evolución del paciente como la decisión del inicio y tipo de tratamiento. Por eso se precisan criterios muy estrictos para definir conceptos clave. Además, el tratamiento específico de la enfermedad ósea varía si el mieloma es sintomático o asintomático, por lo que se reproducirá aquí su definición exacta.
Enfermedad ósea: se define por la existencia de lesiones osteolíticas visibles en la radiología convencional o CRE. La detección de lesiones por otros medios de imagen o la alteración de los marcadores óseos son insuficientes por sí solas para definir la presencia de enfermedad ósea y se discutirán más adelante.
Complicaciones relacionadas con el esqueleto (CRE): vienen definidas por cualquiera de los siguientes episodios:12 1) fracturas patológicas, vertebrales o no vertebrales; 2) irradiación ósea; 3) cirugía ósea; 4) compresión de la médula espinal, y 5) hipercalcemia.
Hipercalcemia: se define por concentración sérica de calcio superior a la normalidad en 1mg/dl (0,25mmol/l) o una cifra superior o igual a 11,0mg/dl (2,75mmol/l). Aunque los primeros ensayos12 no clasificaron la hipercalcemia como una CRE, sino como una manifestación independiente, en la actualidad los principales ensayos la incluyen dentro de las CRE de referencia14,15.
MM sintomático: según los criterios del Grupo Internacional de Mieloma (IMG), junto con la presencia de componente M y las CP infiltrantes se requiere la presencia de algún signo de daño orgánico o tisular relacionado con el mieloma: 1) anemia (hemoglobina reducida en 2g/dl respecto al nivel normal o <10g/dl); 2) lesión renal (creatinina >2mg/dl); 3) hipercalcemia (calcio sérico superior a la normalidad en 1mg/dl o ≥11,0mg/dl); 4) lesiones líticas u osteoporosis con fracturas compresivas; 5) hiperviscosidad sintomática; 6) amiloidosis sintomática, y 7) infecciones bacterianas recurrentes (>2 episodios en 12 meses)3.
3Patogenia de la enfermedad ósea en el paciente con mieloma múltipleEl desarrollo de la lesión ósea en el MM se debe a un aumento de la función osteoclástica (resorción) junto con una reducción de la actividad osteoblástica (formación)4–6,21. La enfermedad no cursa con destrucción ósea neta en sus inicios, puesto que, aunque la formación de osteoclastos está incrementada en la vecindad de las células mielomatosas, ésta se ve compensada por un aumento de la formación de hueso, que da lugar a presencia de enfermedad sin lesiones4,5.
La actividad osteoclástica se ve potenciada por muchos estímulos originados por las CP tumorales, el estroma medular y los linfocitos T, entre los que figuran RANKL (receptor activator of nuclear factor kappa B ligand), MIP-1α (macrophage inflammatory peptide 1α), interleucina (IL) 3, IL-6 y SDF-1 (stromal-derived factor-1) (revisado en las referencias4,5). De ellos, el más relevante parece RANKL, cuya expresión está muy aumentada en mieloma, ya que las células tumorales estimulan la producción de RANKL en la estroma o lo producen directamente. Además, las CP bloquean la producción del inhibidor natural de RANKL, la osteoprotegerina (OPG), en osteoblastos y otras células, hecho que se correlaciona con enfermedad ósea avanzada, mieloma más activo y peor pronóstico. Esto posibilita el uso de OPG exógena para prevenir la enfermedad ósea. El incremento de la actividad osteoclástica determina un aumento de los productos de la degradación del colágeno tipo I y de enzimas específicas de osteoclastos4,5.
En casos con enfermedad ósea avanzada también hay defectos osteoblásticos. Hay alteración de la diferenciación e inducción de apoptosis en osteoblastos maduros, que al final se traduce en un descenso de la formación ósea. Esto se debe al aumento de moléculas secretadas por las CP, tales como dkk-1 (dickkopf-1)22 y sFRP-2 (secreted frizzled related protein 2)23, que actúan como antagonistas de Wnt (wingless-type), vía trascendental en los osteoblastos. Otros factores que influyen en estas alteraciones son IL-7 e IL-3, TGF-β (transforming growth factor), Fas-ligando y TRAIL (TNF-related apoptosis inducing ligand)4,5,
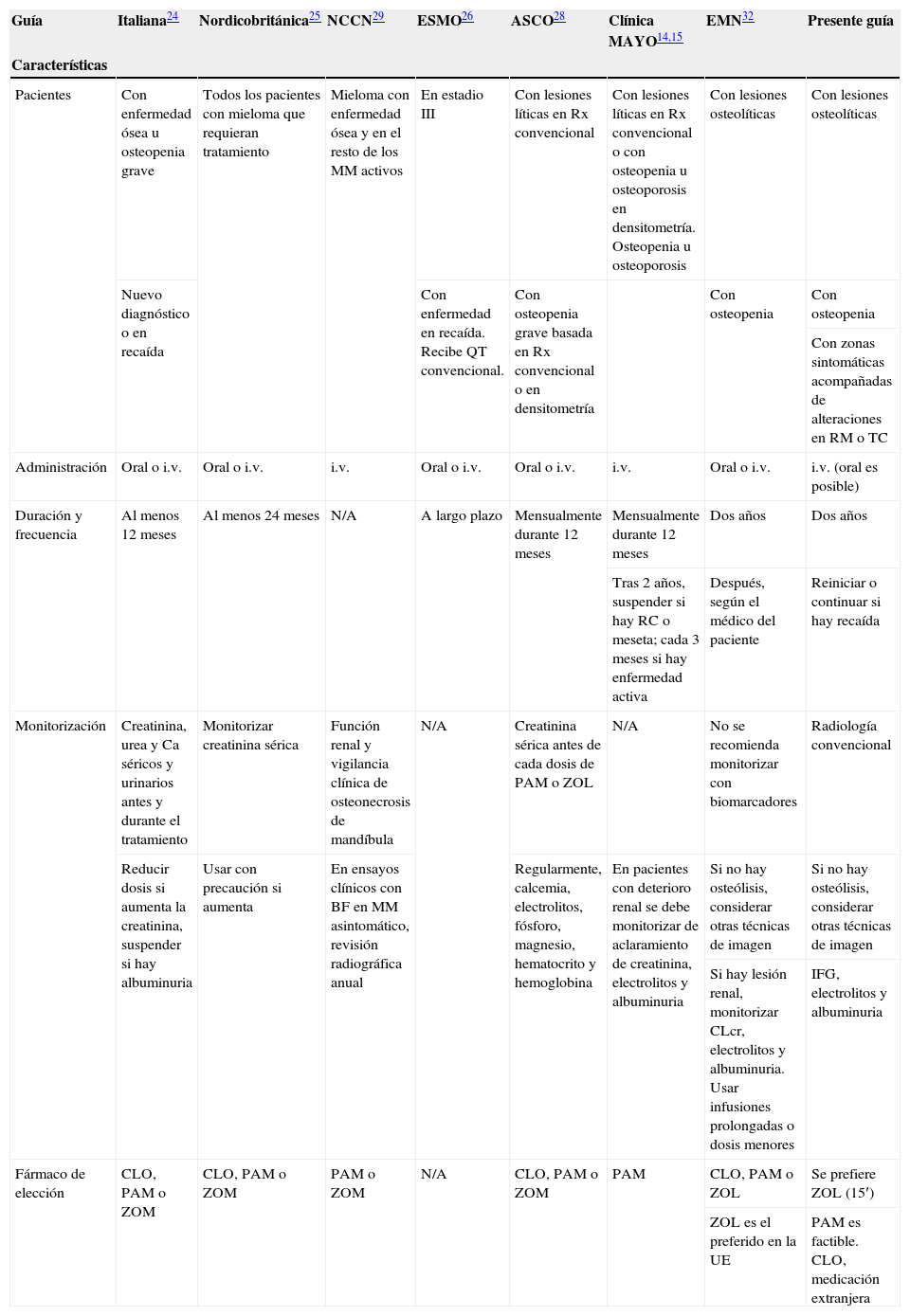
4Guías actuales para el uso de bisfosfonatos en mieloma múltipleEn la actualidad hay múltiples guías disponibles sobre el uso de BF en MM. La tabla 1 compara las principales e incluye los siguientes grupos: SIE (Italian Society of Hematology, y las 2 sociedades afiliadas, SIES & GITMO)24, UK Myeloma Forum (Nordic Myeloma Study Group and British Committee for Standards in Haematology)25, ESMO (European Society for Medical Oncology)26, Clínica Mayo27, ASCO (American Society of Clinical Oncology)28, NCCN (National Comprehensive Cancer Network)29, Grupo Internacional de Mieloma (International Myeloma Working Group [IMWG])30, Grupo Castellano Leonés para el Estudio de las Gammapatía Monoclonales31 y EMN (European Myeloma Network)32.
Principales guías para el uso de bisfosfonatos en mieloma múltiple
| Guía | Italiana24 | Nordicobritánica25 | NCCN29 | ESMO26 | ASCO28 | Clínica MAYO14,15 | EMN32 | Presente guía |
| Características | ||||||||
| Pacientes | Con enfermedad ósea u osteopenia grave | Todos los pacientes con mieloma que requieran tratamiento | Mieloma con enfermedad ósea y en el resto de los MM activos | En estadio III | Con lesiones líticas en Rx convencional | Con lesiones líticas en Rx convencional o con osteopenia u osteoporosis en densitometría. Osteopenia u osteoporosis | Con lesiones osteolíticas | Con lesiones osteolíticas |
| Nuevo diagnóstico o en recaída | Con enfermedad en recaída. Recibe QT convencional. | Con osteopenia grave basada en Rx convencional o en densitometría | Con osteopenia | Con osteopenia | ||||
| Con zonas sintomáticas acompañadas de alteraciones en RM o TC | ||||||||
| Administración | Oral o i.v. | Oral o i.v. | i.v. | Oral o i.v. | Oral o i.v. | i.v. | Oral o i.v. | i.v. (oral es posible) |
| Duración y frecuencia | Al menos 12 meses | Al menos 24 meses | N/A | A largo plazo | Mensualmente durante 12 meses | Mensualmente durante 12 meses | Dos años | Dos años |
| Tras 2 años, suspender si hay RC o meseta; cada 3 meses si hay enfermedad activa | Después, según el médico del paciente | Reiniciar o continuar si hay recaída | ||||||
| Monitorización | Creatinina, urea y Ca séricos y urinarios antes y durante el tratamiento | Monitorizar creatinina sérica | Función renal y vigilancia clínica de osteonecrosis de mandíbula | N/A | Creatinina sérica antes de cada dosis de PAM o ZOL | N/A | No se recomienda monitorizar con biomarcadores | Radiología convencional |
| Reducir dosis si aumenta la creatinina, suspender si hay albuminuria | Usar con precaución si aumenta | En ensayos clínicos con BF en MM asintomático, revisión radiográfica anual | Regularmente, calcemia, electrolitos, fósforo, magnesio, hematocrito y hemoglobina | En pacientes con deterioro renal se debe monitorizar de aclaramiento de creatinina, electrolitos y albuminuria | Si no hay osteólisis, considerar otras técnicas de imagen | Si no hay osteólisis, considerar otras técnicas de imagen | ||
| Si hay lesión renal, monitorizar CLcr, electrolitos y albuminuria. Usar infusiones prolongadas o dosis menores | IFG, electrolitos y albuminuria | |||||||
| Fármaco de elección | CLO, PAM o ZOM | CLO, PAM o ZOM | PAM o ZOM | N/A | CLO, PAM o ZOM | PAM | CLO, PAM o ZOL | Se prefiere ZOL (15′) |
| ZOL es el preferido en la UE | PAM es factible. CLO, medicación extranjera |
ASCO: American Society for Medical Oncology; BF: bisfosfonato; Ca: calcio; CLcr: aclaramiento de creatinina; CLO: clodronato; EMN: European Myeloma Network; ESMO: European Society for Medical Oncology; GEM/PETHEMA: Grupo Español de Mieloma/ Programa para el Estudio de la Terapéutica en Hemopatía Maligna; IFG: índice de filtración glomerular; i.v.: intravenoso; N/A: no aplicable; NCCN: Nacional Comprehensive Cancer Network; PAM: pamidronato; RC: respuesta completa. RM: resonancia magnética; Rx: radiología; TC: tomografía computarizada; UE: Unión Europea; ZOL: ácido zoledrónico.
En el presente trabajo se revisarán las guías y la literatura científica sobre uso de BF para tratar la enfermedad ósea del MM, con el objeto de proporcionar recomendaciones adaptadas a la realidad clínica española y bajo el consenso del Comité de Expertos del GEM/PETHEMA.
5Indicaciones de los bisfosfonatos en mieloma múltipleVarios estudios clínicos, incluyendo estudios bien controlados, doble ciego, aleatorizados frente a placebo o entre sí, han demostrado que los BF son beneficiosos en pacientes con MM que presentan lesiones osteolíticas y se hallan bajo tratamiento con quimioterapia12,13,15,33–41. También se ha demostrado, aunque con datos menos consistentes, que los pacientes con osteopenia grave pueden beneficiarse de los BF, aun en ausencia de lesiones osteolíticas33,36,42. Además, aunque no haya datos directos, también pueden estar indicados en la osteoporosis del MM, ya que su uso está plenamente aprobado en la osteoporosis de forma genérica43. A falta de estudios específicos, el panel recomienda emplear BF en casos de MM sintomático sin lesiones en la radiografía, pero con alteraciones óseas en la RM o en la tomografía computarizada (TC). Actualmente, los BF no han demostrado ventajas frente a placebo en discrasias de CP asintomáticas44–48, por lo que no se pueden recomendar en la gammapatía monoclonal de significado incierto (GMSI), plasmocitoma solitario y mieloma asintomático.
Recomendaciones: los BF están indicados en MM con lesiones osteolíticas, fracturas patológicas o hipercalcemia (nivel de evidencia A). Los BF están indicados en MM sintomático con osteopenia u osteoporosis grave (nivel de evidencia C). Se puede asociar tratamiento con BF en MM sintomático en ausencia de lesiones visibles en la radiología simple si hay zonas afectadas con alteraciones en la RM o TC (nivel de evidencia D). No se recomienda emplear BF en GMSI y mieloma asintomático (nivel de evidencia C).
6Elección del bisfosfonato según eficacia, control del dolor, cumplimiento terapéutico y vía de administración6.1Eficacia teórica: potencia in vitro y mecanismo de acciónLos BF son análogos sintéticos del pirofosfato inorgánico resistentes a la hidrólisis de las fosfatasas sanguíneas49. Su afinidad por el Ca++ los fija rápida y específicamente a los cristales hidroxiapatita y con ello al hueso, especialmente en zonas de alto recambio. Así, cuando el hueso se degrada, los BF se acumulan bajo el osteoclasto que se expone así a altas concentraciones50.
Dependiendo de su contenido en nitrógeno, hay 2 tipos principales de BF con efectos diferentes en su mecanismo de acción para prevenir la resorción ósea. Los primeros BF como etidronato (ETI) y clodronato (CLO) carecen de nitrógeno, se metabolizan en análogos del adenosín trifosfato con capacidad citotóxica, y provocan la muerte del osteoclasto. Los BF nitrogenados más modernos, como ibandronato (IBA), risedronato (RIS), PAM y ZOL tienen mayor potencia, ya que también inhiben la farnesil pirofosfato sintasa (FPPS)51. Esto bloquea la vía del mevalonato y con ello la formación de farnesil y geranil difosfato. Ambas moléculas participan en la prenilación, proceso postraducción que modifica las proteínas y permite su unión a la membrana mediante un anclaje hidrofóbico. Este proceso es crítico para muchas proteínas necesarias para el osteoclasto, tales como GTP-asas, Ras, Rac y Rho. La ausencia de estas proteínas conduce a apoptosis de los osteoclastos52.
Se ha demostrado que la potencia de los BF nitrogenados para inhibir la actividad de la FPPS se correlaciona bien con la potencia observada para inhibir la resorción ósea in vitro. Asimismo, la potencia in vivo de los BF se correlaciona también con la potencia in vitro. El orden, de mayor a menor potencia, es ZOL >minodronato >RIS >IBA >incadronato >alendronato (ALE) >PAM. Las diferencias de estructura influyen notablemente en la potencia. Así, el segundo átomo de nitrógeno parece ser el causante de la mayor potencia in vitro e in vivo de ZOL respecto a todos los demás BF4.
Recomendación: el BF que ha demostrado tener mayor potencia in vivo e in vitro es ZOL (nivel de evidencia A).
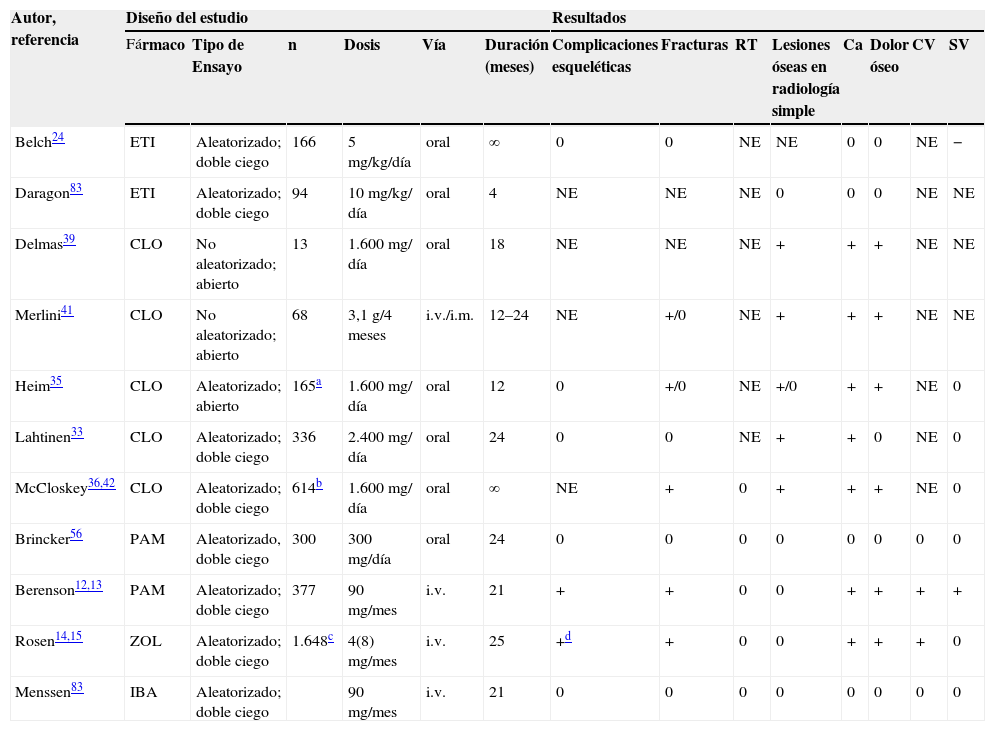
6.2Eficacia clínica realVarios estudios han demostrado que el tratamiento con BF es beneficioso en pacientes con MM13,15,33,36. La tabla 2 resume los principales ensayos clínicos llevados a cabo en MM.
Ensayos clínicos con bisfosfonatos como tratamiento de la lesión ósea del mieloma múltiple
| Autor, referencia | Diseño del estudio | Resultados | ||||||||||||
| Fármaco | Tipo de Ensayo | n | Dosis | Vía | Duración (meses) | Complicaciones esqueléticas | Fracturas | RT | Lesiones óseas en radiología simple | Ca | Dolor óseo | CV | SV | |
| Belch24 | ETI | Aleatorizado; doble ciego | 166 | 5mg/kg/día | oral | ∞ | 0 | 0 | NE | NE | 0 | 0 | NE | − |
| Daragon83 | ETI | Aleatorizado; doble ciego | 94 | 10mg/kg/ día | oral | 4 | NE | NE | NE | 0 | 0 | 0 | NE | NE |
| Delmas39 | CLO | No aleatorizado; abierto | 13 | 1.600mg/ día | oral | 18 | NE | NE | NE | + | + | + | NE | NE |
| Merlini41 | CLO | No aleatorizado; abierto | 68 | 3,1g/4 meses | i.v./i.m. | 12–24 | NE | +/0 | NE | + | + | + | NE | NE |
| Heim35 | CLO | Aleatorizado; abierto | 165a | 1.600mg/ día | oral | 12 | 0 | +/0 | NE | +/0 | + | + | NE | 0 |
| Lahtinen33 | CLO | Aleatorizado; doble ciego | 336 | 2.400mg/ día | oral | 24 | 0 | 0 | NE | + | + | 0 | NE | 0 |
| McCloskey36,42 | CLO | Aleatorizado; doble ciego | 614b | 1.600mg/ día | oral | ∞ | NE | + | 0 | + | + | + | NE | 0 |
| Brincker56 | PAM | Aleatorizado, doble ciego | 300 | 300mg/día | oral | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Berenson12,13 | PAM | Aleatorizado; doble ciego | 377 | 90mg/mes | i.v. | 21 | + | + | 0 | 0 | + | + | + | + |
| Rosen14,15 | ZOL | Aleatorizado; doble ciego | 1.648c | 4(8)mg/mes | i.v. | 25 | +d | + | 0 | 0 | + | + | + | 0 |
| Menssen83 | IBA | Aleatorizado; doble ciego | 90mg/mes | i.v. | 21 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
+/0: resultado mejor en el grupo de bisfosfonato respecto al placebo pero sin alcanzar diferencias estadísticamente significativas; +: mejor en el grupo tratado con bisfosfonato; ∞: indefinido; 0: resultado similar entre placebo y el bisfosfonato; -: mejor con placebo que con el bisfosfonato; BF: bisfosfonato; Ca: reducción de los niveles de calcio o de la aparición de hipercalcemia; CLO: clodronato; CV: calidad de vida; ETI: etidronato; IBA: ibandronato; i.m.: intramuscular; i.v.: intravenoso; NE: no evaluado; PAM: pamidronato; RT: necesidad de radioterapia ósea antiálgica; SV: supervivencia; ZOL: ácido zoledrónico.
Aproximadamente el 15% de los pacientes presenta hipercalcemia en el momento del diagnóstico y puede desarrollarse hasta en la mitad de ellos durante la evolución. Además de la hidratación, CLO, PAM y ZOL han demostrado su eficacia en el control de esta complicación. En el momento actual no hay dudas de que el BF más eficaz es el ZOL. En un estudio aleatorizado, una dosis única de ZOL corrigió la hipercalcemia en más del 88% de los pacientes, frente a un 70% en el caso de PAM53. PAM, IBA, ALE y CLO también son eficaces, pero las respuestas son menores, incluso en estudios aleatorizados4.
Recomendación: tanto CLO como PAM o ZOL han demostrado ser eficaces en la reducción de la hipercalcemia. ZOL controla esta complicación mejor que PAM y éste mejor que CLO (nivel de evidencia A).
6.2.2Prevención de complicaciones relacionadas con el esqueletoETI e IBA no han demostrado ser eficaces para mejorar el dolor óseo o prevenir CRE54,55. Sólo CLO, PAM y ZOL tienen indicación aprobada en Europa. En un estudio del grupo nórdico, CLO demostró ser capaz de reducir en un 50% la aparición de nuevas lesiones osteolíticas33. También disminuyó la incidencia de hipercalcemia, hipercalciuria y dolor óseo (el 24 frente al 12%; p = 0,026), sin impacto en la supervivencia global33,34. En el estudio británico, la administración de CLO se asoció a reducción en la tasa de fracturas al año del tratamiento (el 13,2 frente al 6,8%; p=0,04) y un retraso en la aparición de la primera factura no vertebral36. En este trabajo se observó una mayor supervivencia en el grupo de pacientes con fracturas al diagnóstico cuando se administraba CLO frente a placebo (59 frente a 37 meses; p=0,006)42. No hay datos de comparación directa entre CLO y otros BF.
En administración oral, PAM no parece reducir la aparición de CRE cuando se compara frente a placebo, probablemente debido a su mala absorción oral56. Por el contrario, en el estudio multinacional del Myeloma Aredia Study Group, PAM por vía intravenosa (i.v.) sí se asoció con un menor número de CRE (el 41 frente al 24%; p<0,001) y una prolongación del tiempo hasta la aparición de la primera CRE en comparación con placebo12,13. Respecto a supervivencia, no hubo diferencias significativas entre los grupos, pero sí se observó cierto beneficio en aquellos pacientes que habían recibido más de una línea terapéutica previa (14 frente a 21 meses; p=0,04). Además, también se observó que el control del dolor y los parámetros de calidad de vida mejoraron en el grupo de pacientes que recibieron PAM13.
Respecto a ZOL, se han llevado a cabo 2 estudios comparativos frente a PAM. En un ensayo fase II se comparó PAM en dosis de 90mg frente a ZOL en dosis de 4mg, y se demostró que ambos agentes reducían significativamente la aparición de CRE. Tras esto, el estudio fase III mostró que ambos tipos de BF reducían la morbilidad esquelética de forma semejante y que el tiempo hasta la primera CRE era similar en los 2 fármacos14. Con mayor seguimiento (25 meses), ZOL resultó un 16% más eficaz que PAM para reducir las CRE, aunque las diferencias sólo fueron significativas en las pacientes con cáncer de mama15.
Recomendación: la administración de BF es una parte integral del tratamiento de los pacientes con MM con lesiones osteolíticas (nivel de evidencia A) u osteoporosis (nivel de evidencia C).
6.2.3Control del dolorEl dolor óseo asociado a la presencia de lesiones osteolíticas es un síntoma muy común en la gran mayoría de los pacientes con MM, y repercute directamente en su calidad de vida. Aunque por un mecanismo no bien conocido, los BF han demostrado reducir el dolor óseo, mejorar la calidad de vida y disminuir la necesidad de consumo de analgésicos4,5. En el control del dolor, los analgésicos deben usarse de manera conjunta con los BF y seguir la escalada terapéutica recomendada por la Organización Mundial de la Salud (OMS). Otras alternativas útiles para controlar el dolor óseo en estos pacientes son la radioterapia y la vertebroplastia o la cifoplastia, especialmente en pacientes con dolor intratable secundario a compresión espinal por fracturas vertebrales múltiples.
Recomendación: ZOL (i.v.), PAM (i.v.) o CLO (por vía oral [p.o.]) son útiles en el control del dolor óseo asociado a la afectación ósea en pacientes con MM. La administración de BF debe acompañarse de tratamiento analgésico, de acuerdo con las recomendaciones de la OMS (nivel de evidencia B).
6.3Posible efecto antitumoralRecientemente se ha postulado que estos agentes pueden tener efecto antitumoral y prevenir el desarrollo de metástasis esqueléticas. Datos preclínicos indican que los BF tienen actividad antitumoral mediante varios mecanismos, entre los que figura la inhibición de la angiogénesis y de la proliferación celular57. Por otro lado, hay algunas evidencias en pacientes con MM que muestran esta actividad, que no obstante contrastan con otros estudios con resultados negativos4,5. Por eso, no hay datos concluyentes que permitan confirmar o negar la eficacia antitumoral de los BF.
Recomendación: actualmente no se dispone de suficientes datos concluyentes sobre la eficacia antitumoral de los BF.
6.4Vía de administraciónLa administración oral de CLO es una opción en aquellos pacientes que no puedan o no quieran tener un cuidado hospitalario directo, pero su eficacia depende de un cumplimiento terapéutico adecuado, que con frecuencia falla. Además, los BF orales requieren cumplir escrupulosamente algunas precauciones para evitar efectos gastrointestinales adversos. La utilización oral de PAM es ineficaz56. La administración i.v. de BF (PAM o ZOL) se lleva a cabo con hospitalización ambulatoria, lo que asegura el cumplimiento y la monitorización. En los pacientes que no pueden ir al hospital cabe la posibilidad de administrar ZOL por vía i.v. en régimen i.v. domiciliario.
Recomendación: se recomienda la vía de administración i.v. de PAM o ZOL por el mayor grado de adherencia, y es preferible la utilización de este último, dado su menor tiempo de infusión. Se administrará CLO por vía oral en los casos en los que se requiera administración de un BF oral. En estos casos se procurará instruir al paciente para facilitar el cumplimiento y la adherencia al tratamiento99,118.
7Inicio, pauta y duración del tratamiento con bisfosfonatos7.1Inicio del tratamientoNo hay estudios que hayan abordado la pregunta sobre cuándo hay que empezar tratamiento con BF en pacientes con MM. El grupo de expertos acordó que tras la indicación no hay justificación real para demorar el inicio del tratamiento. No obstante, la necesidad de prevenir la osteonecrosis de mandíbula ha hecho que se acepten retrasos en el inicio del tratamiento para permitir que un especialista en enfermedad dental efectúe una revisión de la cavidad bucal y, si fuera necesario, resolver los problemas susceptibles de necesitar actos quirúrgicos en el futuro58.
Recomendación: una vez establecida la indicación, conviene iniciar la administración de los BF en las primeras etapas del tratamiento general del MM (nivel de evidencia D).
7.2DosificaciónLas dosis de CLO p.o. son de 400–600mg/6h33,36. Otras dosificaciones no han mostrado mejores resultados35,39,41. PAM i.v. se administra en dosis de 90mg en infusión i.v. de al menos 2h cada 4 semanas13, aunque hay algunas evidencias para usar dosis de 60mg. ZOL es eficaz en dosis de 4mg en infusión de 15min cada 4 semanas14,37. Aunque dosis menores (2mg) han mostrado cierta eficacia, ésta parece ser menor37, mientras que dosis mayores son tóxicas14,37.
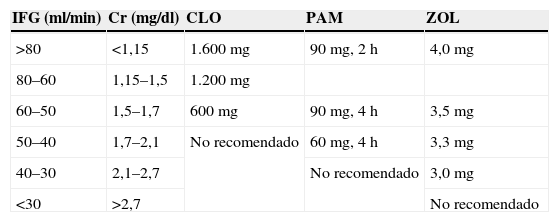
Como norma general, para reducir el riesgo de toxicidad renal, no se debe incrementar la dosis de BF, ni reducir el tiempo de infusión ni acortar el intervalo entre dosis28. Aunque la toxicidad renal es poco frecuente, obliga a ajustar las dosis o prolongar los tiempos de infusión, como se indica en el apartado 8.2.1 de esta guía. En cualquier caso, la tabla 3 resume los cambios aceptados por la mayoría de las guías y fichas técnicas de los productos.
Ajuste de dosis de bisfosfonatos según la función renal
| IFG (ml/min) | Cr (mg/dl) | CLO | PAM | ZOL |
| >80 | <1,15 | 1.600mg | 90mg, 2h | 4,0mg |
| 80–60 | 1,15–1,5 | 1.200mg | ||
| 60–50 | 1,5–1,7 | 600mg | 90mg, 4h | 3,5mg |
| 50–40 | 1,7–2,1 | No recomendado | 60mg, 4h | 3,3mg |
| 40–30 | 2,1–2,7 | No recomendado | 3,0mg | |
| <30 | >2,7 | No recomendado |
CLO: clodronato; Cr: creatinina; IFG: índice de filtración glomerular; PAM: pamidronato; ZOL: ácido zoledrónico.
Recomendación: la dosis de BF debe ajustarse según el grado de función renal (nivel de evidencia C).
7.3Pauta de tratamientoSe recomienda la administración i.v. de PAM y ZOL cada 4 semanas14, aunque hay datos que avalan su empleo cada 314 o cada 5 semanas59. Se han propuesto pautas alternativas, como la administración trimestral, que podría reducir la toxicidad, pero todavía no se dispone de suficientes datos para recomendar pautas diferentes a la convencional, cada 3–5 semanas. CLO sólo se usa en MM en dosis oral diaria33,36; la dosis i.v. intermitente ha caído en desuso.
Recomendación: PAM y ZOL se deben administrar por vía i.v., una infusión cada 4±1 semanas, y CLO por vía oral en 4 tomas diarias (nivel de evidencia A).
7.4Duración del tratamientoAún no se ha establecido la duración exacta del tratamiento. En ensayos clínicos, la duración de los tratamientos con BF i.v. ha oscilado cerca de los 9 meses12, con extensión a 2113 y 24 meses14. Por esto, la mayoría de los grupos acepta que el tiempo más adecuado se sitúa en torno a los 2 años. Aun así, algunos recomiendan usarlo indefinidamente, otros mensualmente durante 2 años y luego trimestralmente hasta la progresión, y otros durante 2 años y luego a juicio de cada médico. No obstante, estas estrategias carecen de suficiente respaldo científico. Hay un estudio que demostró que los pacientes que alcanzan respuesta completa tras trasplante no se benefician del tratamiento con PAM superior a 12 meses60.
Finalmente, en los ensayos se incluyeron tanto pacientes con MM al diagnóstico como en recaída13,15, sin que se observasen diferencias en el beneficio del tratamiento con BF. Por eso, hay acuerdo general en que el tratamiento debe reiniciarse si, tras haberse suspendido el tratamiento con BF, se observa una progresión del MM con enfermedad ósea activa.
Recomendación: la duración del tratamiento con BF en pacientes con MM debe ser de 2 años (nivel de evidencia C). Está indicado reiniciar el tratamiento en el caso de que un paciente que ya no estaba recibiendo BF progrese y tenga enfermedad ósea (nivel de evidencia D).
7.5Monitorización del tratamientoAunque los BF tienen buena tolerancia, pueden provocar algunos efectos secundarios relevantes. Por esto, debe hacerse un seguimiento clínico mensual con evaluación de síntomas (véase más adelante) y estudios biológicos en suero (electrolitos, calcemia incluida y creatinina), así como determinación de albuminuria cada 3 meses61.
La mayoría de los marcadores de resorción ósea (productos de degradación del colágeno tipo I, como puentes de piridinolina, telopéptidos N- o C-término [NTX, ICTP] e isoenzima 5b de la fosfatasa resistente al ácido tartrato) están aumentados en pacientes con MM y enfermedad ósea4,5 y se correlacionan con el riesgo de CRE, progresión o supervivencia62–64. Estos marcadores se reducen tras tratamiento con BF65, con algunas diferencias según el fármaco usado. Así, ZOL reduce los valores de NTX con mayor eficacia que PAM15. Se ha indicado que estos análisis pueden utilizarse en la detección precoz de lesiones óseas y progresión de la enfermedad4,5. Respecto a marcadores de formación ósea hay menos datos, pero una fosfatasa alcalina de origen óseo elevada se correlacionaría con mayor beneficio en pacientes tratados con ZOL66.
Todos estos marcadores podrían llegar a usarse como ayuda tanto en el diagnóstico como en la monitorización de la enfermedad ósea del MM, pero los datos aún son insuficientes, e incluso en algunos casos contrapuestos, por lo que no se puede recomendar su uso fuera de ensayos clínicos.
La monitorización con técnicas de imagen no es imprescindible para evaluar la evolución de la enfermedad ósea con BF, pese a que son necesarias para evaluar tanto la extensión como la progresión de la enfermedad. Con la radiografía simple se encuentran lesiones líticas en el 80–90% de los pacientes9, cuya presencia implica la pérdida de al menos un 30% del hueso trabecular67. Esto implica una baja sensibilidad que puede conducir a infradiagnosticar la osteopenia. Este problema podría resolverse con densitometría ósea, que además tiene algún valor añadido. Una densidad ósea espinal reducida se correlaciona con riesgo de fracturas65, y el empleo de BF durante 6–12 meses puede mejorar los valores un 5–10%68. Aún así, todavía no hay base suficiente para recomendar la densitometría ósea como parámetro de indicación de los BF. Otras técnicas más sensibles incluyen la RM y la tomografía por emisión de positrones (PET) sola o combinada con TC (PET-TC). La sensibilidad comparada entre PET-TC, PET, RM, TC y radiología convencional es del 89, el 86, el 83, el 70 y el 47%, respectivamente69. La RM tiene gran relevancia en casos con radiología normal y alta sospecha de enfermedad ósea, pero tiene limitaciones técnicas aún en fase de resolución. La PET-TC tiene como inconvenientes su elevado precio, alta irradiación y escasa disponibilidad.
A la hora de recomendar las indicaciones de las pruebas de imagen adicionales, el panel se adhiere al consenso elaborado por el grupo internacional de mieloma70, donde aún se les asigna un papel relativamente marginal para monitorizar el tratamiento con BF en pacientes con MM.
Recomendaciones: los pacientes que reciben tratamiento con BF deben seguirse clínicamente y con determinaciones del nivel de creatinina y electrolitos en suero y de albúmina en orina (nivel de evidencia B). El uso de biomarcadores en el diagnóstico y la monitorización del MM sólo se recomiendan dentro de ensayos clínicos (nivel de evidencia B). La radiología simple convencional con seriada ósea sigue siendo el método estándar para evaluar la enfermedad ósea (nivel de evidencia C). La RM puede ser de utilidad, en especial cuando hay sospecha de complicaciones óseas en ausencia de lesiones osteolíticas (nivel de evidencia D).
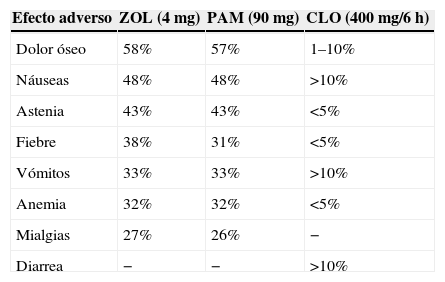
8Seguridad y efectos adversos8.1Efectos secundarios poco relevantesEl tratamiento con BF es en general bien tolerado y aunque los efectos adversos son muy variados, suelen ser poco relevantes y no suponen una contraindicación (tabla 4)15,42,71,72.
Efectos adversos más frecuentes asociados al tratamiento con bisfosfonatos
| Efecto adverso | ZOL (4mg) | PAM (90mg) | CLO (400mg/6h) |
| Dolor óseo | 58% | 57% | 1–10% |
| Náuseas | 48% | 48% | >10% |
| Astenia | 43% | 43% | <5% |
| Fiebre | 38% | 31% | <5% |
| Vómitos | 33% | 33% | >10% |
| Anemia | 32% | 32% | <5% |
| Mialgias | 27% | 26% | − |
| Diarrea | − | − | >10% |
CLO: clodronato; PAM: pamidronato; ZOL: ácido zoledrónico.
Los BF orales se absorben mal en el tracto gastrointestinal, por lo que necesitan dosis elevadas. Para aumentar su absorción se recomienda administrarlos con el estómago vacío, sólo con agua y seguir en ayunas durante al menos una hora73. Los principales problemas son náuseas, vómitos, diarrea y dolor abdominal. Raramente se han descrito esofagitis y ulceraciones, por lo que se recomienda evitar el decúbito tras la ingesta. Esto provoca que el cumplimiento terapéutico sea escaso y que los BF orales se utilicen poco en la práctica clínica32. Con los BF i.v. también puede haber náuseas, vómitos y diarrea, pero en general de poca entidad y sólo tras las primeras dosis15.
8.1.2Reacciones agudasLa administración de BF i.v. es bien tolerada. Pueden presentarse reacciones locales en el lugar de punción, como dolor, inflamación y flebitis. La tercera parte de los pacientes pueden presentar reacciones agudas postinfusionales en forma de cuadros seudogripales, con fiebre, escalofríos, artromialgias y dolores óseos. Este cuadro suele presentarse tras la primera infusión y suele ser autolimitado, sin contraindicar la continuación del tratamiento15,32.
8.1.3HipocalcemiaLas alteraciones hidroelectrolíticas (hipocalcemia, hipofosfatemia, hipomagnesemia) son relativamente frecuentes y en la mayor parte de los casos, asintomáticas. Ocasionalmente se han descrito casos de hipocalcemia grave, en general cuando se asocian a hipomagnesemia o hipoparatiroidismo. Se aconseja la administración de suplementos de calcio y vitamina D para evitar ascensos bruscos de la paratohormona (PTH) que supondrían un estímulo exacerbado de la resorción32.
8.2Alteraciones renales8.2.1Aumento de creatininaLa administración de PAM y ZOL se ha asociado a la aparición de insuficiencia renal, particularmente en pacientes con deterioro previo de la función renal. En estudios aleatorizados no se han visto diferencias significativas entre PAM y ZOL, con incidencia del 9–15% con ambos fármacos15,28,72. El grado de insuficiencia suele ser leve-moderada, aunque algunos casos han llegado a requerir diálisis. Se ha visto por biopsia renal que el daño producido por el ZOL se debe a necrosis tubular aguda, sin daños glomerulares74. Por el contrario, los pacientes tratados con PAM muestran un patrón de afectación glomerular de especial mal pronóstico.
Los BF no se metabolizan y se eliminan inalterados por el riñón, por lo que administrar dosis elevadas o acortar el tiempo de infusión puede aumentar la concentración de BF en sangre y, con ello, el riesgo de insuficiencia renal75. Así, el tiempo de infusión y la dosis de BF se deben ajustar según la función renal. En la ficha técnica de ZOL y de PAM se especifican los ajustes de dosis en función del aclaramiento de creatinina. Como norma general, en pacientes con creatinina entre 1,5 y 3mg/dl (filtrado glomerular entre 30–60ml/min) se recomienda disminuir la dosis de ZOL a 3mg y de PAM a 60mg. El uso de BF está contraindicado en casos de insuficiencia renal grave (aclaramiento de creatinina<30ml/min)28, excepto en caso de insuficiencia renal inducida por hipercalcemia, en cuyo caso se considera que el beneficio supera el riesgo. Además de reducir la dosis, se aconseja prolongar el tiempo de infusión (ZOL en 30–60 min y PAM en 4h).
Se recomienda monitorizar la función renal antes de cada dosis de BF28,32. El tratamiento se debe interrumpir si se detecta un aumento de la creatinina ≥0,5mg/dl o >2 veces el valor basal para los pacientes con creatinina basal normal, o un aumento de ≥1mg/dl o >2 veces el valor basal para los pacientes con creatinina basal anormal. La administración de BF no deberá reanudarse hasta que la creatinina disminuya por debajo del 10% del valor basal28,32.
El CLO oral también debe ajustarse en caso de insuficiencia renal. Su ficha técnica lo contraindica en pacientes con insuficiencia renal grave.
8.2.2AlbuminuriaAdemás de producir insuficiencia renal por una necrosis tubular aguda, PAM se ha relacionado con la aparición de síndrome nefrótico debido a una glomeruloesclerosis focal segmentaria colapsante que puede acabar provocando una insuficiencia renal terminal61. El diagnóstico precoz es fundamental, por lo que además de monitorizar la función renal y los electrolitos, debe monitorizarse periódicamente la albuminuria mediante la determinación de la proteinuria de 24h y el uroproteinograma. La aparición de una albuminuria inexplicada (>500mg/24h) debe alertar al clínico, quien debe suspender el tratamiento con BF. Se debe reevaluar al paciente cada 3–4 semanas hasta la desaparición de la albuminuria. En el caso de reiniciar el tratamiento con BF, los expertos recomiendan prolongar el tiempo de infusión de PAM (≥4h) y no exceder la dosis de 90mg cada 4 semanas. Las guías clínicas no establecen cómo debe reiniciarse ZOL, pero algunos expertos recomiendan prolongar el tiempo de infusión (≥30min)28,32.
Recomendaciones: los BF orales tienen una elevada toxicidad gastrointestinal y deben tomarse de la manera adecuada para prevenirla (nivel de evidencia A). Los BF i.v. producen con relativa frecuencia reacciones agudas en forma de cuadros seudogripales, especialmente tras la primera infusión, que no contraindican la continuación del tratamiento (nivel de evidencia B). Se deben monitorizar periódicamente los electrolitos, la creatinina y la albuminuria (nivel de evidencia B). Se deben administrar suplementos de calcio y vitamina D para prevenir la hipocalcemia (nivel de evidencia B). Es conveniente ajustar la dosis de BF en función del aclaramiento de creatinina (nivel de evidencia B). Se debe interrumpir el tratamiento si aparece deterioro de la función renal o albuminuria (nivel de evidencia B). Se desaconseja el uso de BF en la insuficiencia renal grave, excepto cuando ésta es debida a hipercalcemia de origen tumoral (nivel de evidencia B).
8.3Osteonecrosis de mandíbulaLa osteonecrosis de la mandíbula (ONM) es una complicación poco frecuente pero grave de la administración de BF en pacientes con MM. Se define como presencia de una o varias lesiones ulceradas en la mucosa de los procesos alveolares, con exposición de hueso maxilar o mandibular de aspecto necrótico con ausencia de cicatrización durante al menos 8 semanas76. Puede desarrollarse de manera espontánea, pero suele aparecer tras una extracción dental u otro procedimiento dental invasivo. La causa exacta de la ONM se desconoce pero probablemente sea multifactorial58. El tipo de BF utilizado, la duración del tratamiento y la presencia de otros factores de riesgo, como la quimioterapia, la radioterapia y los corticoides, parecen ser importantes. Aunque no hay estudios comparativos directos, ZOL se ha asociado a un riesgo más elevado de ONM que PAM en algunos estudios77,78, con una incidencia del 6–13% con ZOL frente al 4–6% con PAM (p<0,01). La incidencia está relacionada con la duración del tratamiento, ya que el riesgo de ONM se incrementa con el tiempo de exposición al fármaco77–79, que es del 1% a los 12 meses, del 6% a los 36 meses y del 11–13% a los 48 meses. En el estudio GEM 2000, que recomendaba el empleo de BF hasta los 2 años, la frecuencia fue del 4,9% para ZOL, del 2,9 para PAM y del 5,0% para PAM seguido de ZOL (sometido a publicación).
Varios grupos han dado recomendaciones sobre ONM relacionada con BF, incluyendo el grupo español80. Todas las guías coinciden en afirmar que la mejor fórmula para controlar esta complicación es prevenirla. Estudios recientes han mostrado que una evaluación dental adecuada y una restricción en los procedimientos dentales invasivos durante el tratamiento con BF reducen la incidencia de ONM81,82, hasta llegar a cifras casi equivalentes a cero.
El tratamiento de las lesiones ya establecidas debe ser conservador y se recomienda suprimir el BF mientras exista la lesión. No se debería reiniciar el BF en tanto no se compruebe la cicatrización completa de la lesión, ya que esto reduce el riesgo de recidiva o curación parcial. En cualquier caso, dada la asociación entre recurrencia y reinicio del BF, en casos que han desarrollado ONM se recomienda tratamiento con BF sólo si el balance riesgo-beneficio es claramente favorable.
Recomendaciones: debe examinarse y educarse a los pacientes respecto a su higiene dental (nivel de evidencia C.) Si hay afecciones dentales de alto riesgo, deberán resolverse antes de empezar el tratamiento con BF (nivel de evidencia C). Tras empezar el tratamiento, se evitarán procedimientos dentales invasivos innecesarios y se monitorizará el estado bucodental anualmente (nivel de evidencia D). El hematólogo y el especialista bucodental deben seguir el estado de la salud bucodental del paciente (nivel de evidencia D). Los procedimientos dentales inevitables deberán afrontarse de forma conservadora (nivel de evidencia C). La suspensión temporal de los BF debería considerarse 2–3 meses antes de algún procedimiento invasivo (nivel de evidencia D) y mantenerse hasta la completa cicatrización de la herida. El tratamiento inicial de la ONM debería incluir la suspensión del BF hasta que se produzca una cicatrización completa (nivel de evidencia C). La decisión de reiniciar BF debería individualizarse (nivel de evidencia D). El médico debe sopesar las ventajas e inconvenientes de la administración de tratamiento con BF en todos los pacientes, especialmente en el caso de enfermedad en recaída o refractaria (nivel de evidencia D).
9Proceso del consensoNiveles de evidencia para las recomendaciones: se siguieron los niveles considerados por las normas de medicina basada en la evidencia, y se usaron los mismos que se emplearon en la guía de la Red Europea de Mieloma32. También se consideró la experiencia de los autores y la realidad sanitaria española. Todas las recomendaciones se basan en el consenso de la opinión de los expertos y en los resultados de ensayos terapéuticos, estudios observacionales y casos clínicos.
El desarrollo de esta guía ha sido posible gracias al soporte de Novartis Oncology España. Tras varias rondas de comunicación, el grupo tuvo una reunión en Madrid el 19 de mayo de 2009, en la que se discutieron a fondo todos los aspectos que figuran en el presente manuscrito. El Dr. García-Sanz preparó el primer borrador del manuscrito y todos los autores lo revisaron cuidadosamente. Después se envió a los miembros de la mesa del GEM/PETHEMA para que éste pudiera asumirlo, después de varias revisiones en las que todos los autores pudieron incluir diversas consideraciones sin afectar al contenido básico del consenso mayoritario.
Para establecer los grados de evidencia se utilizaron los mismos niveles establecidos en el documento de consenso del grupo europeo de mieloma.
9.1Tipo de evidencia- •
Nivel I: evidencia obtenida del metaanálisis de múltiples estudios controlados bien diseñados. Ensayos aleatorizados con bajo riesgo de falsos positivos o negativos (alto poder).
- •
Nivel II: evidencia obtenida de al menos un estudio experimental bien diseñado. Ensayos aleatorizados con alto riesgo de falsos positivos o negativos (bajo poder).
- •
Nivel III: evidencia obtenida de estudios cuasi experimentales bien diseñados, tales como estudios no aleatorizados, controlados de grupo único, pre-post, de cohortes, de tiempo, o series pareadas de casos y controles.
- •
Nivel IV: evidencia de estudios bien diseñados pero non experimentales, tales como comparaciones y descripciones correlativas de casos.
- •
Nivel V: evidencia derivada de casos simples y ejemplos clínicos.
- •
Grado A: hay evidencias de tipo I o hallazgos consistentes en múltiples estudios de tipo II, III, o IV.
- •
Grado B: hay evidencias de tipo II, III, o IV y los hallazgos son generalmente consistentes.
- •
Grado C: hay evidencias de tipo II, III, o IV, pero algunos hallazgos son inconsistentes.
- •
Grado D: hay escasas evidencias empíricas, o ninguna, y la recomendación se basa en el panel de consenso.
RGS: participación en reuniones de consejo científico a Novartis y en publicaciones promovidas por Novartis.
AA: participación en reuniones de consejo científico a Novartis.
FJC: participación en reuniones de consejo científico a Novartis.
JMH: participación en reuniones de consejo científico a Novartis.
LR: participación en reuniones de consejo científico a Novartis.
JR: participación en reuniones de consejo científico a Novartis.
AS: participación en reuniones de consejo científico a Novartis.
Contribuciones de los autores: este manuscrito refleja la opinión de consenso de los autores, bajo la coordinación del Dr. García-Sanz, tomando como referencia inicial el Consenso de la Red Europea de Mieloma sobre el Tratamiento con Bisfosfonatos en Mieloma Múltiple. El consenso cuenta con el apoyo del grupo español de mieloma GEM/PETHEMA.