El carcinoma hepatocelular (CHC) es la principal causa de muerte en pacientes con cirrosis, y su situación actual en España no es bien conocida. Por esto, se ha creado un registro nacional para evaluar las características de los pacientes con CHC de novo.
Pacientes y métodoEntre el 1 de octubre de 2008 y el 31 de enero de 2009, 62 centros de referencia registraron las características demográficas, clínicas y tumorales, la primera opción de tratamiento y la elegibilidad para el trasplante ortotópico hepático (TOH) de los CHC diagnosticados en este tiempo.
ResultadosSe contabilizaron 705 casos nuevos de CHC, un 78% en varones; la edad media era de 65 años y un 89% eran cirróticos (el 58% con Child-Pugh clase A, el 42% estaban infectados por el virus de la hepatitis C, el 30% consumía alcohol). Solo 334 casos (47%) se diagnosticaron mediante cribado. El tamaño del nódulo principal y el estadio Barcelona Clinic Liver Cancer fueron significativamente menores en el grupo de cribado que en el resto (p<0,001). La aplicabilidad de los tratamientos radicales (resección y ablación percutánea) fue significativamente mayor (el 47,5 frente al 24,6%; p<0,001), así como la evaluación para el TOH (el 31 frente al 12%; p<0,001). El cribado no fue diferente en función del sexo (p=0,204) ni de la edad (≤50 años; <65; <75 y >75 años) (p=0,171). La quimioembolización fue el tratamiento más indicado: en tumores iniciales (46,4%), en tumores mayores de 5cm (15,7%), en multifocales (37,9%) y como puente al TOH (33%).
ConclusiónLa mayoría de los CHC en España se diagnostican fuera de los programas de detección precoz y esto limita la posibilidad de aplicación de tratamientos con intención curativa.
Hepatocellular carcinoma (HCC) is the leading cause of death in patients with cirrhosis and its current situation in Spain is not well known. Therefore, a national registry was created to assess the characteristics of patients with de novo HCC.
Patients and methodBetween 1/10/2008 and 31/1/2009, 62 centers reported the baseline demographic, clinical and tumor characteristics, the first choice of treatment and eligibility for transplantation (OLT) of HCC diagnosed during this time.
ResultsThere were 705 new cases of HCC, 78% men, mean age 65 years, 89% cirrhosis (58% Child-Pugh class A, 42% HCV, 30% alcohol). Only 334 cases (47%) were diagnosed by screening. The size of the main nodule and BCLC stage were significantly lower in the screening group than in the rest (p<0.001). The applicability of radical therapies (resection and percutaneous ablation) was significantly higher (47.5% versus 24.6%, p<0.001) as well as the evaluation for OLT (31% versus 12%, p<0.001). The screening did not differ according to gender (p=0.204) or age (<50 years, <65, <75, >75 years) (p=0.171). Chemoembolization was the most common treatment: initial tumors (46.4%), tumors >5cm (15.7%), multifocal HCC (37.9%) and as a bridge to OLT (33%).
ConclusionThe majority of HCC patients are diagnosed in Spain out of early detection programs, and this limits the chance for early diagnosis and effective therapy.
El carcinoma hepatocelular (CHC) es la sexta neoplasia más frecuente a nivel mundial y la tercera en cuanto a muertes relacionadas con el cáncer1. La causa más habitual es la infección crónica por el virus de la hepatitis B2, si bien en los países occidentales predomina la infección por el virus de la hepatitis C (VHC) y el consumo de alcohol. El CHC asienta fundamentalmente en pacientes con cirrosis, y constituye la principal causa de muerte más allá de las hemorragias o las infecciones3. Se diagnostican unos 500.000 casos de CHC al año y la mortalidad por CHC también es de 500.000 casos anuales, es decir, la mediana de supervivencia desde el diagnóstico es de 12 meses4. Sin embargo, con un diagnóstico precoz que permita la aplicación de un tratamiento curativo en estadios iniciales, la tasa de supervivencia del CHC puede alcanzar el 70% a los 5 años5. Se estima que la incidencia seguirá aumentando las próximas décadas, debido sobre todo a la expansión de la infección por el VHC y al aumento de la obesidad6.
Dada la frecuencia cada vez mayor de CHC y dado que existe una técnica de cribado aceptable y eficaz, la población de riesgo (fundamentalmente los pacientes con cirrosis) debe incluirse en programas de vigilancia periódica mediante ecografía abdominal semestral7,8. A pesar de los resultados de diversos estudios que muestran el beneficio de los programas de cribado en la supervivencia9,10, esta herramienta no está plenamente establecida y todavía un alto número de pacientes se diagnostica en estadio avanzado y sintomático.
El estado actual del CHC en España no es bien conocido. Los datos que aportan los registros de mortalidad y los registros globales de cáncer son fragmentados y escasos. Por esto, se ha propuesto elaborar un registro nacional de CHC de novo para conocer el estado actual de la enfermedad. El objetivo de este estudio es conocer el estado actual del CHC y averiguar las características clínicas y tumorales de los pacientes con CHC recientemente diagnosticados en España.
Pacientes y métodoDesde el 1 de octubre de 2008 hasta el 31 de enero de 2009 se han recogido de forma prospectiva las características demográficas, clínicas, analíticas y tumorales de los pacientes con CHC diagnosticados durante este tiempo en España. Para esto, se ha diseñado una red de centros con distribución en toda la geografía española. La recogida de datos se ha realizado de acuerdo con la Ley Orgánica 15/1999, del 13 de diciembre, de Protección de Datos de Carácter Personal. Los datos se han enviado desde cada centro a una sede central a través de una dirección de correo electrónico (registrohcc@gmail.com). Estos datos se han revisado y se han tratado estadísticamente con el programa SPSS (versión 17.0).
- 1.
Diseño de la red de centros. Se contactó con 80 centros asistenciales de nivel secundario y terciario de toda España a través del Grupo de Estudio del Cáncer de Hígado, adscrito al CIBERehd.
- 2.
Definiciones. Se han utilizado los criterios de Milán: nódulo único de 5cm o menos de diámetro, o 3 o menos nódulos de 3cm o menos de diámetro como máximo. En el texto también se denominan tumores iniciales. El estado general del paciente se definió siguiendo el índice Eastern Cooperative Oncology Group Performance Status Scale (ECOG-PS)11. El estadio tumoral se definió siguiendo el sistema de estadificación del Barcelona Clinic Liver Cancer (BCLC)12.
- 3.
Análisis estadístico. Las variables cuantitativas se describieron mediante el procedimiento EXAMINE, con el que se mostraron la media, los extremos y la desviación típica, y con representación gráfica mediante diagramas de cajas. Las variables categóricas se describieron mediante el procedimiento FREQUENCIES. Para estudiar la relación entre las variables categóricas (estadio tumoral, ECOG-PS, estadio BCLC, tipo de tratamiento aplicado, etc.) y su pertenencia o no al grupo diagnosticado mediante cribado, se aplicó el test de la χ2 y el test exacto de Fisher. Para el análisis de las variables cuantitativas se utilizó el T-Test y ANOVA.
- 1.
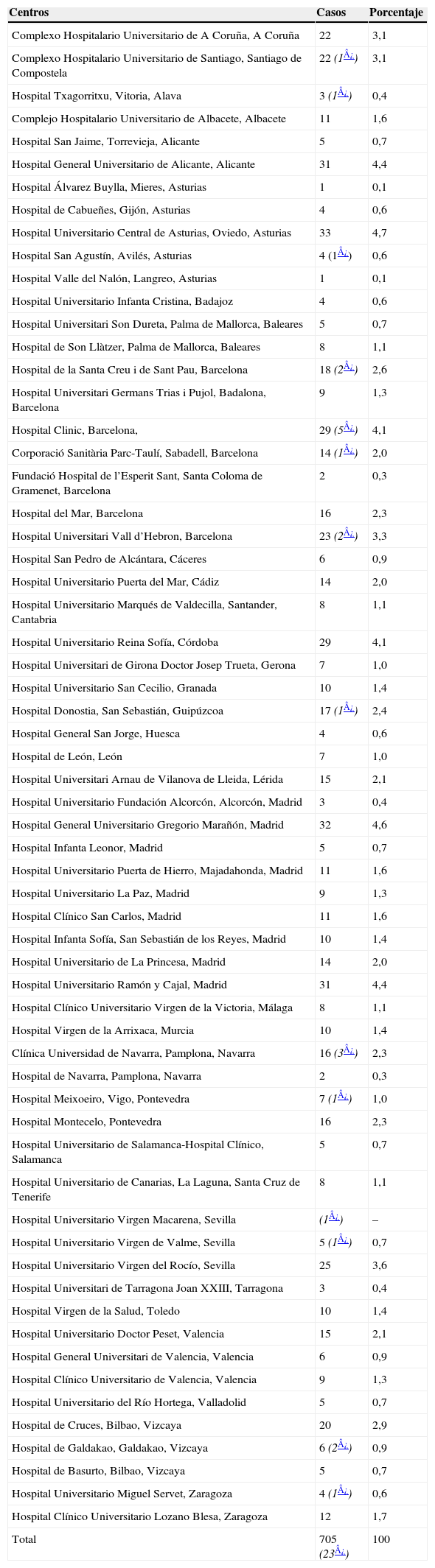
Centros: se han adscrito al proyecto 62 hospitales (tabla 1), y presentaron una distribución homogénea en todas las comunidades autónomas, incluidas Baleares y Canarias. El número total de pacientes registrados durante los 4 meses fue de 728; 23 de ellos fueron dobles registros, por lo que el número final de pacientes incluidos fue de 705. Teniendo en cuenta la incidencia anual estimada mediante los registros de cáncer y mortalidad por cáncer de los países del sur de Europa6,13,14, los casos registrados representan el 38% de los casos esperados en toda España durante el período de tiempo del estudioa. Barcelona y Madrid son las provincias con mayor número de casos registrados (111 y 126, respectivamente), seguidas de Asturias (43 casos), Alicante (36), Vizcaya (31), Valencia (30), Sevilla (30), Córdoba (29) y Pontevedra (23).
Tabla 1.Relación de centros que han participado en el registro con el número de casos aportados por cada uno, excluidas las 23 repeticiones(*)
Centros Casos Porcentaje Complexo Hospitalario Universitario de A Coruña, A Coruña 22 3,1 Complexo Hospitalario Universitario de Santiago, Santiago de Compostela 22 (1¿) 3,1 Hospital Txagorritxu, Vitoria, Alava 3 (1¿) 0,4 Complejo Hospitalario Universitario de Albacete, Albacete 11 1,6 Hospital San Jaime, Torrevieja, Alicante 5 0,7 Hospital General Universitario de Alicante, Alicante 31 4,4 Hospital Álvarez Buylla, Mieres, Asturias 1 0,1 Hospital de Cabueñes, Gijón, Asturias 4 0,6 Hospital Universitario Central de Asturias, Oviedo, Asturias 33 4,7 Hospital San Agustín, Avilés, Asturias 4 (1¿) 0,6 Hospital Valle del Nalón, Langreo, Asturias 1 0,1 Hospital Universitario Infanta Cristina, Badajoz 4 0,6 Hospital Universitari Son Dureta, Palma de Mallorca, Baleares 5 0,7 Hospital de Son Llàtzer, Palma de Mallorca, Baleares 8 1,1 Hospital de la Santa Creu i de Sant Pau, Barcelona 18 (2¿) 2,6 Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona 9 1,3 Hospital Clinic, Barcelona, 29 (5¿) 4,1 Corporació Sanitària Parc-Taulí, Sabadell, Barcelona 14 (1¿) 2,0 Fundació Hospital de l’Esperit Sant, Santa Coloma de Gramenet, Barcelona 2 0,3 Hospital del Mar, Barcelona 16 2,3 Hospital Universitari Vall d’Hebron, Barcelona 23 (2¿) 3,3 Hospital San Pedro de Alcántara, Cáceres 6 0,9 Hospital Universitario Puerta del Mar, Cádiz 14 2,0 Hospital Universitario Marqués de Valdecilla, Santander, Cantabria 8 1,1 Hospital Universitario Reina Sofía, Córdoba 29 4,1 Hospital Universitari de Girona Doctor Josep Trueta, Gerona 7 1,0 Hospital Universitario San Cecilio, Granada 10 1,4 Hospital Donostia, San Sebastián, Guipúzcoa 17 (1¿) 2,4 Hospital General San Jorge, Huesca 4 0,6 Hospital de León, León 7 1,0 Hospital Universitari Arnau de Vilanova de Lleida, Lérida 15 2,1 Hospital Universitario Fundación Alcorcón, Alcorcón, Madrid 3 0,4 Hospital General Universitario Gregorio Marañón, Madrid 32 4,6 Hospital Infanta Leonor, Madrid 5 0,7 Hospital Universitario Puerta de Hierro, Majadahonda, Madrid 11 1,6 Hospital Universitario La Paz, Madrid 9 1,3 Hospital Clínico San Carlos, Madrid 11 1,6 Hospital Infanta Sofía, San Sebastián de los Reyes, Madrid 10 1,4 Hospital Universitario de La Princesa, Madrid 14 2,0 Hospital Universitario Ramón y Cajal, Madrid 31 4,4 Hospital Clínico Universitario Virgen de la Victoria, Málaga 8 1,1 Hospital Virgen de la Arrixaca, Murcia 10 1,4 Clínica Universidad de Navarra, Pamplona, Navarra 16 (3¿) 2,3 Hospital de Navarra, Pamplona, Navarra 2 0,3 Hospital Meixoeiro, Vigo, Pontevedra 7 (1¿) 1,0 Hospital Montecelo, Pontevedra 16 2,3 Hospital Universitario de Salamanca-Hospital Clínico, Salamanca 5 0,7 Hospital Universitario de Canarias, La Laguna, Santa Cruz de Tenerife 8 1,1 Hospital Universitario Virgen Macarena, Sevilla (1¿) – Hospital Universitario Virgen de Valme, Sevilla 5 (1¿) 0,7 Hospital Universitario Virgen del Rocío, Sevilla 25 3,6 Hospital Universitari de Tarragona Joan XXIII, Tarragona 3 0,4 Hospital Virgen de la Salud, Toledo 10 1,4 Hospital Universitario Doctor Peset, Valencia 15 2,1 Hospital General Universitari de Valencia, Valencia 6 0,9 Hospital Clínico Universitario de Valencia, Valencia 9 1,3 Hospital Universitario del Río Hortega, Valladolid 5 0,7 Hospital de Cruces, Bilbao, Vizcaya 20 2,9 Hospital de Galdakao, Galdakao, Vizcaya 6 (2¿) 0,9 Hospital de Basurto, Bilbao, Vizcaya 5 0,7 Hospital Universitario Miguel Servet, Zaragoza 4 (1¿) 0,6 Hospital Clínico Universitario Lozano Blesa, Zaragoza 12 1,7 Total 705 (23¿) 100 - 2.
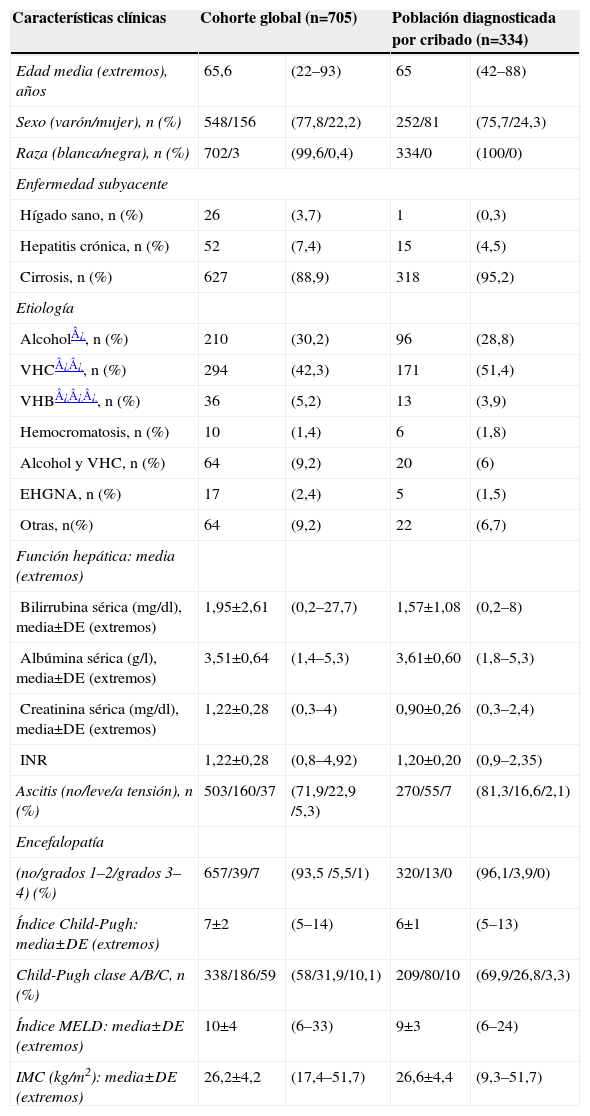
Características de los pacientes registrados (n=705) (tabla 2): el 99% eran pacientes de raza blanca, un 78% eran varones, el 89% tenía cirrosis (el 58% con Child-Pugh A, el 32% con Child-Pugh B, el 10% con Child-Pugh C), con una edad media de 65 años (extremos: 22–93). Un total de 210 casos tenía etiología alcohólica (30,3%), 294 casos por el VHC (42,3%) y 64 casos por causa mixta: alcohol y VHC (9,2%). Se registraron 17 casos (2,4%) atribuidos a enfermedad por hígado graso no alcohólico. El 3% estaba coinfectado por el virus de la inmunodeficiencia humana (VIH), un 30% eran diabéticos y 72 casos (10%) tenían antecedente de otro cáncer concomitante.
Tabla 2.Características demográficas, clínicas y analíticas de los 705 casos de carcinoma hepatocelular incluidos en el registro y de los 334 casos diagnosticados mediante cribado
Características clínicas Cohorte global (n=705) Población diagnosticada por cribado (n=334) Edad media (extremos), años 65,6 (22–93) 65 (42–88) Sexo (varón/mujer), n (%) 548/156 (77,8/22,2) 252/81 (75,7/24,3) Raza (blanca/negra), n (%) 702/3 (99,6/0,4) 334/0 (100/0) Enfermedad subyacente Hígado sano, n (%) 26 (3,7) 1 (0,3) Hepatitis crónica, n (%) 52 (7,4) 15 (4,5) Cirrosis, n (%) 627 (88,9) 318 (95,2) Etiología Alcohol¿, n (%) 210 (30,2) 96 (28,8) VHC¿¿, n (%) 294 (42,3) 171 (51,4) VHB¿¿¿, n (%) 36 (5,2) 13 (3,9) Hemocromatosis, n (%) 10 (1,4) 6 (1,8) Alcohol y VHC, n (%) 64 (9,2) 20 (6) EHGNA, n (%) 17 (2,4) 5 (1,5) Otras, n(%) 64 (9,2) 22 (6,7) Función hepática: media (extremos) Bilirrubina sérica (mg/dl), media±DE (extremos) 1,95±2,61 (0,2–27,7) 1,57±1,08 (0,2–8) Albúmina sérica (g/l), media±DE (extremos) 3,51±0,64 (1,4–5,3) 3,61±0,60 (1,8–5,3) Creatinina sérica (mg/dl), media±DE (extremos) 1,22±0,28 (0,3–4) 0,90±0,26 (0,3–2,4) INR 1,22±0,28 (0,8–4,92) 1,20±0,20 (0,9–2,35) Ascitis (no/leve/a tensión), n (%) 503/160/37 (71,9/22,9 /5,3) 270/55/7 (81,3/16,6/2,1) Encefalopatía (no/grados 1–2/grados 3–4) (%) 657/39/7 (93,5 /5,5/1) 320/13/0 (96,1/3,9/0) Índice Child-Pugh: media±DE (extremos) 7±2 (5–14) 6±1 (5–13) Child-Pugh clase A/B/C, n (%) 338/186/59 (58/31,9/10,1) 209/80/10 (69,9/26,8/3,3) Índice MELD: media±DE (extremos) 10±4 (6–33) 9±3 (6–24) IMC (kg/m2): media±DE (extremos) 26,2±4,2 (17,4–51,7) 26,6±4,4 (9,3–51,7) DE: desviación estándar; EHGNA: enfermedad hepática por hígado graso; IMC: índice de masa corporal; INR: ratio normalizada internacional; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
- 3.
Características tumorales de la cohorte global: 334 casos (47,4%) se diagnosticaron en el seno de un programa de cribado y un 22% de los casos se diagnosticó a raíz de la aparición de síntomas vinculados a la enfermedad. El 72% de los casos de CHC se diagnosticó al aplicar los criterios no invasivos establecidos en las guías clínicas7,8 y en un 20% el diagnóstico se obtuvo mediante citohistología. La prueba de imagen más utilizada fue la tomografía computarizada trifásica (82%), seguida de la resonancia magnética dinámica (60%) y de la ecografía con contraste (28%). El tiempo medio transcurrido entre el diagnóstico del CHC y el tratamiento fue de 21 días (extremos: 0–105). Los tratamientos que se aplicaron en forma más inmediata fueron la inyección percutánea de alcohol (18 días de espera, intervalo de confianza del 95%: 12–24, máximo: 56 días) y sorafenib (18 días de espera, intervalo de confianza del 95%: 13–23, máximo: 98 días).
- 4.
Características de la población en el programa de diagnóstico precoz (n=334). Las características clínicas principales vienen reflejadas en la tabla 2. Un 76% eran varones, la edad media fue de 65 años (extremos: 42–88), un 95% tenía cirrosis, un 51% estaba infectado crónicamente por el VHC, un 29% tenía etiología alcohólica y un 6% tenía ambas causas (alcohol y VHC). El 84% se diagnosticó mediante técnicas de imagen (tomografía computarizada trifásica en un 79%, resonancia magnética en un 71% y ecografía con contraste en el 36%). El 76% de los tumores se diagnosticó en fase inicial. Solamente un 6% de los casos presentó invasión vascular y solo un 3% presentó extensión extrahepática del CHC (tabla 3).
Tabla 3.Características tumorales de los 705 casos incluidos en el registro y de los 334 casos diagnosticados mediante cribado
Características tumorales Cohorte global (n=705) Población diagnosticada por cribado (n=334) Tamaño del tumor principal (mm de diámetro): media (extremos) 44,35 10–253 32,45 10–100 Forma de sospecha Cribado (%) 334 (47,7) 334 (100 ) Hallazgo casual (%) 215 (30,5) – – Síntomas (%) 155 (22,1) – – Método diagnóstico Clínica, AFP, ecografía (%) 61 (8,7) 9 (2,7) Diagnóstico no invasivo¿ (%) 506 (71,7) 280 (83,8) Anatomía patológica (%) 138 (19,6) 45 (13,5) Características del CHC: Tumor único ≤2cm (%) 78 (11,1) 61 (18,3) Tumor único >2, ≤5cm (%) 245 (34,8) 152 (45,5) Hasta 3 nódulos ≤3cm (%) 66 (9,4) 42 (12,6) Tumor único >5cm (%) 89 (12,6) 19 (5,7) Multinodular (>3 o >3cm) (%) 226 (32,1) 60 (18) AFP categorizada: pacientes (%) AFP ≤20ng/ml 375 (56,3) 198 (62,3) AFP >20, ≤200ng/ml 138 (20,7) 76 (23,9) AFP >200, ≤400ng/ml 28 (4,2) 14 (4,4) AFP >400ng/ml 125 (18,8) 30 (9,4) Invasión vascular (sí/no)¿¿ (%) 108/564 (16,1/83,9) 18/301 (5,6/94,4) Metástasis (sí/no)¿¿¿ (%) 68/603 (10,1/89,9) 10/315 (3,1/96,9) ECOG-PS11¿¿¿¿(%) 0 384 (54,7) 243 (73) 12 170/84 (24,2/12) 63/24 (18,9/7,2) 34 49/15 (7/2,1) 2/1 (0,6/0,3) BCLC12(%) 0 54 (7,7) 42 (12,6) A 295 (42,1) 193 (58) B 139 (19,8) 62 (18,6) C 132 (18,8) 27 (8,1) D 81 (11,6) 9 (2,7) Primera opción de tratamiento Resección quirúrgica (%) 59 (9,4) 27 (9,5) Inyección percutánea con alcohol (%) 57 (9,1) 40 (14) Radiofrecuencia (%) 104 (16,5) 69 (24,2) Quimioembolización (%) 153 (24,3) 92 (32,3) Sorafenib (%) 78 (12,4) 23 (8,1) Tratamiento sintomático (%) 164 (26,1) 28 (9,8) Ensayos clínicos, Yttrium90, etc. (%) 14 (2,2) 6 (2,1) Estudios pretrasplante (sí/no) (%) 144/536 (21,2/78,8) 101/225 (31/69) AFP: alfafetoproteína; BCLC: Barcelona Clinic Liver Cancer; CHC: carcinoma hepatocelular; ECO-PS: Eastern Cooperative Oncology Group Performance Status Scale.
¿Uso del patrón característico del CHC en las pruebas de imagen dinámicas (ecografía con contraste, TC trifásica, angio-RM): intensa captación de contraste en fase arterial seguida de un lavado rápido de éste en fase venosa o tardía. Si la lesión tumoral es ≤20mm de diámetro el patrón ha de ser coincidente en 2 pruebas de imagen para evitar falsos positivos7,8.
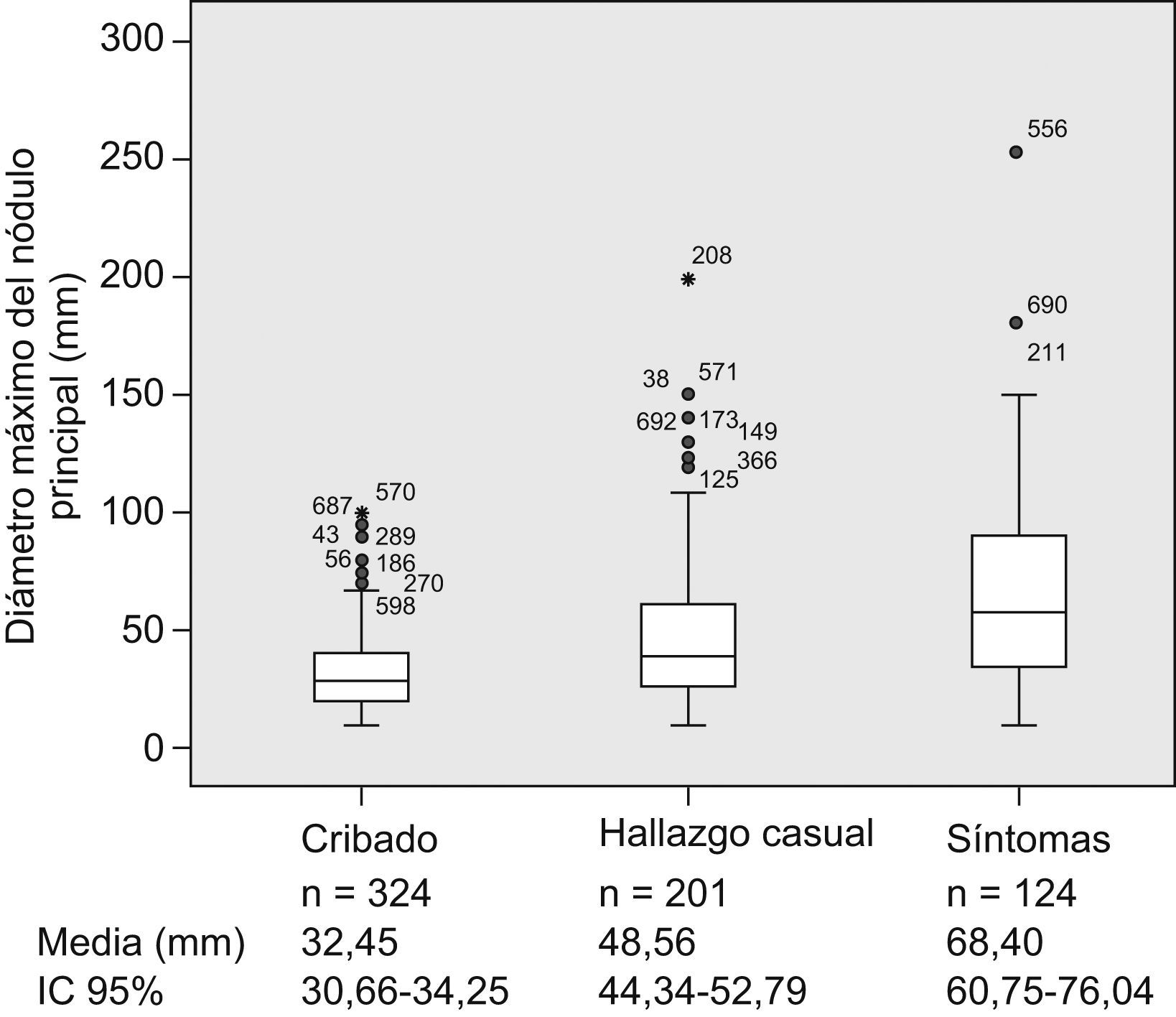
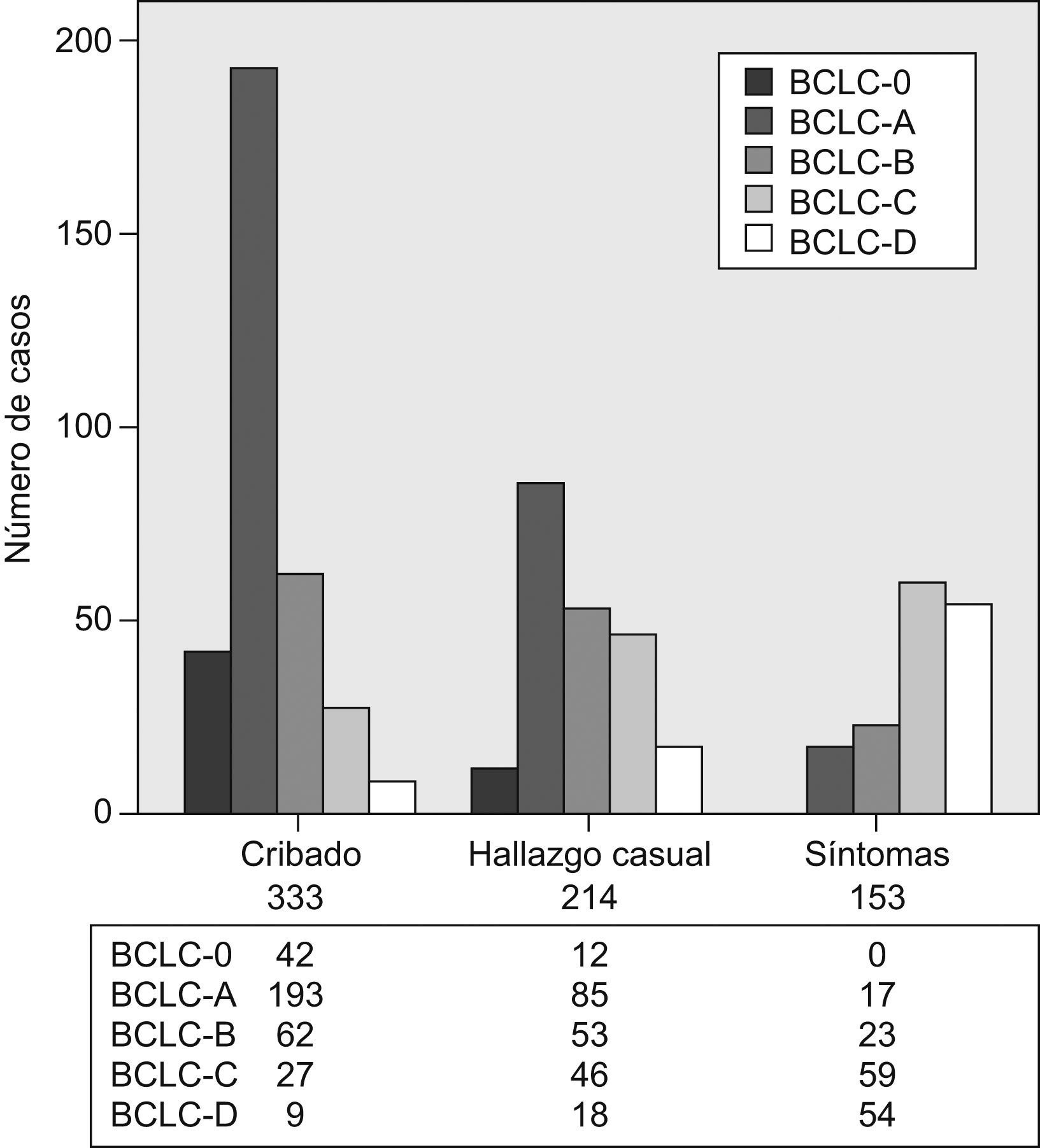
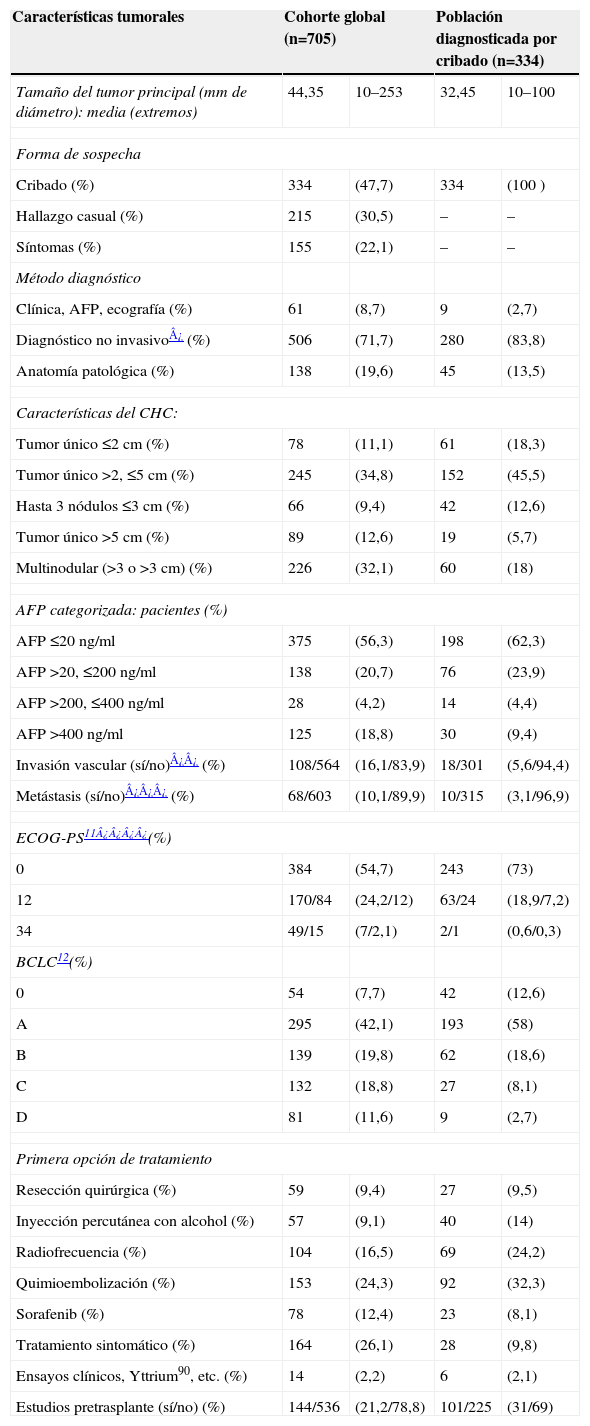
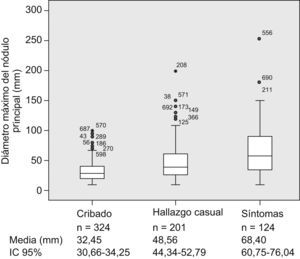
Al comparar los pacientes incluidos en el seno de los programas de cribado con el resto de los pacientes, observamos que tanto el tamaño del nódulo principal (fig. 1) como el estadio BCLC (fig. 2) fueron significativamente menores en los pacientes del grupo de cribado respecto a los segundos (p<0,001). Asimismo sucede con la primera opción de tratamiento escogida: la aplicación de los tratamientos con intención radical (resección, radiofrecuencia e inyección percutánea de alcohol) fue significativamente superior en aquellos pacientes diagnosticados mediante técnicas de cribado (el 47,5 frente al 24,6%; p<0,001), así como la consideración para evaluar la posibilidad de trasplante hepático (el 30,9 frente al 12%; p<0,001). La aplicación del cribado no varió en cuanto a la distribución por sexos (p=0,204), los grupos de edad (≤50; 51–65; 66–75 o >75 años) (p=0,171), la presencia de infección por el VIH (p=0,817), la diabetes (p=0,161) o el antecedente de otros tumores (p=0,983). Respecto a la etiología, los pacientes con VHC estaban más frecuentemente en el programa de cribado que los pacientes de otras etiologías (el 58,2 frente al 40,4%; p<0,01).
Figura 1.Diagrama de cajas (box-plot) en el que se observa cómo el diámetro máximo del tumor principal varía de forma significativa con el abordaje diagnóstico; de menor tamaño en los pacientes diagnosticados mediante programas de cribado y mayor en los diagnosticados tras la aparición de síntomas (n=649, que son los casos en que se ha registrado el diámetro mayor del nódulo tumoral principal y el tipo de sospecha diagnóstica, un 92% de los casos del registro; se indican las medias y el intervalo de confianza del 95% de los diámetros máximos).
(0,14MB).Figura 2.Diagramas de barras en que se muestra la proporción de pacientes en cada estadio Barcelona Clinic Liver Cancer según el abordaje diagnóstico: cribado (n=333), hallazgo casual (n=214) y síntomas (n=153). Ambos datos están presentes en 700 casos del registro. BCLC: Barcelona Clinic Liver Cancer.
(0,14MB). - 5.
Obesidad. La proporción de los CHC diagnosticados en el programa de cribado no varió en el grupo de los pacientes obesos (definida obesidad como índice de masa corporal [IMC] igual o superior a 30kg/m2) respecto a los pacientes con IMC inferior a 30kg/m2 (p=0,373). No hubo diferencias en la aplicabilidad del método de diagnóstico no invasivo (p=0,150) entre obesos y pacientes con IMC inferior a 30kg/m2 ni respecto al tamaño del nódulo tumoral principal (p=0,306). En los pacientes con cirrosis a los que se les realizó vigilancia periódica, tampoco fue diferente la proporción de tumores diagnosticados en estadio inicial entre obesos y no obesos (el 75,7 frente al 77,1%; p=0,837).
- 6.
Heterogeneidad entre centros. La proporción del CHC de causa alcohólica fue distinta entre las autonomías del norte de España (Galicia, Asturias, Cantabria, País Vasco, Navarra, Aragón, La Rioja y Castilla León) y el resto, y la diferencia entre ambas áreas fue estadísticamente significativa (el 37,8 frente al 26,4%; p=0,003). Se ha evaluado si la experiencia en el tratamiento del CHC podía tener alguna influencia en la proporción de pacientes diagnosticados mediante cribado, y para esto se compararon los centros que incluyeron 15 casos o más (18 centros con 410 casos, el 58,5% del registro), medida indirecta de que poseen mayor experiencia en el tratamiento de la enfermedad, y los que registraron menos de 15 casos (42 centros con 291 casos, el 41,5% del registro). No hubo diferencias en la proporción de pacientes diagnosticados en el seno de programas de cribado entre ambos grupos de hospitales (p=0,772).
- 7.
Aplicación de los tratamientos. Se consideraron para trasplante 144 casos, de éstos el 94% eran pacientes con tumores iniciales (dentro de los criterios de Milán), 4 con tumores únicos mayores de 5cm de diámetro y 4 con tumores multifocales (>3 nódulos o ≥3cm). Como puente al trasplante, un 63% recibió otro tratamiento: 6 resección quirúrgica, 19 inyección percutánea de alcohol, 23 radiofrecuencia y 30 quimioembolización. La resección quirúrgica se indicó en 59 casos, el 91% con tumores únicos; la ablación mediante inyección percutánea de alcohol se indicó en 57 casos, el 42% con tumores únicos de 2cm o menos y el 44% con tumores únicos entre 2 y 5cm; el tratamiento con radiofrecuencia se prescribió en 104 casos, el 87% con tumores únicos de 5cm o menos (el 66% con tumores de entre 2 y 5cm). La quimioembolización fue el tratamiento más frecuentemente indicado: 153 casos, el 46% eran iniciales (4 casos en nódulos ≤2cm, 51 casos en nódulos únicos entre 2 y 5cm y 16 casos en tumores ≤3 nódulos de ≤3cm), el 16% eran únicos mayores de 5cm (n=24) y el 38% eran multinodulares (>3 nódulos o >3cm) (n=58). El sorafenib fue la primera opción de tratamiento para 78 casos (el 12% de los CHC del registro). La mayoría procedía del grupo diagnosticado fuera de programas de cribado (70,5%) y su uso no se vio afectado por las diferentes franjas etarias (el 14% ≤50 años y el 23% >75 años). Se indicó en 5 casos con enfermedad terminal (BCLC-D), en 3 casos con ECOG-PS3 y en 16 casos con función hepática Child-Pugh superior a 7/15 (4 Child-Pugh C).
El cáncer constituye la segunda causa de muerte en España después de las enfermedades cardiovasculares. En el año 2007 fallecieron por cirrosis hepática 3.185 personas y por CHC 3.028 personas18. Cada año, un 3% de pacientes con cirrosis desarrolla un CHC, y la historia natural de la enfermedad es infausta en los tumores avanzados, con una supervivencia mediana inferior a un año. En cambio, en estadio inicial se alcanzan supervivencias superiores al 70% a los 5 años mediante la aplicación de tratamientos con intención curativa.
Recientemente se ha publicado en Medicina Clínica la guía del tratamiento del CHC8. En paralelo con la elaboración de la guía se realizó este registro multicéntrico español con los casos de CHC diagnosticados de octubre de 2008 a enero de 2009, y este artículo resume los principales hallazgos. Se han contabilizado 705 casos en 4 meses, lo que representa el 38% de los casos nuevos estimados para la población española en este período de tiempo según los principales registros de mortalidad y de cáncer13. Dado que han participado 62 hospitales de segundo y tercer nivel de todas las comunidades autónomas, creemos que este registro es representativo de la realidad del CHC en España.
Más del 70% de los casos se ha diagnosticado mediante pruebas de imagen; se eludió la necesidad de obtener material histológico. El uso aislado de la alfafetoproteína para el cribado del CHC se desaconseja en las guías más recientes7,8, y su uso combinado con la ecografía es controvertido15,16. En el registro, el 62,3% de los casos diagnosticados en el seno de programas de cribado presentaba valores normales de alfafetoproteína, por lo que este resultado confirma la falta de sensibilidad de este marcador para detectar el CHC y su falta de beneficio como herramienta de cribado.
Respecto a los factores de riesgo implicados en el desarrollo del CHC, cabe destacar que la proporción de pacientes con cirrosis de causa alcohólica es significativamente superior en las comunidades del norte de España (Galicia, Asturias, Cantabria, País Vasco, Navarra, La Rioja, Aragón y Castilla León), mientras que en el resto de las comunidades autónomas la causa subyacente más frecuente es la infección crónica por el VHC. Otro aspecto destacable es la alta prevalencia de pacientes diabéticos y de pacientes con VIH en el registro comparada con la población general española (el 30,8 frente al 5,58% y el 2,8 frente al 0,32%, respectivamente; fuente: Ministerio de Sanidad y Consumo). Se ha descrito recientemente que la diabetes es un factor de riesgo independiente de la presencia de infección crónica por el VHB o el VHC para el desarrollo del CHC17 y quizás esto podría explicar en parte los resultados obtenidos. Por otro lado, más de un tercio de los pacientes con infección por el VIH han adquirido por la misma vía de transmisión el VHB o el VHC, y se sabe que la evolución de la hepatopatía crónica en pacientes coinfectados es más rápida18; ambos factores podrían explicar esta diferencia entre la prevalencia de la infección por el VIH entre el registro y la población general.
El resultado más importante de este estudio es que más del 50% de los casos de CHC se diagnostica fuera de los programas de vigilancia periódica. Este hecho está directamente relacionado con un estadio tumoral más avanzado y con la menor aplicabilidad de tratamientos curativos (el 50% de los casos en estadio BCLC B, C o D; el 65% candidatos a tratamiento paliativo con quimioembolización, sorafenib o tratamiento sintomático). La prueba de cribado actualmente recomendada es la realización de una ecografía abdominal con periodicidad semestral, con una sensibilidad para detectar un nódulo hepático del 53–89%19,20. A pesar de que la población diana está definida, hasta un 44% de los pacientes con cirrosis Child-Pugh A o B se diagnosticó de forma casual o por síntomas asociados a enfermedad tumoral avanzada. Una de las razones que podría explicar este hecho es que en algunos pacientes el diagnóstico de la cirrosis se realiza a la vez que el CHC y, por tanto, no estaban incluidos en ningún programa de vigilancia previamente. Hay que destacar que los pacientes con VHC se siguen dentro de los programas de cribado de manera significativamente mayor que los pacientes seronegativos, y es en éstos, especialmente en los de causa alcohólica, en los que tenemos que hacer un mayor esfuerzo en la búsqueda del diagnóstico de cirrosis y, si ésta se confirma, incluirlos en programas de vigilancia, ya que el riesgo de CHC se mantiene incluso tras 10 años de abstinencia21.
Otro hecho relevante detectado con el registro es el bajo tiempo de espera para los tratamientos, aproximadamente un mes, y éste es inferior a 3 semanas si se trata de inyección percutánea de alcohol o sorafenib. Una vez diagnosticado el CHC, la heterogeneidad en la aplicación de los tratamientos entre los centros es muy baja y las excepciones, fuera de las guías clínicas, son mínimas. Según las guías clínicas vigentes8, el sorafenib está indicado en pacientes con enfermedad avanzada (BCLC C) y en aquéllos en estadios A y B que no pueden beneficiarse de tratamientos de mayor prioridad, como resección, trasplante, ablación percutánea o quimioembolización. En el caso de este tratamiento oral, menos del 10% de los pacientes presentaba una contraindicación formal para su uso, y es el grado de insuficiencia hepática el principal limitante en su indicación. Además de las opciones terapéuticas expuestas, la radiación interna con Yttrium90 y otros tratamientos sistémicos pueden incorporarse en un futuro y aumentar la eficacia de los actuales, lo que beneficiará a aquellos pacientes que ahora no disponen de un tratamiento eficaz por contraindicación o toxicidad.
En conclusión, el número de casos de CHC diagnosticado a nivel estatal es relevante. El diagnóstico en fase inicial, momento en que es posible aplicar un tratamiento con finalidad curativa, se da únicamente en un 50% de los casos. Esto indica la necesidad de aumentar la detección de los pacientes en riesgo e incluirlos en programas de seguimiento intencionado o de cribado. La aplicación de las guías de diagnóstico y tratamiento del CHC en el entorno sanitario español debe resultar en una progresiva mejora de la situación actual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEstudio realizado en el marco de colaboración previsto en la Acción Transversal del Cáncer aprobada por el Consejo de Ministros del 11 de octubre de 2007, al amparo del convenio suscrito por el ISCIII, organismo autónomo dependiente actualmente del Ministerio de Ciencia e Innovación, y el CIBER para el área temática de enfermedades hepáticas y digestivas. Estudio realizado con el patrocinio de Bayer Healthcare.
A Gustavo Pérez Álvarez, médico adjunto del Servicio de Digestivo del HUCA, Oviedo, y a Alejandro Forner González, hepatólogo del grupo BCLC, del Hospital Clínic de Barcelona, por la ayuda en la gestión de la base de datos central.
Participantes en el registro (por orden alfabético provincial): A Coruña: Dr. Manuel Delgado, Complexo Hospitalario Universitario de A Coruña; Dr. Javier Fernández-Castroagudín, Complexo Hospitalario Universitario de Santiago, Santiago de Compostela. Álava: Dr. Salvador Zabaleta, Hospital Txagorritxu, Vitoria. Albacete: Dr. José María Moreno, Complejo Hospitalario Universitario de Albacete, Albacete. Alicante: Dr. Juan Carlos Penalva, Hospital San Jaime, Torrevieja; Dra. Sonia Pascual, Hospital General Universitario de Alicante, Alicante. Asturias: Dra. Eugenia Lauret y Dra. Ana Milla, Hospital Álvarez Buylla, Mieres; Dra. Carmen Álvarez-Navascués, Hospital de Cabueñes, Gijón; Dra. Valle Cadahía, Hospital Universitario Central de Asturias, Oviedo; Dr. Juan de la Vega, Hospital San Agustín, Avilés; Dra. Emilia G Riesco, Hospital Valle del Nalón, Langreo. Badajoz: Dr. José Luis Montero y Dra. Ana Guiberteau, Hospital Universitario Infanta Cristina, Badajoz. Baleares: Dr. Pere Vaquer, Hospital Universitari Son Dureta, Palma de Mallorca; Dr. Hernán Andreu, Hospital de Son Llàtzer, Palma de Mallorca. Barcelona: Dr. Adolfo Gallego, Hospital de la Santa Creu i de Sant Pau, Barcelona; Dra. Margarita Sala, Hospital Universitari Germans Trias i Pujol, Badalona; Dra. María Reig y Dr. Carlos Rodríguez de Lope, Hospital Clinic, Barcelona; Dra. Mercè Vergara, Corporació Sanitària Parc-Taulí, Sabadell; Dr. Miquel Torres, Fundació Hospital de l’Esperit Sant, Santa Coloma de Gramenet; Dra. Susana Coll, Hospital del Mar, Barcelona; Dr. Lluis Castells, Hospital Universitari Vall d’Hebron, Barcelona. Cáceres: Dr. Miguel Fernández-Bermejo, Hospital San Pedro de Alcántara, Cáceres. Cádiz: Dra. Paloma Rendón, Hospital Universitario Puerta del Mar, Cádiz. Cantabria: Dr. Luis Martín-Ramos, Hospital Universitario Marqués de Valdecilla, Santander. Córdoba: Dr. Manuel de la Mata, Hospital Universitario Reina Sofía, Córdoba. Gerona: Dr. Carlos Huertas-Nadal, Hospital Universitari de Girona Doctor Josep Trueta, Gerona. Granada: Dr. Ángel Palacios, Hospital Universitario San Cecilio, Granada. Guipúzcoa: Dr. Juan Arenas y Dr. Manuel García-Bengoechea, Hospital Donostia, San Sebastián. Huesca: Dra. Sara Lorente, Hospital General San Jorge, Huesca. León: Dra. Gabriela Rascarachi y Dr. José Luis Olcoz, Hospital de León, León. Lérida: Dr. Carles Aracil, Hospital Universitari Arnau de Vilanova de Lleida. Madrid: Dr. Jose Luis Lledó y Dr. Conrado Fernández, Hospital Universitario Fundación Alcorcón, Alcorcón; Dra. Ana Matilla, Hospital General Universitario Gregorio Marañón, Madrid; Dr. Antonio Díaz y Dra. Mercedes Aldeguer, Hospital Infanta Leonor, Madrid; Dr. Fernando Pons-Renedo, Hospital Universitario Puerta de Hierro, Majadahonda; Dr. Francisco Gea, Hospital Universitario La Paz, Madrid; Dr. José María Ladero, Hospital Clínico San Carlos, Madrid; Dr. Óscar Núñez, Hospital Infanta Sofía, San Sebastián de los Reyes; Dr. Pablo Miranda y Dra. Marisa García-Buey, Hospital Universitario de La Princesa, Madrid; Dra. Regina Serradilla y Dr. Luis Ruiz del Árbol, Hospital Universitario Ramón y Cajal, Madrid. Málaga: Dra. Marta Lozano, Hospital Clínico Universitario Virgen de la Victoria, Málaga. Murcia: Dra. M Carmen Garré, Hospital Virgen de la Arrixaca, Murcia. Navarra: Dra. Mercedes Iñarrairaegui y Dr. Bruno Sangro, Clínica Universidad de Navarra, Pamplona; Dra. Patricia Ochoa y Dra. Ruth Vera, Hospital de Navarra, Pamplona, Navarra. Pontevedra: Dra. Lola Martínez-Rodríguez y Dr. Ignacio Martín-Granizo, Hospital Meixoeiro, Vigo; Dr. Juan Turnes, Complejo Hospitalario de Pontevedra, Pontevedra. Salamanca: Dr. Felipe Jiménez, Hospital Universitario de Salamanca-Hospital Clínico, Salamanca. Santa Cruz de Tenerife: Dr. Manuel Hernández-Guerra y Dr. Enrique Quintero, Hospital Universitario de Canarias, La Laguna. Sevilla: Dra. Elena Hoyas, Hospital Universitario Virgen de Valme, Sevilla; Dr. Juan Manuel Pascasio, Hospital Universitario Virgen del Rocío, Sevilla; Dr. Juan Pérez-Martínez, Hospital Universitario Virgen Macarena, Sevilla. Tarragona: Dra. Silvia Montoliu, Hospital Universitari de Tarragona Joan XXIII, Tarragona. Toledo: Dr. Rafael Gómez, Hospital Virgen de la Salud, Toledo. Valencia: Dr. Adolfo del Val, Hospital Universitario Doctor Peset, Valencia; Dra. Carmen González, Hospital General Universitario de Valencia, Valencia; Dra. Paloma Lluch, Hospital Clínico Universitario de Valencia, Valencia. Valladolid: Dr. Félix García Pajares, Hospital Universitario del Río Hortega, Valladolid. Vizcaya: Dr. Fco. Javier Bustamante, Hospital de Cruces, Bilbao; Dra. Carmen Garay, Hospital de Galdakao, Galdakao; Dra. Sonia Blanco, Hospital de Basurto, Bilbao. Zaragoza: Dr. Javier Fuentes, Hospital Universitario Miguel Servet, Zaragoza; Dra. Trinidad Serrano, Hospital Clínico Universitario Lozano Blesa, Zaragoza.
Cálculo de la incidencia de CHC en España: según el Instituto Nacional de Estadística, al día 1 de enero de 2008 la población española era de 46.157.822 personas. Si la incidencia estimada de CHC es de 10-12 casos/100.000 habitantes al año en nuestro medio, se deberían registrar más de 5.530 casos de CHC al año, esto es, unos 1.846 casos al cuatrimestre. En el registro se han incluido 705 casos, que equivalen al 38% de los casos aproximadamente.