El tipo de estrategia de revascularización en el síndrome coronario agudo sin elevación del ST es motivo de actual debate. Los estudios aleatorizados revelan resultados heterogéneos cuando se compara la eficacia de una estrategia de revascularización invasiva frente a un manejo conservador. Estas discrepancias obedecen a diferencias en: a) las características basales de las poblaciones; b) la metodología empleada, y c) los criterios de valoración estudiados. A pesar de que las guías de actuación recomiendan una estrategia de revascularización invasiva en los pacientes de alto riesgo, no existe aún evidencia sólida que pruebe que este tipo de abordaje otorgue una mejoría pronóstica en estos pacientes. Para llegar a conclusiones definitivas, se necesitan estudios aleatorizados adicionales que: a) proporcionen mayor validez externa, ampliando los criterios de inclusión a grupos de población de mayor riesgo, y b) uniformicen los protocolos de actuación, los objetivos y sus respectivas definiciones.
Revascularization strategy in the setting of non-ST-segment acute coronary syndromes remains a controversy. Evidence obtained from clinical trials, generally performed in selected patients, reveals heterogeneous and insufficient results when a routine invasive revascularization strategy and a conservative one are compared. The conflicting results among trials are due to differences in: a) baseline characteristics; b) methodology and protocols applied and; c) objectives and outcomes definitions. Although present guidelines recommend that a routine invasive strategy should be used in high risk non-ST-segment elevation acute coronary syndromes, there is no consistent evidence that supports this approach. In order to reach definitive conclusions, further randomized studies should: a) expand inclusion criteria to highest risk populations and; b) standardize the methodology, objectives and outcome definitions.
En el abordaje terapéutico de pacientes con síndrome coronario agudo sin elevación del segmento ST (SCASEST) se distinguen 2 tipos de estrategias de revascularización claramente diferenciadas: a) la estrategia de revascularización invasiva (EI), que se basa en la realización rutinaria de una angiografía coronaria seguida de eventual revascularización en función de los hallazgos angiográficos, y b) la estrategia conservadora o selectivamente invasiva (EC), que se fundamenta en la realización de una coronariografía y eventual revascularización solamente en casos seleccionados donde se constate isquemia residual o inestabilidad clínica a pesar de tratamiento médico. Ambas estrategias se basan en fundamentos fisiopatológicos válidos. Con la EI pretendemos «curar» la lesión subyacente de forma temprana antes de que siga progresando, mientras que en la EC se busca estabilizar la placa ateroesclerótica mediante tratamiento médico agresivo (antitrombóticos y antiplaquetarios) teniendo en cuenta que la lesión vascular subyacente inestable es típicamente de tipo no obstructivo1. A pesar de que los estudios realizados hasta la fecha no han suministrado una evidencia consistente en este debate, las recomendaciones actuales de actuación clínica sugieren la adopción rutinaria de la EI (<48h) para el manejo de estos pacientes de alto riesgo2. A continuación, revisaremos la evidencia científica disponible con respecto al presente tópico.
Ensayos clínicosLa controversia acerca de la superioridad de la EI en el pronóstico de los pacientes con SCASEST se inició a raíz de los primeros estudios clínicos aleatorizados realizados durantes los años noventa. En el estudio TIMI-IIIB3 el criterio de valoración principal (defunción, reinfarto e isquemia recurrente) ocurrió con frecuencia similar entre una EI frente a EC a 6 semanas (18,1 frente a 16,2; p=NS). De forma similar, el estudio MATE, que incluyó sólo a 201 pacientes, no mostró diferencias en cuanto a frecuencia de revascularización tardía, infarto recurrente y mortalidad a largo plazo4. Finalmente, los resultados del estudio VANQWISH demostraron una superioridad pronóstica de la EC sobre la EI; los pacientes asignados a una EI experimentaron mayor frecuencia de episodios mayores (defunción y infarto) durante la hospitalización (36 frente a 15 pacientes; p=0,004), el primer mes (48 frente a 26; p=0,012) y el primer año (111 frente a 85; p=0,05), que los sujetos tratados de manera conservadora5.
Es importante resaltar que estos resultados deben tomarse con cautela, ya que las circunstancias históricas que predominaron difieren marcadamente de las existentes hoy en día. Entre estas, caben destacar: a) utilización anecdótica o inexistente de stents coronarios; b) utilización de terapia antitrombótica actualmente considerada como «subóptima» (no utilización de clopidogrel, heparina de bajo peso molecular, ni inhibidores plaquetarios IIb–IIIa), y c) frecuencia de complicaciones que hoy día consideraríamos inaceptables (p. ej., en el estudio VANQWISH la mortalidad posquirúrgica a 30 días fue del 11,6%).
A principios de la presente década, con la llegada de los nuevos marcadores de necrosis miocárdica, la redefinición de los síndromes coronarios agudos6, la identificación de marcadores de alto riesgo (elevación de troponina, descenso del segmento ST)7–11, la aparición de nuevos fármacos antitrombóticos y el empleo sistemático de los stents intracoronarios12, aparecieron nuevos estudios que revaluaron la eficacia pronóstica de una EI frente a una EC en el SCASEST.
El estudio FRISC-II13 fue el primer estudio que demostró una reducción significativa de eventos mayores, reingresos y revascularizaciones tras el alta hospitalaria. Durante el primer año, el episodio combinado de muerte e infarto ocurrió en 127 (10,4%) frente a 174 (14,1%) de los pacientes que recibieron una EI y EC, respectivamente (riesgo relativo [RR]=0,74; intervalo de confianza [IC] del 95%, 0,60–0,92; p=0,005). Además, fue el primer trabajo en demostrar una reducción significativa de la mortalidad a un año de seguimiento; 27 (2,2%) pacientes que recibieron una EI y 48 (3,9%) en el grupo de EC murieron (RR=0,57; IC del 95%, 0,36–0,90; p=0,016). En ese trabajo, se debe destacar que el manejo del grupo conservador distó de lo habitual en la práctica clínica: se exigía una ergometría muy positiva para realizar cateterismo en este grupo y sólo se revascularizó antes del alta al 9% de los pacientes asignados a una EC (frente al 71% del grupo invasivo). Quizá este manejo excesivamente conservador pudo exagerar las diferencias en favor del tratamiento invasivo. Resultados recientes de este estudio, con seguimiento de los pacientes a 5 años, siguen mostrando un beneficio pronóstico de la EI para episodios mayores, pero a expensas de una menor tasa de infarto recurrente (12,9 frente a 17,7; p=0,002) y no de mortalidad14. En el análisis estratificado de acuerdo con la escala de riesgo clínico se demostró que el beneficio atribuible a la EI temprano se concentraba en los pacientes con signos isquémicos en el electrocardiograma y elevación de troponina. Además, el efecto beneficioso de la EI no se observó en mujeres ni fumadores.
El estudio TACTICS15 mostró una reducción del episodio combinado de muerte, infarto y rehospitalización a 6 meses de seguimiento en favor de la EI sobre la EC (el 15,9 frente al 19,4%; p=0,025). La tasa de reingreso por síndrome coronario agudo se redujo dramáticamente, mientras que la reducción de eventos mayores (a expensas de infarto pero no de muerte) también fue significativa (el 7,3 frente al 9,5%; odds ratio [OR]=0,74; IC del 95%, 0,54–1,00; p<0,05). En este trabajo se debe destacar que se llevó a cabo un manejo «óptimo», con uso de inhibidores IIb/IIIa en todos los casos y coronariografía (en el grupo invasivo) entre las 4 y las 48h tras el ingreso. En este estudio se volvió a corroborar que los subgrupos de población que más se beneficiaron de una EI fueron los que presentaron un descenso del segmento ST, elevación de marcadores de necrosis miocárdica o los clasificados de «alto riesgo» según la puntuación de riesgo TIMI.
El ensayo RITA-316 incluyó a 1.810 pacientes entre 1997 y 2001, con predominio de pacientes sin criterios de alto riesgo (predominio de angina inestable). El manejo fue más parecido a los observados en los estudios observacionales actuales (tabla 1). El objetivo (muerte, infarto agudo de miocardio [IAM] o angina refractaria a los 4 meses) se redujo significativamente con la EI a expensas del componente más blando. En cuanto a episodios mayores (muerte o infarto), no se observaron diferencias a los 4 meses ni al año de seguimiento. Sin embargo, con un seguimiento mayor (mediana de seguimiento de 5 años), los pacientes asignados a una EI presentaron una menor frecuencia de muerte/infarto (el 16,6 frente al 20%; RR=0,78; IC del 95%, 0,61–0,99; p=0,044), con beneficios similares para cada uno de los componentes del episodios compuesto17.
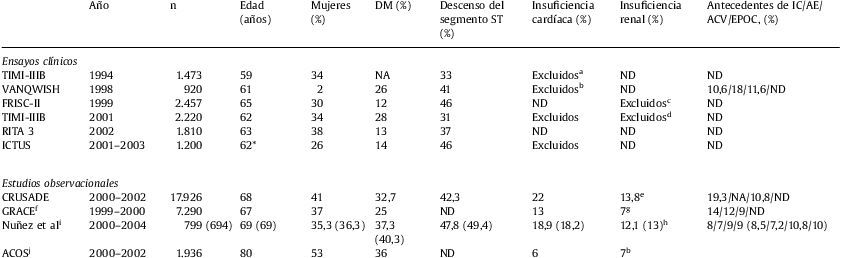
Comparación entre el perfil de riesgo de los diferentes estudios que evalúan la eficacia pronóstica de una estrategia de revascularización invasiva frente a otra conservadora en sujetos con SCASEST
| Año | n | Edad (años) | Mujeres (%) | DM (%) | Descenso del segmento ST (%) | Insuficiencia cardíaca (%) | Insuficiencia renal (%) | Antecedentes de IC/AE/ACV/EPOC, (%) | |
| Ensayos clínicos | |||||||||
| TIMI-IIIB | 1994 | 1.473 | 59 | 34 | NA | 33 | Excluidosa | ND | ND |
| VANQWISH | 1998 | 920 | 61 | 2 | 26 | 41 | Excluidosb | ND | 10,6/18/11,6/ND |
| FRISC-II | 1999 | 2.457 | 65 | 30 | 12 | 46 | ND | Excluidosc | ND |
| TIMI-IIIB | 2001 | 2.220 | 62 | 34 | 28 | 31 | Excluidos | Excluidosd | ND |
| RITA 3 | 2002 | 1.810 | 63 | 38 | 13 | 37 | ND | ND | ND |
| ICTUS | 2001–2003 | 1.200 | 62* | 26 | 14 | 46 | Excluidos | ND | ND |
| Estudios observacionales | |||||||||
| CRUSADE | 2000–2002 | 17.926 | 68 | 41 | 32,7 | 42,3 | 22 | 13,8e | 19,3/NA/10,8/ND |
| GRACEf | 1999–2000 | 7.290 | 67 | 37 | 25 | ND | 13 | 7g | 14/12/9/ND |
| Nuñez et ali | 2000–2004 | 799 (694) | 69 (69) | 35,3 (36,3) | 37,3 (40,3) | 47,8 (49,4) | 18,9 (18,2) | 12,1 (13)h | 8/7/9/9 (8,5/7,2/10,8/10) |
| ACOSj | 2000–2002 | 1.936 | 80 | 53 | 36 | ND | 6 | 7b | |
AE. apoplejía encefálica; ACV: accidente cerebrovascular; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; IC: insuficiencia cardíaca; ND: información no disponible; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
En resumen, los 3 estudios anteriores mostraron de forma homogénea un beneficio pronóstico atribuible a la EI a expensas de una reducción de los componentes menores de los criterios de valoración compuestos. En cuanto a episodios mayores, estos estudios mostraron que la adopción de una EI se asoció a una reducción del riesgo para éstos, en particular, con la extensión del seguimiento a largo plazo.
Las recomendaciones actuales de actuación que sugieren una EI rutinaria en todos los pacientes con SCASEST de riesgo elevado se basaron en la evidencia aportada por los anteriores estudios2,18.
Sin embargo, en el año 2005 se publicaron los resultados del ensayo ICTUS19 en el cual se aleatorizó a 1.200 pacientes con elevación de troponina T y signos electrocardiográficos de isquemia o antecedentes documentados de cardiopatía isquémica a recibir una EI temprana o EC. Al año de seguimiento, la aparición del episodio principal (muerte, infarto recurrente no fatal y reingreso por angina) fue similar entre ambos grupos de tratamiento (el 22,7 frente al 21,2%; RR=1,07; IC del 95%, 0,87–1,33; p=0,33). La mortalidad fue similar en ambos grupos, sin embargo, el reinfarto fue más frecuente en los pacientes asignados a una EI (el 15 frente al 10%; p=0,005), mientras que la rehospitalización fue más frecuente en el grupo de EC (el 7,4 frente al 10,9%; p=0,04). Los autores concluyeron que, con tratamiento médico optimizado, una EI no demostró ser superior a una estrategia selectivamente invasiva. Con respecto a este artículo, a diferencia de los anteriores, llaman la atención los siguientes puntos: a) la tasa de revascularización fue alta en ambos grupos (el 76 y el 40% durante la hospitalización inicial, y el 79 y el 54% tras un año de seguimiento en el grupo de EI y EC, respectivamente); b) la mortalidad al año fue baja en ambos grupos (2,5%), a pesar de que se incluyeron teóricos pacientes de «alto riesgo», y c) el reinfarto se definió como cualquier elevación de fracción MB de la creatincinasa (CK-MB), independientemente si fue espontánea o ligada al procedimiento. Como era de esperar, la mayoría de los infartos se constataron tras un procedimiento y fueron de reducido tamaño. En este estudio se aplicó la definición actual de infarto de la ESC/ACC20, a diferencia de las definiciones utilizadas en estudios previos, que elevaron el umbral de marcadores para el diagnóstico de infartos secundarios a un procedimiento intervencionista (tabla 2). Recientemente, los resultados publicados a 3 años de seguimiento muestran un beneficio marginal a favor de una EI para el objetivo compuesto primario a expensas de menos reingresos; se observó, a un año, una mayor frecuencia de reinfarto periprocedimiento en los pacientes asignados a una EI y ausencia de diferencias en mortalidad e infarto espontáneo21.
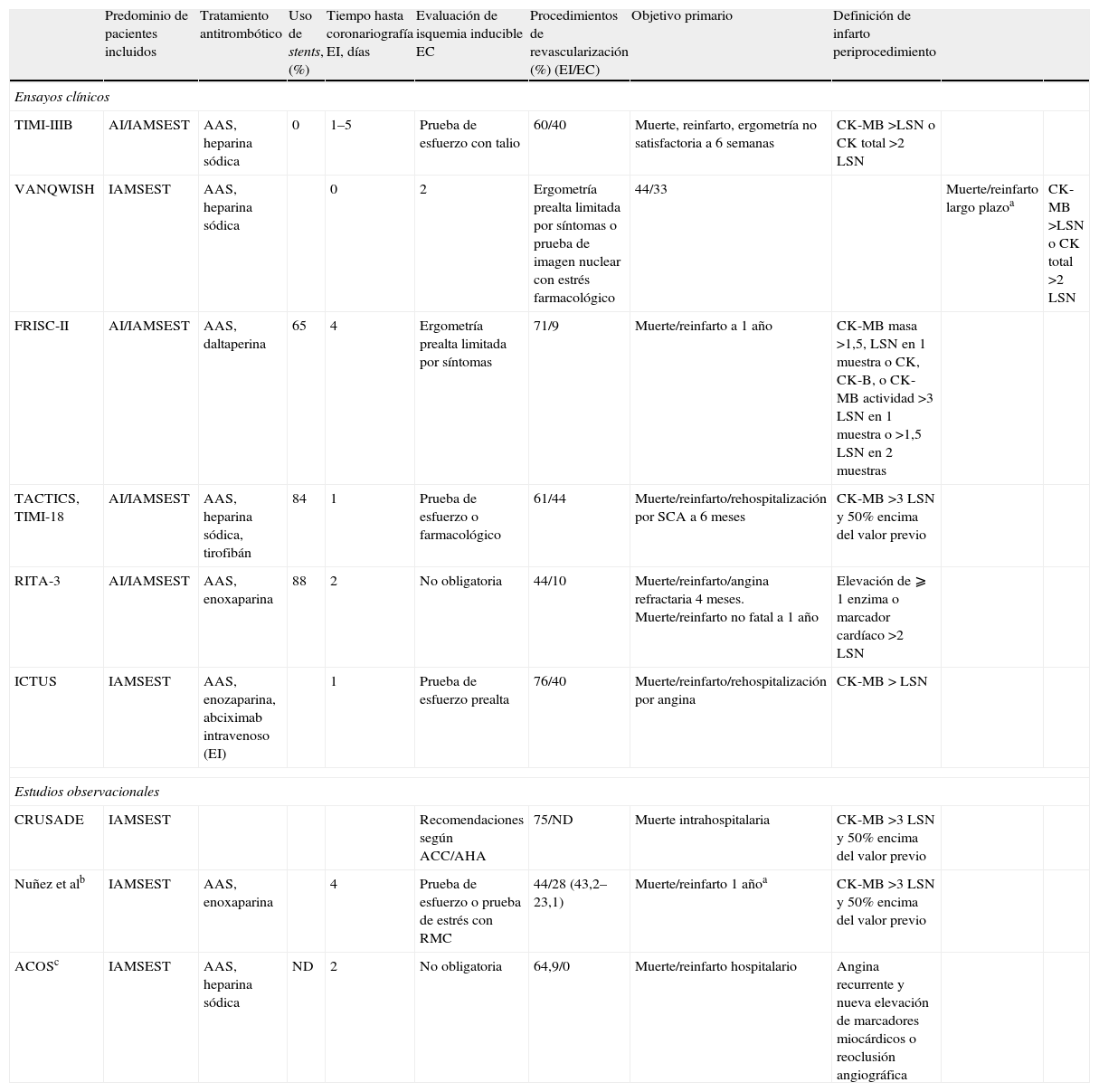
Diferencias en la metodología y criterios de valoración entre los principales estudios
| Predominio de pacientes incluidos | Tratamiento antitrombótico | Uso de stents, (%) | Tiempo hasta coronariografía EI, días | Evaluación de isquemia inducible EC | Procedimientos de revascularización (%) (EI/EC) | Objetivo primario | Definición de infarto periprocedimiento | |||
| Ensayos clínicos | ||||||||||
| TIMI-IIIB | AI/IAMSEST | AAS, heparina sódica | 0 | 1–5 | Prueba de esfuerzo con talio | 60/40 | Muerte, reinfarto, ergometría no satisfactoria a 6 semanas | CK-MB >LSN o CK total >2 LSN | ||
| VANQWISH | IAMSEST | AAS, heparina sódica | 0 | 2 | Ergometría prealta limitada por síntomas o prueba de imagen nuclear con estrés farmacológico | 44/33 | Muerte/reinfarto largo plazoa | CK-MB >LSN o CK total >2 LSN | ||
| FRISC-II | AI/IAMSEST | AAS, daltaperina | 65 | 4 | Ergometría prealta limitada por síntomas | 71/9 | Muerte/reinfarto a 1 año | CK-MB masa >1,5, LSN en 1 muestra o CK, CK-B, o CK-MB actividad >3 LSN en 1 muestra o >1,5 LSN en 2 muestras | ||
| TACTICS, TIMI-18 | AI/IAMSEST | AAS, heparina sódica, tirofibán | 84 | 1 | Prueba de esfuerzo o farmacológico | 61/44 | Muerte/reinfarto/rehospitalización por SCA a 6 meses | CK-MB >3 LSN y 50% encima del valor previo | ||
| RITA-3 | AI/IAMSEST | AAS, enoxaparina | 88 | 2 | No obligatoria | 44/10 | Muerte/reinfarto/angina refractaria 4 meses. Muerte/reinfarto no fatal a 1 año | Elevación de ⩾ 1 enzima o marcador cardíaco >2 LSN | ||
| ICTUS | IAMSEST | AAS, enozaparina, abciximab intravenoso (EI) | 1 | Prueba de esfuerzo prealta | 76/40 | Muerte/reinfarto/rehospitalización por angina | CK-MB > LSN | |||
| Estudios observacionales | ||||||||||
| CRUSADE | IAMSEST | Recomendaciones según ACC/AHA | 75/ND | Muerte intrahospitalaria | CK-MB >3 LSN y 50% encima del valor previo | |||||
| Nuñez et alb | IAMSEST | AAS, enoxaparina | 4 | Prueba de esfuerzo o prueba de estrés con RMC | 44/28 (43,2–23,1) | Muerte/reinfarto 1 añoa | CK-MB >3 LSN y 50% encima del valor previo | |||
| ACOSc | IAMSEST | AAS, heparina sódica | ND | 2 | No obligatoria | 64,9/0 | Muerte/reinfarto hospitalario | Angina recurrente y nueva elevación de marcadores miocárdicos o reoclusión angiográfica | ||
AAS: acido acetilsalicílico; ACC/AHA: American College of Cardiology/American Heart Association; AI: angina inestable; CK: creatincinasa total; CK-MB: fracción MB de la creatincinasa; EC: estrategia conservadora; EI: estrategia invasiva; IAMEST: infarto agudo sin elevación del segmento ST; LSN: límite superior de la normalidad.
En un afán de poder compilar toda la evidencia proveniente de los ensayos clínicos mencionados anteriormente, se han publicado tres importantes metaanálisis en los últimos años20–22. En los 2 primeros22,23 los pacientes aleatorizados a una EI presentaron una disminución significativa de la frecuencia de reinfarto no fatal, sin diferencias en cuanto a mortalidad. El tercero, recientemente publicado24 y que incluyó 2 nuevos ensayos clínicos (entre ellos el ICTUS) y los resultados a 5 años del FRISC-II y del RITA-3, no halló diferencias significativas entre ambos tipos de estrategias para episodios mayores (RR=0,9; IC del 95%, 0,74–1,08) muerte ni infarto cuando fueron valorados como episodios aislados. En un análisis de sensibilidad, excluyendo del anterior metaananálisis el estudio ICTUS, los autores, en concordancia con los 2 metaanálisis previos, reportaron un menor riesgo de reinfarto no fatal en los pacientes asignados a una EI.
En resumen, y basados en la evidencia anteriormente expuesta, concluimos que la adopción de una EI frente a una EC se asoció a un menor riesgo de complicaciones menores (reingresos, revascularización postalta) en pacientes con SCASEST; sin embargo, ese beneficio sigue siendo discutible cuando se evalúan episodios mayores.
Estudios observacionalesA pesar de la limitación inherente de los estudios observacionales, los resultados obtenidos de estos registros son importantes dado que reflejan el perfil de los pacientes habitualmente observados en la práctica clínica diaria. En este sentido, difieren de la mayoría de estudios aleatorizados que limitan la validación externa de los resultados a grupos de pacientes idealmente seleccionados, a expensas de una sólida validez interna. En el registro multicéntrico CRUSADE se analizó a 17.926 pacientes con tratamiento farmacológico óptimo, de los que a 8.037 (44,8%) se les practicó una coronariografía dentro de las primeras 48h. Tras un minucioso ajuste mediante emparejamiento por índice de propensión, los autores observaron de que la EI se asoció a menor riesgo de mortalidad hospitalaria (el 2,5 frente a 3,7%; p<0,001) cuando se comparó con la EC25.
En nuestro medio, nuestro grupo de trabajo ha publicado 2 estudios observacionales comparando 2 cohortes cronológicas consecutivas recientes. En la primera se seguía una estrategia de revascularización selectivamente invasiva y en la segunda se recomendaba por protocolo de servicio una EI en los pacientes con SCASEST de alto riesgo. A corto plazo constatamos, tras un escrupuloso ajuste por reconocidas variables pronósticas y confusoras, que la adopción de una EI se asoció a una disminución del riesgo del episodio combinado (muerte, reinfarto, revascularización) a 12 semanas del 25%26. A un año de seguimiento y limitando el análisis a una población con elevación de troponina I y/o descenso del segmento ST, observamos una reducción ajustada y significativa del riesgo del episodio combinado muerte/reinfarto no fatal del 29% en la cohorte de población que siguió una estrategia de revascularización invasiva27. En concordancia con estos resultados, la EI se ha asociado a menor riesgo de episodios adversos en otros estudios observacionales contemporáneos en subgrupos de población clásicamente infrarepresentados en los estudios aleatorizados, como los ancianos28. En resumen, y en función de los resultados provenientes de los registros observacionales, se constata que la adopción de una EI se asocia a reducciones de riesgo de mayor magnitud que las halladas en los estudios aleatorizados.
La comparación directa entre los resultados obtenidos de los estudios observacionales y de los ensayos clínicos lleva consigo numerosas dificultades debido a la heterogeneidad en el perfil de riesgo y la metodología empleada, hecho que explica, al menos en parte, las diferencias observados entre ambos contextos29.
Motivos que dificultan la interpretación de los resultadosA continuación, presentamos las razones que potencialmente explican los resultados conflictivos provenientes tanto de ensayos clínicos como de estudios observacionales:
Perfil de riesgo de la población estudiadaLos pacientes incluidos en los ensayos clínicos son pacientes seleccionados con un perfil de riesgo muy diferente de los observados en la práctica clínica diaria. Pensamos que este hecho se ve reflejado en las diferencias observadas en la incidencia de episodios clínicos adversos que varían ampliamente entre los estudios aleatorizados y los estudios observacionales. Por ejemplo, las tasas de mortalidad varían desde las cifras del 2,5% al año observada en el estudio ICTUS a cifras intrahospitalarias que superan con creces este porcentaje en registros contemporáneos25,30, lo que corrobora que las poblaciones estudiadas difieren en su riesgo basal.
Numerosas publicaciones han subrayado el impacto pronóstico de algunas condiciones asociadas, como la ancianidad, la inestabilidad hemodinámica y la comorbilidad vascular y extravascular acompañante31,32. Aunque teóricamente en los ensayos clínicos se incluye a pacientes etiquetados de “alto riesgo” basados en la presencia de alteraciones del segmento ST y elevación de marcadores de necrosis miocárdica, éstos usualmente son más jóvenes, con mayor predominio de varones, menor prevalencia de diabetes, escasa comorbilidad y complicaciones hemodinámicas que lo que habitualmente se constata en la práctica clínica diaria (tabla 1). Consideramos, por tanto, que la inclusión de pacientes en esos estudios es sesgada y limitada sólo a algunas características de riesgo, infrarrepresentando así a los pacientes que poseen, además, enfermedades o procesos concomitantes que elevan drásticamente el riesgo de complicaciones y que además, según ciertos análisis post hoc parecen beneficiarse en mayor medida de una EI33,34. Este sesgo de selección a la hora de adoptar una estrategia de revascularización también se pone de relieve en estudios observacionales, como en el CRUSADE, donde las variables que se asociaron a un manejo invasivo fueron entre otras: pacientes jóvenes, varones, raza blanca, ausencia de insuficiencia cardíaca actual o previa, ausencia de insuficiencia renal, elevación de troponina y alteraciones electrocardiográficas compatibles con isquemia25. Nos parece contraproducente que se pretenda conocer la eficacia clínica de una estrategia terapéutica sobre una patología excluyendo a los sujetos con mayor riesgo de complicaciones.
Metodología y protocolos de actuación empleadosPor razones lógicas, son pocos los escenarios donde es tan frecuente la variabilidad en el porcentaje de sujetos en los que habiéndose asignado una intervención se lleva a cabo ésta. El primer hecho a apuntar es la amplia variabilidad observada entre las frecuencias de revascularización intrahospitalaria en los sujetos asignados a cada una de las estrategias de revascularización; por ejemplo, las cifras de revascularización intrahospitalaria en los sujetos asignados a EI variaron desde el 76 y el 60% en los estudios ICTUS y FRISC-II a cifras del 44% en el estudio RITA-3 para la rama invasiva. Estas variaciones en las tasas de revascularización también se observaron en los pacientes asignados a EC; en el estudio FRISCII la revascularización intrahospitalaria en este brazo sólo llegó al 9%, mientras que en el estudio ICTUS el porcentaje de revascularizaciones fue del 40%. Esta dispersión en la frecuencia de revascularización es tan llamativa que las cifras obtenidas en la EC en el estudio ICTUS (40%) fueron equiparables las de la EI en el estudio RITA-3 (44%) (tabla 2). Lo anterior conlleva a sugerir que, aparte de la diferencias en el perfil de riesgo basal, las indicaciones de coronariografía, especialmente en la rama conservadora, son dispares y/o basadas criterios con alto grado variabilidad. Por ejemplo, en 2 estudios importantes no se realizó rutinariamente una prueba de estrés antes del alta hospitalaria4,16, mientras que en otros 2 estudios a los pacientes que no pudieron ejecutar una prueba de esfuerzo no se les practicó otra prueba de provocación de isquemia alternativa11,17 (tabla 2).
Otros puntos que hacen difícil la interpretación y comparación de los resultados entre los distintos trabajos y más aún su extrapolación a la población de pacientes habitualmente encontrados en la practica clínica diaria está en las diferentes estrategias ancilares de tratamiento empleadas en los distintos estudios; por ejemplo, el empleo de stents coronarios fue sistemático en 6 estudios13,15,16,19, no así en el TIMI-IIIB y VANQWISH. En cuanto al régimen antitrombótico, también se constata una elevada variabilidad: mientras los primeros estudios utilizaron heparina sódica e incluso trombolíticos en porcentaje no despreciable de pacientes (el 49 y el 13% de los pacientes del estudio TIMI- IIIB y VANQWISH recibieron trombolíticos, respectivamente), el empleo de inhibidores de la glucoproteína IIb-IIIa fue sistemático en 2 importantes estudios15,19, menor del 25% en otros 213,16 y otros no describieron el uso de estos fármacos3–5.
Además, hay que resaltar que el uso «ideal» de estrategias terapéuticas de contrastada eficacia en los ensayos clínicos difiere en gran medida de las observadas en los grandes registros contemporáneos30.
Criterios de valoración principal y definición de éstosSon fundamentalmente dos los aspectos a este respecto que merecen anotarse:
Diferentes criterios de valoración principal para cada estudioLa mayor parte de los estudios basan el cálculo del tamaño muestral en criterios de valoración principal compuestos de elementos con distinto impacto pronóstico, lo que genera cierto grado de incertidumbre cuando se extraen conclusiones de episodios adversos aislados que no constituyeron el objetivo primario del estudio. Por otro lado, la utilización de episodios combinados como criterio de valoración principal es fuente de numerosas críticas, especialmente en el área cardiovascular35–37. Se sugiere que cada uno de los sucesos valorados dentro de un objetivo combinado tenga una importancia clínica similar, hecho que no se cumple cuando se incluyen episodios mortales y no mortales dentro del criterio de valoración compuesto, y dentro de estos últimos, especialmente cuando éstos no tienen la misma importancia biológica ni pronóstica. Recientemente, Ferreira-González et al37, basándose en una revisión sistemática de ensayos clínicos cardiovasculares, concluyeron que el uso de episodios compuestos es muy frecuente y el beneficio terapéutico atribuido a alguna estrategia terapéutica se basa habitualmente en disminución de episodios adversos menores, y por tanto, a una apreciación errónea del impacto de un tratamiento sobre el pronóstico final del paciente, hecho que se constata en este mismo escenario.
Definición de episodios adversosLa definición de infarto, tanto espontáneo como periprocedimiento, es fuente importante de variabilidad; por ejemplo, en los estudios FRISC-II y TACTIS la definición de infarto varió entre ambas estrategias, a diferencia del RITA-3 e ICTUS que emplearon una definición común para infarto de miocardio. En cuanto al infarto periprocedimiento, la variabilidad es importante, en particular cuando los criterios para definir éstos son dispares entre los diferentes estudios (tabla 2). Aunque diversos trabajos corroboran el efecto pronóstico negativo de los “infartos periprocedimiento”38, hay otros que matizan esta afirmación y sugieren un efecto pronóstico adverso en función de la magnitud de la elevación y de factores como el éxito angiográfico o el correlato electrocardiográfico39,40, punto éste que sigue siendo motivo de actual controversia. El estudio ICTUS definió infarto a cualquier elevación de CK-MB periprocedimiento, y tanto a 1 como 3 años mostró una frecuencia superior de reinfarto en los pacientes sometidos a una EI, la mayoría de ellos intrahospitalarios y periprocedimiento, llamando la atención que su presencia no se asoció a un aumento de mortalidad a largo plazo20,41.
ConclusionesLa evidencia actual disponible sugiere una disminución de episodios menores cuando se emplea una EI en el manejo de pacientes con SCASEST. Sin embargo, no existe información sólida que demuestre que una EI frente a una EC aporte beneficios en la reducción de episodios mayores. Para llegar a conclusiones definitivas, se necesitan futuros estudios aleatorizados que, entre otros: a) proporcionen mayor validez externa, ampliando la inclusión a amplios subgrupos de población con SCASEST observados en la clínica diaria y, en particular, aquellos donde la evidencia sea escasa o aún más conflictiva; b) uniformicen los protocolos de actuación, y c) homogeneicen los objetivos a estudio y sus definiciones. Sólo en esas circunstancias conoceremos el impacto real de un tipo u otro de estrategia de revascularización en el manejo del SCASEST.
FinanciaciónEste estudio se realizó con la ayuda del Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III, RED HERACLES RD06/0009/1001 (Madrid, España).