La hiperlipidemia familiar combinada (HFC) es un modelo genético de dislipidemia aterogénica con insulinorresistencia y cardiopatía isquémica precoz. Nuestro objetivo fue evaluar la presencia de alteraciones a nivel carotídeo, como marcador de arteriosclerosis sistémica, en sujetos con HFC, y valorar el efecto del tratamiento con 80mg de atorvastatina diarios durante 2 años sobre el grosor de la placa de ateroma.
Sujetos y métodosEstudiamos 100 sujetos con HFC sin diabetes en prevención primaria reclutados consecutivamente. Se determinaron parámetros clínicos y bioquímicos, y se realizó ecografía carotídea. En los sujetos con placa de ateroma se inició tratamiento con 80mg de atorvastatina durante 2 años.
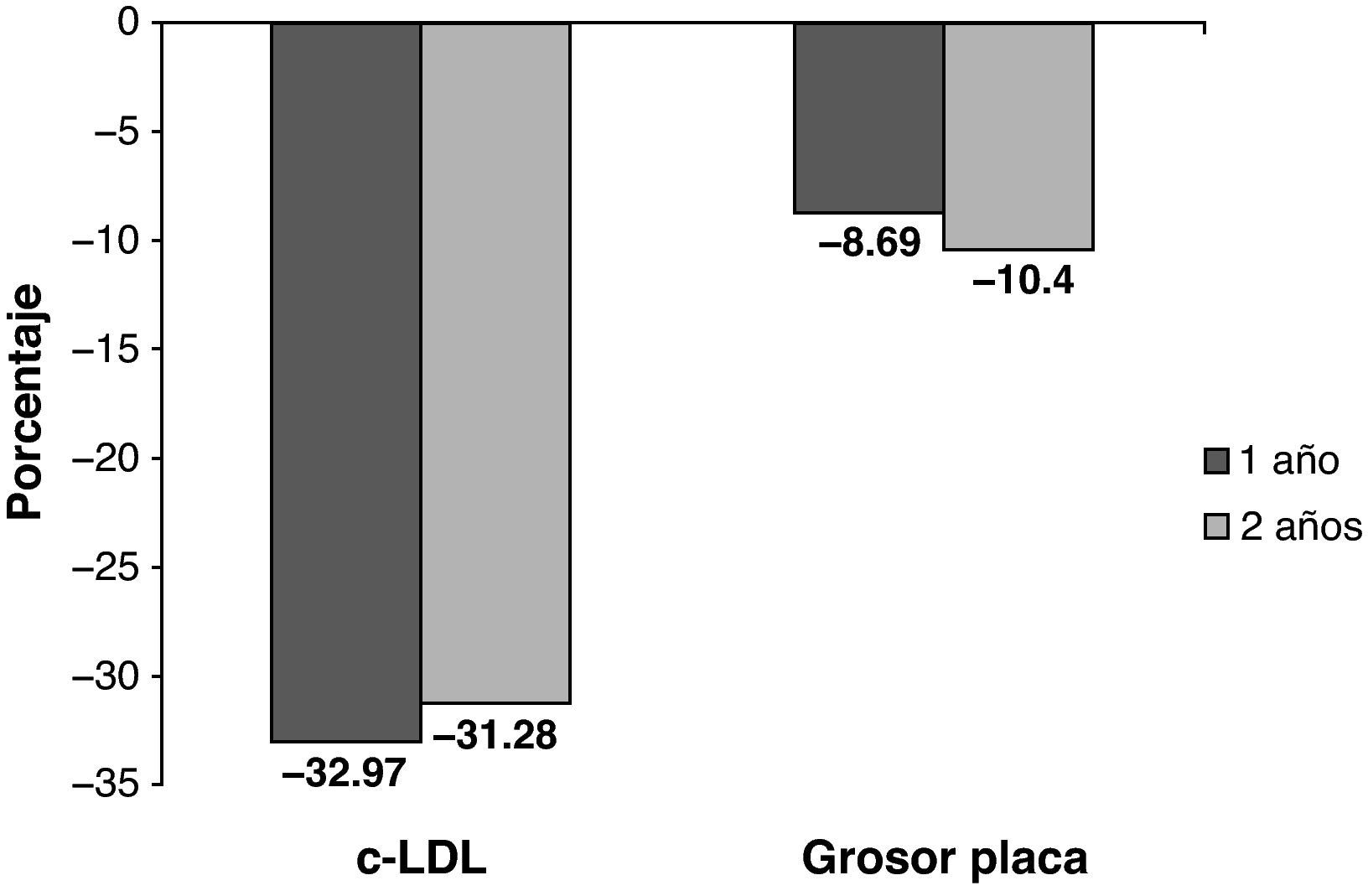
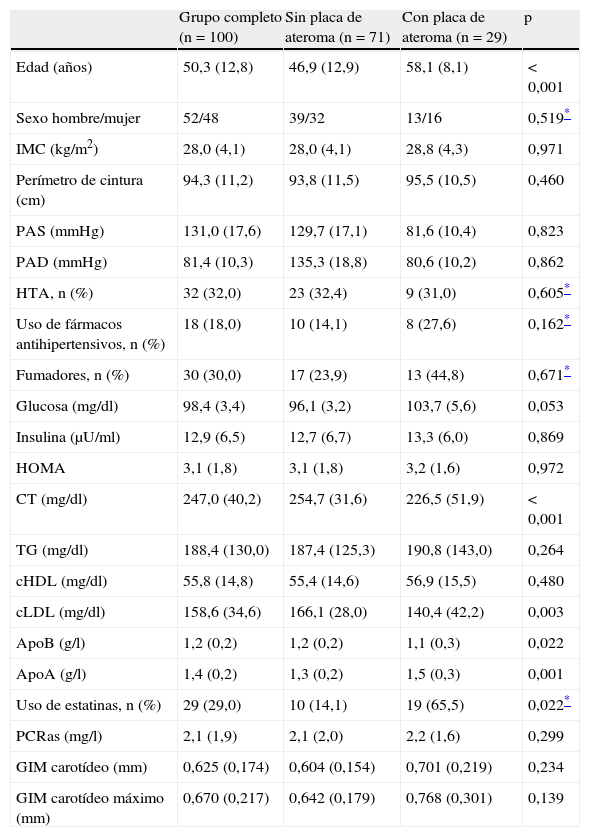
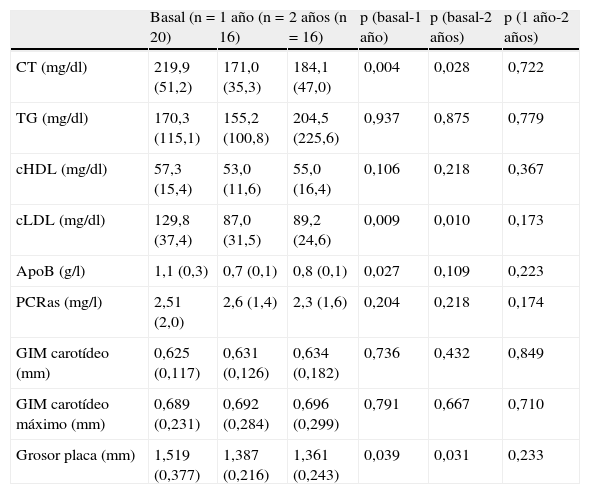
ResultadosEl 29% de los pacientes presentaban placa de ateroma. No encontramos diferencias significativas entre los sujetos con y sin placa de ateroma en ninguno de los parámetros que permitiera predecir qué sujetos con HFC serían susceptibles de desarrollar arteriosclerosis subclínica. Veinte sujetos con placa de ateroma aceptaron participar en el estudio de intervención. Tras 2 años hubo una reducción significativa de las cifras de cLDL (30%) y del grosor de la placa de ateroma (10%).
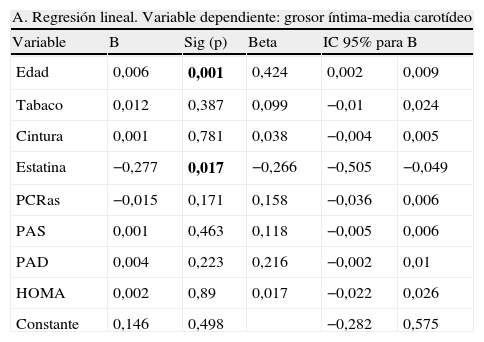
DiscusiónLa ecografía carotídea es útil para detectar arteriosclerosis subclínica en pacientes de alto riesgo cardiovascular como son los sujetos con HFC. Además, el tratamiento con dosis elevadas de atorvastatina induce una regresión de la placa de ateroma mantenida tras 2 años de tratamiento. Nuestros datos sugieren que el tratamiento intensivo con atorvastatina podría ser beneficioso para reducir el desarrollo de enfermedad cardiovascular en este grupo de pacientes.
Familial combined hyperlipidemia (FCH) is a genetic model of atherogenic dyslipidemia with insulin resistance and early coronary disease. Our objective was to evaluate the presence of carotid alterations as a marker of systemic atherosclerosis in subjects with FCH and assess the effect of 80mg of atorvastatin per day in carotid plaque thickness after 2years.
Subjects and methods100 non diabetic subjects with FCH in primary prevention were consecutively included. Clinical and biochemical parameters and carotid ultrasonography were performed. Subjects with carotid plaque started treatment with 80mg of atorvastatin per day for 2years.
Results29% of subjects had carotid plaques. We did not find significant differences in any of the parameters between subjects with presence or absence of carotid plaques. Twenty subjects with carotid plaques accepted/agreed to participate in the interventional study. Two years follow-up showed a significant reduction in LDLc (30%) and carotid plaque thickness (10%).
ConclusionCarotid ultrasonography is useful to detect subclinical atherosclerosis in high risk cardiovascular patients such as subjects with FCH. Treatment with high doses of atorvastatin induces the regression of carotid plaque thickness after 2years follow-up. Our results suggest that intensive treatment with atorvastatin could be useful to reduce the development of cardiovascular disease in this group of patients.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora