El ancho de distribución eritrocitaria (ADE) es una medida cuantitativa de la variabilidad del tamaño de los eritrocitos circulantes utilizada clásicamente para el diagnóstico diferencial de las anemias. En los últimos años, se ha sugerido que el ADE podría ser un marcador pronóstico útil en pacientes con insuficiencia cardiaca crónica. Sin embargo, es escasa la evidencia que respalda su papel en población no seleccionada con insuficiencia cardiaca aguda (ICA), de manera independiente a los factores de riesgo establecidos. El objetivo del estudio fue establecer la asociación entre el ADE y la mortalidad a largo plazo en pacientes ingresados por ICA.
Pacientes y métodoSe analizaron 1.190 pacientes consecutivos ingresados por ICA en nuestro centro. A todos los pacientes se les realizó una determinación de ADE durante el ingreso. Los valores del ADE se estratificaron en cuartiles (Q) y su asociación con la mortalidad total se evaluó mediante regresión de Cox.
ResultadosTras una mediana de seguimiento de 15 meses (intervalo intercuartílico 3-33 meses) se identificaron 458 (38%) muertes. Se observó un incremento progresivo de las tasas de mortalidad desde Q1 a Q4: 1,34, 1,82, 2,56 y 3,53 por 10 pacientes-año de seguimiento para Q1, Q2, Q3 y Q4, respectivamente (p de la tendencia<0,001). En el análisis multivariante, esta asociación se mantuvo independiente para los pacientes pertenecientes a Q3 (15-16%) y Q4 (>16%) frente a Q1 (≤14%): hazard ratio [HR] 1,66, intervalo de confianza del 95% [IC 95%] 1,24-2,22, p<0,01; y HR 1,80, IC 95% 1,33-2,43, p<0,01, respectivamente, en un modelo ajustado por las variables pronósticas establecidas en ICA.
ConclusiónEn pacientes con ICA los valores elevados del ADE se asocian a una mayor mortalidad a largo plazo.
Red cell distribution width (RDW) is a quantitative measure of the variability in size of erythrocytes, and it is used for the differential diagnosis of anemia. Recent reports have suggested that high RDW could play a role for risk stratification in patients with chronic heart failure. However, the prognostic role of RDW in unselected population with acute heart failure (AHF), after a thoroughly multivariate adjustment, has not been well established. The aim of this study was to establish the association between RDW and long-term mortality in patients admitted for AHF.
Patients and methodWe analyzed 1,190 consecutive patients admitted for AHF in our center. RDW measurement was performed on admission. RDW values were stratified into quartiles (Q) and the association of RDW with total mortality was assessed using Cox regression.
ResultsAfter a median follow-up of 15 months (interquartile range 3-33 months) 458 (38%) deaths were identified. There was a progressive increase in mortality rates from Q1 to Q4: 1.34, 1.82, 2.56 and 3.53 per 10 patients-year of follow-up (for Q1, Q2, Q3 and Q4 respectively, P for trend <.001). In the multivariate analysis, this association remained independent for patients in Q3 (15-16%) and Q4 (>16%) versus Q1 (≤14%), hazard ratio (HR): 1.66, 95% confidence interval (95% CI) 1.24-2.22, P<.01, HR: 1.80, 95% CI 1.33-2.43, p<.01, respectively, in a model adjusted for established prognostic markers in AHF.
ConclusionIn patients with AHF, higher RDW values were associated with increased long-term mortality.
En los últimos años, está creciendo un gran interés por encontrar nuevos biomarcadores en insuficiencia cardiaca (IC) ampliamente accesibles, relacionados con procesos fisiopatológicos clave en la progresión de la enfermedad, que permitan mejorar la estratificación de riesgo de los pacientes y puedan tener potenciales implicaciones terapéuticas. Uno de estos biomarcadores en auge es el índice de ancho de distribución eritrocitaria (ADE), que representa la medida de la variabilidad del tamaño de los eritrocitos circulantes. En condiciones normales, esta sigue una distribución normal, donde el ADE representa el coeficiente de variación de dicha curva y habitualmente se expresa en porcentaje. Un aumento de su valor refleja procesos tanto de destrucción como de falta de producción de los hematíes, por lo que clásicamente ha sido utilizado en el diagnóstico diferencial de las anemias, y su determinación es rutinaria en los tests de laboratorio habituales1,2. En IC se ha observado que existe una correlación importante entre los valores de ADE y marcadores de inflamación crónica, signos de eritropoyesis ineficaz, menores valores de hierro sérico, ferritina o índice de saturación de la transferrina, y disfunción renal3. En un reciente trabajo, Pascual-Figal et al. mostraron que los valores elevados de ADE determinados durante un ingreso hospitalario por insuficiencia cardiaca aguda (ICA) se asociaron con el desarrollo de anemia de novo durante el seguimiento4. Sin embargo, ha sido la asociación del ADE con episodios adversos clínicos en IC lo que ha sido motivo de importante investigación clínica en los últimos años. Así pues, se ha señalado recientemente que valores elevados se asocian con mayor riesgo de mortalidad y hospitalizaciones en pacientes con IC estable, independientemente de la presencia o no de anemia, otras variables hematológicas, y otros marcadores de reconocido valor pronóstico, como los péptidos natriuréticos o el grado de disfunción renal5–7. Incluso se ha mostrado que podrían predecir el desarrollo de IC en población general8. Sin embargo, la mayor parte de los estudios han evaluado el marcador en el contexto de la IC estable. En el ámbito de la ICA disponemos de poca evidencia de su utilidad práctica, dado que se han desarrollado escasos estudios y con algunas limitaciones: a) no han incluido covariables de reconocido valor pronóstico, como son la función renal, la fracción de eyección9, o los péptidos natriuréticos10, y b) se han realizado en población seleccionada en un contexto post hoc11. El objetivo de nuestro estudio fue evaluar la relación entre los valores de ADE al ingreso hospitalario en una serie amplia de pacientes no seleccionados ingresados por ICA, y la mortalidad en el seguimiento a largo plazo.
Pacientes y métodoEstudiamos una cohorte de 1.190 pacientes consecutivos, ingresados en el Servicio de Cardiología del Hospital Clínico Universitario de Valencia desde junio de 2003 hasta el 1 de julio de 2009 con el diagnóstico de ICA. Esta se definió como la presencia de síntomas o signos secundarios a una función cardiaca anormal, así como de anomalías estructurales o funcionales del corazón como cardiomegalia, tercer ruido o soplo cardiaco, anormalidades en el estudio ecocardiográfico o elevación de los valores séricos de péptidos natriuréticos, siguiendo las recomendaciones europeas vigentes12,13. Excluimos los pacientes que, en el momento del ingreso, presentaban otros procesos que podrían interferir en los valores de las variables estudiadas, como fueron: trastornos hematológicos (n=12), neumonías (n=16), cáncer (n=18), sepsis (n=8) y enfermedades inflamatorias crónicas (n=11). A todos ellos se les realizó una determinación de ADE en el momento del ingreso hospitalario usando un contador automático de células sanguíneas. Se definió la presencia de anemia de acuerdo con los criterios de la Organización Mundial de la Salud: hemoglobina<13g/dl en varones y<12g/dl en mujeres14. La fracción de eyección se obtuvo mediante ecocardiografía realizada durante el ingreso hospitalario (Sonos 5500, Philips, Massachusetts, EE.UU.).
El seguimiento de los pacientes se realizó durante una mediana de 15 meses (intervalo intercuartílico 3-33 meses) y su seguimiento se censuró en caso de fallecimiento, cirugía de recambio valvular o trasplante cardiaco. La supervivencia se constató mediante visitas clínicas rutinarias o por contacto telefónico con el paciente o familiares, en su defecto. La información sobre las causas de la muerte se extrajo de la historia clínica, siendo adjudicadas por un investigador que desconocía los valores hematológicos. Estas se categorizaron de acuerdo con la clasificación de la American Heart Association15.
Análisis estadísticoLas variables continuas se expresaron como media (desviación estándar) o en forma de mediana (intervalo intercuartílico) si la variable no seguía una distribución normal de acuerdo con la prueba de Kolmogorov-Smirnov. Las variables discretas se presentaron en forma de porcentajes. Los valores del ADE se estratificaron en cuartiles (Q) y su relación con respecto a las características basales se contrastó mediante las pruebas de ji al cuadrado, ANOVA y Kruskal-Wallis para variables categóricas, continuas paramétricas y continuas no paramétricas, respectivamente. Se cuantificó también el valor de p de la tendencia. La asociación independiente entre los Q del ADE y la mortalidad total se evaluó mediante el análisis de regresión de Cox. Las covariables incluidas en el modelo multivariante se seleccionaron en base al conocimiento médico previo, independientemente del valor de p. Se incluyeron en el análisis multivariante final las siguientes covariables: edad, sexo, clase funcional de la New York Heart Association basal previa al ingreso, presión arterial sistólica al ingreso (PAS), IC previa, ictus, fibrilación auricular, sodio sérico, hemoglobina, CA125 sérico, urea sérica, brain natriuretic peptide (BNP, «péptido natriurético cerebral») sérico, frecuencia cardiaca al ingreso, fracción de eyección ventricular izquierda (FEVI), antecedente de cardiopatía isquémica y tratamiento con anticoagulantes o betabloqueantes. La capacidad discriminativa del modelo final se evaluó mediante el estadístico C de Harrell, y su calibración mediante el test de Hosmer-Lemeshov. Se consideró estadísticamente significativo para todos los análisis un valor de p<0,05. Todos los análisis se realizaron utilizando el programa estadístico Stata 11.1 (StataCorp LP, College Station, Texas, EE.UU.).
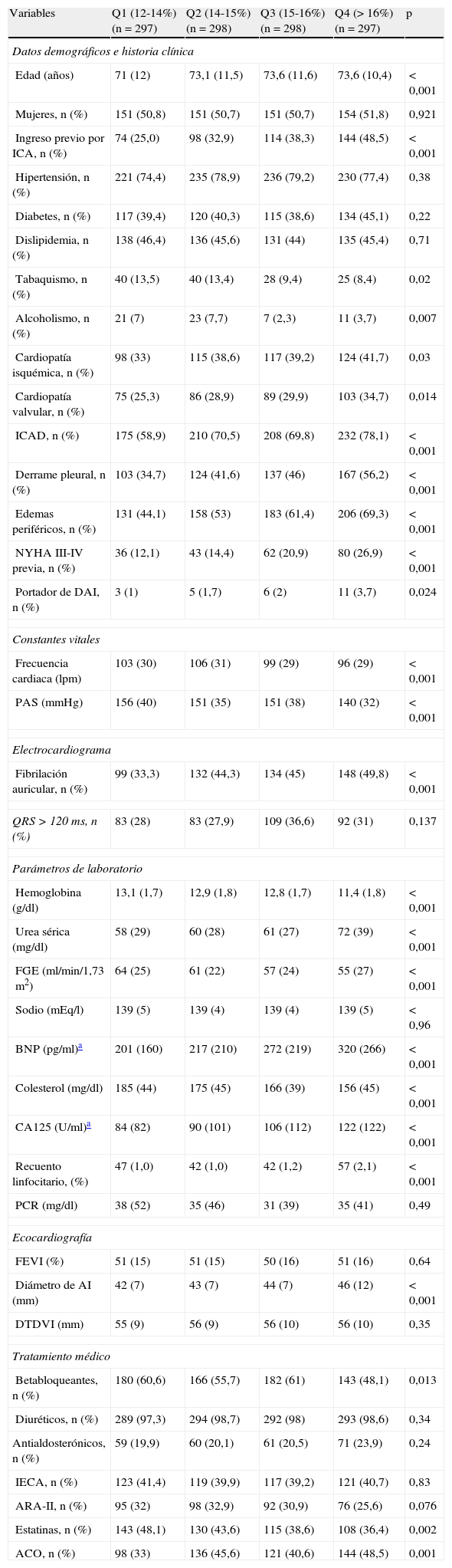
ResultadosLa media (DE) de edad de la población fue de 73 (11) años. El 50,8% fueron mujeres, el 54% presentaron una FEVI conservada (FE≥50%) y el 38,2% presentaban antecedentes de cardiopatía isquémica. La mediana de ADE fue del 15% (intervalo intercuartílico 14-16). Las características basales se compararon entre Q de ADE (tabla 1).
Características basales estratificadas por cuartiles de ancho de distribución eritrocitaria
| Variables | Q1 (12-14%) (n=297) | Q2 (14-15%) (n=298) | Q3 (15-16%) (n=298) | Q4 (>16%) (n=297) | p |
| Datos demográficos e historia clínica | |||||
| Edad (años) | 71 (12) | 73,1 (11,5) | 73,6 (11,6) | 73,6 (10,4) | <0,001 |
| Mujeres, n (%) | 151 (50,8) | 151 (50,7) | 151 (50,7) | 154 (51,8) | 0,921 |
| Ingreso previo por ICA, n (%) | 74 (25,0) | 98 (32,9) | 114 (38,3) | 144 (48,5) | <0,001 |
| Hipertensión, n (%) | 221 (74,4) | 235 (78,9) | 236 (79,2) | 230 (77,4) | 0,38 |
| Diabetes, n (%) | 117 (39,4) | 120 (40,3) | 115 (38,6) | 134 (45,1) | 0,22 |
| Dislipidemia, n (%) | 138 (46,4) | 136 (45,6) | 131 (44) | 135 (45,4) | 0,71 |
| Tabaquismo, n (%) | 40 (13,5) | 40 (13,4) | 28 (9,4) | 25 (8,4) | 0,02 |
| Alcoholismo, n (%) | 21 (7) | 23 (7,7) | 7 (2,3) | 11 (3,7) | 0,007 |
| Cardiopatía isquémica, n (%) | 98 (33) | 115 (38,6) | 117 (39,2) | 124 (41,7) | 0,03 |
| Cardiopatía valvular, n (%) | 75 (25,3) | 86 (28,9) | 89 (29,9) | 103 (34,7) | 0,014 |
| ICAD, n (%) | 175 (58,9) | 210 (70,5) | 208 (69,8) | 232 (78,1) | <0,001 |
| Derrame pleural, n (%) | 103 (34,7) | 124 (41,6) | 137 (46) | 167 (56,2) | <0,001 |
| Edemas periféricos, n (%) | 131 (44,1) | 158 (53) | 183 (61,4) | 206 (69,3) | <0,001 |
| NYHA III-IV previa, n (%) | 36 (12,1) | 43 (14,4) | 62 (20,9) | 80 (26,9) | <0,001 |
| Portador de DAI, n (%) | 3 (1) | 5 (1,7) | 6 (2) | 11 (3,7) | 0,024 |
| Constantes vitales | |||||
| Frecuencia cardiaca (lpm) | 103 (30) | 106 (31) | 99 (29) | 96 (29) | <0,001 |
| PAS (mmHg) | 156 (40) | 151 (35) | 151 (38) | 140 (32) | <0,001 |
| Electrocardiograma | |||||
| Fibrilación auricular, n (%) | 99 (33,3) | 132 (44,3) | 134 (45) | 148 (49,8) | <0,001 |
| QRS>120ms, n (%) | 83 (28) | 83 (27,9) | 109 (36,6) | 92 (31) | 0,137 |
| Parámetros de laboratorio | |||||
| Hemoglobina (g/dl) | 13,1 (1,7) | 12,9 (1,8) | 12,8 (1,7) | 11,4 (1,8) | <0,001 |
| Urea sérica (mg/dl) | 58 (29) | 60 (28) | 61 (27) | 72 (39) | <0,001 |
| FGE (ml/min/1,73m2) | 64 (25) | 61 (22) | 57 (24) | 55 (27) | <0,001 |
| Sodio (mEq/l) | 139 (5) | 139 (4) | 139 (4) | 139 (5) | <0,96 |
| BNP (pg/ml)a | 201 (160) | 217 (210) | 272 (219) | 320 (266) | <0,001 |
| Colesterol (mg/dl) | 185 (44) | 175 (45) | 166 (39) | 156 (45) | <0,001 |
| CA125 (U/ml)a | 84 (82) | 90 (101) | 106 (112) | 122 (122) | <0,001 |
| Recuento linfocitario, (%) | 47 (1,0) | 42 (1,0) | 42 (1,2) | 57 (2,1) | <0,001 |
| PCR (mg/dl) | 38 (52) | 35 (46) | 31 (39) | 35 (41) | 0,49 |
| Ecocardiografía | |||||
| FEVI (%) | 51 (15) | 51 (15) | 50 (16) | 51 (16) | 0,64 |
| Diámetro de AI (mm) | 42 (7) | 43 (7) | 44 (7) | 46 (12) | <0,001 |
| DTDVI (mm) | 55 (9) | 56 (9) | 56 (10) | 56 (10) | 0,35 |
| Tratamiento médico | |||||
| Betabloqueantes, n (%) | 180 (60,6) | 166 (55,7) | 182 (61) | 143 (48,1) | 0,013 |
| Diuréticos, n (%) | 289 (97,3) | 294 (98,7) | 292 (98) | 293 (98,6) | 0,34 |
| Antialdosterónicos, n (%) | 59 (19,9) | 60 (20,1) | 61 (20,5) | 71 (23,9) | 0,24 |
| IECA, n (%) | 123 (41,4) | 119 (39,9) | 117 (39,2) | 121 (40,7) | 0,83 |
| ARA-II, n (%) | 95 (32) | 98 (32,9) | 92 (30,9) | 76 (25,6) | 0,076 |
| Estatinas, n (%) | 143 (48,1) | 130 (43,6) | 115 (38,6) | 108 (36,4) | 0,002 |
| ACO, n (%) | 98 (33) | 136 (45,6) | 121 (40,6) | 144 (48,5) | 0,001 |
ACO: anticoagulación oral; AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; BNP: brain natriuretic peptide («péptido natriurético cerebral»); CA 125: antígeno carbohidrato 125; DAI: desfibrilador automático implantable; DTDVI: diámetro telediastólico de ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; FGE: filtrado glomerular estimado; ICA: insuficiencia cardiaca aguda; ICAD: insuficiencia cardiaca aguda descompensada; IECA: inhibidores de la enzima conversiva de la angiotensina; NYHA: New York Heart Association; PAS: presión arterial sistólica; PCR: proteína C reactiva; Q: cuartiles.
Las variables cuantitativas se expresan como media (desviación estándar), excepto si se señala lo contrario, y las variables categóricas se expresan como porcentajes.
En general, se observó una asociación entre la mayoría de las variables relacionadas con la gravedad de la enfermedad y los valores de ADE (tabla 1). Es de resaltar que no se observó relación alguna entre la FEVI y los valores de ADE.
La presencia de edemas tibiomaleolares, derrame pleural, fibrilación auricular, ingresos previos por IC, valores de urea, BNP y diámetros de la aurícula izquierda se asociaron independiente y positivamente con los valores del logaritmo de ADE (lnADE). Por el contrario, la frecuencia cardiaca al ingreso, los valores de colesterol total y la hemoglobina se asociaron inversamente con el lnADE. La variable que explica de manera más importante los valores del lnADE fue la cifra de hemoglobina (54,7% del R2), seguida del colesterol sérico total (15,6% del R2) y la PAS (8,1% del R2).
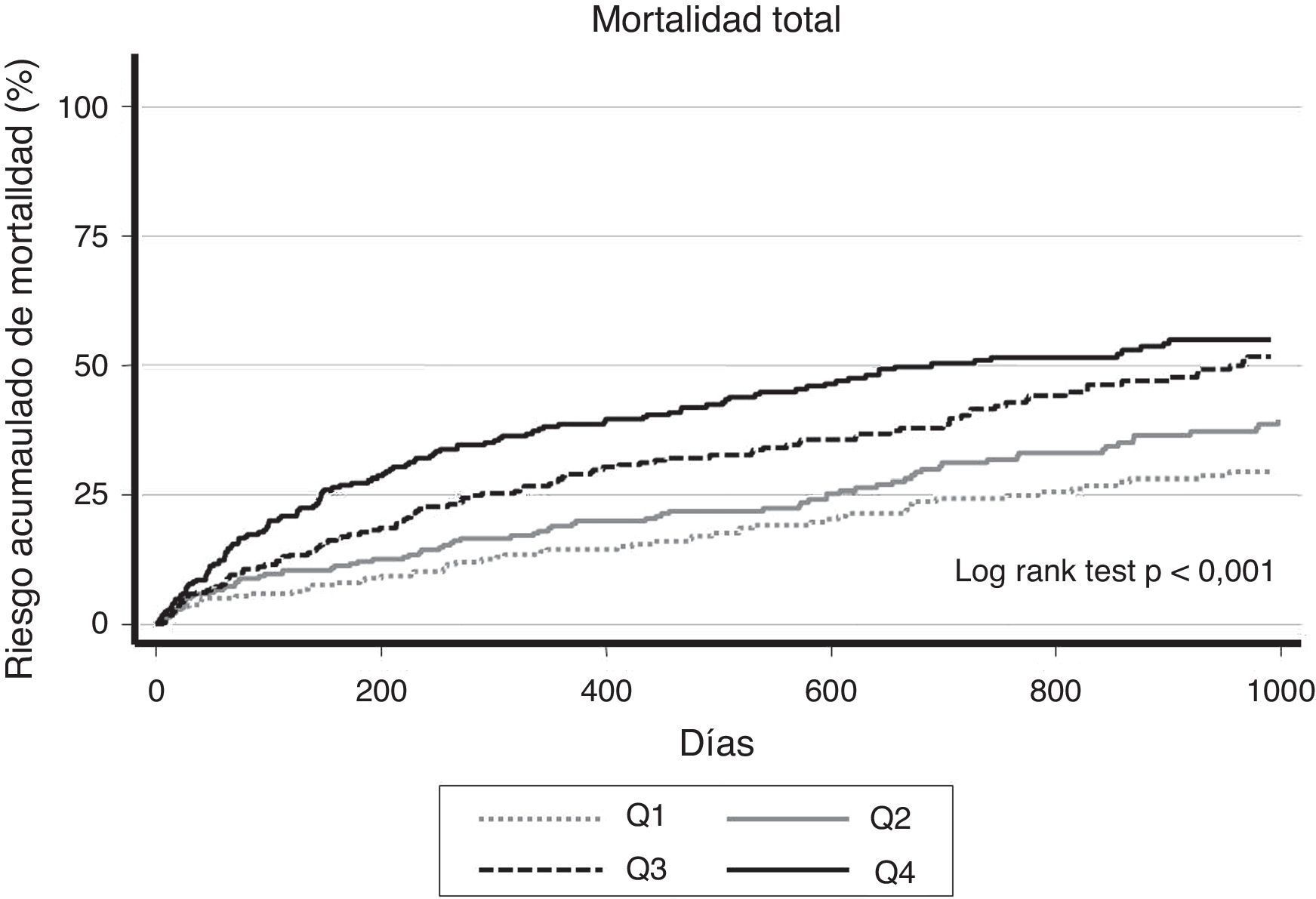
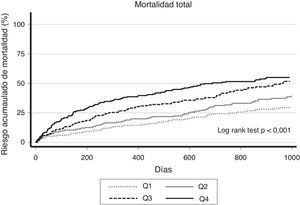
Ancho de distribución eritrocitaria y mortalidad a largo plazoTras una mediana de seguimiento de 15 meses (intervalo intercuartílico 3-33 meses) se identificaron 458 (38%) muertes totales. Se constató un incremento progresivo de las tasas de mortalidad total desde Q1 a Q4: 1,34, 1,82, 2,56 y 3,53 por 10 pacientes-año de seguimiento, para Q1 (≤14%), Q2 (14-16%), Q3 (15-16%) y Q4 (>16%), respectivamente (p de la tendencia<0,001). Estas diferencias de riesgo son ya tangibles durante el primer año tras el episodio índice de hospitalización por ICA, manteniéndose a lo largo del resto de seguimiento, como se aprecia en la figura 1.
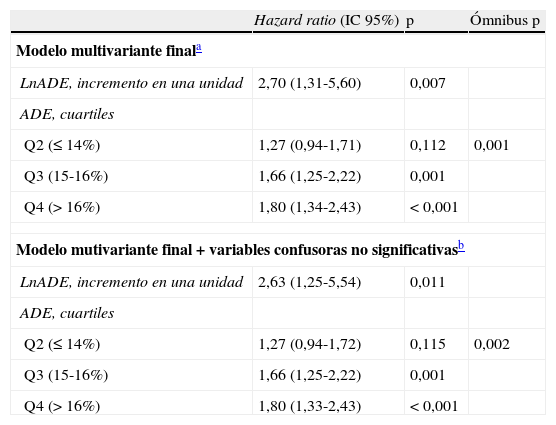
Tras un minucioso análisis multivariante, ajustado por factores de riesgo bien establecidos en ICA, esta asociación se mantuvo independiente tanto para el lnADE como para los pacientes pertenecientes a Q3 y Q4 (es decir, los pacientes con valores de ADE>15%) frente a Q1: hazard ratio (HR) 1,66, intervalo de confianza del 95% (IC 95%) 1,25-2,22, p<0,01; HR: 1,80, IC 95% 1,34-2,43, p<0,01, respectivamente (tabla 2). El modelo final mostró una adecuada capacidad discriminativa y calibración (estadístico C de Harrell=0,73 y test de Hosmer-Lemeshov=0,23).
Ancho de distribución eritrocitaria y mortalidad en insuficiencia cardiaca aguda. Análisis multivariante de regresión de Cox
| Hazard ratio (IC 95%) | p | Ómnibus p | |
| Modelo multivariante finala | |||
| LnADE, incremento en una unidad | 2,70 (1,31-5,60) | 0,007 | |
| ADE, cuartiles | |||
| Q2 (≤14%) | 1,27 (0,94-1,71) | 0,112 | 0,001 |
| Q3 (15-16%) | 1,66 (1,25-2,22) | 0,001 | |
| Q4 (>16%) | 1,80 (1,34-2,43) | <0,001 | |
| Modelo mutivariante final+variables confusoras no significativasb | |||
| LnADE, incremento en una unidad | 2,63 (1,25-5,54) | 0,011 | |
| ADE, cuartiles | |||
| Q2 (≤14%) | 1,27 (0,94-1,72) | 0,115 | 0,002 |
| Q3 (15-16%) | 1,66 (1,25-2,22) | 0,001 | |
| Q4 (>16%) | 1,80 (1,33-2,43) | <0,001 | |
ADE: ancho de distribución eritrocitaria, ICA: insuficiencia cardiaca aguda; IC 95%: intervalo de confianza del 95%; lnADE: logaritmo del ancho de distribución eritrocitaria.
Modelo ajustado por edad, sexo, clase funcional de la New York Heart Association basal previa al ingreso, presión arterial sistólica (PAS) al ingreso, hipertensión arterial (HTA), insuficiencia cardiaca (IC) previa, ictus, fibrilación auricular (FA), sodio, hemoglobina, CA 125, urea, brain natriuretic peptide (BNP, «péptido natriurético cerebral»), frecuencia cardiaca al ingreso, fracción de eyección ventricular izquierda (FEVI), antecedente de cardiopatía isquémica y tratamiento con anticoagulantes o betabloqueantes.
Modelo ajustado por edad, sexo, clase funcional de la New York Heart Association basal previa al ingreso, PAS al ingreso, HTA, IC previa, ictus, FA, sodio, hemoglobina, CA 125, urea, BNP, frecuencia cardiaca al ingreso, FEVI, antecedente de cardiopatía isquémica, tratamiento con anticoagulantes, betabloqueantes, edemas periféricos, colesterol total y derrame pleural al ingreso.
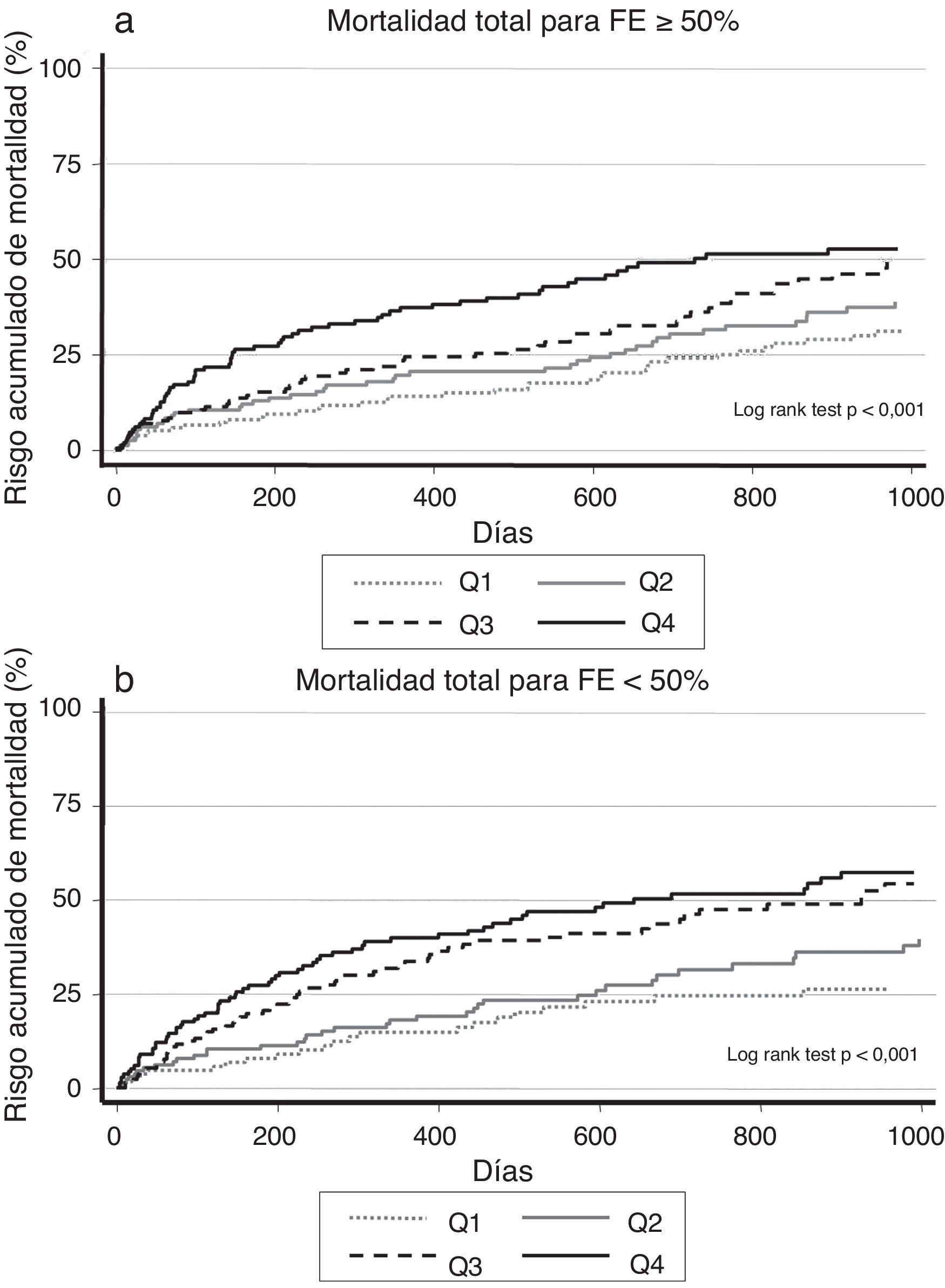
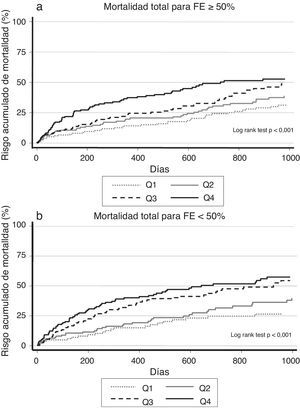
Cuando se analizó el impacto pronóstico de los valores de ADE de acuerdo con la presencia o no de disfunción sistólica, observamos que el riesgo de muerte se incrementó desde Q1 a Q4 en ambas categorías (fig. 2 a y b), hecho que se confirmó en el contexto multivariante, donde el riesgo de muerte atribuible al ADE fue homogéneo en ambas categorías de función ventricular (p de la interacción=0,25).
a. Riesgo acumulado de mortalidad total en los pacientes con FEVI≥50%, según los valores del ancho de distribución eritrocitaria. b. Riesgo acumulado de mortalidad total en los pacientes con FE<50%, según los valores del ancho de distribución eritrocitaria.
FE: fracción de eyección; FEVI: fracción de eyección de ventrículo izquierdo; Q: cuartil.
En un análisis de sensibilidad, ajustando por potenciales variables confusoras no incluidas en el modelo final de Cox, pero independientemente asociadas a los valores de ADE (colesterol total, presencia de derrame pleural y edemas periféricos), la asociación entre los valores de ADE y el riesgo de muerte se mantuvo independiente y de magnitud similar (tabla 2).
DiscusiónEl principal hallazgo de nuestro estudio es que en una población amplia y no seleccionada de pacientes con ICA, incluyendo más de la mitad de los pacientes con FEVI preservada, los valores más elevados de ADE se asociaron de manera independiente con una mayor mortalidad total durante un seguimiento a largo plazo.
Los valores de ADE han surgido en los últimos años como un potente marcador pronóstico en IC. Felker et al. fueron los primeros en mostrar, en 2 cohortes de pacientes con IC estable (del programa CHARM y la base de datos de la Universidad de Duke), que los valores de ADE elevados se asociaban a una mayor morbimortalidad5. Estos datos, junto a su potencial uso práctico dada la amplia disponibilidad de su determinación y su bajo coste económico, sirvieron para desarrollar nuevos estudios que confirmaron esos hallazgos. Así pues, en pacientes con IC estable, Al-Najjar et al. confirmaron el papel pronóstico del ADE de manera independiente a los valores de péptidos natriuréticos6. Bonaque et al. han indicado recientemente que, también en el contexto de la IC estable, un valor aumentado de ADE se asoció a un incremento del riesgo de mortalidad y de nuevas hospitalizaciones por IC, de manera adicional a las clásicas variables con interés pronóstico16.
En la ICA, sin embargo, la evidencia que respalda la utilidad pronóstica del ADE es mucho menor. Hasta el momento, únicamente 3 estudios han evaluado el rol del ADE como marcador pronóstico en este contexto; en todos ellos los valores elevados de ADE se asocian a una mayor mortalidad tras un ingreso hospitalario por ICA, pero la aplicación en la práctica clínica de sus conclusiones está limitada por varios aspectos. En el estudio previo de Jackson et al. no se incluyeron en el modelo pronóstico datos de importancia clínica reconocida como son la fracción de eyección o la función renal9. En otro estudio observacional en pacientes con ICA10 no se disponía de datos de los péptidos natriuréticos, biomarcador de indiscutible valor en la actualidad17. Finalmente, en el estudio que evalúa los valores de ADE en conjunto a un mayor número de variables pronósticas11, los valores de ADE se asociaron a la mortalidad a un año tras la hospitalización por ICA, pero la muestra de pacientes incluida en el estudio es relativamente pequeña (n=205) y fue seleccionada de un análisis post hoc del estudio PRIDE. Nuestros resultados, en una serie amplia de pacientes no seleccionados, vienen a corroborar los datos de estudios previos, de tal forma que incluso en un modelo pronóstico ajustado por la función renal, los péptidos natriuréticos o la fracción de eyección, los valores de ADE siguen teniendo un valor pronóstico independiente en relación con la mortalidad en el seguimiento.
De manera similar a la IC, en otras enfermedades cardiovasculares, como la enfermedad coronaria18, la enfermedad cerebrovascular19 o la tromboembolia pulmonar20, los valores de ADE también se han asociado a un mayor riesgo de complicaciones.
El umbral de valores de ADE que discrimina un peor pronóstico corresponde a los pacientes de Q3 y Q4, es decir, aquellos con un valor de ADE superior al 15%, correspondiente al mismo valor que en el análisis de van Kimmenade et al.11, y similar al del análisis de Pascual-Figal et al., del 14,4%9, y el de Jackson et al., del 14,5%9. Estos valores son similares (15-15,5%) a los propuestos por algunos autores como referencia para la estratificación de riesgo en IC estable16.
Los mecanismos fisiopatológicos por los cuales los valores elevados de ADE se relacionan con un peor pronóstico en la IC no son totalmente conocidos. Un incremento de la anisocitosis eritrocitaria, es decir, una mayor variabilidad del tamaño de los eritrocitos y, por tanto, un incremento de los valores de ADE, se puede encontrar en situaciones en las que existe una alteración de la eritropoyesis, o bien un incremento de la destrucción de los eritrocitos21. Una eritropoyesis ineficaz puede tener lugar cuando existe déficit de ciertos nutrientes esenciales para la formación de los glóbulos rojos, tales como hierro, ácido fólico o vitamina B12. Los pacientes con IC presentan frecuentemente ferropenia y, a su vez, una dificultad para la movilización y la utilización de los depósitos de hierro22,23. En estadios más avanzados de la enfermedad pueden presentarse, además, otros déficits nutricionales, por malabsorción intestinal o por desarrollar una caquexia cardiaca, que pueden contribuir a su vez a la eritropoyesis ineficaz24. A su vez, las citoquinas proinflamatorias circulantes en la IC se han asociado con una inhibición de la maduración de los eritrocitos inducida por la eritropoyetina, de modo que se incrementarían los valores de ADE25,26.
La utilidad desde el punto de vista pronóstico del ADE es independiente de la presencia de anemia o de la alteración de otras variables hematológicas. Sin embargo, sí conocemos que valores elevados de ADE se relacionan en pacientes con IC con marcadores que reflejan un desorden en el metabolismo del hierro, como son un menor hierro sérico, ferritina, o índice de saturación de la transferrina, así como con marcadores de inflamación crónica o disfunción renal3, todos ellos aspectos ligados a la aparición y a la perpetuación de la anemia en la IC. En este sentido, Pascual-Figal et al. demostraron que los valores de ADE en el contexto de una hospitalización por IC se ligaban al desarrollo de anemia en el seguimiento, en pacientes no previamente anémicos4. Por tanto, unos valores de ADE anormalmente elevados podrían reflejar el estado inflamatorio crónico, la eritropoyesis ineficaz y el desorden del metabolismo del hierro que frecuentemente coexisten en la insuficiencia cardiaca, y que se asocian a un estadio funcional más avanzado y a un peor pronóstico, tanto en un estado preanémico como en el caso de una anemia ya establecida27. Recientes estudios que evalúan el papel pronóstico, independientemente de la anemia, del desorden en el metabolismo del hierro (déficit de hierro funcional o absoluto) en la IC, como el de Jankowska et al., parecen apoyar esta hipótesis de plausibilidad fisiopatológica28. Además, recientemente se ha observado que, en una amplia cohorte de pacientes ambulatorios con IC, un incremento progresivo en determinaciones seriadas de los valores de ADE se asocia a una mayor progresión y a un estadio mas avanzado de la enfermedad29.
Así pues, nuestro estudio muestra la serie más amplia hasta el momento de pacientes no seleccionados con ICA, en los que valores de ADE anormalmente elevados se asocian con un mayor riesgo de mortalidad en el seguimiento a largo plazo, independientemente de la FEVI, los péptidos natriuréticos, la anemia o la disfunción renal. Nuestros datos vienen a confirmar los resultados de series previas y, en general, a apoyar que en la IC el ADE es un importante marcador pronóstico, que sumado a su bajo coste y su amplia disponibilidad, podría incorporarse a los modelos pronósticos que se realizan actualmente al ingreso en un paciente con ICA. Además, se abren las puertas de testar si aquellos pacientes con ADE elevado podrían ser subsidiarios de medidas diagnósticas o terapéuticas adicionales.
La principal limitación del estudio es su carácter observacional y unicéntrico, por lo que, debido a su diseño, puede estar sujeto a diferentes tipos de sesgos y factores de confusión residuales. A su vez, evaluamos los valores de ADE en el contexto del paciente agudo, con lo que desconocemos el valor que la posible variabilidad de los mismos en determinaciones seriadas ambulatorias tras el alta puede tener en su valor pronóstico.
ConclusionesEl ADE es un biomarcador simple y ampliamente disponible con potencial para identificar pacientes con un mayor riesgo de mortalidad tras un ingreso hospitalario por ICA. Los valores elevados del ADE se asocian a una mayor mortalidad a largo plazo, independientemente de las clásicas variables pronósticas en ICA, incluyendo la anemia, los péptidos natriuréticos y la función sistólica del ventrículo izquierdo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.