La alergia a alimentos (AA) es una entidad que suscita un interés creciente, como lo prueba el número de artículos que aparecen en Medline al realizar una búsqueda sobre este tema y que prácticamente se ha doblado en la última década comparada con la previa. Si bien hay casos banales con repercusión mínima en la salud del individuo, su estado nutricional o su calidad de vida, en otros casos la gravedad de las reacciones ocasionadas o el número o tipo de alimentos a evitar se traducen en limitaciones que condicionan de forma notable al paciente y su entorno. Además, el incremento progresivo del número de pacientes que presentan este tipo de alergia hace que pediatras, médicos de familia y otros profesionales sanitarios deban responder cada vez con más frecuencia a las demandas de atención de estos pacientes.
En esta revisión nos centraremos principalmente en la AA mediada por la inmunoglobulina (Ig) E y obviaremos otros trastornos relacionados como las gastroenteropatías eosinofílicas, enteropatías proteicas, enfermedad celíaca y otros.
Epidemiología
La prevalencia de la AA es muy variable entre diferentes áreas geográficas, principalmente por los distintos hábitos dietéticos. En los estudios poblacionales muchos individuos refieren tener AA; sin embargo, cuando se realiza estudios con provocación a doble ciego controlada con placebo, no siempre se confirman estas reacciones. En niños menores de 10 años la prevalencia de AA se sitúa en el 6-8%, y en adultos en el 1-4%1-4. En el European Community Respiratory Health Survey 1991-19945, el 12% de los encuestados referían alergia o intolerancia a alimentos, porcentaje que varía desde un 4,6% en España al 19,1% en Australia. Según un estudio multicéntrico nacional, la AA en España afectaría al 3,6% de los pacientes que consultan a servicios de alergología6.
Clasificación
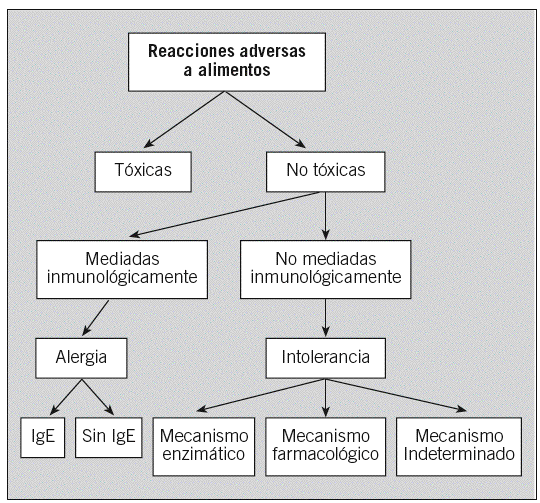
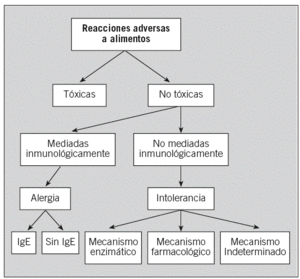
La Sociedad Española de Alergología e Inmunología Clínica publicó en el año 2003 una clasificación de las reacciones adversas a alimentos7 basada en la de la Academia Europea8 (fig. 1). Si se demuestran mecanismos inmunológicos en la patogenia, el término adecuado es el de AA y, si está implicada la IgE, AA mediada por IgE.
Fig. 1. Clasificación de las reacciones adversas a alimentos según los mecanismos que las producen. Ig: inmunoglobulina.
Según los conocimientos actuales, se han descrito varios grupos de AA con características patogénicas, diagnósticas, pronósticas y terapéuticas definidas, que se recogen en la clasificación propuesta por Larramendi9 (tabla 1). La AA independiente es la forma clásica, en que el alimento es necesario y suficiente para inducir la reacción en el individuo sensibilizado. Ésta se subdivide en primaria y secundaria; en la primaria el alimento es la causa de la sensibilización alérgica (corresponde a la AA clase 1 de Sampson4), mientras que en la secundaria hay una sensibilización previa del individuo al alérgeno por una vía no digestiva (vía respiratoria o cutánea), como ocurre en los síndromes de reactividad cruzada polen-alimentos (AA clase 24). En la AA dependiente se requiere la intervención de otros factores, además del alimento, para inducir los síntomas (ejercicio y fármacos, entre otros). Por último, se mencionan las reacciones de alergia «relacionada» con alimentos, en las que la implicación de éstos no es siempre clara, y la AA por vía no digestiva, como el asma inducida por la inhalación de alimentos o de vapores de su cocción.
Mecanismos fisiopatológicos
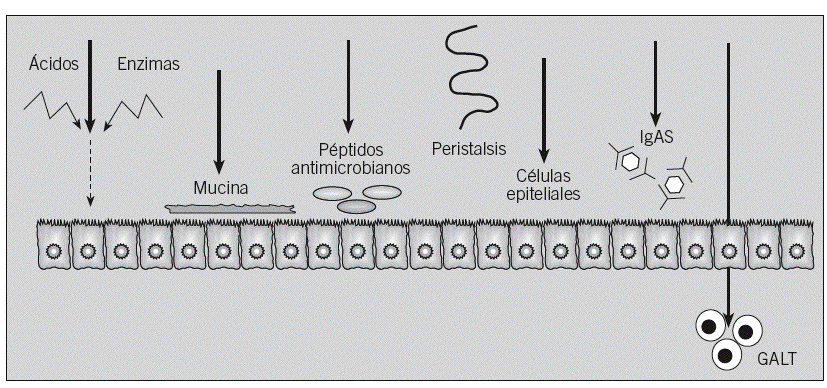
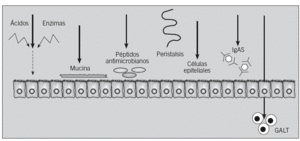
La mucosa gastrointestinal se ve bombardeada por miles de antígenos potenciales durante el día, pero sólo un pequeño porcentaje de pacientes desarrolla AA. Esto es debido a que en condiciones fisiológicas el sistema inmunitario de la mucosa digestiva induce el fenómeno conocido como tolerancia oral. En este proceso están implicadas células presentadoras de antígeno (células epiteliales, células M y células dendríticas) y células T reguladoras (células T helper [Th] 3, Tr1, CD4+CD25+, CD8+ y células citolíticas)10. La barrera mucosa gastrointestinal, que incluye mecanismos físicos e inmunológicos, procesa y modifica las proteínas de la dieta, de forma que sólo un 2% aproximadamente se convierte al final en antígenos potenciales11-13 (fig. 2).
Fig. 2. Barreras fisiológicas para la penetración de antígenos en la mucosa intestinal. Se trata de una barrera protectora que incluye mecanismos inmunológicos, como la inmunoglobulina A secretora (IgAs), el tejido linfoide asociado al tubo digestivo (GALT) y los péptidos antimicrobianos (defensinas y catelicidinas), y mecanismos físicos, como la acción del peristaltismo intestinal, el ácido gástrico y las enzimas proteolíticas, que degradan las proteínas ingeridas y destruyen los epítopos inmunogénicos, las células epiteliales, unidas por las uniones estrechas, que restringen el paso de moléculas grandes, o la capa de moco que cubre fisiológicamente la células epiteliales.
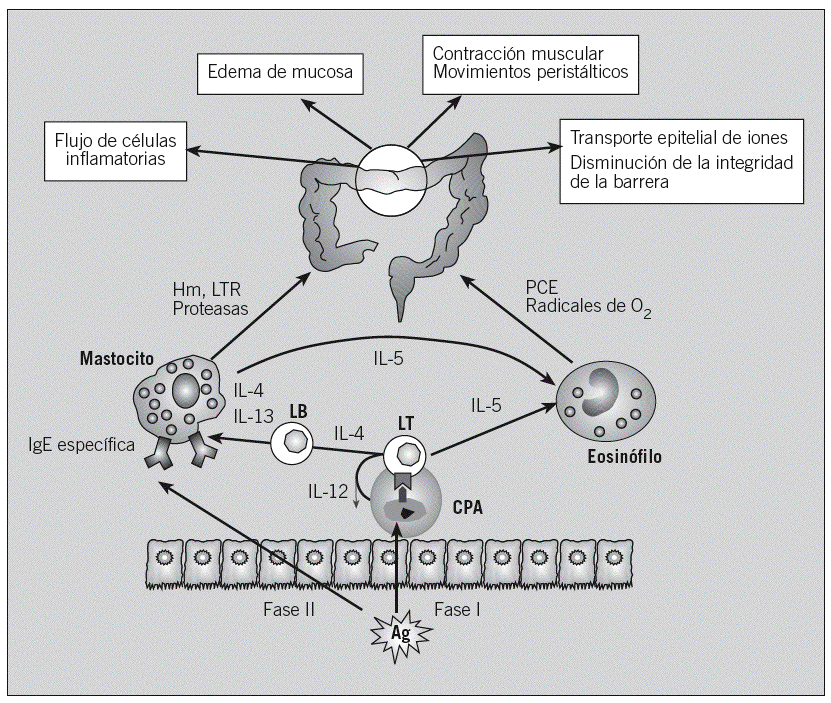
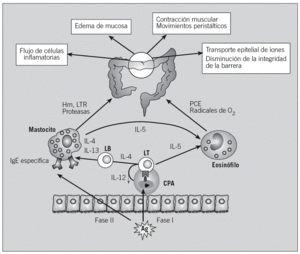
En cambio, en el proceso de sensibilización alérgica, las proteínas antigénicas de la dieta son captadas por las células presentadoras de antígeno de la mucosa, procesadas y presentadas a células T CD4+, en el contexto de moléculas del complejo principal de histocompatibilidad de clase II. Se induce la proliferación de los linfocitos T, así como la generación de citocinas Th2, que estimulan a los plasmocitos, promoviendo la producción de IgE específica, y favorecen el reclutamiento de otras células inflamatorias, como los eosinófilos. En exposiciones sucesivas, el alérgeno se unirá a 2 moléculas de IgE específica de la superficie de los mastocitos, con lo que se producirán su activación y la liberación de mediadores, que causan las manifestaciones clínicas (fig. 3).
Fig. 3. Fenómeno de sensibilización y reacción alérgica. Para que se produzca una reacción alérgica, primero debe producirse la sensibilización al antígeno (Ag) (fase I); en siguientes exposiciones se produce la fase efectora (fase II), en la que los mediadores liberados darán lugar a las manifestaciones clínicas. CPA: célula presentadora de antígenos; LT: célula T; LB: célula B o plasmocito; Hm: histamina; PCE: proteína catiónica del eosinófilo; LTR: leucotrienos; Ig: inmunoglobulina.
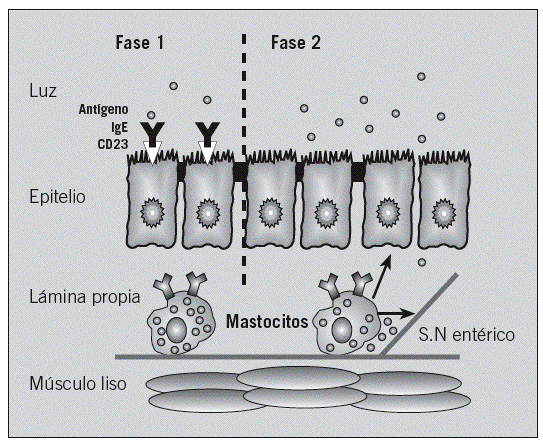
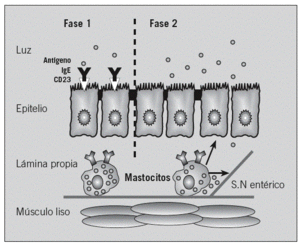
Estudios en animales sensibilizados indican que el transporte transepitelial de antígenos alimentarios es un proceso complejo que se compone de 2 fases bien diferenciadas14,15. La primera fase, detectable 2 min después de la exposición antigénica, en la que se produce el transporte transcelular del antígeno mediante endososomas hasta la lámina propia, es independiente de los mastocitos intestinales. Esta fase está mediada por la IgE mediante de receptores de baja afinidad (CD23/Fc*RII) en las células epiteliales y regulada por la interleucina 416,17. La unión a la IgE protege al antígeno sensibilizante de la degradación lisosómica18. La segunda fase depende de la activación de los mastocitos de la lámina propia, implica un aumento masivo de la permeabilidad transepitelial y paracelular, puede observarse 30 min después de la exposición antigénica15 y facilita que el exceso antigénico pueda alcanzar el sistema inmunitario (fig. 4). Estudios en humanos demuestran una permeabilidad intestinal aumentada en la AA después de la provocación con alimentos, aunque no en condiciones basales19-22. Este incremento perpetúa la exposición antigénica a los mastocitos activados, cuyos mediadores están implicados en la alteración de la permeabilidad inducida por la AA23, el estrés24 y los procesos inflamatorios intestinales25.
Fig. 4. Transporte de alérgenos a través de la barrera epitelial. Consta de una primera fase, donde el alérgeno es transportado por vía transcelular y que está mediada por los receptores de baja afinidad para la inmunoglobulina (Ig) E (Fc*RII); una vez que el alérgeno llega a la lámina propia, se produce la activación de los mastocitos, lo que implica un aumento de la permeabilidad y el paso paracelular de más alérgenos (segunda fase), tanto por la acción directa de los mediadores liberados por los mastocitos como indirectamente por la activación del sistema nervioso (SN) entérico.
Debemos tener en cuenta que, además, hay factores extrínsecos que por sí mismos pueden aumentar la permeabilidad intestinal, como el ejercicio, los antiinflamatorios no esteroideos, el alcohol o el estrés. Cuando se asocian a la ingesta del alimento al cual el individuo está sensibilizado, pueden potenciar la respuesta clínica.
Manifestaciones clínicas
Las manifestaciones clínicas de la AA mediada por IgE pueden implicar a uno o más órganos diana, tales como la piel, las vías respiratorias, el tracto gastrointestinal y el sistema cardiovascular. Típicamente, los síntomas aparecen de forma inmediata (entre pocos minutos y 2 h) tras la ingestión del alimento.
Síntomas cutáneos
Son la expresión clínica más frecuente de la AA. Su manifestación puede variar desde urticaria generalizada con angioedema hasta síntomas más leves como prurito orofaríngeo con lesiones eritematosas peribucales. Otras manifestaciones menos frecuentes son la urticaria de contacto y la dermatitis de contacto proteica.
Síntomas gastrointestinales
El síndrome de alergia oral (SAO), que se puede considerar una forma de urticaria de contacto localizada en la orofaringe, es la manifestación clínica más frecuente de AA en el adulto. Consiste en la aparición rápida de prurito y angioedema de labios, lengua, paladar y garganta. En la mayoría de los casos la resolución es rápida y espontánea, aunque se ha descrito que algunos pacientes pueden desarrollar molestias gastrointestinales o afección sistémica. Es más frecuente en pacientes alérgicos a pólenes y los alimentos más comúnmente implicados son los de origen vegetal, debido a la reactividad cruzada entre ambos26.
Otros síntomas gastrointestinales incluyen náuseas, dolor abdominal cólico, vómitos y diarrea. Lo más frecuente es que estos síntomas acompañen a manifestaciones alérgicas en otros órganos en el contexto de un cuadro anafiláctico.
Síntomas respiratorios
Tras provocaciones orales con alimentos se han desencadenado tanto síntomas rinoconjuntivales como respuestas broncospásticas, pero es raro que aparezcan de forma aislada. Algunos pacientes alérgicos al pescado, los crustáceos y las legumbres pueden presentar rinitis o asma inducida por la inhalación de vapores de cocción.
Anafilaxia generalizada
Aunque es la manifestación más grave de la AA, muchas veces no es reconocida por los médicos ni por los propios pacientes27. Se define por la aparición de síntomas cutáneos acompañados de afección de, al menos, otro órgano diana (aparato digestivo, vías respiratorias, sistema cardiovascular), y su forma de manifestación más grave es el shock anafiláctico. Los síntomas que determinan la gravedad son los cardiovasculares, como la hipotensión, el colapso vascular y las arritmias, junto con el broncospasmo. El reconocimiento temprano del cuadro clínico es crucial para iniciar el tratamiento adecuado. Se estima que los alimentos son la causa de al menos un tercio de los casos de anafilaxia que se atienden en urgencias28 y los implicados con mayor frecuencia son frutos secos, huevos, pescados y mariscos.
La anafilaxia por esfuerzo dependiente de alimentos se produce cuando el paciente realiza ejercicio en las 2-4 h siguientes a la ingestión del alimento, que, en ausencia de ejercicio, suele tolerar sin problemas29.
Alérgenos alimentarios
La diversidad de la dieta humana es enorme. Sin embargo, sólo unos pocos alimentos son la cuasa de la mayoría de las reacciones alérgicas en todo el mundo. Los hábitos dietéticos regionales y la forma de preparación de los alimentos desempeñan un papel muy importante en la prevalencia de AA específicas en cada país.
Siguiendo la clasificación establecida por Sampson4, la sensibilización a los alérgenos puede tener lugar en el aparato digestivo (AA clase 1) o como consecuencia de una sensibilización a neumoalérgenos (AA clase 2).
La mayoría de los alérgenos de clase 1 son glucoproteínas solubles en agua con un tamaño de 10 a 70 kDa, estables al calor y a la digestión enzimática. En cambio, los alérgenos de clase 2 suelen ser lábiles al calor y a la digestión, probablemente porque contienen epítopos conformacionales; estas proteínas están muy conservadas en la evolución del reino vegetal y están presentes tanto en pólenes como en alimentos vegetales. Esto condiciona la reactividad cruzada polen-alimentos, de forma que el individuo se sensibiliza por vía inhalada a un alérgeno de reactividad cruzada y manifiesta síntomas con la ingesta del alimento cuya proteína comparte una elevada homología estructural. La clínica suele ser leve (SAO), resultado de la labilidad del alérgeno.
Hasta la fecha se ha identificado un gran número de alérgenos alimentarios que se han secuenciado, clonado y expresado como proteínas recombinantes; todos ellos se encuentran en la base de datos del Comité de Nomenclatura de Alérgenos de la Unión Internacional de Sociedades Inmunológicas (www.allergen.org).
En España, los alimentos que producen AA con más frecuencia en niños son la leche, el huevo y el pescado, mientras que en los adultos son las frutas y los frutos secos, seguidos por el pescado6.
Leche. Es, junto con el huevo, la causa más frecuente de AA en menores de 5 años. La alergia a las proteínas de la leche de vaca típicamente se manifiesta coincidiendo con la introducción de la lactancia artificial. Los síntomas cutáneos son la presentación más frecuente, seguidos de los síntomas digestivos. Tiende a evolucionar a la remisión; a los 2 años, la tolerancia es del 70-75% y alcanza el 85% a los 4 años de vida. La betalactoglobulina y la caseína son las causas de la mayor parte de las sensibilizaciones. Se ha descrito que la persistencia de IgE específica a determinados epítopos de betalactoglobulina y de caseína se relaciona con la persistencia de la alergia a las proteínas de la leche de vaca30.
Huevo. La clínica alérgica producida por la ingestión de huevo es fundamentalmente cutánea, seguida de digestiva y respiratoria. Los síntomas suelen iniciarse con la introducción de huevo completo, si bien no es rara la tolerancia previa a la yema. La ovoalbúmina y el ovomucoide, proteínas parcialmente termoestables presentes en la clara de huevo, son los alérgenos más relevantes30. Suele afectar a niños menores de 2 años y en aproximadamente el 66% de los casos se llega a la tolerancia tras un período de evitación prolongado31.
En adultos, la mayoría de los casos se incluyen dentro del síndrome ave-huevo, en que la sensibilización inicial se produce por inhalación de antígenos de ave y posteriormente aparecen síntomas por ingestión de huevo. La alfalivetina o albúmina sérica de pollo presente en la yema de huevo y en las plumas de aves es el alérgeno que causa la reactividad cruzada32.
Pescado y marisco. El pescado es la tercera causa de AA en niños y adultos, y suele ser más persistente que la alergia a la leche o el huevo. La manifestación clínica más frecuente es cutánea, aunque cabe destacar que hasta un 10% de los pacientes presenta manifestaciones respiratorias tras la inhalación de vapores33. Los alérgenos principales del pescado son las parvoalbúminas, proteínas termoestables y resistentes a la digestión enzimática, que además son las causas de la reactividad cruzada entre especies34. Los pescados que con más frecuencia inducen reacciones alérgicas son la merluza, el bacalao, el gallo y el lenguado. Un estudio llevado a cabo en España con niños alérgicos a pescado demostró en más del 50% de los casos tolerancia a otras especies, de las cuales el atún y el emperador son los mejor tolerados35.
Cabe recordar la elevada prevalencia de parasitación por Anisakis del pescado en nuestro medio, que es capaz de desencadenar cuadros de alergia y de seudooclusión intestinal, por lo que siempre deberá plantearse la alergia a Anisakis en el diagnóstico diferencial de una reacción alérgica por pescado.
Los mariscos más frecuentemente implicados en casos de alergia en España, según la serie de Castillo et al36, son la gamba y el calamar, y los síntomas más frecuentes son la urticaria/angioedema, el asma y la rinitis. También se han descrito casos de asma ocupacional y dermatitis de contacto proteica. El alérgeno principal de los crustáceos es la tropomiosina, proteína muscular que ha conservado una alta homología a lo largo de la evolución de las especies; se ha descrito en ácaros del polvo, caracoles y nematodos, y condiciona síndromes clínicos de reactividad cruzada34.
Frutas. Son la causa más frecuente de AA en niños mayores y en adultos. En Europa, las frutas que la causan con más frecuencia son las pertenecientes a la familia Rosaceae (manzana, melocotón, pera, cereza, albaricoque, ciruela, fresa, entre otras); en España es el melocotón, seguido del melón37. En la alergia a Rosaceae se han observado diferencias en la presentación clínica en distintas áreas geográficas en función del patrón de alérgenos implicados. Así, en el norte y centro de Europa se asocia con sensibilización a polen de abedul y el síntoma principal es el SAO debido a la sensibilización a alérgenos homólogos de Bet v 1 (alérgeno principal del polen de abedul) y a profilinas38 (AA clase 2). Sin embargo, en el área mediterránea, donde el abedul no es un árbol común, la alergia a Rosaceae es más grave, con frecuente manifestación sistémica. En estas poblaciones, la sensibilización primaria se produce por proteínas transferidoras de lípidos, alérgenos termoestables y resistentes a la digestión enzimática39 (AA clase 1).
Dentro de la alergia a frutas, conviene destacar el denominado síndrome látex-frutas. Entre un 20 y un 60% de los pacientes alérgicos a látex presentan reacciones con una amplia variedad de alimentos, principalmente el plátano, el aguacate, el kiwi y la castaña. Las manifestaciones clínicas de estas reacciones pueden variar desde SAO hasta reacciones anafilácticas. Los alérgenos identificados como causantes de la reactividad cruzada son las quitinasas de clase I, enzimas que pertenecen a un grupo de proteínas relacionadas con la defensa de las plantas40.
Legumbres. En España suponen la quinta causa de AA en población pediátrica. Las lentejas son las que causan alergia con más frecuencia, seguidas por los garbanzos. Hay una reactividad cruzada importante entre la lenteja, el garbanzo y el guisante, y algo menos con el cacahuete. Un estudio realizado sobre población pediátrica española demostró que el 75% de los niños referían síntomas con 2 o más legumbres41. El cacahuete, que se consume como fruto seco, es la causa de la mayoría de las reacciones alérgicas en EE.UU., donde su prevalencia se ha doblado en población pediátrica en los últimos años, hasta alcanzar un 1,2%. Sus manifestaciones clínicas suelen ser graves, y es la primera causa de reacciones anafilácticas42. La mayoría de los alérgenos de legumbres y frutos secos son proteínas de almacenamiento de semillas.
Frutos secos. En España son la segunda causa de AA en el adulto. Aunque son pocos los estudios epidemiológicos realizados, se estima que la almendra y la nuez son los alérgenos implicados con más frecuencia43. En Europa, en cambio, es más común la alergia a la avellana, y se observan diferencias en la expresión clínica según el patrón de alérgenos, al igual que ocurre con las frutas Rosaceae44. La alergia a frutos secos no tiende a desaparecer durante la vida45.
Cereales. El trigo es el cereal más alergénico y los síntomas de AA derivados de su ingesta son más frecuentes en la infancia. La mayoría de los niños alérgicos a trigo presentan dermatitis atópica moderada o grave y es frecuente la coexistencia de sensibilización a otros alimentos como la leche o el huevo46. Hay reactividad cruzada entre los diferentes cereales, así como con pólenes de gramíneas, debido a que pertenecen a la misma familia. En adultos es frecuente la implicación de la harina de trigo en la anafilaxia inducida por ejercicio; el alérgeno más implicado en estas reacciones es la gliadina *-547.
Diagnóstico
El diagnóstico de la AA se basa en la anamnesis, la demostración de IgE específica para el alimento y la prueba de provocación con el alimento.
La anamnesis es fundamental para establecer si el cuadro clínico y la secuencia temporal son indicativos de una reacción alérgica y cuál es el alimento que la causa. Una vez formulada la sospecha diagnóstica, se debe confirmar la sensibilización al alimento mediante pruebas cutáneas (prick) y/o determinación de IgE sérica específica.
Los extractos alergénicos de alimentos de los que se dispone para la realización de pruebas cutáneas frecuentemente son inadecuados ya que carecen de la estandarización y estabilidad necesarias. Por ello, en muchas ocasiones es preciso utilizar el alimento fresco para realizar la prueba cutánea (prick-prick), especialmente en el caso de alimentos vegetales. En términos generales, unas prueba cutánea negativa descarta la existencia de alergia mediada por IgE (valor predictivo negativo del 95%)48.
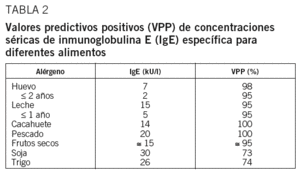
La determinación de la IgE específica sérica se realiza habitualmente mediante técnicas de enzimoinmunoanálisis de forma cuantitativa. Se han establecido unos valores umbral de IgE específica para diferentes alérgenos que conferirían un valor predictivo positivo del 95% de reacción alérgica en caso de ingestión del alimento (tabla 2), si bien estos valores pueden variar según la población estudiada31,49-51.
Aunque en la práctica clínica habitual no siempre es necesario realizar pruebas de provocación a alimentos, éstas son imprescindibles cuando hay discordancia entre la anamnesis y las pruebas cutáneas o la determinación de IgE específica. Se pueden realizar pruebas de provocación abiertas, a simple o a doble ciego controlada con placebo; esta última es la que se considera de referencia. La provocación debe llevarse a cabo con la supervisión de profesionales entrenados y en condiciones que permitan atención médica urgente si fuera preciso. Los protocolos que se aplican consisten en el seguimiento estricto del estado clínico del individuo y de parámetros hemodinámicos y de función respiratoria (pico expiratorio de flujo, volumen espiratorio forzado en el primer segundo) durante la ingesta de placebo o del alimento en cuestión; éste se administra en dosis progresivas hasta llegar a una cantidad predeterminada o hasta la aparición de síntomas7. En los casos en que la reacción es clara, especialmente en cuadros anafilácticos graves, y se demuestra la existencia de IgE, se considera el diagnóstico ya establecido.
En pacientes pediátricos alérgicos a leche o huevo es necesaria la revaluación periódica para comprobar o descartar el desarrollo de tolerancia.
único método de prevención disponible en la actualidad. Esta recomendación, aparentemente sencilla, muchas veces es difícil de cumplir debido a las reactividades cruzadas y a la presencia de alérgenos «ocultos» en los alimentos52. En este sentido, es importante destacar la nueva legislación española de etiquetado de alimentos, que obliga a la declaración de los alérgenos más frecuentes presentes, aun en cantidades mínimas, en cualquier producto manufacturado (Real Decreto 2220/2004).
Los antihistamínicos son útiles para el tratamiento del SAO y para el tratamiento de las reacciones cutáneas, pero no previenen la aparición de reacciones sistémicas. En casos de anafilaxia, el tratamiento de elección es la adrenalina, que deberá administrarse lo antes posible y por vía intramuscular53,54 a dosis de 0,1 mg/kg de peso. La adrenalina, además de broncodilatadora, cronotropa e inotropa positiva, inhibe la liberación de mediadores mastocitarios. Actualmente disponemos en España de un dispositivo para la autoadministración de adrenalina intramuscular (Adreject® ALK- Abelló) a dosis de 0,3 mg para adultos y 0,15 mg para niños (de hasta 15 kg de peso). Su administración deberá acompañarse de antihistamínicos y glucocorticoides por vía parenteral para prevenir las reacciones tardías. Deberá instruirse a todo paciente con antecedentes de anafilaxia por alimentos en el uso de adrenalina autoinyectable, y en la necesidad de disponer de antihistamínicos, glucocorticoides y agonistas ß2 de acción rápida en caso de ser asmático. Se trasladará al paciente al centro médico más cercano y se le mantendrá en observación médica como mínimo durante 12 h, ya que se estima que un tercio de los pacientes con anafilaxia pueden experimentar una reacción bifásica55.
Aunque no es una práctica habitual, en algunos casos podría considerarse la desensibilización56 como opción terapéutica, sobre todo con alimentos básicos para la nutrición o en sensibilizaciones graves. No obstante, los estudios publicados son escasos y se desconoce la duración del efecto a largo plazo.
En los últimos años se están desarrollando nuevos tratamientos inmunomoduladores para las enfermedades alérgicas, que ofrecen un interesante potencial en el campo de la AA. En su mayoría se hallan en fase de experimentación animal, pero en un futuro podrán evitar que un paciente esté sometido de por vida al riesgo que supone una ingestión inadvertida del alérgeno. Por ejemplo, se calcula que, en el caso del cacahuete, del 35 al 50% de los pacientes alérgicos presentará una ingesta accidental en un período de 4 años48. Entre estos tratamientos, figuran los que se basan en la inversión de la respuesta inmunológica de Th2 a Th1, como la inmunoterapia convencional57, la inmunoterapia con péptidos «puros»58 o modificados genéticamente59 y la inmunoterapia con ADN (plásmidos y secuencias inmunoestimuladoras)60. Otras opciones terapéuticas incluyen la modulación del sistema inmunitario mediante la promoción de un ambiente Th1 con la administración de interleucina 1261 o el uso de sustancias que modifiquen la permeabilidad intestinal, como el péptido 2 similiar al glucagón62.
Una forma no específica de tratamiento que podría beneficiar simultáneamente distintas situaciones de hipersensibilidad es la administración de anticuerpos humanizados anti-IgE, mediante la que se consigue un bloqueo de la respuesta alérgica. Aunque inicialmente se desarrolló para el tratamiento del asma alérgica, se ha utilizado con éxito en pacientes con alergia al cacahuete63.
Otra perspectiva la ofrece la elaboración de alimentos hipoalergénicos obtenidos a partir de modificaciones genéticas y químicas64.
Conclusiones
El ser humano está preparado para tolerar los antígenos absorbidos con los nutrientes de la dieta y una alteración en esta tolerancia conduce a la AA. En los últimos años se han caracterizado muchos de los alérgenos alimentarios más comunes, se han definido algunas características que confieren a las proteínas la capacidad de actuar como alérgenos y se ha avanzado notablemente en el conocimiento de los mecanismos fisiopatológicos implicados. Las líneas de investigación futuras deberán dirigirse al desarrollo de estrategias de prevención primaria y de tratamiento eficaces.