Las células NKT invariantes (NKTi) fueron identificadas inicialmente por presentar características similares a las célulasT y NK. Actualmente se han definido como linfocitosT con características únicas, desde su selección y diferenciación en el timo hasta su respuesta a estímulos específicos. A partir de estudios realizados en ratones se han caracterizado las vías de maduración y diferenciación de esta población celular, en las cuales la molécula CD1d, tiene un papel fundamental en la selección de sus precursores y, adicionalmente, en la presentación de glucolipídicos para la activación de las células NKTi en periferia. En sangre periférica humana se han encontrado 4subpoblaciones de células NKTi: CD4+, CD8αβ+, CD8αα+ y Doble Negativas, las cuales cooperan e interactúan de forma particular con las demás células del sistema inmune. Finalmente, estudios de las células NKTi muestran la posibilidad de plantear alternativas terapéuticas, pero a su vez abren más interrogantes sobre el comportamiento de este tipo de linfocitos.
Invariant natural killer (iNK) T lymphocytes (iNKTL) were initially identified due to having similar characteristics to NK and Tcells. Nowadays, it is known that these cells are Tlymphocytes with unique characteristics, from their maturing process and differentiation in the thymus to the response at specific stimuli. Studies in mice have been useful for examining the maturing process and differentiation pathways of iNKTL. In these pathways the CD1d molecule has a fundamental role in the selection of their precursors, and also in the peripheral glycolipid presentation for the activation of iNKTL. Four sub-populations of iNKTL CD4+, CD8αβ+, CD8αα+ and Double Negatives, were identified in human peripheral blood. They particularly cooperate and interact with others immune cells. The information obtained by studying iNKTL opens the possibility of proposing this cell line as a therapeutic alternative, but further studies on the behavior of this type of lymphocyte are needed.
El término linfocitos «NKT» fue publicado por primera vez en 1995 para referirse a un subgrupo de linfocitos T murinos que comparten características con los linfocitos asesinos naturales (NK, del inglés natural killer), específicamente, la expresión del marcador NK1.11. No obstante, ya en 1987, 3grupos diferentes publicaron estudios de una subpoblación particular de linfocitosTα/β en ratones que expresa niveles intermedios del receptor de la célula T (TCR), presenta la cadena Vβ8 del TCR a una frecuencia 2 a 3veces mayor que los linfocitosT convencionales y carece de la expresión de CD4 o CD82. El interés en estas células aumentó cuando se descubrió que son fuente importante de muchas citoquinas inmunorreguladoras, incluyendo la IL-4, el IFN-γ y el TNF-α3. Observaciones adicionales revelaron que el desarrollo de estos linfocitos T NK1.1+ es independiente de la expresión del complejo mayor de histocompatibilidad (CMH) clasei en el timo, pero dependiente de la β2-microglobulina (β2m), y hasta ese momento se pensaba que ellos no expresaban CD84. Esto llevó a dilucidar el papel de la molécula CD1d como ligando importante en la función de las células T NK1.1+5. CD1d es una molécula homóloga a CMH clasei, expresada principalmente en células del linaje hematopoyético (monocitos, células dendríticas y linfocitosT y B) pero también en células no hematopoyéticas (células epiteliales tímicas, queratinocitos y hepatocitos, entre otros)6. Similar a CMH clasei, CD1d tiene 3dominios extracelulares (α1, α2 y α3), que forman un heterodímero con la β2m, como se observa en la figura 1. Adicionalmente se descubrió que la mayoría de las células NKT usan una cadenaα invariante del TCR. Por otra parte, existían evidencias crecientes que las moléculas CD1 presentan antígenos lipídicos hidrofóbicos a las célulasT, y se identificó la α-galactosil-ceramida (αGalCer) como un potente factor estimulador de las células NKT7. αGalCer es un glucolípido sintético, derivado de una esponja marina, que contiene enlaces glucosídicos α anoméricos de residuos de galactosa en una base de esfingosina8.
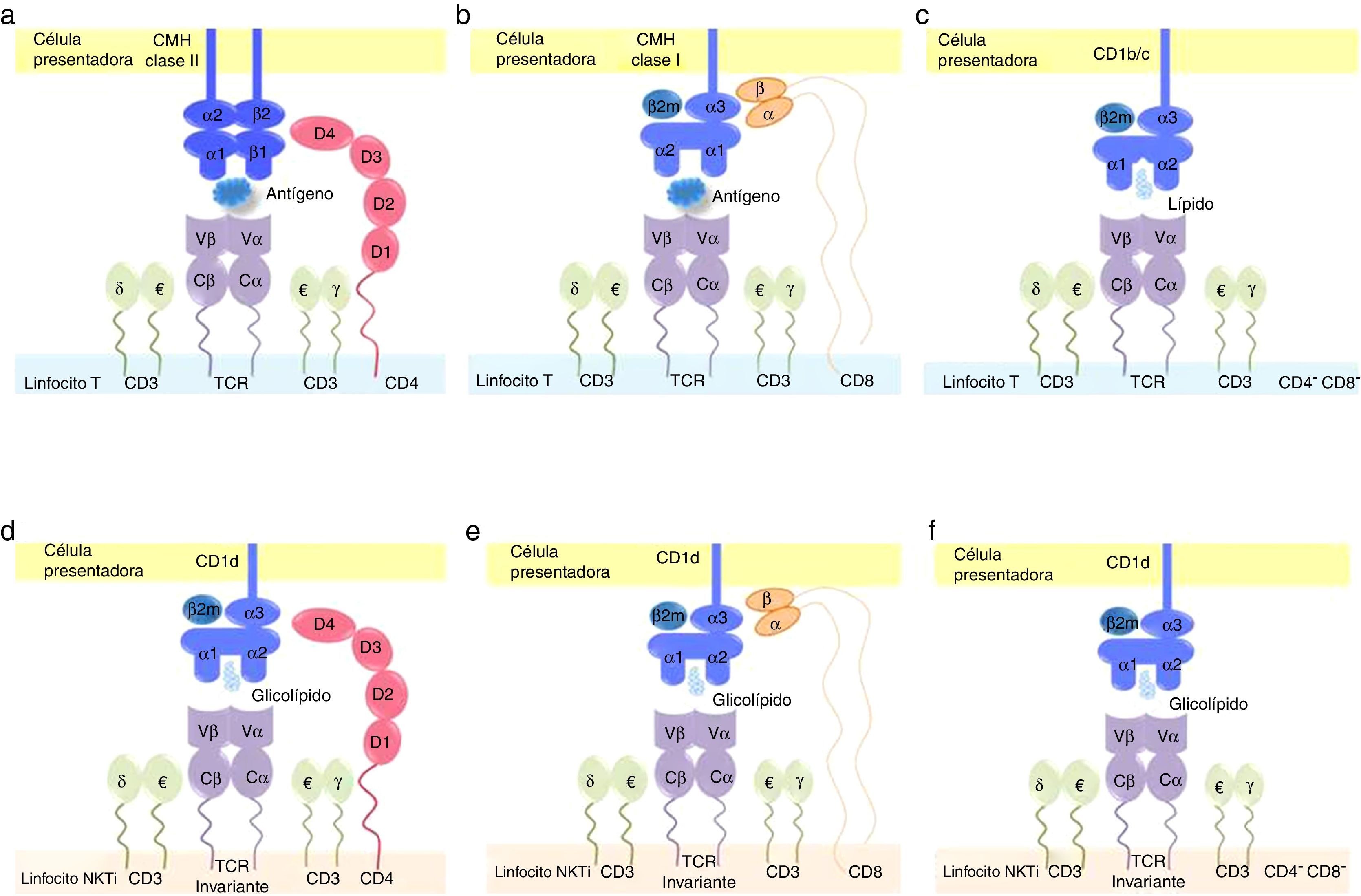
Sinapsis inmunológica en los linfocitosT convencionales y en las células NKTi. Los linfocitosT convencionales, tanto CD4+ (a) como CD8+ (b), reconocen antígenos presentados por células especializadas a través de moléculas del complejo mayor de histocompatibilidad (CMH) claseii y clasei, respectivamente, a través de su receptor de célulaT (TCR por sus siglas en inglés). El correceptor CD4 interactúa con las regiones β1 y β2 del CMH claseii, mientras que CD8 lo hace con las regiones α1 y α2 del CMH clasei. Por su parte, los LT doble negativos DN, CD4–/CD8−) (c) reconocen lípidos presentados por CD1b o CD1c, moléculas no convencionales estructuralmente asociadas al CMH clasei. Para las células NKTi, la presentación antigénica también se realiza por moléculas no convencionales, específicamente por la proteína CD1d, que expone antígenos glucolipídicos al TCR invariante de la célula NKTi. Los correceptores CD4 (d) y CD8 (e) interactúan con las regiones α1 y α2 de CD1d. Sin embargo, aun en ausencia de estas moléculas en células NKTi DN (f), esta interacción también se traduce en activación celular.
Todas estas observaciones llevaron a caracterizar un nuevo linaje de linfocitosT, llamado NKT invariante (NKTi), cuya característica fundamental es su reactividad a αGalCer y lípidos estructuralmente relacionados en el contexto de CD1d9. Adicionalmente, la gran mayoría de estas células en humanos expresa la cadena Vα24-Jα18 junto con la cadena Vβ11 del TCR, marcadores de fenotipo de célulasT de memoria efectora como CD45RO10 y que tiene una gran capacidad de producir citoquinas. Anteriormente se incluía entre las características únicas de las células NKTi en humanos la expresión del marcador específico de células NK, CD161; sin embargo, actualmente se conoce que otras subpoblaciones de linfocitosT convencionales pueden expresar este marcador después de su activación, y que los niveles de expresión de CD161 varían con los estados de maduración y activación celular11.
Ontogenia de las células NKT invariantes: un proceso coordinado y con características particulares en relación con los linfocitosT convencionalesComo para todos los linfocitosT, el desarrollo de las células NKTi se lleva a cabo en el timo, donde estas células experimentan procesos de selección positiva y negativa que están determinados principalmente por la avidez de la interacción del TCR a ligandos específicos12,13. Sin embargo, una de las características más peculiares que tiene el proceso de diferenciación de las células NKTi en el timo es que, a diferencia del proceso de selección positiva para los linfocitos T convencionales el cual es mediado por células epiteliales tímicas que expresan moléculas del CMH, los linfocitos NKTi involucran a la molécula CD1d expresada en los timocitos corticales doble positivos (DP, CD4+/CD8+) en la presentación antigénica. Esta afirmación es soportada por evidencias que indican que específicamente las células NKTi están ausentes en los ratones deficientes en CD1d14. Cuando se reconstituye el timo de estos ratones con timocitos DP CD1d+/+, las células NKTi se desarrollan normalmente15. Por otra parte, utilizando ratones quiméricos cuyas células de médula ósea carecen de la expresión de CD1d se demostró que los timocitos DP CD1d−/− son incapaces de soportar el desarrollo tímico de las células NKTi. Sin embargo, no solo se requiere que CD1d se exprese en los timocitos DP, sino también que su interacción con los precursores NKTi se lleve a cabo de manera adecuada, ya que pequeños cambios en la estructura de esta molécula afectan la avidez de su interacción con el TCR de los precursores de las células NKTi, influyendo la producción de estas en el timo y el hígado16.
Respecto a los autoantígenos naturales presentados por el CD1d en los timocitos corticales DP para la selección de las células NKTi, no existen aún datos concluyentes. Sin embargo, se ha planteado que fosfolípidos, glucoesfingolípidos, gangliósidos y galactosil-ceramidas pueden participar en este proceso17. αGalCer no se incluye en este grupo porque no es un ligando natural de estas células en mamíferos. Sin embargo, un estudio reciente demostró que isoformas de la βD-glucopiranosilceramida podrían representar autoantígenos importantes de las células NKTi murinas y humanas en el timo18,19. La isoglobotrihexosilceramida (iGb3) ha sido propuesta como un potente autoantígeno en el modelo murino, mas su papel en la activación de las células NKTi humanas ha sido controversial; sin embargo, después de realizar un análisis de la activación y función de las células NKTi de sangre periférica (SP) de personas sanas en respuesta a iGb3, en comparación a la respuesta inducida por αGalCer, se determinó que iGb3 no estimula la expansión de las células NKTi ni tampoco la liberación de citoquinas como IL-4, IFN-γ, IL-13 o GM-CSF, demostrando que iGb3 no es un antígeno esencial en la biología de los las células NKTi en el contexto humano20. La diferenciación de las células NKTi comienza, al igual que para los demás linfocitosT, con el rearreglo de los segmentos génicos de la cadenaβ del TCR. Sin embargo, para la generación del TCR invariante este proceso continúa en ratones, con el rearreglo de los segmentos que codifican Vα14 y Jα18 de esta molécula21, lo que permite su selección positiva, al reconocer antígenos lipídicos presentados por la molécula CD1d expresada en la superficie de timocitos seleccionadores DP22. La interacción homotípica entre estos timocitos DP (uno funcionando como seleccionador y el otro como precursor de linfocitos NKTi) permite la interacción homofílica de proteínas miembros de la familia SLAM; SLAM y Ly108, lo cual activa vías de señalización en las cuales participan la proteína adaptadora de SLAM (SAP), la tirosina quinasa Fyn y factores de señalización como PKC¿ y NFκB. Estas moléculas son necesarias en la selección positiva, ya que influyen en la expresión del TCR invariante y también en la expansión de las células NKTi, hecho evidenciado por el bloqueo del desarrollo de las células NKTi (mas no en los linfocitosT convencionales), en ratones deficientes en SAP o Fyn23,24.
Luego de la selección positiva, se han formulado 4fases para la maduración de las células NKTi en ratones, basadas en la presencia de CD24, CD44 y NK1.1, tal como se observa en la tabla 125. CD24 es una molécula de adhesión celular que se expresa en granulocitos maduros, en linfocitosB y en células en diferenciación. CD44, por su parte, es una glucoproteína de membrana utilizada para rastrear el desarrollo de los linfocitosT convencionales en el timo y es un marcador de activación. NK 1.1, como ya se ha mencionado, es un marcador de las células NK característico de las células NKTi murinas. En humanos, de los marcadores de maduración establecidos en ratones, solamente el homólogo de NK1.1, CD161, ha sido estudiado. En los ensayos realizados por Hu et al.26, CD161 se expresa en una proporción mayor en las células NKTi en SP en comparación con los presentes en el timo. Por otra parte, la expresión de CD161 es menor en donantes menores a los 6meses de edad respecto a niños mayores. Todo lo anterior indica que CD161 es un marcador de madurez de las células NKTi, pero aún se deben definir los marcadores relacionados con las fases de maduración de las células NKTi humanas en el timo.
Fases de la maduración en células NKTi murinas, en timo y órganos periféricos
| Fase | Fenotipo | Características |
| Estadio 0 | CD24hi, CD44lo, NK1.1– | Fenotipo de las células NKTi inmediatamente luego de la selección positiva en la corteza tímica. En este estadio se determina el fenotipo de estas células. En algunas se regula negativamente CD4, generando una subpoblación doble negativa (DN) |
| Estadio 1 | CD24lo, CD44lo, NK1.1– | Proliferación marcada. La población total de linfocitos NKTi aumenta aproximadamente 100 veces. Estas células tienen capacidad de producir principalmente IL-4 |
| Estadio 2 | CD24lo, CD44hi, NK1.1– | Proliferación marcada. Adquisición del fenotipo de memoria. Las células adquieren la capacidad de producir IFN-γ y otras citoquinas |
| Estadio 3 | CD24lo, CD44hi, NK1.1+ | Después de adquirir el marcador NK1.1+, algunos linfocitos NKTi maduran extratímicamente. Sin embargo, algunas células maduran en el timo originando linfocitos residentes terminales de larga vida |
Aunque para los linfocitos T convencionales es reconocido que los procesos de selección negativa se relacionan con el reconocimiento de antígenos propios con alta afinidad, los mecanismos que regulan la selección negativa de las células NKTi aún no se entienden completamente. Se ha observado que en ratones inyectados intraperitonealmente con altas dosis de α-GalCer en el día 3-14 después del nacimiento hay una disminución de las células reactivas a esta molécula en el timo, efecto que no se observa en ratones adultos30. El mismo efecto se observa cuando se sobreexpresa CD1d en el estroma tímico31. Estos datos indican que la exposición a autoantígenos lipídicos en el timo en etapas tempranas del desarrollo puede seleccionar negativamente las células NKTi que presentan una alta afinidad a estas moléculas, pero se conoce muy poco sobre los mecanismos o las moléculas antigénicas que median este proceso.
Otro interrogante que no se ha resuelto en la actualidad sobre la ontogenia de las células NKTi son los factores que determinan la expresión de las moléculas CD4 y CD8 en su superficie, lo cual, como veremos más adelante, le confiere características funcionales diferentes. Estudios iniciales sugieren que un factor de transcripción como THPOK bloquea la expresión de CD8 en estas células en el timo, aunque también cumple esta función en los linfocitosT convencionales32. Adicionalmente, se ha sugerido que las células NKTi doble negativas (DN) se originan de timocitos DPdim en el timo12.
Fenotipo y función de las células NKTi: plasticidad y adaptabilidad en los diferentes patrones de cooperación celularAl salir del timo, las células NKTi son activadas en la periferia por moléculas lipídicas asociadas a CD1d, generando ciclos de expansión clonal en el bazo, el hígado y la médula ósea. Aunque poco se conoce sobre los antígenos naturales que son presentados mediante CD1d en la periferia, se ha observado que α-glucuronosil-ceramidas o diacilglicerol aislado de bacterias gramnegativas como las del género Sphingomona o glucolípidos de Borrelia burgdorferi se unen específicamente a CD1d33. Aunque se presume que la activación de las células NKTi mediada por la molécula CD1d de las células presentadoras de antígeno se lleva a cabo por presentación de lípidos derivados de patógenos, evidencias crecientes sugieren que antígenos lipídicos propios pueden participar también en la activación de estas células en situaciones en las que antígenos lipídicos exógenos no están presentes. Esta propiedad confiere a estas células la capacidad de ser activadas en diferentes contextos patológicos y a partir de un umbral de afinidad con el antígeno18,34. La expansión de las células NKTi mediada por moléculas asociadas a CD1d se relaciona entonces con una producción sostenida de citoquinas que contribuye a la activación de las células NK, células dendríticas, linfocitosB y otros linfocitosT35.
La evaluación del número de células NKTi en SP humana es complicada, principalmente por su baja frecuencia en sangre y por las diferencias en los anticuerpos usados para su caracterización. Analizando 90controles sanos, Montoya et al.10 describen que la frecuencia de las células NKTi varía de 0,01 a 0,92% de los linfocitos totales usando una combinación del anticuerpo obtenido de la clona 6B11 (que reconoce el TCR Vα24-Jα18) y anti-CD3 para su caracterización. Sin embargo, en este artículo no se presentan los valores absolutos de estas células en SP. En otro estudio, realizado por Bienemann et al.36, se reporta que la frecuencia de las células NKTi puede variar de 0,021 a 0,712% de los linfocitos totales en SP de niños sanos con valores absolutos que fluctúan entre 515 y 8.762células/ml. Por otra parte, se ha determinado que la frecuencia de células NKTi en sangre humana disminuye con la edad, un efecto que es más marcado en hombres, a expensas de una disminución de subpoblación DN (revisado por Peralbo et al.37).
También existe mucha variabilidad en los métodos usados para estudiar las diferentes subpoblaciones de las células NKTi en SP humana. En la literatura se ha reportado que existen 4subpoblaciones: CD4+/CD8–, CD4−/CD8αα+, CD4−/CD8α+β+ y CD4–/CD8−, y se ha descrito que existe una relación inversa entre el número total de las células NKTi y el porcentaje de las células NKTi CD4+10. Los linfocitos NKTi CD4+ producen mayores cantidades de IL-4, IL-13, GM-CSF e IL-2 que sus contrapartes DN (CD4–, CD8α−) y CD8α+ (que comprende las subpoblaciones CD8α+β+ y CD8α+β−)38. Realizando un estudio comparativo en el que se cultivaron cada una de las subpoblaciones de células NKTi junto a linfocitosT convencionales CD4+ o CD8+, linfocitos NK o B, obtenidos de SP de donantes sanos, se observó que las células NKTi CD4+ fueron la subpoblación con la mayor capacidad de inducir la regulación positiva de los marcadores CD69 y CD25 en linfocitosT CD4+ y B frente a las otras subpoblaciones. Estas células también exhiben mayor capacidad de inducir la expresión del marcador CD69 en linfocitos NK. Es importante resaltar, sin embargo, que en este estudio las células NKTi CD8+ y DN también mostraron la capacidad de activar linfocitosT CD4+, NK y B autólogos, aunque en menor proporción comparados con sus contrapartes CD4+. Por su parte, las células NKTi CD8β+ mostraron una mayor capacidad para inducir la expresión de CD25 en linfocitosT CD8+ convencionales. Esta capacidad cooperadora de las células NKTi con otros linfocitos se asocia con su habilidad para producir diferentes citoquinas, mostrando los linfocitos NKTi CD4+ habilidad para secretar tanto IFN-γ como IL-4, mientras que los CD8+ y DN producen casi exclusivamente IFN-γ38. Este estudio, sin embargo, no analizó la subpoblación de células NKTi CD8αα+, aunque presumimos que se incluye dentro de las células DN (CD4–/CD8β−). Se ha observado adicionalmente que las células NKTi CD8αβ+ exhiben un fenotipo Th1 y actividad citotóxica, al igual que las células NKTi DN, y tienen una mayor capacidad de eliminar células tumorales en relación a las células NKTi CD4+ o DN39. Por su parte, las células NKTi DN han mostrado habilidad para secretar IL-17 tras la estimulación con PMA/ionomicina o αGalCer y la exposición a células HeLa transfectadas con CD1d40.
En otro estudio, en el cual se intenta caracterizar las subpoblaciones de las células NKTi CD4+ o DN (no se caracteriza la subpoblación de estas células que expresa CD8), las células NKTi DN (CD4–/CD8β−) expresan en mayor cantidad receptores de quemoquinas y marcadores de membrana del linaje celular NK (como CCR5 y CD94/NKG2A, entre otros) respecto a las células NKTi CD4+. Además, estas células producen IFN-γ y TNF-α en altas cantidades41. Sin embargo, varios estudios evidencian que la capacidad de producir citoquinas o expresar determinados receptores de superficie en estas células depende en gran medida del estímulo utilizado35,40,42. De esta manera, cuando se altera la molécula αGalCer acortando sus residuos de esfingosina, las células NKTi exhiben un fenotipo Th2, mientras que una activación mediada por la molécula NK1.1 favorece una respuesta Th141,43. De igual manera, las células NKTi DN producen mayor cantidad de perforina comparadas con las CD4+ al activarse con αGalCer, IL-2, IL-12 o LPS, mientras que se observa el efecto contrario cuando estas células se activan con PMA/ionomicina36.
Respecto a las células NKTi CD8αα+, se ha evidenciado que pueden tener un efecto supresivo en la proliferación de linfocitosT activados, ya que adicionando clones de las diferentes subpoblaciones de células NKTi humanas a un cultivo de células mononucleares de SP estimuladas con estreptoquinasa, se observó una reducción dosis-dependiente de la respuesta proliferativa de linfocitosT específicos hasta en el 70% cuando se co-cultiva con las células NKTi CD8αα+, sugiriendo que esta subpoblación está directamente relacionada con la regulación de los linfocitosT convencionales después de su estimulación44. En la figura 2 se representa la ontogenia de los las células NKTi y su diferenciación a células CD4+/CD8−, CD4−/CD8αα+, CD4−/CD8α+β+ y CD4−/CD8−.
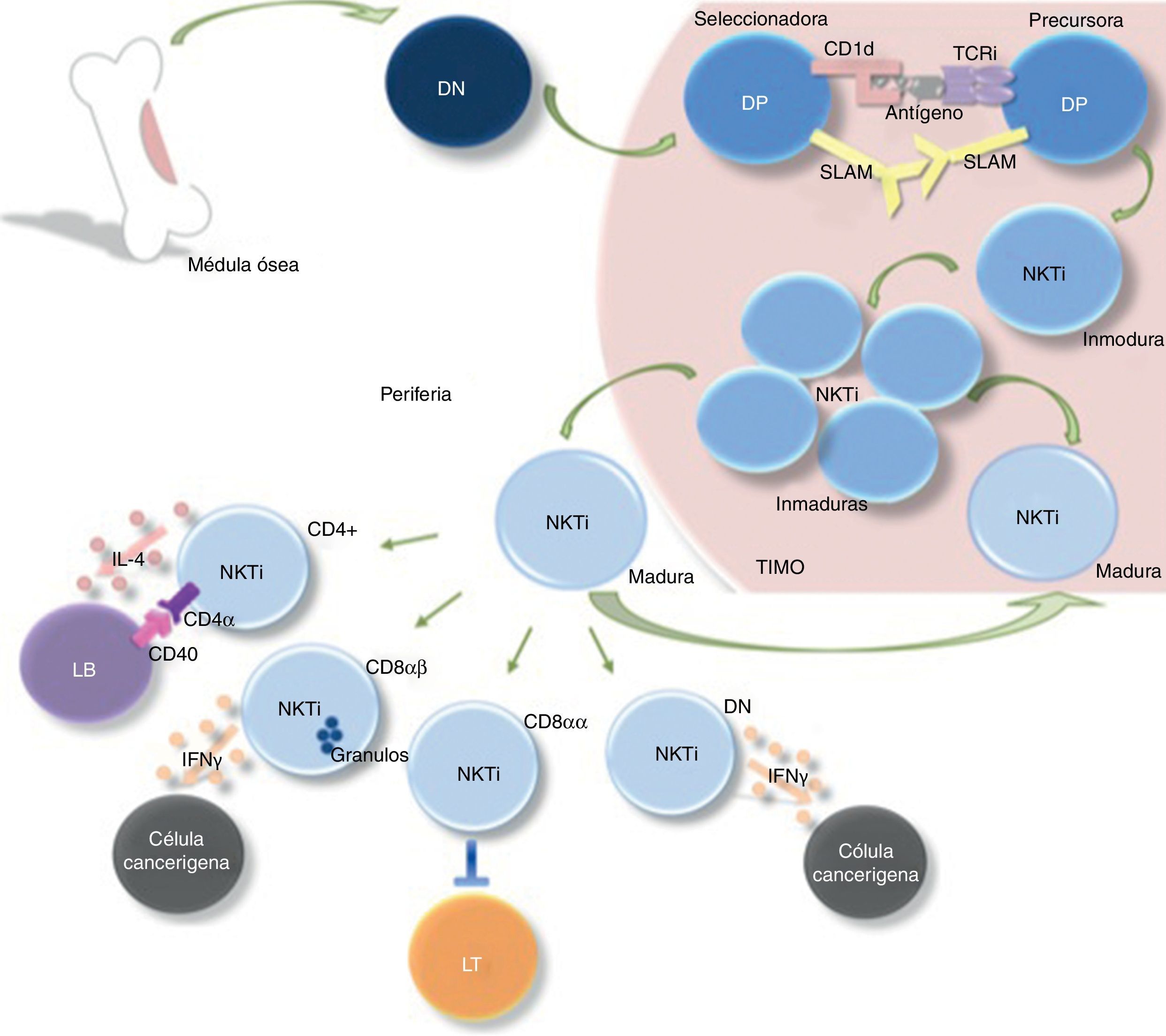
Proceso de selección y maduración de los linfocitos NKTi. Una célula doble negativa (DN) proveniente de la médula ósea pasa al timo para su diferenciación en célula precursora de linfocitos doble positiva (DP). Su selección ocurre por la interacción de una célula seleccionadora (presentadora de antígeno por CD1d) y una célula precursora (que posee un TCR invariante), originándose una célula NKTi inmadura. Posteriormente, estas células inmaduras proliferan y continúan su proceso de maduración tanto en el timo como en la periferia. La diferenciación en las distintas subpoblaciones de linfocitos NKTi (CD4+, CD8αβ, CD8αα y DN) sucede extratímicamente, en donde cumplen funciones específicas de cooperación e interacción con otras células del sistema inmune.
Algunos fenómenos autoinmunes parecen tener una marcada influencia en el número de células NKTi circulantes en humanos. Se ha reportado, por ejemplo, una marcada disminución en el número absoluto de células NKTi en SP de pacientes con Lupus Eritematoso Sistémico (LES)45 al igual que en los pacientes con Artritis Reumatoidea, en quienes se ha relacionado con la severidad de la enfermedad46. Sin embargo, este no es un hallazgo constante de todas las enfermedades autoinmunes ya que por ejemplo, en diabetes mellitus tipo1 las células NKTi circulantes se han encontrado aumentadas, normales o disminuidas comparadas con aquellas de los controles sanos47.
En lo relacionado con enfermedades infecciosas, se ha reportado que en pacientes con tuberculosis los niveles de células NKTi de SP están significativamente disminuidos, hallazgo que se correlaciona inversamente con los niveles de proteína C reactiva y con la actividad de la infección48. En individuos afectados por el virus de la inmunodeficiencia humana (VIH) la disminución en los números absolutos de células NKTi también se relaciona con la progresión de la enfermedad49. De igual forma, durante estadios crónicos de hepatitisB la frecuencia en SP de las células NKTi está disminuida, pero estos valores aumentan después de terapia antiviral50. Curiosamente, durante la infección por el virus de la hepatitisC esta subpoblación celular no se encuentra afectada en número en SP51.
Teniendo en cuenta estos hallazgos, se han realizado estudios que buscan proponer nuevas estrategias de inmunoterapia por medio de la activación de las células NKTi in vivo o in vitro, proponiendo como primera aproximación la administración de análogos sintéticos de α-GalCer52,53. En 2007 se realizó un estudio fasei/ii en 40pacientes con hepatitisC crónica, a quienes se les suministraron diferentes concentraciones de KRN7000 en intervalos de 4semanas. Solamente en un paciente se observó una reducción marcada de los niveles de ARN del virus de la hepatitisC51. De igual forma, la capacidad antiviral de KRN7000 se evaluó en 27pacientes con hepatitisB crónica, en quienes no se observó una disminución en el ADN viral en SP después del tratamiento, que además fue poco tolerado por los pacientes54.
Los ensayos clínicos se han centrado, sin embargo, en pacientes con cáncer. En 2002, Giaccone et al.55 administraron KRN7000 (el análogo sintético de αGalCer) en 24pacientes con tumores sólidos por cáncer avanzado a diferentes tiempos durante 4semanas. Clínicamente, 7 de los pacientes que recibieron KRN7000 presentaron estabilización en la progresión tumoral, mientras que en 15 de ellos se observó una progresión de la enfermedad.
Por otra parte, se han realizado ensayos clínicos infundiendo células pulsadas con glucolípidos para inducir la activación de las células NKTi de una manera más efectiva. Uno de los primeros estudios clínicos de fasei publicados se realizó en 12pacientes con metástasis malignas de diferentes tipos de cáncer. En intervalos de 2semanas se infundieron células dendríticas derivadas de monocitos pulsadas (CDMo) con KRN7000 marcadas radiactivamente. Se demostró que después de 24h la mayoría de estas CDMo migraron desde los pulmones al hígado y al bazo, y en menor proporción a la médula ósea. Aunque la respuesta tumoral no era un objetivo del estudio, se observó que los marcadores tumorales en suero disminuyeron en 2pacientes con adenocarcinoma, se desarrolló necrosis extensa del tumor en otro de los participantes con carcinoma de células renales y se redujeron en suero las enzimas hepatocelulares de otros 2pacientes con infiltración tumoral hepática56. Adicionalmente, se ha probado la infusión intravenosa de células dendríticas estimuladas con KRN7000 en combinación con fármacos antitumorales, demostrando una reducción tumoral relacionada con el protocolo terapéutico57.
Se establece entonces que la administración en diferentes dosis de KRN7000 resulta bien tolerada por pacientes con cáncer; sin embargo, no es suficiente la estimulación con el glucolípido in vivo para lograr una respuesta inmune antitumoral efectiva. En cuanto a los parámetros inmunológicos, todos estos estudios muestran que en SP las células NKTi presentan variaciones transitorias tras las infusiones de glucolípido o células pulsadas con este. Sin embargo, se comprueba que la activación de las células NKTi por estos métodos incrementa la producción de citoquinas en suero, y cuando estos parámetros se evalúan, también la citotoxicidad de las células NK y la expresión de un fenotipo de memoria por parte de las células NKTi. Al parecer, la producción de IFN-γ por parte de estas células es determinante para su eficacia clínica. Esta afirmación se fundamenta en el trabajo de Ishikawa et al.58, quien después de evaluar la seguridad de su protocolo de transferencia adoptiva determina los números de células productoras de IFN-γ de SP en 17pacientes con cáncer pulmonar de células no pequeñas, en respuesta a inyecciones de CMSP pulsadas con KRN7000. Los números de células productoras de IFN-γ, identificadas como células NK, y las células NKTi se incrementaron en 10pacientes después de la estimulación. En estos 10casos se observó un incremento en el tiempo medio de sobrevida (31,9meses promedio) y 4 se clasificaron como de enfermedad estable. De los 7pacientes en los cuales no se observó incremento en las células productoras de IFN-γ, el tiempo medio de supervivencia fue menor (9,7meses en promedio), y solo un caso fue clasificado como estable59.
ConclusionesDesde los primeros estudios realizados a las células NKTi, el análisis de su fenotipo y de sus funciones ha demostrado la importancia de esta subpoblación de linfocitosT en la respuesta inmune. A partir de su caracterización en ratones se ha logrado establecer diferentes estadios de maduración celular; sin embargo, estos estadios no son claros en las células NKTi en humanos, lo cual genera preguntas como: ¿cuáles son los marcadores celulares relevantes en el proceso de maduración de estas células en el timo humano? ¿En qué partes del timo ocurre este proceso? ¿Cuáles son los factores determinantes de la diferenciación en las células NKTi CD4+, CD8αβ+, CD8αα+ o DN?
Por otra parte, la identificación de la molécula presentadora de antígenos glucolipídicos CD1d, como elemento indispensable para la selección y la activación de los las células NKTi, la señala como un blanco de investigación en el entendimiento de la relación de las células NKTi y sus potenciales antígenos. Sin embargo, es necesario identificar con precisión los autoantígenos que son presentados por esta molécula en el timo y los que inducen una respuesta por parte de las células NKTi en la periferia, ya que, como se mencionó anteriormente, tanto α-GalCer como KRN7000 son moléculas no fisiológicas.
El estudio de la función de los las células NKTi ha permitido dilucidar el efecto de la interacción entre las diferentes subpoblaciones de estos linfocitos y otras subpoblaciones celulares del sistema inmune, como la activación de linfocitosB asociada a las células NKTi CD4+, la regulación de la proliferación de linfocitosT activados por las células NKTi CD8αα+ y la actividad citotóxica contra células tumorales asociada a las células NKTi CD8αβ+, entre otras. Estos hallazgos hacen evidente la importancia de estas células como mediadoras de la respuesta inmune y permite plantearlas como indicadores del avance de ciertas enfermedades y como alternativas terapéuticas. Las evidencias indican que tanto el uso terapéutico de glucolípidos específicos como la infusión de células presentadoras de antígeno pulsadas con estos puede potenciar la respuesta inmune innata y adaptativa. Sin embargo, se necesita optimizar e individualizar estos protocolos para lograr una mayor eficacia clínica.
FinanciaciónEste trabajo fue escrito en el marco del proyecto «Estudio de la coestimulación de los linfocitos NKT invariantes a los linfocitos B en Inmunodeficiencia Común Variable: Un posible mecanismo para explicar deficiencias en la producción de anticuerpos en humanos», aprobado por el Departamento Administrativo de Ciencia, Tecnología e Innovación, COLCIENCIAS, código 11115-519-29012.
Conflicto de interesesLos autores declaramos no tener ningún conflicto de intereses.