La neoplasia mucinosa papilar intraductal es una lesión pancreática premaligna que se caracteriza por presentar una proliferación papilar intraductal de células ductales productoras de mucina que conducen a la dilatación del conducto pancreático principal y/o de sus ramas y son a menudo multifocales.
El diagnóstico preoperatorio de benignidad o malignidad tiene importantes implicaciones terapéuticas y pronósticas. La resección quirúrgica temprana es el tratamiento de elección para evitar la degeneración maligna, siempre que confluyan factores de riesgo como la localización, el tamaño, los nódulos murales, las atipias en el líquido intraquístico o la existencia de síntomas. La extensión de la resección es un tema aún debatido ya que no existe un consenso absoluto. Estos pacientes requieren, aunque hayan sido resecados, un seguimiento clínico y mediante técnicas de imagen para identificar recidivas, signos de riesgo de malignización o lesiones metacrónicas. También es importante investigar la existencia de posibles neoplasias extrapancreáticas sincrónicas o metacrónicas.
Intraductal papillary mucinous neoplasm (IPMN) is a premalignant pancreatic entity characterized by papillary growth of the ductal epithelium with rich mucin production and cystic dilatation of the main pancreatic duct and/or its branches. These neoplasms are often multifocal.
Preoperative distinction between benign and malignant lesions is important to select the most appropriate treatment and to improve prognosis. Early surgical resection is the treatment of choice to avoid malignant transformation when predictive factors for malignancy are present. These factors include localization, cyst greater than 3cm, nodules in the cystic wall, atypias in the cyst fluid and the presence of symptoms. The extent of resection required for adequate treatment of IPMN of the pancreas is still controversial. Patients who retain a portion of their pancreas following resection of an IPMN need to be followed up with periodic imaging to detect recurrences, signs indicating a risk of malignant transformation, and metachronous lesions. The existence of possible synchronous or metachronous lesions in other organs should also be investigated.
La neoplasia mucinosa papilar intraductal (NMPI) es una lesión quística pancreática con un gran riesgo de degeneración maligna, cuyos primeros casos fueron descritos en Japón a principios de la década de 1980 por Ohashi et al.1. Aunque inicialmente fue considerada una enfermedad extraordinariamente rara, en la actualidad representa aproximadamente el 5-20% de todas las neoplasias pancreáticas, dado el aumento de incidencia observado en estos últimos años2–4. Desde el punto de vista histológico se caracteriza por presentar una proliferación papilar intraductal de células columnares que producen una abundante secreción de mucina y conducen a la dilatación del conducto pancreático principal, de sus ramas o de ambos, y no pocas veces son multifocales5,6.
Estas lesiones pueden presentar diversos grados de transformación celular que van desde la displasia de bajo grado (adenoma) hasta el adenocarcinoma invasivo (tabla 1). Esta última fase puede alcanzarse en un período entre los 3 y 6 años de conocerse el diagnóstico7.
Esta neoplasia afecta a ambos sexos por igual, con mayor frecuencia entre los 60 y 70 años. Clínicamente puede manifestarse en forma de dolor abdominal o provocar episodios de pancreatitis aguda. En ocasiones no se descubre el tumor hasta después de varios episodios de pancreatitis8,9. Sin embargo, a menudo bastantes pacientes están asintomáticos en el momento del diagnóstico (40% de los casos), al que se llega de forma incidental al someterlos a una exploración abdominal mediante una técnica de imagen por motivos ajenos a esta enfermedad pancreática7,8,10,11.
El diagnóstico se consigue mediante la realización de técnicas de imagen, como la tomografía computarizada (TC) o la colangiopancreatografía por resonancia magnética (CPRM). La ultrasonografía endoscópica (USE) permite además la obtención de material para citología mediante punción aspirativa con aguja fina (PAAF) o por cepillado del interior de la lesión12.
El diagnóstico diferencial con otras lesiones quísticas pancreáticas puede ser difícil. No obstante, la identificación de comunicación entre una formación quística de rama colateral y el conducto de Wirsung13 o la presencia de mucina, ya sea en el material obtenido mediante punción o la observación de su salida a través de la papila son características de la NMPI.
Algunos autores han evaluado la significación de determinados marcadores en el líquido aspirado del interior de la formación quística (CEA, CA19.9, CA15-3, CA72-4, amilasa, lipasa, viscosidad, etc.) con resultados divergentes. Unos concluyen que el valor del CEA asociado a otros factores, como grosor de la pared, presencia de nódulos o grado de viscosidad permite diferenciar las neoplasias quísticas benignas de las malignas14–16. Otros consideran que los valores de CEA solo son útiles para diferenciar las neoplasias quísticas mucinosas de las no mucinosas pero no permiten identificar con claridad la existencia de malignidad17,18.
La NMPI de conducto principal tiene una prevalencia de malignización del 70%, si se incluyen los carcinomas in situ y del 43% si solo se consideran los carcinomas invasivos. En las neoplasias de rama colateral esta prevalencia es del 25% si se consideran los carcinomas in situ y del 15% si únicamente se tienen en cuenta los carcinomas invasivos5,19. Según la guía de consenso internacional, discutida en la reunión de Sendai (Japón) en 2004, debe sospecharse la posibilidad de degeneración maligna si el diámetro del conducto de Wirsung es mayor de 6mm o las ramas colaterales superan los 30mm. La observación de nódulos mayores de 3mm o de irregularidades en la pared del tumor también deben hacer sospechar malignidad y, por supuesto, la identificación de atipia celular en el material obtenido mediante punción intraquística5.
El pronóstico es muy bueno en las NMPI benignas puesto que a los 5 años la supervivencia de los pacientes oscila entre el 77 y el 100%. Algunos de estos pacientes fallecen por alguna complicación post-operatoria o a lo largo del seguimiento por enfermedades ajenas a la NMPI7,11,13,19–22. Cuando desarrollan un carcinoma invasivo la supervivencia de los enfermos se ve reducida a un 28-62% a los 5 años7,11,13,19–23, inferior a las NMPI con carcinoma in situ (supervivencia alrededor del 80%)11 pero superior a la del adenocarcinoma ductal pancreático que tiene una supervivencia que oscila entre el 5 y el 20% a los 5 años24.
El pronóstico del carcinoma invasivo desarrollado sobre una NMPI depende del subtipo histológico que adquiere el epitelio columnar mucinoso de los conductos pancreáticos. Se consideran 4 subtipos histológicos: gástrico, intestinal, pancreatobiliar y oncocítico25. El subtipo gástrico, virtualmente indistinguible de las células de la mucosa gástrica, es más frecuente en las NMPI de ramas colaterales, tiene una baja actividad proliferativa y cuando se transforma en carcinoma invasivo adquiere una arquitectura de tipo tubular. El subtipo intestinal es morfológicamente similar al adenoma velloso colónico. Es más propio de las NMPI de conducto principal y proclive a desarrollar carcinoma invasivo de tipo coloide. Tras la resección presenta un mejor pronóstico respecto a los otros subtipos26. El subtipo pancreatobiliar es menos frecuente y se caracteriza por presentar células cuboides. Este grupo muchas veces se observa entremezclado con epitelio de tipo gástrico. Los carcinomas invasivos surgidos del subtipo pancreatobiliar son frecuentemente de tipo tubular, raramente de tipo coloide, y tienden a presentar un comportamiento más agresivo25,26. Finalmente, el subtipo epitelial oncocítico es descrito como una categoría aparte de NMPI, como neoplasia papilar oncocítica intraductal. Tiene algunas características peculiares. Las papilas son delicadas y arborescentes y en caso de existir invasión esta es limitada, o sea, son más benignos25.
Así pues, el carcinoma surgido sobre una NMPI es citomorfológicamente muy heterogéneo ya que puede presentar la forma de adenocarcinoma tubular, carcinoma coloide o carcinoma oncocítico. Esta heterogeneidad parece tener un papel determinante en cuanto a la agresividad del tumor y a la supervivencia del paciente, como así lo demuestra un estudio recientemente publicado por Mino-Kenudson et al.26. En él estudiaron 61 pacientes con NMPI con carcinoma invasivo a lo que se les había practicado cirugía presuntamente curativa y los compararon con un grupo control de 570 pacientes con adenocarcinoma ductal pancreático (ACDP) convencional, no derivado de NMPI, que habían sido resecados con intención curativa. Observaron que la supervivencia media después de la resección era de 18 meses en los ACDP y de 58 meses en los carcinomas desarrollados sobre NMPI (p<0,0001). Al separar estos últimos según el subtipo celular las supervivencias eran muy distintas para ACDP, carcinoma coloide sobre NMPI y carcinoma oncocítico sobre NMPI (18 vs. 95, y 132 meses, respectivamente; p<0,0001). Sin embargo, si la supervivencia media del ACDP se comparaba con la del adenocarcinoma tubular sobre NMPI la diferencia no era significativa (18 vs. 35 meses, respectivamente; p=0,76). Este estudio cuestiona los resultados de otros 2 trabajos recientes que señalaban que la mejor supervivencia de los carcinomas sobre NMPI estaba relacionada con un diagnóstico más precoz que comportaría un menor tamaño del tumor y una menor incidencia de ganglios metastásicos27,28. Los hallazgos del estudio de Mino-Kenudson et al.26 plantean la pregunta de si los adenocarcinomas tubulares sobre NMPI, que tienen una supervivencia muy similar a los ACDP, pueden beneficiarse de un tratamiento adyuvante similar al que se aplica a estos.
Estrategia terapéuticaLa estrategia que debe aplicarse para decidir la actitud a seguir frente a una NMPI viene condicionada por su elevado riesgo de degeneración maligna, ya que pueden desarrollar ACDP de forma sincrónica, sobre la misma NMPI, o metacrónica, en una zona libre de NMPI29,30. En una reciente publicación de Ingkakul et al.31, en la que analizan retrospectivamente los factores predictivos de aparición de carcinoma ductal concomitante en un área no afectada por NMPI, se identifican el empeoramiento del control de la diabetes y el aumento sérico del marcador tumoral CA19.9 como parámetros independientes de predicción de malignidad.
Actualmente, los factores predictivos de malignidad de la NMPI se basan en los parámetros propuestos en la reunión de Sendai por la Asociación Internacional de Pancreatología5. Según esta si la neoplasia asienta sobre el conducto principal tiene un mayor riesgo que si está implantada en una rama colateral. Ocurre lo mismo si el calibre de aquel es superior a 6mm. En las NMPI de rama un diámetro mayor de 30mm, la existencia de componente sólido en su interior o si el paciente ha presentado síntomas atribuibles al tumor (dolor abdominal, pérdida de peso o pancreatitis) también deben hacer sospechar un mayor riesgo de degeneración maligna32,33.
En nuestra experiencia el tamaño y el antecedente de síntomas son los factores predictivos independientes que pueden asociarse a un mayor riesgo de malignidad11.
El grupo de la Universidad de Kyushu, después de realizar un análisis uni y multivariante en 138 pacientes con NMPI resecados, concluye que las neoplasias de conducto principal deben ser siempre operadas, dado su elevado riesgo de degeneración maligna. Por otro lado, en las NMPI de rama identifican 4 parámetros de riesgo: un tamaño del quiste mayor de 30mm, la presencia de nódulos murales, el antecedente de pancreatitis aguda y la observación de atipias en la citología del material intraquístico obtenido mediante punción. Los autores consideran que si en las NMPI de rama se identifican 2 o más de los 4 factores antes enumerados es recomendable que el paciente reciba pancreatectomía con disección ganglionar. Si el paciente presenta uno o ningún factor de riesgo puede ser tratado mediante pancreatectomía sin resección nodal o recibir un cuidadoso seguimiento34.
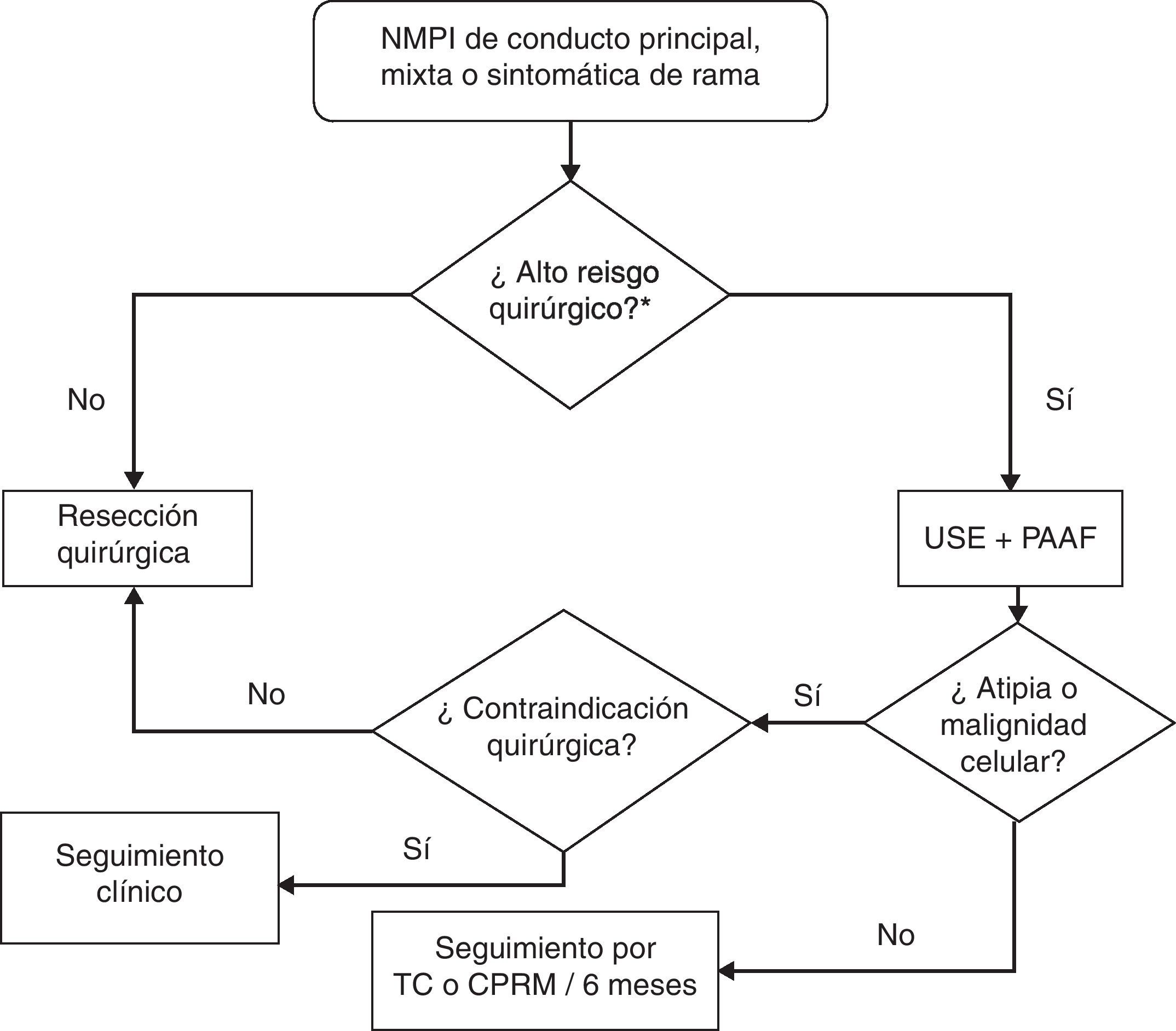
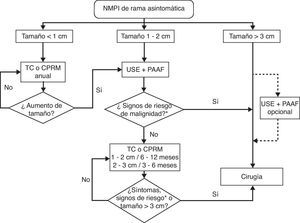
Para decidir la estrategia terapéutica en estos pacientes nosotros planteamos el algoritmo propuesto por el grupo de Boston para las NMPI de conducto principal o mixtas, o sintomáticas de rama35 (fig. 1). En estos casos es importante valorar el riesgo-beneficio de la cirugía habida cuenta de la lenta evolución de estas neoplasias; así, la edad avanzada y la comorbilidad son factores determinantes en el momento de tomar una decisión.
Algoritmo aconsejado para el manejo de las neoplasias mucinosas papilares intraductales de conducto principal, mixtas y sintomáticas de rama. CPRM: colangiopancreatografía por resonancia magnética; PAAF: punción aspirativa con aguja fina; TC: tomografía computarizada; USE: ultrasonografía endoscópica.
*Factores de alto riesgo quirúrgico: edad avanzada y comorbilidad.
Adaptada de Sahani et al.35.
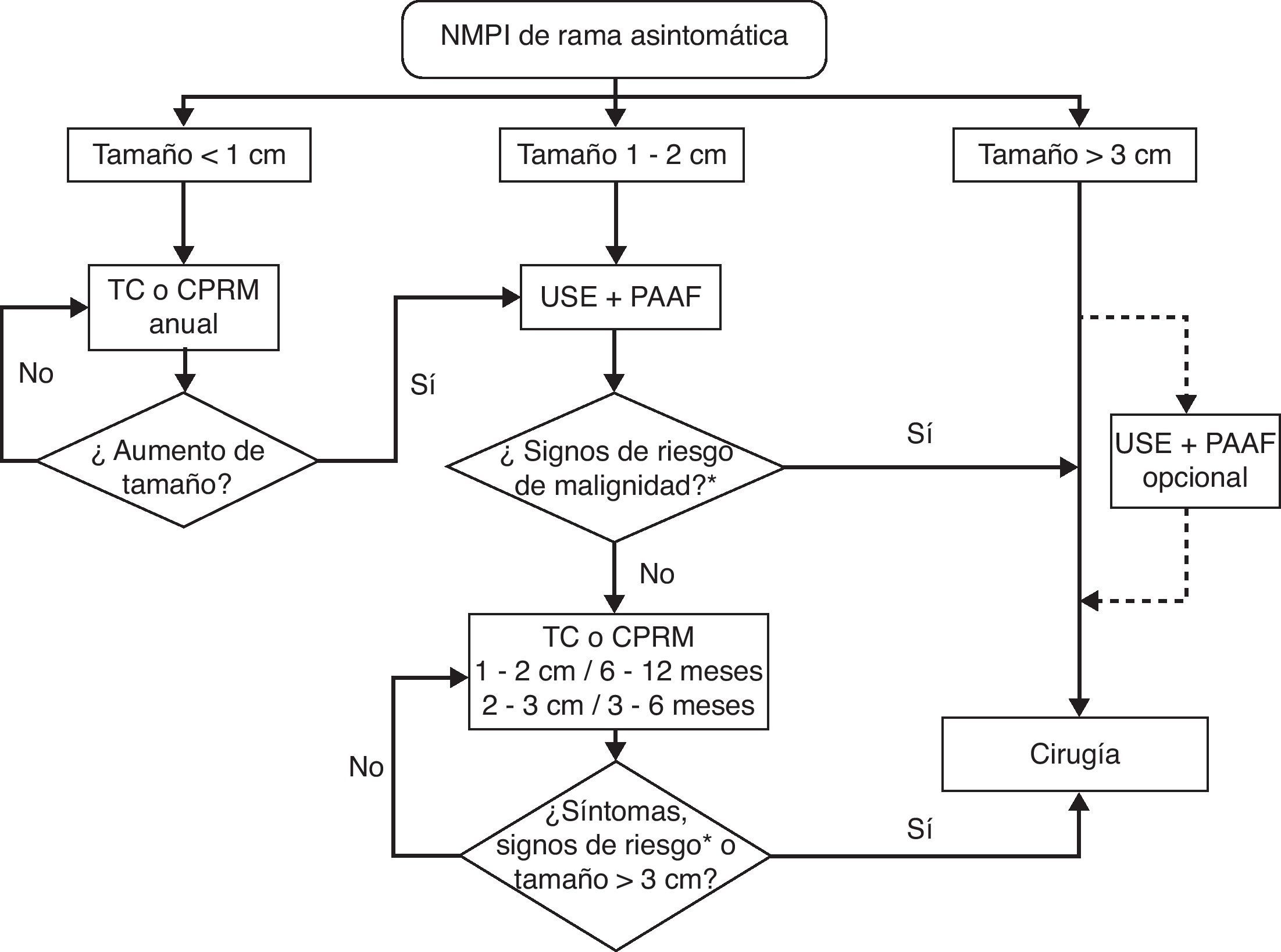
Una actitud distinta debe plantearse en las NMPI de rama colateral asintomáticas que está claramente basada en el tamaño del tumor quístico. En estos casos el tamaño superior a 30mm de diámetro, la presencia de nódulos en la pared del quiste, la aparición de sintomatología y la detección de atipias en el material aspirado condicionan la actuación intervencionista5,36,37, mientras que la falta de estas características permite realizar controles periódicos clínicos y con técnicas de imagen (fig. 2).
Algoritmo de seguimiento de las neoplasias mucinosas papilares intraductales de rama asintomáticas. CPRM: colangiopancreatografía por resonancia magnética; PAAF: punción aspirativa con aguja fina; TC: tomografía computarizada; USE: ultrasonografía endoscópica.
*Signos de riesgo de malignidad: nódulos murales y atipia celular neoplásica.
Adaptada de Tanaka et al.5.
Una vez decidida la necesidad de resección quirúrgica de la lesión deberá plantearse el tipo de cirugía más adecuado para cada situación. Así, cuando existe una notoria sospecha de malignidad será necesaria una cirugía agresiva propia de los casos de ACDP. Por ello, se indicará una pancreatectomía reglada con linfadenectomía estándar, ya que la existencia de nódulos metastásicos ha estado claramente relacionada con una más corta supervivencia a los 5 años38. Sin embargo, el potencial beneficio de una linfadenectomía ampliada no se conoce y deberá explorarse mediante estudios prospectivos.
Por otro lado, el tipo de resección pancreática dependerá de la localización y extensión de la lesión, de la edad del paciente y de sus expectativas de vida y de la necesidad de preservar el máximo de función exocrina y endocrina.
Neoplasia mucinosa papilar intraductal de conducto principalPuede afectar todo el Wirsung o solo a un segmento y, en este caso, asentarse en la parte proximal o distal del conducto. Según ello deberá indicarse duodenopancreatectomía cefálica en las neoplasias de cabeza pancreática, pancreatectomía corporocaudal en las de páncreas izquierdo, pancreatectomía segmentaria en las de cuerpo y pancreatectomía total en los tumores difusos. En esta última técnica deberá valorarse previamente, además de la edad del paciente, la comorbilidad y la existencia de diabetes preoperatoria, aunque hoy en día tanto esta como la malabsorción son controlables farmacológicamente. La pancreatectomía segmentaria ofrece la ventaja de preservar mejor la función exocrina y endocrina pero tiene un mayor número de complicaciones, en particular la fístula pancreática (22%)39.
Todas estas técnicas se asocian a una baja mortalidad y a una aceptable morbilidad en los centros con un elevado volumen de intervenciones40,41. Hoy en día las resecciones pancreáticas por laparoscopia se llevan a cabo con gran éxito, especialmente en las lesiones corporocaudales42,43. Mediante esta técnica se consigue una estancia hospitalaria más corta y una más rápida recuperación.
Neoplasia mucinosa papilar intraductal de rama colateralEstas lesiones tienen indicación quirúrgica si presentan riesgo o sospecha de malignidad o si son sintomáticas. En este último caso no solo por un mayor peligro de malignización, sino también para alivio de la sintomatología. Las técnicas aplicadas también dependerán de la localización del tumor. La pancreatectomía segmentaria puede ser de elección en tumores sintomáticos de cuello de páncreas, aunque el tamaño sea inferior a 30mm y no existan datos que hagan sospechar malignidad44.
Vigilancia de los márgenes de resecciónDeberá tenerse especial cuidado en el examen de los bordes de resección, puesto que al tratarse de una neoplasia multifocal existe el riesgo de que quede una lesión residual (alrededor del 28% de ocasiones)45. Es pues de suma importancia el estudio intraoperatorio del estado de los márgenes de resección. Estos pueden clasificarse como negativos (epitelio normal o neoplasia mucinosa sin displasia) o positivos (adenoma, displasia moderada o de alto grado o adenocarcinoma)45.
La Guía de Consenso elaborada en Sendai propuso que si en los bordes se identifica adenoma o lesiones PanIN1 no es necesario ampliar la resección, puesto que el primero raramente degenera y el segundo es un hallazgo frecuente en la población general. Sin embargo, si se detecta lesión limítrofe, carcinoma in situ o invasivo, deberá ampliarse el área de resección hasta que se consigan unos márgenes libres de lesión5. Recientemente, Partelli et al.38 demostraron que la presencia de desepitelización de las estructuras del margen de resección estaban asociadas a un peor pronóstico, probablemente por una mayor dificultad en la interpretación de los datos anatomopatológicos, por lo que aconsejan, también en estos casos, una ampliación de la resección.
Un dato a tener en cuenta es que un borde de resección negativo no permite asegurar la ausencia de células neoplásicas en el páncreas residual dado el carácter multifocal de la NMPI. Ello hace aconsejable, a pesar de haber realizado una resección presuntamente curativa, el posterior control periódico de estos pacientes.
Otros tratamientosRecientemente se han publicado algunos estudios que valoran la utilidad del lavado intraquístico con etanol para la ablación de la NMPI de rama secundaria. Estas investigaciones, aunque han mostrado un cierto éxito, fueron realizadas en escaso número de pacientes y no existe un seguimiento lo suficientemente prolongado que permita demostrar su eficacia a largo plazo46,47.
Estrategia de seguimientoDependerá de las características clínicas y morfológicas de la lesión y de si el paciente ha requerido o no intervención quirúrgica.
Pacientes asintomáticos con neoplasia mucinosa papilar intraductal de ramaComo ya ha sido comentado con anterioridad estos pacientes requieren controles periódicos mediante técnicas de imagen (TC o, mejor, CPRM) y de valoración clínica para poder estimar el crecimiento de la lesión (30mm es un tamaño que se considera determinante), el desarrollo de nódulos murales y/o la aparición de sintomatología. Todo ello hará modificar la inicial actitud conservadora a intervencionista (fig. 2).
Pacientes con neoplasia mucinosa papilar intraductal resecadaLa estrategia en este grupo de enfermos está condicionada al carácter multifocal de estas lesiones que se observa hasta en un 30% de casos. Esto determina la necesidad de vigilancia de los pacientes, puesto que una vez resecada la zona afectada no excluye que pueda desarrollarse otra lesión en una nueva localización. En otras ocasiones, en los pacientes en que se ha resecado la lesión dominante conociendo que existían otras formaciones quísticas sincrónicas, pero de escaso desarrollo, también deberá mantenerse un control estricto sobre estas lesiones y valorar su evolución.
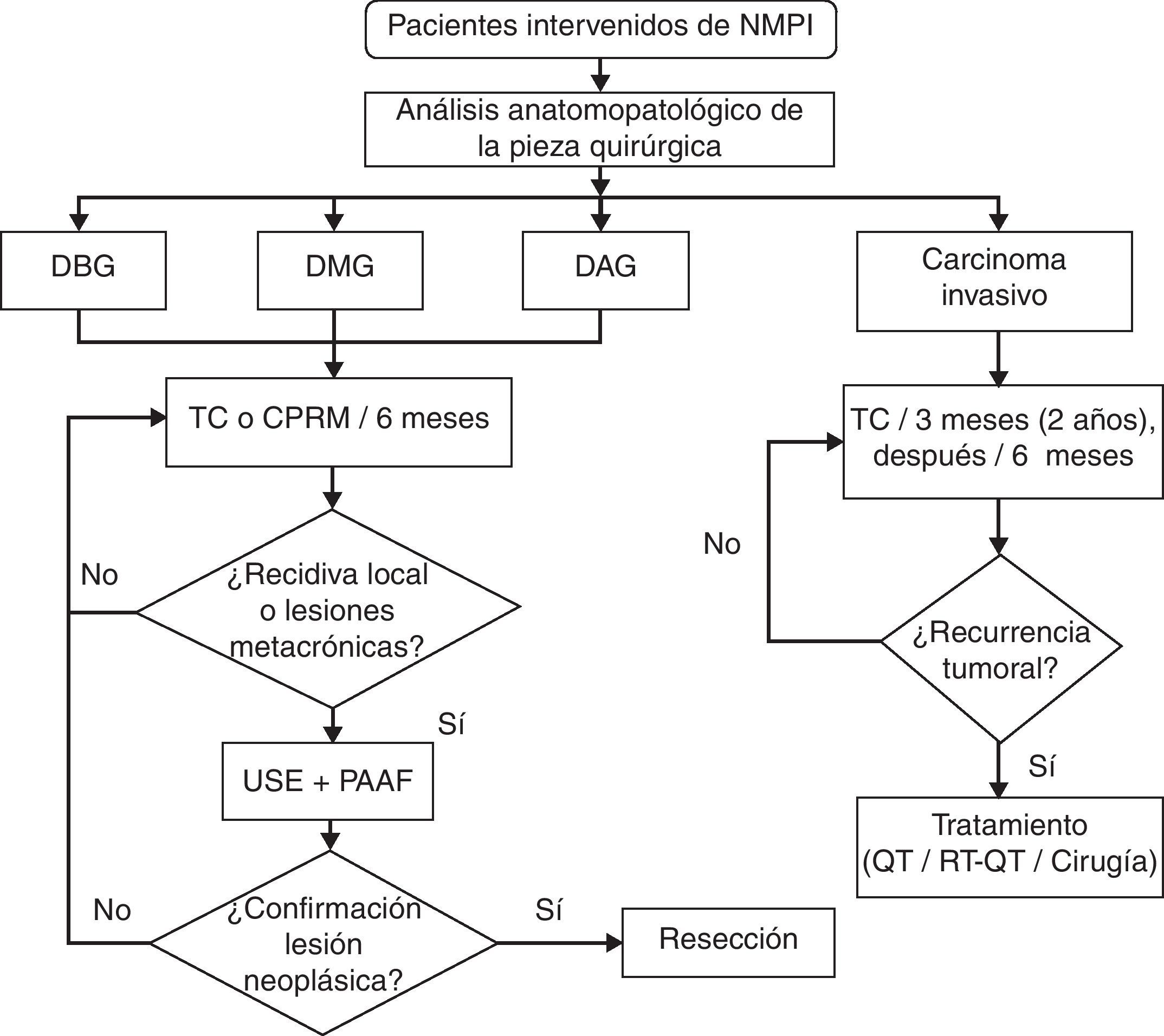
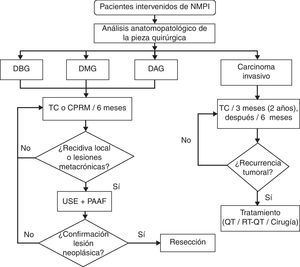
En otro orden de cosas debe considerarse que existe una recurrencia posquirúrgica del 8% en las NMPI malignas no invasivas y que esta aumenta hasta el 67% cuando existe carcinoma invasivo48–50. El seguimiento de estos pacientes depende del grado histopatológico de la lesión extirpada. El algoritmo de vigilancia que proponemos está adaptado del planteado por Ohtsuka et al.49 en un estudio reciente en el que aconsejan que en las NMPI con displasia se sigan controles semestrales mediante TC o CPRM y en aquellas con carcinoma invasivo controles trimestrales mediante TC. La aparición de recidiva determinará la decisión terapéutica a aplicar, ya sea nueva cirugía, quimioterapia o quimiorradioterapia (fig. 3). Esta última está basada en una mejor supervivencia observada en un subgrupo de pacientes (T3 y T4 con afectación ganglionar)51.
Algoritmo de vigilancia de las neoplasias mucinosas papilares intraductales después de la resección quirúrgica, según su grado histopatológico. CPRM: colangiopancreatografía por resonancia magnética; DBG, DMG y DAG: displasia de bajo, medio y alto grado; PAAF: punción aspirativa con aguja fina; TC: tomografía computarizada; USE: ultrasonografía endoscópica.
Adaptada de Ohtsuka et al.49.
En estas 2 últimas décadas diferentes estudios han observado una mayor incidencia de neoplasias extrapancreáticas en los pacientes con NMPI que en la población general. Estas neoplasias adicionales se han identificado en el 10-50% de los enfermos con NMPI. Las lesiones más frecuentes son los pólipos y el cáncer de colon, gástrico (más en orientales) y de esófago, tumores del estroma, mama, próstata, pulmón y tumor carcinoide. Esto hace aconsejable, debido a las implicaciones clínicas que conlleva, realizar estudios para descartar la presencia de estos diferentes tipos de tumores, tanto en el momento del diagnóstico de la NMPI como durante el seguimiento52.
ConclusionesEl diagnóstico preoperatorio de benignidad o malignidad en las NMPI tiene importantes implicaciones terapéuticas y pronósticas.
La realización de una resección quirúrgica temprana es el tratamiento de elección con el fin de evitar la degeneración maligna, siempre que existan factores de riesgo de malignidad como la afectación del conducto pancreático principal (tiene más riesgo de degeneración maligna que el de rama colateral), el tamaño (> 6mm en la NMPI de conducto pancreático principal o > 30mm en la NMPI de rama colateral), nódulos murales, atipias en el líquido intraquístico o síntomas. La extensión de la resección es un tema aún debatido ya que no existe un consenso absoluto.
Estas lesiones requieren, aunque hayan sido resecadas, un seguimiento clínico y mediante técnicas de imagen para detectar recidivas lo más tempranamente posible. También es importante investigar la presencia de posibles neoplasias extrapancreáticas sincrónicas o metacrónicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.