A pesar de la alta prevalencia de anemia por déficit de hierro (ADH) en pacientes con hemorragia digestiva (HD) aguda o crónica, la ADH y el déficit de hierro (DH) son frecuentemente infratratados. Diversos conceptos erróneos sobre el impacto, el diagnóstico y la eficacia de los nuevos tratamientos de la ADH probablemente lo justifican. Para abordar estos errores conceptuales, este artículo resume la evidencia actual para una mejor comprensión y manejo de la ADH. A pesar de que existen pocos estudios controlados que hayan evaluado la eficacia del tratamiento con hierro en pacientes con HD, hay evidencia que sugiere que: (a) la ADH debe ser investigada diligentemente; (b) el tratamiento eficaz del DH/ADH mejora la calidad de vida relacionada con la salud y puede evitar relevantes complicaciones cardiovasculares, y (c) el hierro intravenoso debe ser considerado como un tratamiento bien tolerado en este contexto. En general, los conceptos erróneos y las prácticas inadecuadas descritas en este artículo deben ser reemplazados por estrategias que estén más en línea con las directrices actuales y buenas prácticas clínicas en HD y otras condiciones causantes del DH/ADH.
Despite high prevalence of iron deficiency anemia (IDA) in patients with acute or chronic gastrointestinal bleeding (GIB), IDA and iron deficiency (ID) are frequently untreated. Reasons may be misconceptions about the impact and diagnosis of IDA and the efficacy of new treatments. Addressing these misconceptions, this article summarizes current evidence for better understanding and management of GIB-associated IDA. Despite only few controlled studies evaluated the efficacy of iron treatment in patients with GIB, there is consistent evidence suggesting that: (a) IDA should be diligently investigated, (b) effective treatment of ID/IDA improves outcomes such as health-related quality of life and can avoid severe cardiovascular consequences, and (c) intravenous iron should be considered as well-tolerated treatment in this setting. Overall, the misconceptions and practices outlined in this article should be replaced with strategies that are more in line with current guidelines and best practice in GIB and other underlying conditions of ID/IDA.
La hemorragia digestiva (HD) es una complicación frecuente en muchas enfermedades digestivas1-7. En una de las recopilaciones de datos más exhaustivas realizadas en los EE.UU. sobre la enfermedad ulcerosa péptica y la HD, que incluía datos de 2001 a 2009, se indicó la existencia de aproximadamente 66 casos de HD alta por cada 100.000 personas y de 223 casos de cualquier tipo de HD por cada 100.000 personas8, con aumentos sustanciales en los gastos de hospitalización y la duración de la estancia9. A pesar de que las hospitalizaciones debidas a HD altas (especialmente las debidas a hemorragias y perforaciones por úlceras pépticas) han disminuido en los últimos años, las varices y las HD bajas (especialmente por angiodisplasia y hemorragia diverticular de colon) siguen siendo dolencias frecuentes o incluso en aumento10,11. Aunque se han producido algunos avances en el manejo de las HD, es probable que los costes hayan aumentado.
La HD es el motivo más frecuente para la aparición de déficit de hierro (DH) y de anemia por déficit de hierro (ADH) en hombres adultos y mujeres posmenopáusicas12,13. A su vez, la ADH es una causa frecuente de derivación a gastroenterólogos y especialistas en medicina interna12, puede provocar la hospitalización, contribuye a la fatiga, afecta a la calidad de vida (CdV) relacionada con la salud14-16 y puede asociarse a un aumento de la mortalidad en determinadas poblaciones17-19. El papel de la ADH como comorbilidad frecuente en un amplio abanico de trastornos digestivos y hepáticos ha sido objeto de una revisión reciente20 según la cual la detección temprana y el manejo coste-efectivo de la anemia y el DH resultarían beneficiosos tanto para los pacientes como para los sistemas sanitarios.
Mientras que la incidencia de la ADH en la enfermedad inflamatoria intestinal (EII) ha sido recogida de forma adecuada21-23, los datos sobre la prevalencia de la ADH asociada a HD son escasos. La heterogeneidad de las enfermedades digestivas subyacentes forma parte de las dificultades que presentan el registro y la caracterización de la ADH asociada a HD5,12,14. Habitualmente, la ADH se atribuye a hemorragias ocultas en la parte superior o inferior del tubo digestivo7. Además, la edad y la desnutrición o los medicamentos relacionados con la edad, como el ácido acetilsalicílico (AAS) o los antiinflamatorios no esteroideos (AINE) y los antitrombóticos/anticoagulantes, pueden desencadenar o agravar las HD y, como consecuencia, la ADH24. Entre otras causas de ADH relacionadas con la función digestiva se incluye la resección intestinal extensa, asociada a restricciones dietéticas, malabsorción e infección por Helicobacter pylori25-29. Finalmente, la ADH puede ser la consecuencia posthemorrágica de un manejo insuficiente de un acontecimiento de HD grave manifiesta.
Debido a la escasez de datos y de directrices sobre la HD en diferentes enfermedades digestivas subyacentes, a lo largo del tiempo se han planteado diversas preguntas no resueltas y conceptos erróneos sobre el diagnóstico y el manejo del DH y la ADH en pacientes con HD (tabla 1). Esta revisión tiene por objeto resumir las evidencias disponibles actualmente y las que se encuentran en fase de desarrollo para comprender mejor la ADH asociada a HD y mejorar los desenlaces de los pacientes, con el objetivo de abordar este riesgo modificable, pero habitualmente infraconsiderado. Los resúmenes y las conclusiones son el resultado de conversaciones entre especialistas con base en publicaciones científicas y en su propia experiencia. Reflejan la opinión colectiva e independiente de los autores, con un consenso unánime en el enfoque de estas preguntas no resueltas y conceptos erróneos.
Conceptos erróneos habituales y aclaraciones sobre el déficit de hierro y la anemia por déficit de hierro en pacientes con hemorragia digestiva
| 1. Prevalencia e impacto de la anemia |
| 1a. La anemia generalmente es leve en los pacientes con HD → Habitualmente, la anemia es moderada o grave en los pacientes con HD |
| 1b. El impacto de la ADH sobre la calidad de vida de los pacientes con HD es muy limitado → El impacto de la ADH sobre la calidad de vida de los pacientes con HD es importante |
| 2. Diagnóstico |
| 2a. Los médicos están atentos a la detección y al tratamiento de la anemia durante la hospitalización y en el momento del alta de los pacientes con HD aguda y manifiesta → Los médicos no suelen estar atentos a la detección y al tratamiento de la anemia durante la hospitalización de los pacientes con HD |
| 2b. La ferritina es lo suficientemente precisa para el diagnóstico y la monitorización del DH en la HD → La evaluación de los niveles de ferritina únicamente no es lo suficientemente precisa para el diagnóstico del DH en la HD ni para su monitorización después de la administración de hierro i.v. |
| 2c. La anemia —y no el DH— es el único parámetro analítico relevante en la HD → El DH, con o sin anemia, es un parámetro analítico relevante en la HD |
| 3. Objetivos y eficacia del tratamiento |
| 3a. Todos los pacientes con HD y ADH son bastante similares y, por tanto, un único enfoque terapéutico para la ADH es adecuado para todos ellos → Los pacientes con HD y ADH son heterogéneos y necesitan un enfoque terapéutico personalizado para la ADH |
| 3b. Cuando se trata la ADH con suplementos de hierro en pacientes que presentan un episodio de HD, el objetivo es únicamente aumentar los niveles de Hb, no necesariamente normalizarlos → Cuando se trata la ADH con suplementos de hierro en el contexto de la HD, el objetivo es lograr valores normales de Hb |
| 3c. La administración de hierro i.v. debe reservarse para pacientes con HD con anemia muy grave (p.ej., Hb <8g/dl) → La administración de hierro i.v. no debe reservarse únicamente a los pacientes con HD con anemia muy grave |
| 3d. Cuando se trata la ADH con la administración de hierro i.v., una dosis de entre 500 y 1.000mg es suficiente → Las dosis totales de hierro i.v. que se deben administrar deben personalizarse, aunque con frecuencia son superiores a 1.000mg; la mayor parte de los datos clínicos disponibles se basan en dosis únicas de hasta 1.000mg de hierro |
| 3e. La corrección de la ADH después de la administración de hierro i.v. es prácticamente inmediata → La corrección de la ADH después de la administración de hierro i.v. es rápida, pero conlleva algún tiempo (varias semanas) |
| 3f. La eficacia del hierro i.v. para el tratamiento de la ADH en la HD, al contrario que en pacientes con hemorragia no digestiva, no ha sido demostrada → La eficacia del hierro i.v. para el tratamiento de la ADH en pacientes con HD ha sido demostrada |
| 3g. El tratamiento con hierro i.v. no es seguro → El tratamiento con hierro i.v. es seguro |
| 3h. La transfusión de hematíes está indicada en pacientes hemodinámicamente estables cuando los niveles de Hb descienden por debajo de 8-9g/dl → La transfusión de hematíes no está indicada en pacientes hemodinámicamente estables cuando la Hb es >7-8g/dl |
| 3i. Después de la transfusión de hematíes, no se necesita ningún tratamiento con hierro i.v. adicional → Incluso después de la transfusión de hematíes, el tratamiento con hierro i.v. es necesario en la mayor parte de los casos |
| 3j. Cuando se administra hierro oral, a los pacientes con HD deben prescribirse dosis mayores de lo habitual → Cuando se administra hierro oral, a los pacientes con HD no deben prescribirse dosis mayores de lo habitual |
| 3k. La respuesta de la ADH a los suplementos de hierro oral es prácticamente siempre excelente en la HD → La respuesta de la ADH a la suplementación con hierro oral es variable y depende de factores como la edad, el sexo, los fármacos concomitantes y las comorbilidades |
| 3l. El tratamiento con hierro i.v. no tiene ninguna función en pacientes con HD atendidos en el servicio de urgencias por una hemorragia autolimitada, sin ingreso hospitalario → El tratamiento con hierro i.v. puede ser crucial en pacientes con ADH atendidos en el servicio de urgencias por una hemorragia autolimitada que reciben el alta de forma temprana, sin llegar a ser ingresados en el hospital |
| 4. Otros |
| 4a. La función del gastroenterólogo termina cuando el acontecimiento de HD ha sido controlado (detener la HD es la prioridad, la anemia no es relevante) → La función del gastroenterólogo no es únicamente controlar el episodio de HD, sino también tratar la ADH y el DH |
| 4b. Las formulaciones de hierro i.v. son caras y no resultan coste-efectivas → El hierro i.v. puede ser coste-efectivo |
ADH: anemia por déficit de hierro; DH: déficit de hierro; Hb: hemoglobina; HD: hemorragia digestiva; i.v.: intravenoso.
Aunque la anemia en adultos se define por una hemoglobina (Hb) <13g/dl en hombres o <12g/dl en mujeres (anemia moderada: Hb <10g/dl; anemia grave: Hb <8,0g/dl), los niveles de Hb <12g/dl en hombres y <10g/dl en mujeres deben investigarse con mayor urgencia, ya que los niveles menores de Hb son indicativos de una enfermedad más grave12. El estudio más reciente de la Organización Mundial de la Salud sobre la carga mundial de las enfermedades mostró una prevalencia global de la anemia del 33% en 2010, con un 15% de los episodios clasificados como anemia moderada o grave30.
Los datos específicos sobre pacientes con HD manifiesta aguda o crónica (no oncológica) y ADH son escasos. Entre los pacientes que fueron ingresados por hemorragia digestiva alta aguda (HDAA) no varicosa en un hospital universitario en Dinamarca, el 50% tuvo Hb <10g/dl en el momento del ingreso y el 80% siguió anémico en el momento del alta (mediana de la Hb: 10,6g/dl)1. Un estudio multicéntrico reciente realizado en España (REGIS)31, que analizó las características de 379 pacientes hospitalizados debido a enfermedades digestivas, mostró una prevalencia de anemia del 60% en el momento del ingreso, con anemia grave (Hb<10g/dl) en la mitad de estos pacientes. Los pacientes con HD oculta (hemorragia crónica de origen desconocido) tuvieron una Hb media baja de 8,0g/dl. A pesar de la ausencia de estudios similares en otros países, es muy probable que estos resultados puedan extrapolarse a otras regiones geográficas.
Conclusión de los autores: habitualmente, la anemia es moderada o grave en los pacientes con HD.
Concepto erróneo 1b. El impacto de la anemia por déficit de hierro sobre la calidad de vida relacionada con la salud de los pacientes con hemorragia digestiva es muy limitadoEl impacto de la ADH en la CdV a menudo resulta infraestimado o incluso se ignora. Aunque los pacientes suelen adaptarse a los niveles bajos de Hb32,33, en realidad se trata de una adaptación a una peor CdV.
Los estudios sobre la CdV en pacientes con lesiones específicas por HD y ADH o síntomas relacionados son escasos y de dimensiones reducidas34,35. Un subestudio de un ensayo sobre el tratamiento con hierro de pacientes con HD aguda mostró que los pacientes que no tenían anemia después de 3meses de tratamiento presentaban un índice medio de CdV general relacionada con la salud más elevado que los pacientes anémicos34. Aunque esta diferencia no fue estadísticamente significativa, cabe destacar que el índice medio de CdV permaneció estable en los pacientes no anémicos, mientras que disminuyó sustancialmente en los pacientes anémicos durante los 3meses siguientes, lo que dio como resultado proporciones significativamente diferentes de pacientes que alcanzaron una CdV relacionada con la salud normal en función de su edad y sexo. En pacientes con EII u otras enfermedades asociadas a ADH, los estudios de la CdV sugieren que la ADH tiene un impacto sustancial sobre la CdV32,33,36-39. Los estudios en pacientes con EII tratados con hierro mostraron mejoras significativas en la CdV respecto al momento basal38,40. En un estudio se llegaron a correlacionar los aumentos en cada unidad de los niveles de Hb con las mejoras en las puntuaciones de CdV independientemente de los cambios en la actividad de la enfermedad. Teniendo en cuenta que la ADH puede afectar a varios sistemas del organismo33, se podría esperar un impacto similar de la ADH sobre la CdV de los pacientes con HD. En particular, incluso antes del descenso de la Hb a niveles anémicos, el DH puede afectar tanto a la CdV como al funcionamiento cognitivo y conductual41-43.
Conclusión de los autores: el impacto de la ADH sobre la CdV de los pacientes con HD es importante.
DiagnósticoConcepto erróneo 2a. Los médicos están atentos a la detección y al tratamiento de la anemia durante la hospitalización y en el momento del alta de los pacientes con hemorragia digestiva aguda y manifiestaLa evidencia sugiere justamente lo contrario: entre los pacientes con HD del estudio REGIS, la prevalencia de anemia grave no cambió de forma significativa entre el ingreso y el alta31. Con frecuencia, la anemia fue ignorada o se dejó sin tratar en los pacientes hospitalizados debido a enfermedades digestivas; un 58% seguían anémicos (un 17% con anemia grave) en el momento del alta. De forma análoga, otro estudio en pacientes hospitalizados con HDAA no varicosa mostró que >80% se encontraban anémicos en el momento del alta1. Además, la mayor parte de los pacientes con HDAA no varicosa desarrollaron ADH en los 30días posteriores al episodio44, lo que sugiere un tratamiento subóptimo de la ADH en una proporción considerable de los ingresos hospitalarios.
Estos hallazgos sobre la HD coinciden con los resultados de un estudio reciente sobre el manejo de la anemia y el DH asociados a EII en 9 países europeos45. Este estudio mostró que las pruebas diagnósticas y los criterios usados para evaluar o confirmar el DH y la ADH variaron de forma considerable, lo que implica que no se seguían las directrices existentes. Además, las frecuencias elevadas de anemia grave (15%) y DH absoluto (76%) son indicativas de una supervisión y una reposición insuficientes del hierro en el manejo rutinario de la enfermedad. Al contrario que las recomendaciones publicadas disponibles, que dan preferencia al tratamiento con hierro intravenoso (i.v.) frente al hierro oral21, solo el 28% de los pacientes recibieron hierro i.v.
Conclusión de los autores: los médicos no suelen estar atentos a la detección y al tratamiento de la anemia durante la hospitalización de los pacientes con HD.
Concepto erróneo 2b. La ferritina es lo suficientemente precisa para el diagnóstico y la monitorización del déficit de hierro en la hemorragia digestivaEn pacientes con HDAA, no solo los niveles basales de Hb y ferritina, sino también los niveles de Hb y el índice de saturación de transferrina (IST) 5días después de la HD fueron pronósticos del desarrollo de ADH 30días después del episodio de HD (los pacientes no recibieron hierro i.v., sino transfusiones cuando estaban hemodinámicamente inestables)44. Además, los pacientes con HD aguda pueden presentar una inflamación crónica no tratada o desconocida o comorbilidades que pueden producir niveles de ferritina equívocamente normales o aumentados debido a que la ferritina es un reactante de fase aguda46. Por tanto, los criterios diagnósticos del DH deben adaptarse a la posibilidad o a la confirmación de la presencia de inflamación (p.ej., a través de niveles elevados de proteínaC reactiva, evidencias endoscópicas, diarrea). El IST y la hematimetría, como el contenido de Hb de reticulocitos o el porcentaje de células hipocrómicas, tienen una menor propensión a sufrir dichas influencias. Por ello, la mitad de las 22 directrices de asociaciones profesionales sobre el diagnóstico y el tratamiento del DH en diferentes indicaciones proponen el IST como prueba diagnóstica alternativa o complementaria además de la ferritina sérica47. La directriz de la Sociedad Británica de Gastroenterología para el manejo de la ADH en enfermedades digestivas propone considerar que existe DH cuando los valores de ferritina sérica se sitúan por debajo de 15 a 50μg/l, en función del estado inflamatorio12. En la anemia asociada a EII, las recomendaciones de consenso sugieren que los límites inferiores de ferritina sérica y del IST en pacientes con evidencia de inflamación deben ser de 100μg/l y 16-20%, respectivamente21,48,49. Sin evidencia de inflamación o daño hepático, una ferritina sérica <30μg/l es indicativa de DH50. Además de la Hb, la situación del hierro y los marcadores de inflamación o daño hepático (proteínaC reactiva, alanina aminotransferasa), una evaluación completa también debe incluir los niveles de vitamina B12 y ácido fólico, tal y como recomiendan las directrices europeas para pacientes con EII48,49.
En general, la situación del hierro debe supervisarse para minimizar el riesgo de DH y ADH de nuevo desarrollo o recurrente en el contexto de la enfermedad del paciente y el manejo de la HD. En cuanto a la supervisión, la Sociedad Británica de Gastroenterología propone que los niveles de Hb y los índices eritrocitarios se evalúen a intervalos de 3meses durante un año, una vez en el año siguiente e inmediatamente en caso de reaparición de síntomas de DH/ADH12.
En el contexto de la asistencia primaria, donde las deficiencias nutricionales, el cáncer/quimioterapia o la insuficiencia renal crónica pueden descartarse con facilidad, los valores de ferritina, en combinación con las pruebas analíticas habituales y un hemograma completo, pueden considerarse suficientemente exactos para diagnosticar DH o ADH51.
Conclusión de los autores: la evaluación de los niveles de ferritina como único parámetro de los depósitos de hierro no es lo suficientemente precisa para el diagnóstico del DH en la HD ni para la monitorización de los niveles de hierro antes o después de la administración de hierro i.v.
Concepto erróneo 2c. La anemia —y no el déficit de hierro— es el único parámetro analítico relevante en la hemorragia digestivaCabe destacar que cualquier enfermedad crónica puede interferir en la homeostasia férrica y finalmente reducir la disponibilidad de hierro para una eritropoyesis y una producción de Hb eficaces50, y el DH no tratado con probabilidad progresa a ADH. Por tanto, la evaluación regular de los niveles de hierro (ferritina e IST) está justificada, con una evaluación diagnóstica adecuada y una consideración a las consecuencias clínicas si se encuentran alteraciones de los niveles de hierro12. La relevancia del DH, más allá de ser únicamente un parámetro analítico, ha quedado reflejada en estudios en diferentes poblaciones, y se ha evidenciado que el DH puede afectar a la CdV y a la función cognitiva, incluso antes de la aparición de la anemia. Además, la reposición de hierro mejoró la capacidad funcional y la CdV en pacientes con DH con y sin anemia41-43,52,53. Un estudio presentado recientemente llevado a cabo en pacientes con EII ambulatorios en España mostró que el 37% presentaba DH, pero no estaba anémico, y que estos pacientes tenían unas puntuaciones en la CdV (CCVEII-9) y fatiga (FACIT-F) significativamente menores que los pacientes con niveles de hierro y Hb normales54.
Conclusión de los autores: el DH, con o sin anemia, es un parámetro analítico relevante en la HD.
Objetivos y eficacia del tratamientoConcepto erróneo 3a. Todos los pacientes con hemorragia digestiva y anemia por déficit de hierro son bastante similares y, por tanto, un único enfoque terapéutico para la anemia por déficit de hierro es adecuado para todos ellosLas directrices para el tratamiento de la HDAA prácticamente no hacen referencia a la ADH y, cuando lo hacen, la transfusión de eritrocitos es el único tratamiento sugerido para los pacientes con niveles de Hb por debajo de 7-8g/dl55. Sin embargo, también es fundamental considerar otras características de los pacientes que pueden influir de forma diferente en la etiología de la HD y la ADH, como por ejemplo la edad avanzada, las comorbilidades (especialmente insuficiencia cardíaca y enfermedad pulmonar obstructiva crónica) o los medicamentos como anticoagulantes (administrados a aproximadamente el 30% de los pacientes con ADH tratada)56,57, AAS, AINE e inhibidores de la bomba de protones (IBP)58,59. Aunque los anticoagulantes se suspenden de forma transitoria durante las hemorragias activas, se reintroducen poco después del periodo hemorrágico, especialmente en pacientes con insuficiencia cardíaca, fibrilación auricular o valvulopatías cardíacas, aumentando así el riesgo de hemorragia recurrente y ADH. Además, las enfermedades asociadas a inflamación aguda o crónica y la medicación concomitante con IBP que aumentan el pH gástrico pueden afectar a la eficacia del hierro oral50,60. El tratamiento con hierro i.v. es menos dependiente en pacientes de tales características y tiene perfiles de efectos secundarios digestivos muy diferentes a los del hierro oral21. No obstante, los límites aprobados para las dosis varían para los diferentes preparados de hierro i.v. en función de su estabilidad61. Con respecto al hierro oral, debe tenerse en cuenta el efecto sobre la coloración de las heces que puede, o bien asustar a los pacientes que pueden llegar a creer que tienen un nuevo episodio hemorrágico (incluso habiendo sido informados de dicho efecto por su médico) o, por el contrario, pueden obviar este signo típico de hemorragia ya que creen que se trata de un efecto secundario del tratamiento.
Conclusión de los autores: los pacientes con HD y ADH son heterogéneos y necesitan un enfoque terapéutico personalizado para la ADH.
Concepto erróneo 3b. Cuando se trata la anemia por déficit de hierro con suplementos de hierro en pacientes que presentan un episodio de hemorragia digestiva, el objetivo es únicamente aumentar los niveles de hemoglobina, no necesariamente normalizarlosLos objetivos generales del tratamiento de la ADH son normalizar los niveles de Hb y reponer los depósitos de hierro12. Un estudio en el que se investigaron pacientes hospitalizados debido a insuficiencia cardíaca de nuevo diagnóstico o por empeoramiento mostró una reducción pronunciada en la mortalidad entre los pacientes con niveles de Hb cercanos a la normalidad (13g/dl) en el momento del ingreso hospitalario62. En dos estudios diferentes en los que se hizo seguimiento de pacientes con insuficiencia cardíaca crónica (ICC), los análisis multivariables mostraron que la anemia (Hb <12g/dl) es un factor de riesgo independiente de mortalidad y de reingreso debido a una insuficiencia cardíaca, con tasas de aproximadamente un 30% en pacientes anémicos y de un 15% en no anémicos. Se ha observado el beneficio de aumentos incluso incrementales en los niveles de Hb en diferentes poblaciones de pacientes en las que el aumento de Hb y no necesariamente su normalización se correlacionó con mejoras en la CdV38,63. Entre pacientes con HD aguda que han recibido un tratamiento de 3meses para la anemia, aproximadamente el 60% de los pacientes con anemia resuelta, pero solo alrededor del 30% de los pacientes con anemia no resuelta, tuvieron puntuaciones normales de CdV 3meses después del tratamiento34.
Después del alta hospitalaria, el seguimiento de los pacientes con ADH debe abordar el objetivo de aumentar y mantener la Hb en los niveles normales (>13g/dl en hombres y >12g/dl en mujeres)12,21,49. De lo contrario, la anemia puede reaparecer relativamente rápido, tal y como se ha observado en pacientes con enfermedad de Crohn y colitis ulcerosa64.
Conclusión de los autores: cuando se trata la ADH con suplementos de hierro en el contexto de la HD, el objetivo principal es lograr valores normales de Hb, y el objetivo adicional debería ser normalizar los depósitos de hierro (reflejado mediante los niveles de ferritina o del IST).
Concepto erróneo 3c. La administración de hierro intravenoso debe reservarse para pacientes con hemorragia digestiva con anemia muy grave (p.ej., hemoglobina <8g/dl)En el pasado, el hierro i.v. se reservaba para la anemia muy grave debido a los posibles efectos secundarios de las primeras formulaciones de hierro dextrano de alto peso molecular, que se asociaban a un riesgo de reacciones alérgicas65. Incluso en la actualidad, la anemia parece ser ignorada o tratada únicamente en casos graves31. Dado que los nuevos preparados de hierro i.v. presentan, en general, una buena tolerabilidad cuando se usan según la indicación aprobada12,66, los pacientes con HD crónica que son intolerantes o que no responden al hierro oral deben recibir hierro i.v. para la corrección de la ADH y la reposición de los depósitos de hierro en el organismo12. Desde un punto de vista heurístico sencillo, el hierro i.v. puede estar indicado en todos los casos en los que los niveles de Hb son <10g/dl y en los casos en los que los niveles de Hb son >10g/dl, asociado a comorbilidades cardíacas o respiratorias relevantes. Estudios observacionales en pacientes oncológicos han mostrado que el tratamiento con hierro i.v. puede mejorar de forma sistemática los niveles de Hb en diferentes rangos iniciales de Hb (Hb <10g/dl, 10-11g/dl)67,68.
En la práctica clínica, la HD a menudo se asocia a una nefropatía crónica69-71, una enfermedad que cuenta con amplios antecedentes y vasta experiencia en el uso seguro y eficaz de hierro i.v. para el tratamiento del DH y la ADH (con hierro i.v. administrado en monoterapia o en combinación con un agente estimulador de la eritropoyesis)72. Dado que el hierro es un elemento fundamental, necesario en una gran variedad de funciones celulares y fisiológicas73, debe considerarse la rápida resolución del DH con un tratamiento férrico adecuado, incluso en ausencia de anemia21. En pacientes con insuficiencia cardíaca crónica, el tratamiento del DH con hierro i.v. mejoró la capacidad funcional y la CdV en pacientes con y sin anemia52,53.
Conclusión de los autores: la administración de hierro i.v. no debe reservarse únicamente a los pacientes con HD con anemia muy grave.
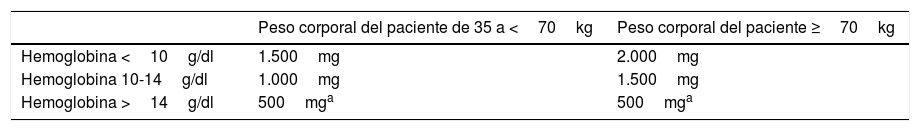
Concepto erróneo 3d. Cuando se trata la anemia por déficit de hierro con la administración de hierro intravenoso, una dosis de entre 500 y 1.000mg es suficienteDe hecho, en la mayor parte de los estudios sobre el tratamiento de la anemia con nuevos preparados de hierro i.v., el hierro se administró en dosis individuales de 500-1.000mg40,74,75. No obstante, en pacientes con hemorragias agudas o crónicas, los déficits de hierro pueden superar fácilmente los 1.000mg según el cálculo mediante la fórmula de Ganzoni76, que suele subestimar las necesidades de hierro40,74,75. En pacientes con EII, se ha estudiado una pauta novedosa y más sencilla para calcular la dosis total, administrada en dosis únicas de 500-1.000mg de hierro en función de la Hb y el peso corporal (tabla 2)40, que ha sido adoptada en la ficha técnica de los preparados de hierro i.v.77. Las opciones de dosis elevadas de hierro para una reposición rápida y eficaz del hierro son la carboximaltosa de hierro y, aunque los datos son escasos, el hierro dextrano de bajo peso molecular. En diversos ensayos clínicos y datos observacionales en los que se evaluó la eficacia y la seguridad de la administración de dosis elevadas de hierro se utilizaron estos compuestos40,78,79.
Conclusión de los autores: las dosis totales de hierro i.v. que se deben administrar deben personalizarse, aunque con frecuencia son mayores de 1.000mg; la mayor parte de los datos clínicos disponibles se basan en dosis únicas de hasta 1.000mg de hierro.
Concepto erróneo 3e. La corrección de la anemia por déficit de hierro después de la administración de hierro intravenoso es prácticamente inmediataAunque generalmente el incremento de los niveles de Hb después del tratamiento con hierro i.v. se produce más rápido que con hierro oral12,80, la utilización del hierro administrado y el proceso de eritropoyesis necesitan de un cierto tiempo. Por tanto, los niveles de Hb no aumentan ni se normalizan inmediatamente después del tratamiento, cosa que sí sucedería en caso de una transfusión de hematíes. Los complejos de hidratos de carbono férricos administrados son captados y degradados por las células del sistema reticuloendotelial, seguido por una utilización del hierro para replecionar los depósitos de hierro o para la eritropoyesis en la médula ósea81. Debe realizarse un control analítico (p.ej., la evaluación de los parámetros de Hb y los niveles de hierro) al menos 10días después de la administración del hierro i.v. (en la mayor parte de los casos después del alta hospitalaria).
Hasta 2meses después de la administración de hierro i.v., se pueden observar niveles elevados de ferritina, una respuesta transitoria normal que no es indicativa de sobrecarga de hierro82,83. Los parámetros férricos adicionales que deben comprobarse para evaluar la respuesta eritropoyética al hierro i.v. son el IST, el contenido de Hb en los reticulocitos (que debe aumentar rápidamente después del tratamiento con hierro) o el porcentaje de células hipocrómicas (reducción lenta después del tratamiento con hierro)14,46.
Conclusión de los autores: la corrección de la ADH después de la administración de hierro i.v. es rápida, pero conlleva algún tiempo (varias semanas).
Concepto erróneo 3f. La eficacia del hierro intravenoso para el tratamiento de la anemia por déficit de hierro en la hemorragia digestiva, al contrario que en pacientes con hemorragia no digestiva, no ha sido demostradaLas evidencias clínicas publicadas sobre el uso de tratamiento con hierro i.v. y de otro tipo de hierro en pacientes con HD aguda o crónica y ADH son escasas en comparación con las disponibles en el caso de la EII. No obstante, en los datos de un ensayo publicado en pacientes con HDAA no varicosa79 y en presentaciones recientes en congresos56,57,84-86 se ha sugerido su beneficio clínico. El ensayo publicado tuvo un diseño con doble ciego y con 3 grupos de estudio (1×1.000mg de carboximaltosa de hierro i.v.; 100mg de sulfato ferroso oral d.v.d. durante 12semanas; placebo)79. Ya desde la semana4 en adelante, los niveles medianos de Hb fueron significativamente más elevados entre los pacientes tratados con hierro en comparación con los tratados con placebo. Desafortunadamente, la mayor parte de los pacientes de este estudio no presentaban DH en el momento basal, y no se detectaron diferencias significativas en los niveles de Hb entre los dos grupos tratados con hierro. Sin embargo, a partir de la semana1, los niveles de ferritina en el grupo de hierro i.v. fueron más altos que los observados en los grupos de hierro oral y de placebo. Además, los niveles de ferritina de los pacientes tratados con hierro oral disminuyeron en un 50% entre el momento basal y la semana4. Se trata de un aspecto importante, ya que un estudio en pacientes con EII reveló que los pacientes con niveles bajos de ferritina (<100μg/l) al final del tratamiento experimentaron una recurrencia más temprana y necesitaron un reinicio de la ferroterapia64. Los resultados previstos de un ensayo en curso (ClinicalTrials.gov NCT01690585) en el que se investiga la administración i.v. de carboximaltosa de hierro en pacientes con HD añadirán evidencias en esta área.
Los datos presentados recientemente sugieren la eficacia de carboximaltosa de hierro en la mejora de los niveles de Hb en pacientes que han tenido HD aguda85,86, angiodisplasia57 y en pacientes ambulatorios con HD debida a diferentes enfermedades que han sido derivados desde un servicio de gastroenterología para el tratamiento de la anemia84. En pacientes que han presentado una HD aguda, una comparación aleatorizada frente a hierro oral mostró una respuesta más rápida de la Hb y una normalización del IST al día 7 después del tratamiento con carboximaltosa de hierro85, y en otro estudio se notificó un aumento significativo de la Hb en pacientes >75años, con índice de Charlson >3 o Hb <10g/dl al ingreso86.
Evidentemente, la ausencia de evidencias publicadas afecta a la práctica clínica. Un estudio retrospectivo en Dinamarca1 mostró que solo una minoría de los pacientes (16%) hospitalizados por HDAA no varicosa recibieron una recomendación de comenzar una suplementación con hierro oral. El hierro i.v. ni siquiera se consideró y más del 80% de los pacientes ingresados se encontraban anémicos en el momento del alta.
La falta de directrices sobre el manejo de la ADH relacionada con HD queda ilustrada por el hecho de que entre 29 directrices de diferentes asociaciones profesionales, solo 3 hacen referencia a enfermedades digestivas; en 2 se hace referencia a la ADH asociada a la EII21,49 y solo en una se habla de las enfermedades digestivas en general12. En lugar de datos clínicos y directrices sobre pacientes con HD, existen evidencias publicadas del manejo eficaz de la sangre y el hierro y del tratamiento con hierro i.v. en pacientes con hemorragia de orígenes diferentes (p.ej., cáncer de colon87,88 o cirugía89). Estos resultados pueden extrapolarse de forma razonable a pacientes anémicos con HD.
Conclusión de los autores: la eficacia del hierro i.v. para el tratamiento de la ADH en pacientes con HD ha sido demostrada.
Concepto erróneo 3g. El tratamiento con hierro intravenoso no es seguroEl concepto erróneo extendido sobre la seguridad del hierro i.v. se basa principalmente en informes históricos sobre reacciones anafilácticas y elevadas tasas de acontecimientos adversos graves asociadas al hierro dextrano de alto peso molecular65 (que ya no se comercializa en muchas regiones), y a un preparado con óxido de hierro superparamagnético90 (cuya autorización de comercialización fue retirada en Europa a petición del fabricante)91. Con otros preparados, la incidencia de acontecimientos adversos graves es muy poco frecuente y la hipersensibilidad suele ser autolimitada61,92-94. Además, la Agencia Europea del Medicamento ha revisado la relación entre beneficios y riesgos de los medicamentos con hierro i.v. y ha llegado a la conclusión de que los beneficios del hierro i.v. siguen superando a sus riesgos en el tratamiento del DH cuando la vía oral no es suficiente o no se tolera de forma adecuada66.
Conclusión de los autores: el tratamiento con hierro i.v. es seguro.
Concepto erróneo 3h. La transfusión de hematíes está indicada en pacientes hemodinámicamente estables cuando los niveles de hemoglobina descienden por debajo de 8-9g/dlEn general, no se recomienda practicar simplemente una transfusión a un determinado umbral de Hb; los clínicos tienen que considerar la edad, las comorbilidades, la causa y la intensidad de la hemorragia, etc., en todos los casos. Si la transfusión de hematíes se estima necesaria, se debe considerar la posibilidad de aplicar una política restrictiva, excepto si existe la comorbilidad de cardiopatía isquémica95,96. Los resultados del ensayo TRIGGER95 sugieren que el umbral de Hb para las transfusiones puede bajarse de forma segura (Hb <8,0g/dl) sin afectar de forma adversa a los resultados clínicos en los pacientes con HD alta aguda. En otro estudio, las transfusiones restringidas (Hb <7,0g/dl) en pacientes con HD alta aguda se asociaron a una menor mortalidad97.
Aun así, una política transfusional restrictiva significa que muchos pacientes seguirán estando anémicos durante algún tiempo; no significa ignorar la ADH y no hacer nada. En cambio, proporciona tiempo para el manejo de la ADH con las alternativas a la transfusión disponibles, especialmente el hierro i.v. Un estudio retrospectivo de pacientes con ADH de moderada (Hb <10g/dl) a grave (Hb <8,0g/dl) que necesitaron transfusión crónica de soporte (>2 transfusiones de hematíes en un año) en 5 centros de transfusión italianos mostró la eficacia del tratamiento con hierro i.v. en la reducción de las necesidades de hematíes98. El tratamiento con carboximaltosa de hierro se asoció a una reducción significativa en la mediana del número anual de unidades de hematíes transfundidas de 6 (intervalo intercuartílico 4-15) a 0 (0-5) y, aun así, los niveles medianos de Hb aumentaron significativamente de 8,7g/dl (8,1-9,2g/dl) a 11,0g/dl (9,9-11,7g/dl).
Una política de transfusiones restrictiva concuerda con la directriz para el manejo de la ADH en las enfermedades digestivas, que recomienda reservar las transfusiones de sangre para pacientes con ADH sintomática a pesar del tratamiento con hierro o para pacientes en riesgo de inestabilidad cardiovascular debido al grado de su anemia12. Este tipo de política también está respaldado por la iniciativa «Choosing Wisely» («Elegir Sabiamente») de la Junta Estadounidense de Medicina Interna (American Board of Internal Medicine [ABIM]) y la Asociación Estadounidense de Bancos de Sangre (American Association of Blood Banks), que pide limitar la administración de unidades de hematíes hasta el mínimo absolutamente necesario y a un umbral de Hb restrictivo de 7,0-8,0g/dl99. Además, las transfusiones de hematíes no deben usarse como tratamiento para el DH en pacientes sin inestabilidad hemodinámica.
Conclusión de los autores: la transfusión de hematíes debe restringirse a pacientes hemodinámicamente inestables y a la cantidad mínima absolutamente necesaria de unidades de hematíes. Si la transfusión se considera necesaria en pacientes hemodinámicamente estables que no presentan factores de riesgo cardiovascular, debe considerarse un umbral de Hb restrictivo de 7,0-8,0g/dl.
Concepto erróneo 3i. Después de la transfusión de hematíes, no se necesita ningún tratamiento con hierro intravenoso adicionalEn la práctica y en las directrices clínicas, las transfusiones de hematíes a menudo se mencionan como tratamiento sin considerar ni abordar las necesidades adicionales de reposición de hierro o de tratamiento de mantenimiento100. Sin embargo, las transfusiones de hematíes solo aumentan los niveles de Hb de forma transitoria sin corregir a la vez la enfermedad subyacente ni la depleción de los depósitos de hierro, lo que hace que la recurrencia de ADH sea más probable12,64. De forma análoga, deben vigilarse los parámetros de los niveles de hierro y los recuentos de sangre completa como parte del seguimiento de la transfusión48. Cabe destacar que una única unidad de hematíes (300ml) contiene aproximadamente 150mg de hierro, mientras que los preparados de hierro i.v. actuales pueden administrarse a dosis de hasta 1.000mg de hierro por administración. Con el hierro i.v., se facilita la producción adecuada de eritrocitos (eritropoyesis) y la reposición de los depósitos de hierro81.
Es prudente tener en cuenta que las transfusiones son una medida transitoria y que su objetivo no es restaurar los valores normales de Hb. Solo se debe transfundir la cantidad mínima de unidades de hematíes que sea necesaria para alcanzar un nivel seguro de Hb y la estabilización hemodinámica del paciente. La restauración de los niveles normales de Hb (y de los depósitos de hierro) puede lograrse siguiendo el tratamiento con hierro i.v. recomendado12,89 y que recientemente se ha demostrado incluso para pacientes con HD aguda86.
Conclusión de los autores: incluso después de la transfusión de hematíes, el tratamiento con hierro i.v. es necesario en la mayor parte de los casos.
Concepto erróneo 3j. Cuando se administra hierro oral, a los pacientes con hemorragia digestiva deben prescribirse dosis mayores de lo habitualExisten pocas evidencias que respalden el uso de dosis elevadas de hierro oral en pacientes con HD, ya que la absorción de hierro puede verse alterada de forma general. Los estudios controlados de eficacia sobre el tratamiento con hierro oral en la ADH en adultos, personas de edad avanzada, pacientes pediátricos y embarazadas respaldan el uso de suplementos con dosis bajas de hierro oral, en forma de comprimido o de líquido101-104. En ausencia de inflamación o enfermedad crónica, el límite superior de absorción diaria de hierro es de aproximadamente 10mg de hierro/día (y es incluso menor en condiciones de inflamación)102,105. Por tanto, una dosis diaria de 100mg de hierro elemental es suficiente y las dosis más altas únicamente elevarían el riesgo de efectos adversos gastrointestinales (p.ej., náuseas, vómitos, estreñimiento y diarrea).
En general, la respuesta al hierro oral (tasa con niveles de Hb normalizados) depende en gran medida de factores como las comorbilidades, la edad y el sexo, que suelen influir en los niveles de citocinas inflamatorias y, por tanto, afectan a la absorción intestinal y a la utilización del hierro50,60.
Conclusión de los autores: cuando se administra hierro oral, a los pacientes con HD no deben prescribirse dosis superiores de lo habitual.
Concepto erróneo 3k. La respuesta de la anemia por déficit de hierro a los suplementos de hierro oral es prácticamente siempre excelente en la hemorragia digestivaAparte de los efectos secundarios digestivos y del riesgo de ocultar un nuevo periodo hemorrágico debido a la coloración de las heces, las principales limitaciones de la suplementación con hierro oral son una lenta respuesta y una mala tolerancia/adherencia al tratamiento (véase el apartado 3j)102,105. En la HDAA no varicosa, una única dosis de 1.000mg de hierro i.v. consiguió resultados en la Hb durante 3meses equivalentes a los obtenidos con la ingesta oral de 100mg de hierro 2 veces al día (aproximadamente una dosis total de 36g de hierro)79. Un estudio aleatorizado y controlado en pacientes con ADH después de una HD aguda presentado recientemente mostró una normalización de Hb, una respuesta de la Hb (≥2g/dl) y un aumento del IST significativamente mejores en pacientes tratados con carboximaltosa de hierro en comparación con los tratados con hierro oral85. En la HD crónica, la absorción de hierro oral puede estar gravemente alterada y la pérdida constante de sangre excederá la capacidad de absorción intestinal de hierro106.
Además, el cumplimiento terapéutico de los pacientes a los tratamientos orales a largo plazo suele ser un problema habitual107,108 y especialmente con hierro oral debido a sus efectos secundarios digestivos como el estreñimiento, las náuseas y la diarrea109. En pacientes que han tenido una HD aguda, se notificaron dolor abdominal y estreñimiento en el 6,7 y el 21% de los pacientes tratados con hierro oral, mientras que no se notificaron efectos secundarios en el grupo de hierro i.v. Asimismo, el cumplimiento terapéutico fue menor con el hierro oral que con el hierro i.v. (87% frente al 100%)85.
En la vida diaria, el cumplimiento terapéutico del paciente puede ser incluso menor que en el contexto de los ensayos clínicos controlados, lo que limitaría aún más la eficacia del tratamiento con hierro oral. A pesar de que el hierro oral (fumarato) se asocia a un aumento de la actividad clínica de la enfermedad en pacientes con EII110, no se dispone de estudios sobre el riesgo de recurrencia hemorrágica en pacientes con HD que toman hierro oral. Cabe destacar que, incluso si los niveles de Hb mejoran con hierro oral, es complicado que la repleción de los depósitos de hierro (niveles de ferritina) se consiga en un periodo de tiempo razonable debido a la mala absorción de hierro y generalmente a los grandes déficits de hierro, aumentando así el riesgo de recurrencia de ADH64,89. Considerando que muchos pacientes con HD pueden tener comorbilidades crónicas con un estado inflamatorio subyacente, el hierro oral no está recomendado48. A pesar de estas válidas precauciones, puede haber casos en los que el tratamiento con hierro oral puede ser suficiente si se tolera adecuadamente.
Conclusión de los autores: la respuesta de la ADH a la suplementación con hierro oral es variable y depende de factores como la edad, el sexo, los fármacos concomitantes y las comorbilidades.
Concepto erróneo 3l. El tratamiento con hierro intravenoso no tiene ninguna función en pacientes con hemorragia digestiva atendidos en el servicio de urgencias por una hemorragia autolimitada, sin ingreso hospitalarioEl diagnóstico y la intervención temprana en el servicio de urgencias puede ser crucial en pacientes con HD subaguda autolimitada y ADH, incluso si los análisis de los niveles de hierro no pueden estar disponibles las 24h en todos los servicios de urgencias. La necesidad de ahorro de sangre, especialmente en pacientes que no necesitan una transfusión aguda, y el uso adecuado de recursos y la gestión de costes en el servicio de urgencias sugiere la existencia de un papel para el hierro i.v. en el manejo de la HD aguda y la HD crónica55,111-113. Aunque muchos casos urgentes de hemorragias autolimitadas se detienen de forma espontánea, como mínimo debería evaluarse la situación del hierro y el riesgo de desarrollar DH o ADH del paciente derivándolo a un médico de atención primaria después del alta. En un hospital de día español, el 34,7% de los pacientes tratados con hierro i.v. después de una HD habían sido derivados desde un servicio de urgencias56.
En un programa de vía rápida (fast-track) para el manejo de la anemia en un servicio de urgencias presentado recientemente en el que se enfatizó la intervención temprana con hierro i.v. (n=202 pacientes con anemia moderada o grave [Hb <11,0g/dl]), el 44% de los casos referidos estaban relacionados con HD crónica112. El uso de carboximaltosa de hierro i.v. se asoció a un aumento medio de 3,9g/dl de la Hb después de 4semanas y a una tasa de respuesta del 84%. Además, se consiguió una tasa baja de transfusiones (17%), lo que demuestra que el uso de hierro i.v. en servicios de urgencias es posible, beneficioso y seguro112. Aunque son necesarios datos adicionales y un seguimiento más prolongado, es evidente que el hierro i.v. desempeña una función para los pacientes con HD subaguda autolimitada y ADH, con un seguimiento estrecho necesario para evitar la recurrencia o las transfusiones.
Además, los pacientes que acuden al servicio de urgencias pueden tener DH de forma independiente a cualquier HD, ya que la anemia es muy prevalente incluso en los países desarrollados114,115. Esto respalda la necesidad de seguimiento, si no una intervención temprana.
Conclusión de los autores: el tratamiento con hierro i.v. puede ser crucial en pacientes con ADH atendidos en el servicio de urgencias por una hemorragia autolimitada que reciben el alta de forma temprana, sin llegar a ser ingresados en el hospital.
OtrosConcepto erróneo 4a. La función del gastroenterólogo termina cuando el acontecimiento de hemorragia digestiva ha sido controlado (detener la hemorragia digestiva es la prioridad, la anemia no es relevante)En paralelo con las necesidades inmediatas de manejo y tratamiento del origen de la HD, se necesitan objetivos específicos de tratamiento y una supervisión adecuada de los pacientes para corregir la ADH o el DH de manera oportuna. Considerando que la CdV se deteriora muy rápidamente en pacientes anémicos con HD, mientras que permanece estable en pacientes no anémicos34, el gastroenterólogo debe considerar la anemia como una comorbilidad grave y ha de tratarla con el mismo rigor que la hemorragia. El control o la resolución de la HD y la anemia no son excluyentes entre sí. Aunque el tratamiento de la enfermedad subyacente está destinado a contener o evitar la pérdida de sangre en el futuro, el objetivo del tratamiento de reposición de hierro paralelo es resolver la anemia y reponer los depósitos de hierro12. Si los pacientes no son objeto de seguimiento en el servicio de gastroenterología, los médicos a los que se realiza la derivación deben recibir instrucciones de continuar la supervisión de la anemia y de los niveles de hierro tal y como se indica en las directrices pertinentes12 e iniciar el tratamiento necesario.
Conclusión de los autores: la función del gastroenterólogo no es únicamente controlar el episodio de HD, sino también tratar la ADH y el DH.
Concepto erróneo 4b. Las formulaciones de hierro intravenoso son caras y no son coste-efectivasAunque el hierro oral puede parecer barato y conveniente, se asocia a una lenta respuesta de la Hb y los acontecimientos adversos gastrointestinales pueden aumentar los costes indirectos. Un análisis de minimización de costes del tratamiento de la ADH en pacientes con cáncer de colon antes de la cirugía mostró la existencia de menores gastos con una dosis elevada de hierro i.v. (carboximaltosa de hierro) en comparación con hierro oral (1.827 frente a 2.101€/paciente), principalmente debido a su mayor eficacia (aumento de la Hb en un periodo de tiempo más corto), lo que se refleja en estancias hospitalarias más cortas y en menor necesidad de transfusiones116. Por otra parte, se observaron mayores costes con un hierro i.v. que necesita administraciones más frecuentes (hierro sacarosa; 2.312€/paciente); posiblemente debido a que la dosis de hierro sacarosa se calculó usando la fórmula de Ganzoni, que parece subestimar las necesidades de hierro.
Otro análisis de coste-efectividad con un programa de tratamiento vía rápida (fast-track) para el manejo de la ADH moderada o grave, que comparó un protocolo de tratamiento de fast-track con hierro i.v. con el tratamiento de referencia previo basado en transfusiones, mostró un ahorro de 78€/paciente con carboximaltosa de hierro frente a las transfusiones de hematíes (594 frente a 672€/paciente)113.
Conclusión de los autores: el hierro i.v. puede ser coste-efectivo.
ConclusionesLos gastroenterólogos se encuentran en una posición única en el seguimiento y la asistencia de los pacientes derivados con HD, especialmente en lo referente al objetivo de identificar y mejorar la(s) causa(s) subyacente(s). La práctica clínica actual no está estandarizada y es subóptima. En primer lugar, es necesario seguir investigando y fomentar la concienciación de los retos relacionados con el DH y la ADH en el contexto de la HD, con el objetivo de influir en los resultados clínicos y la CdV de estos pacientes y minimizar la necesidad de transfusiones de sangre. En segundo lugar, todos los profesionales clínicos implicados en la asistencia del paciente deberían comprometerse a hacer frente a los conceptos erróneos para conseguir un impacto positivo sobre la CdV y minimizar los riesgos de pérdida constante de sangre, de unos niveles de hierro inadecuados en el momento del alta hospitalaria y de recurrencia temprana de la anemia. Sería ideal conseguir compromisos de la red sanitaria para conseguir una mejor coordinación, con directrices basadas en la evidencia que beneficien a los pacientes con DH/ADH.
Aunque hay pocos estudios controlados que evalúen la eficacia del tratamiento para la ADH en la HD, existen datos coherentes que muestran que los pacientes con HD se pueden beneficiar de un estudio y un tratamiento rápidos de la ADH, y que permiten la aplicación de algunos conceptos fundamentales (tabla 1) para hacer frente a los conceptos erróneos habituales. El hierro oral es una opción aceptable de primera línea para pacientes clínicamente estables con solo anemia leve y sin riesgo de recurrencia hemorrágica, complicaciones o secuelas digestivas, inflamación crónica, malabsorción o problemas de tolerabilidad. Cuando se utiliza hierro i.v. se puede esperar una mejoría más rápida de los niveles de hierro y de la Hb. Aunque la mayor parte de los pacientes con HD aguda experimentan una pérdida de sangre significativa antes de las intervenciones endoscópicas, las transfusiones siempre deben restringirse a tratamientos de rescate y combinarse con suplementación con hierro i.v. para reponer los depósitos de hierro. El umbral de Hb para la transfusión debe mantenerse bajo si no hay comorbilidades cardiovasculares presentes.
En vista de las opciones terapéuticas disponibles, el «statu quo» consistente en ignorar el DH y la ADH en la HD no parece ser adecuada. El objetivo del tratamiento no debe ser únicamente detener la hemorragia, sino corregir completamente el DH/la ADH de forma deliberada, eficiente y rápida y minimizar el riesgo de recurrencia de la anemia.
AutoríaÁngel Lanas y Fermín Mearin contribuyeron por igual en este trabajo.
Conflicto de interesesTodos los autores han participado en el consejo asesor de Vifor Pharma España. Fermín Mearin ha formado parte del consejo asesor de Vifor Pharma España. Antonio Hervás ha actuado como consultor de Vifor Pharma España. Miguel Montoro ha actuado como asesor para MSD y Almirall. Javier P. Gisbert ha actuado como ponente, consultor y miembro del consejo asesor para MSD, Abbvie, Hospira, Kern Pharma, Takeda, Janssen, Pfizer, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma, Almirall, Nicomedes, AstraZeneca, Casen Recordati y Allergan, o ha recibido fondos para la investigación por parte de dichas entidades.
Ángel Lanas, Luis Bujanda, Pilar Canelles, José Cotter y Carlos Martín de Argila no declararon ningún conflicto de interés.
La reunión del grupo de expertos y la ayuda en la redacción médica por parte de Walter Fürst, SFL Regulatory Affairs & Scientific Communication, fueron financiadas por Vifor Pharma España. El manuscrito fue revisado y comentado por Mercedes Cucala, Departamento Médico, Vifor Pharma España.